有机化学10种官能团性质
- 格式:doc
- 大小:473.50 KB
- 文档页数:6


化学有机官能团总结有机官能团是有机化合物中的一个重要部分,它决定了化合物的性质和化学反应。
在化学中,有机官能团是指一类特定的原子团,它们赋予了有机化合物特定的化学性质和反应特点。
下面我们将对常见的有机官能团进行总结。
1. 烷基。
烷基是由碳和氢组成的烷烃链,它是有机化合物中最简单的官能团之一。
烷基的化合物通常具有较强的惰性,不容易发生化学反应。
2. 烯基。
烯基是由碳碳双键构成的官能团,它赋予了化合物较强的活性。
烯烃通常具有较高的反应性,可以进行加成反应、氢化反应等。
3. 炔基。
炔基是由碳碳三键构成的官能团,它使得化合物具有较高的活性。
炔烃可以进行加成反应、氢化反应、卤代反应等。
4. 羟基。
羟基是由氧和氢构成的官能团,它赋予了化合物亲水性和醇性。
羟基化合物可以进行醚化反应、酯化反应等。
5. 羰基。
羰基是由碳氧双键构成的官能团,它使得化合物具有较强的极性。
醛和酮是常见的羰基化合物,它们可以进行亲核加成反应、缩合反应等。
6. 羧基。
羧基是由羧基团构成的官能团,它赋予了化合物酸性和亲水性。
羧酸化合物可以进行酯化反应、酰化反应等。
7. 氨基。
氨基是由氮和氢构成的官能团,它赋予了化合物碱性和亲核性。
胺是常见的氨基化合物,它们可以进行酰胺化反应、亲核取代反应等。
总结,有机官能团是有机化合物中的重要组成部分,它决定了化合物的性质和化学反应。
不同的官能团赋予了化合物不同的化学性质和反应特点,对于有机化学的研究和应用具有重要意义。
对于化学学习者来说,理解和掌握各种有机官能团的性质和反应特点,对于理解有机化合物的结构和性质具有重要意义。

高中化学常见官能团的性质总结常见官能团的性质一、中学有机化合物分类及常见官能团名称和主要性质在有机化学中,官能团是指有机分子中带有特殊化学性质的原子团。
常见的官能团有羟基、醛基、羰基、羧基、酯基、酰基等。
烷烃中的烷基,芳香烃中的苯基都不是官能团。
二、有机官能团的化学性质与有机基本反应1.氧化反应1)燃烧。
凡是含碳氢的有机化合物燃烧都生成二氧化碳和水。
烃和含氧衍生物的燃烧通式分别为CnH2n+2 +(3n+1)/2O2 → nCO2 + (n+1)H2O和CnH2nOn + (n+1/2)O2 → nCO2 + (n+1)H2O。
2)被酸性高锰酸钾氧化。
能使酸性高锰酸钾褪色的有机物有不饱和烃、不饱和烃的衍生物(含碳碳双键、碳碳三键)、苯的同系物(苯基上的烃基易被氧化)、含醛基的有机物(如醛、甲酸、甲酸酯、甲酸盐、葡萄糖)和石油产品(裂解气、裂化气)。
3)羟基的催化氧化。
某些含羟基的有机物在催化剂的作用下,能被氧气氧化成醛或酮。
当与羟基相连的碳原子上有两个氢原子时,羟基能被氧化成醛基,如2CH3CH2OH + O2 →2CH3CHO + 2H2O。
当与羟基相连的碳原子上有一个氢原子时,羟基能被氧化成羰基(碳氧双键)。
当与羟基相连的碳原子上没有氢原子时,羟基不能被氧化。
4)醛基的氧化。
有机物中的醛基,不仅可以被氧气氧化成羧基,而且还能被两种弱氧化剂(银氨离子和铜离子)氧化成羧基,如2CH3CHO + O2 → 2CH3COOH和CH3CHO +2[Ag(NH3)2]+ + 2OH- → CH3COO- + NH4+ + 2Ag↓ + 3NH3 +H2O和CH3CHO + 2Cu(OH)2 → CH3COOH + Cu2O↓ + 2H2O。
2.取代反应有机物分子中的某些原子或原子团被其他原子或原子团所代替的反应叫做取代反应。
中学常见的取代反应有:1)烷烃与卤素单质在光照下的取代,如CH4 + Cl2 →CH3Cl + HCl。

常见有机物及官能团有机物是由碳元素与其他元素(如氢、氧、氮等)构成的化合物。
官能团是有机物分子中具有特定化学性质的基团。
本文将介绍一些常见的有机物及其官能团。
1. 烷烃(Alkanes)烷烃是一类仅含有碳和氢元素的饱和烃类化合物。
它们的分子式为CnH2n+2。
由于其分子中只有碳-碳单键和碳-氢单键,烷烃无官能团。
例如,甲烷(CH4)、乙烷(C2H6)等都属于烷烃类化合物。
2. 烯烃(Alkenes)烯烃是一类含有碳-碳双键的有机物。
它们的分子式为CnH2n。
烯烃的官能团为碳-碳双键。
乙烯(C2H4)是一种常见的烯烃。
3. 炔烃(Alkynes)炔烃是一类含有碳-碳三键的有机物。
它们的分子式为CnH2n-2。
炔烃的官能团为碳-碳三键。
乙炔(C2H2)是一种常见的炔烃。
4. 醇(Alcohols)醇是一类由羟基(-OH)官能团连接在碳链上的化合物。
它们的命名通常以“-ol”结尾。
醇可根据羟基连接在碳链的位置分为一级、二级和三级醇。
丙醇(C3H7OH)是一种常见的一级醇。
5. 酮(Ketones)酮是一类由碳骨架上的羰基(C=O)官能团连接而成的化合物。
酮的命名通常以“-one”结尾。
丙酮(C3H6O)是一种常见的酮。
6. 醛(Aldehydes)醛是一类由碳骨架上的羰基官能团和至少一个氢原子连接而成的化合物。
醛的命名通常以“-al”结尾。
乙醛(C2H4O)是一种常见的醛。
7. 酸(Acids)酸是一类具有可离子化的羧基(-COOH)官能团的化合物。
它们的命名通常以“-oic acid”结尾。
乙酸(CH3COOH)是一种常见的酸。
8. 酯(Esters)酯是一类由羧酸和醇反应生成的化合物。
酯的命名通常以“-yl”结尾。
乙酸乙酯(C4H8O2)是一种常见的酯。
9. 酰胺(Amides)酰胺是一类由羧酸与氨或胺反应生成的化合物。
酰胺的命名通常以“-amide”结尾。
乙酰胺(C2H5NO)是一种常见的酰胺。

官能团的性质
官能团是有着特定化学性质和反应特点的原子或原子团。
它们可以在有机化合物中识别和发生化学反应。
官能团的性质主要体现在它们对不同化学试剂的反应性以及在化学反应中的作用上。
不同官能团具有不同的性质和反应特点。
以下是几个常见的官能团及其性质:
1. 羟基(-OH)官能团:羟基官能团具有醇的性质,可以形成氢键,并与酸碱反应。
它还可以参与酯化、醚化、醇化、酮化等反应。
2. 羰基(C=O)官能团:羰基官能团包括醛或酮。
醛具有强酸性,可发生加成反应、缩合反应等。
酮相对来说较稳定,但仍可以发生加成反应、部分亲核反应。
3. 羧基(-COOH)官能团:羧基官能团具有较强的酸性,可以与碱发生酸碱中和反应。
羧酸还能与醇发生酯化反应。
4. 氨基(-NH2)官能团:氨基官能团具有亲核性,可与酸、酐等发生反应,形成与之骨架上的碳原子连接的氨基化合物。
总的来说,官能团的性质主要通过与其他官能团的相互作
用和反应来体现。
不同的官能团相互作用和反应方式的差
异使得有机化合物具有多种多样的性质和功能。
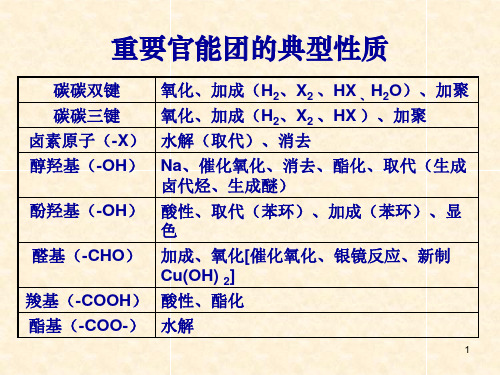
有机化学官能团性质整理本文介绍了有机化学中各种官能团的性质,包括分类、能发生的反应类型以及能否进行某些特定的反应。
其中,能发生取代反应的有烷、烯、炔、苯、卤化烃、醇、酚、醚、醛、酮、羧酸和酯基。
能酯化的有-OH和-COOH。
能发生加成反应的有苯环、C=C、C≡C、-CHO和羰基。
能加聚的有C=C和C≡C。
能水解的有-X和酯基。
苯环上的取代可以通过与液溴反应,使用FeBr3作催化剂来实现。
能发生消去反应的有-X(β-C上有H)和-OH(β-C上有H)。
能发生氧化反应的有醇-OH(α-C上有H)、酚-OH、-CHO、C=C、C≡C和R-C6H5(R为烃基;直接与苯环相连的C上有H),但不包括燃烧反应。
能与酸性高锰酸钾反应(使其褪色)的有醇-OH、酚-OH、-CHO、C=C、C≡C和R-C6H5(R为烃基;直接与苯环相连的C上有H)。
能发生还原反应的有苯环、C=C、C≡C、-CHO和羰基,但都属于上氢还原,是加成反应。
能与H2反应的有苯环、C=C、C≡C、-CHO和羰基。
能与溴水反应的有C=C、C≡C、酚类(苯环上-OH的邻、对位上至少有一个位置有H)和-CHO。
能与Na反应的有醇-OH、酚-OH和-COOH。
能与NaOH反应的有酚-OH和-COOH。
能与Na2CO3反应的有酚-OH和-COOH。
能与NaHCO3反应的有-COOH。
体现酸性的有酚-OH(不能使指示剂变色)和-COOH(可使指示剂变色)。
体现碱性的有-NH2.能与FeCl3反应的有酚-OH。
本文介绍了有机化学中常见的转化关系和实验操作。
其中,烃及其衍生物之间可以通过加成、消去、水解、酯化、加氢等方式相互转化。
重要的转化关系包括直线型转化和有机金三角型转化。
此外,文章还列举了一些重要有机物的制备和检验、鉴别、提纯等实验,以及常见的基本操作,如分液、萃取、蒸馏、分馏、回流、水浴加热、银镜反应和糖类的水解等。
在有机化学中,烃及其衍生物之间的转化关系非常重要。
有机化学之官能团性质总结卤代烃是一种分子结构中含有卤素原子的有机化合物,通式为R—X。
多元饱和卤代烃的通式为CnH2n+2-mXm,其中m为卤原子的个数。
卤代烃能够与NaOH水溶液共热发生取代反应,生成醇。
在碱性条件下,水解更加彻底,但若卤原子与苯环相连,则难以水解。
卤代烃能够跟活泼金属反应生成H2,跟卤化氢或浓氢卤酸发生取代反应生成卤代烃。
此外,卤代烃还能够脱水成醚,催化氧化为醛或酮,去掉氢发生酯化反应,以及被重铬酸钾酸性溶液氧化,由橙红色变为绿色。
醇是一种分子结构中含有羟基的有机化合物,通式为R—OH。
一元醇和饱和多元醇的通式分别为CnH2n+2O和CnH2n+2O。
醇具有弱酸性,比碳酸还要弱,能够与浓溴水发生取代反应生成白色沉淀。
此外,醇遇到FeCl3会呈现出紫色,易被氧化。
醚是一种分子结构中含有醚键的有机化合物,通式为R—O—R'。
酚是一种分子结构中含有酚羟基的有机化合物,通式为CnHnO。
醚具有有极性,能够加成,能够被氧化剂氧化为羧酸。
酚具有弱酸性,能够与FeCl3发生反应,易被氧化。
醛、酮、羧酸是三种常见的含有羰基的有机化合物。
醛的通式为R—CHO,酮的通式为R—CO—R',羧酸的通式为R—COOH。
醛、酮、羧酸具有不同的化学性质,其中醛能够与H2、HCN等加成为醇,能够被氧化剂氧化为羧酸,能够发生银镜反应。
酮不能被氧化剂氧化为羧酸,但其O—H能加成。
羧酸具有酸的通性,能够与含—NH2物质缩去水生成酰胺。
1.肽键是不能被加成的化学键。
2.醋酸可以使苯酚钠变浑浊。
3.甲酸既有酸性又有醛性。
4.酯基中的碳氧单键容易发生水解反应生成羧酸和醇,也可以发生醇解反应生成新酯和新醇。
酯基不稳定,易断裂。
5.一硝基化合物较稳定,但易爆炸。
一般不易被氧化剂氧化,但多硝基化合物易爆炸。
6.有机物的鉴别需要熟悉有机物的性质,抓住某些有机物的特征反应,选用合适的试剂进行鉴别。
7.常用的试剂及其鉴别物质种类和实验现象如下:酸性高锰酸钾溶液:可鉴别含有双键、三键的物质种类和苯,但醇、醛有干扰。
有机化学官能团总结有机化学是化学的一个重要分支,研究有机物的结构、性质、合成和反应规律。
在有机化学中,官能团是指分子中具有特定化学性质的结构基团,它决定了有机物的化学性质和化学反应。
本文将对常见的有机化学官能团进行总结,希望能够帮助读者更好地理解有机化学的基本知识。
1. 烷基。
烷基是由碳和氢原子组成的烷烃基团,是有机化合物中最简单的官能团之一。
它们通常以R表示,是有机物中最常见的官能团之一。
烷基在有机合成中具有重要的作用,常常用于构建更复杂的有机分子结构。
2. 烯基。
烯烃是含有碳碳双键的有机化合物,烯基是由烯烃分子去掉一个氢原子得到的官能团。
烯基具有较高的反应活性,可以发生加成反应、卤代反应等多种化学反应,是有机合成中常见的官能团之一。
3. 炔基。
炔烃是含有碳碳三键的有机化合物,炔基是由炔烃分子去掉一个氢原子得到的官能团。
炔基具有较高的反应活性,可以发生加成反应、卤代反应等多种化学反应,在有机合成中具有重要的应用价值。
4. 羟基。
羟基是氢氧基团与碳原子形成的官能团,是醇类化合物中的主要官能团之一。
羟基具有亲水性和亲电性,可以发生酯化反应、缩合反应等多种化学反应,是有机合成中常见的官能团之一。
5. 羰基。
羰基是碳氧双键与碳原子形成的官能团,是醛、酮、酸酐等化合物中的主要官能团之一。
羰基具有亲电性和亲核性,可以发生加成反应、缩合反应、氧化反应等多种化学反应,是有机合成中常见的官能团之一。
6. 氨基。
氨基是氮原子与碳原子形成的官能团,是胺类化合物中的主要官能团之一。
氨基具有亲电性和亲核性,可以发生取代反应、缩合反应等多种化学反应,是有机合成中常见的官能团之一。
以上是常见的有机化学官能团总结,它们在有机合成中具有重要的作用,决定了有机物的化学性质和化学反应。
希望本文能够帮助读者更好地理解有机化学的基本知识,为进一步学习和研究有机化学打下坚实的基础。
官能团性质与有机反应类型一、主要官能团:①-C=C- 加成、加聚;加成、加聚; ②-C ≡C- 加成加成 ③ 易取代难加成易取代难加成 ④-OH (醇) 置换、取代(卤代、分子间脱水、酯化)、消去(分子内脱水)、氧化氧化 ⑤ 中 和、取代、显色、缩聚和、取代、显色、缩聚 ⑥ -CHO 加成、氧化、还原加成、氧化、还原 ⑦-COOH 中和、脱羧、酯化(取代)(取代) ⑧ -COO- 水解(取代)。
二、一些规律性的东西:①二、一些规律性的东西:① -OH 、-CHO 、-COOH 、-NH 2是亲水基团,分子中数目越多、份量越大,则分子越易溶于水(实质:能与水分子间形成氢键);②能发生加成反应的有:-C=C-、 -C ≡C-、 、-CHO 、-C=O ,而羧基和酯基不能加成!,而羧基和酯基不能加成! ③能发生消去反应只有卤代烃和醇,但没有α-H 则不能消去;④能发生加聚反应的除(则不能消去;④能发生加聚反应的除(HCHO HCHO HCHO)外只有烯烃(乙炔也可以))外只有烯烃(乙炔也可以);⑤能发生缩聚反应的官能团:(酚、醛或酮),二元醇、二元羧酸、氨基酸等双官能团物质;⑥减少碳原子通过脱羧反应,增加碳原子则通过醛或酮的二聚反应或聚合反应;⑦能发生水解反应的为卤代烃、酯、多糖和肽。
卤代烃、酯、多糖和肽。
三、有机反应类型:三、有机反应类型:①取代(卤代、分子间脱水、酯化、磺化、硝化、水解等)①取代(卤代、分子间脱水、酯化、磺化、硝化、水解等)②加成:不饱和变较饱和或饱和,有双键或C ≡C 键的消失键的消失③消去:饱和变不饱和,有双键或C ≡C 键的生成键的生成④加聚:烯烃的特征反应,形成碳链(链上没有N 、O 等杂原子)等杂原子)a 、n A → —A —n (单个单体A )b 、n A + nB → —A —B —n (双单体A 、B ) 【链节和单体化学组成相同】【链节和单体化学组成相同】⑤缩聚:⑤缩聚:a 、n A → —A ′n + n 小分子(单个单体A )b 、n A + nB → —A ′B ′n + n 小分子小分子(双单体A 、B ) 【链节和单体化学组成不相同】【链节和单体化学组成不相同】 ****A A、B 叫单体,方括号内的叫结构单元。
有机化学基础知识
芳香烃苯、甲苯平面构型,12
个原子在同一
平面上
无色有特殊气
味的液体,有
毒,不溶于水,
密度比水小。
1.在氧气中燃烧,生成二氧化碳和水
苯不能使酸性高锰酸钾溶液退色,但甲苯上的甲基可以被甲苯取代,是段性高锰酸钾溶液褪色
2.取代反应:
3.加成反应:
不能使溴的四氯化碳溶液褪色
卤代烃溴乙烷烷烃的氢原子
被卤素(氟、氯、
溴、碘)取代,
空间构型基本
不变
都不溶于水,可
溶于有机溶剂。
氯代烷的沸点
随烃基增大呈
现升高的趋势;
氯代烷的密度
随烃基增大呈
现减小的趋势。
1、取代反应卤代烃在碱性溶液中水解方程式如下:
2、溴乙烷与强碱(NaOH或KOH)的乙醇溶液共热,溴乙烷不再像在NaOH的水溶液那样发生取
代反应,而是从溴乙烷分子中脱去HBr,生成乙烯:
醇乙醇俗称酒精羟基与烃基或
苯环侧链上碳
原子相连的化
合物CH3CH2OH
或C2H5OH 乙醇:1.无色有
特殊气味的液
体,密度比水
小,易挥发,沸
点较低。
能溶解
多种有机物.2.
由于存在氢
1、氧化反应
(1)燃烧:发出淡蓝色火焰,生成二氧化碳和水(蒸气),并放出大量的热,不完全
燃烧时还生成一氧化碳,有黄色火焰,放出热量。
完全燃烧:CH3CH2OH +3O2→2CO2+3H2O
(2)催化氧化:在加热和有催化剂(Cu或Ag)存在的情况下进行。
2 CH3CH2OH +O2→2CH3CHO+2 H2O (工业制乙醛,)
键,,相对分子质量相近的醇和烃,醇的沸点高于烷烃.能与水以任意比互溶.3. 医疗上也常用体积分数为70%—75%的乙醇作消毒剂等。
即催化氧化的实质(用Cu作催化剂)
(3)被酸性高锰酸钾溶液氧化,生成乙酸,即乙醇可以使酸性高锰酸钾溶液褪色
2、酸性
乙醇分子中含有极化的氧氢键,电离时生成烷氧基负离子和质子。
CH3CH2OH→(可逆)CH3CH2O- + H+
2CH3CH2OH + 2Na→2CH3CH2ONa + H2
结论:
(1)乙醇可以与金属钠反应,产生氢气,但不如水与金属钠反应剧烈。
(2)活泼金属(钾、钙、钠、镁、铝)可以将乙醇羟基里的氢取代出来。
3、与氢卤酸反应
CH3CH2OH + HBr→C2H5X + H2O(加热)
CH3CH2OH + HX→ C2H5X + H2O(加热)
4、消去反应
(1)分子内消去制乙烯(170℃浓硫酸)
CH3CH2OH→C2H4↑+H2O
(2)分子间消去制乙醚(140℃浓硫酸)
CH3CH2OH + HOC2H5 →C2H5OC2H5 + H2O(此为取代反应)
5、酯化反应
C2H5OH+CH3COOH-浓H2SO4△(可逆)→CH3COOCH2CH3+H2O
“酸”脱“羟基”,“醇”脱“氢”
6、制备乙醇:
(1)乙烯水化法
CH2═CH2 + H─OH→C2H5OH(催化剂)
(2)卤代烃在碱性溶液中加热
酚苯酚俗称石炭
酸羟基直接与苯
环相连,化学式
为C6H6O结构简
式:C5H5OH
1、常温下为一
种无色晶体。
有毒。
有腐蚀
性,不慎滴落
到皮肤上应马
上用酒精(乙
醇)清洗2、常
1、暴露在空气中被氧气氧化呈粉红色。
2、酸性:酸性强于乙醇弱于碳酸、盐酸等,不能使石蕊试液变色。
温下微溶于
水。
2加热至65摄氏度时能溶于水具有腐蚀性如强酸制弱酸,验证苯酚的酸性弱于碳酸
3、取代反应
用于苯酚的定性检验和定量测定苯酚和FeCl3溶液的反应,由无色变成红色
醛甲醛(水溶液
叫福尔马林)、
乙醛烃基与醛基相
连构成的化合
物简写为:RCHO
1.甲醛:无色
有刺激性气味
的气体,易溶于
水。
2.乙醛:无色
有刺激性气味
的液体,密度比
水小。
易挥发,易燃
烧,能跟谁乙醇
以任意比互溶。
1、氧化反应
(1)氧气氧化乙醛催化氧化:2CH3CHO+O2-→2CH3COOH(催化剂,加热)
(2)银氨溶液:2Ag(NH3)2OH + CH3CHO =(加热) CH3COONH4 + NH3↑ + 2Ag ↓+ H2O
(3)氢氧化铜: CH3CH0 +2Cu(OH)2→△→ CH3COOH +Cu20↓ +2H20(砖红色沉淀)
后两个反应用于醛基的定性检验
2、加成反应
CH3CH0+H2==(催化剂、加热) C2H5OH
酸乙酸:分子式
CH3COOH。
因
是醋的主要
成分,又称醋
酸羧基与烃基直
接相连形成的
化学物。
乙酸的
实验式为CH2O,
化学式为
C2H4O2。
通常被写
为CH3-COOH、
CH3COOH或
CH3CO2H
1、无色有刺激
性气味的液体。
乙酸易溶于水
和乙醇。
当温度
低于熔点时,乙
酸凝结成像冰
一样的晶体,又
称冰醋酸。
1、酸性:酸性CH3COOH > H2CO3 > C6H5OH
2CH3COOH + Na2CO3 ==2CH3COONa + CO2↑+ H2O,能使紫色石蕊试液变红,能和活泼金
属反应生成氢气。
2、酯化反应:
乙酸可以与乙醇在浓硫酸存在并加热的条件下生成乙酸乙酯。
CH3COOH + CH3CH2OH --> CH3COOCH2CH3 + H2O
“酸脱羟基,醇脱氢”
酯乙酸乙酯酸脱羟基,醇脱
氢形成的物质。
通常表示为:
RCOOR’低级酯是具有
芳香气味的液
体,密度一般小
于水易溶于有
机溶剂。
1、水解反应
酸性条件下水解:
CH3COOCH2CH3 + H2O(稀硫酸、加热)←→CH3COOH + CH3CH2OH
碱性条件下水解:
CH3COOCH2CH3 + NaOH(加热)→CH3COONa+ CH3CH2OH 不可逆反应。