(完整版)第十单元__化学与健康__知识点总结
- 格式:doc
- 大小:37.01 KB
- 文档页数:2

第十单元 化学与健康知识总结第一节 食物中的有机物1.六大营养素:蛋白质、糖类、油脂、维生素、无机盐和水前四者是有机物,无机盐和水是无机物。
维生素、无机盐和水可被人体直接吸收。
2.有机化合物化合物有机化合物(有机物)和无机化合物(无机物)。
有机化合物都含有碳元素,但是碳的氧化物(CO CO 2)、碳酸H 2CO 3、碳酸盐Na 2CO 3等具有无机化合物的特点,属于无机化合物。
生活中常见的有机物甲烷CH 4(最简单的有机物、相对分子质量最小的有机物)、乙酸CH 3COOH (俗名:醋酸)、乙醇CH 3CH 2OH (俗名:酒精)、葡萄糖、蔗糖、淀粉、蛋白质等有机物数目庞大的原因:原子的排列方式不同。
根据相对分子质量大小,有机物可分为小分子(如甲烷、乙醇、乙酸、葡萄糖)和有机高分子化合物(如蛋白质、淀粉等)含碳、氢(含碳、氢、氧)的有机物在充分燃烧时,产物都是二氧化碳和水。
而在不充分燃烧时,产物是一氧化碳和水。
3.糖类作用:是生命活动的主要供能物质(食物供给的总能量中60%~70%来自糖类)。
组成:由C 、H 、O 三种元素组成。
又叫做碳水化合物。
常见的糖淀粉:存在于植物种子或块茎中。
如稻、麦、马铃薯等。
淀粉的检验:淀粉遇碘水(I 2)变蓝色。
葡萄糖(人体可直接吸收的糖)呼吸作用:C 6H 12O 6+6O 26CO 2+6H 2O蔗糖:主要存在于甘蔗、甜菜中。
生活中白糖、冰糖、红塘中的主要成分是蔗糖。
4.油脂分类:在常温下,植物油脂呈液态,称为油;动物油脂呈固态,称为脂肪。
功能:提供大量能量。
在正常情况下,每日需摄入50~60g 油脂。
作用:维持生命活动的备用能源,重要的供能物质;促进脂溶性维生素的吸收;保护内脏。
5.蛋白质功能:是构成细胞的基本物质,是机体生长及修补受损组织的主要原料。
成人每天需60~90g 。
存在:动物肌肉、皮肤、毛发、蹄、角的主要成分;植物的种子(如花生、大豆)。
构成:由多种氨基酸(如丙氨酸、甘氨酸等)构成。




九年级化学第十单元知识点化学是一门研究物质及其变化的科学。
在九年级化学课程中,第十单元主要涉及化学的各个知识点,包括离子的形成与键的特性、离子键、金属键和共价键等。
以下是对这些知识点的详细介绍:1. 离子与离子键离子是指由一个或多个原子失去或获得电子而产生的带电粒子。
通常情况下,金属原子会失去电子而形成阳离子,非金属原子会获得电子而形成阴离子。
离子之间由于相互吸引作用而形成离子键。
离子键通常具有高熔点和高沸点,以及良好的导电性。
2. 离子的形成与键的特性离子的形成是由于原子中的电子转移给其他原子导致的,其中正离子失去了一个或多个电子,而负离子获得了一个或多个电子。
离子键具有以下特性:- 离子键是由阳离子与阴离子之间的电荷相吸引形成的;- 离子键是无方向性的,即离子键中的离子可以朝任何方向吸引;- 离子键通常会形成晶体结构。
3. 金属键金属键是由金属元素形成的化学键。
在金属晶体中,金属原子形成球状排列,原子之间共享外层电子,形成电子气体,被称为“海洋模型”。
金属键具有以下特性:- 金属键是由金属原子外层电子形成的电子云相互重叠而形成的;- 金属键是一种无定形化学键,金属原子可以自由移动,因此金属具有良好的导电性和导热性;- 金属键使得金属在常温下呈固体形态,但具有高延展性和高韧性。
4. 共价键共价键是由非金属原子之间的电子共享形成的化学键。
在共价键中,非金属原子共用一个或多个电子对,以满足各自的电子轨道稳定性。
共价键具有以下特性:- 共价键通常形成分子结构,而不是晶体结构;- 共价键具有方向性,电子对在化学键中的方向有一定的偏好;- 共价键可以是单键、双键或三键,取决于原子间的电子共享程度。
通过了解离子键、金属键和共价键,我们可以更好地理解物质之间的化学性质和化学反应的发生机制。
这些知识点对于化学的学习和实践具有重要意义。
总结起来,九年级化学的第十单元主要涉及离子的形成与键的特性、离子键、金属键和共价键等知识点。

第十、十一单元酸、碱、盐、化肥一、酸1、概念:酸是指电离时产生的阳离子全部都是氢离子的化合物。
从化学式上判断的方法——第一个字母是H,除了水和双氧水。
如:硫酸(H2SO4)、盐酸(HCl)等。
2、酸的通性:酸具有通性的原因是:酸电离时产生的阳离子全部是H+,所以酸的通性其实就是H+所表现出来的性质。
(1)与酸碱指示剂反应:使紫色石蕊试液变红色,不能使无色酚酞试液变色;(2)与活泼金属单质反应:金属+酸→ 盐+氢气(置换反应);2HCl +Fe === FeCl2 + H2↑H2SO4 + Fe === FeSO4 + H2↑2HCl +Zn === Zn Cl2 + H2↑ H2SO4 + Zn === Zn SO4 + H2↑注:①只有排在H之前的金属才发生此反应;必记镁、锌、铁与酸的反应②酸――稀盐酸、稀硫酸;(3)与碱性氧化物反应:酸+碱性氧化物→ 盐+水6HCl +Fe2O3 === 2FeCl3+3H2O 3H2SO4 + Fe2O3 === Fe2(SO4)3+ 3H2O (以上两个反应说明:稀盐酸和稀硫酸可用于除铁锈)HCl +CuO === CuCl2+H2O H2SO4+ CuO === CuSO4 + H2O (以上两个反应都可用于除去Cu粉中混有少量的CuO)(4)与碱反应:酸+碱→ 盐+水(复分解反应);HCl +KOH === KCl +H2O H2SO4+ 2NaOH === Na2SO4 +2 H2O2HCl +Cu(OH)2 === CuCl2+2H2O 3H2SO4+ Fe(OH)3 ===Fe 2(SO4)3+ 3H2O3HCl +Al(OH)3 === AlCl3+3H2O 用Al(OH)3治疗胃酸过多的原理(5)与盐反应:酸+盐→ 另一种盐+另一种酸(复分解反应)HCl +AgNO3 === H NO3 +AgCl↓ (用于:检验Cl-)H2SO4+BaCl2 === 2HCl +BaSO4↓ (用于:检验SO42-)2HCl +Na2CO3 ===2 NaCl +H2O+CO2↑ (用于:a、灭火器反应;b、检验CO32-;c、检验NaOH是否变质(Na2CO3);d、除去NaCl中的Na2CO3)2HCl +CaCO3 === CaCl2+H2O+CO2↑ 用于:a、实验室制CO2;b、除去盛石灰水瓶壁上的白色固体(CaCO3);c、证明CaO中是否含有未完全分解的CaCO3;d、食用墨鱼骨粉(含有CaCO3)补钙的原理3注:①浓硫酸具有吸水性所以可以作为许多气体干燥剂,能干燥中性、酸性的气体,如:氧气、氯化氢、二氧化碳、二氧化硫、氯气等;②浓硫酸溶于水会放热,所以稀释浓硫酸时要将浓硫酸加入水中,并不断搅拌。

第十单元化学与健康知识总结第一节食物中的有机物1.六大营养素:蛋白质、糖类、油脂、维生素、无机盐和水前四者是有机物,无机盐和水是无机物。
维生素、无机盐和水可被人体直接吸收。
2.有机化合物化合物有机化合物(有机物)和无机化合物(无机物)。
有机化合物都含有碳元素,但是碳的氧化物(COCO2)、碳酸H2CO3、碳酸盐Na2CO3等具有无机化合物的特点,属于无机化合物。
生活中常见的有机物甲烷CH4(最简单的有机物、相对分子质量最小的有机物)、乙酸CH3COOH(俗名:醋酸)、乙醇CH3CH2OH(俗名:酒精)、葡萄糖、蔗糖、淀粉、蛋白质等有机物数目庞大的原因:原子的排列方式不同。
根据相对分子质量大小,有机物可分为小分子(如甲烷、乙醇、乙酸、葡萄糖)和有机高分子化合物(如蛋白质、淀粉等)含碳、氢(含碳、氢、氧)的有机物在充分燃烧时,产物都是二氧化碳和水。
而在不充分燃烧时,产物是一氧化碳和水。
3.糖类作用:是生命活动的主要供能物质(食物供给的总能量中60%~70%来自糖类)。
组成:由C、H、O三种元素组成。
又叫做碳水化合物。
常见的糖淀粉:存在于植物种子或块茎中。
如稻、麦、马铃薯等。
淀粉的检验:淀粉遇碘水(I2)变蓝色。
葡萄糖(人体可直接吸收的糖)呼吸作用:C6H12O6+6O26CO2+6H2O蔗糖:主要存在于甘蔗、甜菜中。
生活中白糖、冰糖、红塘中的主要成分是蔗糖。
4.油脂分类:在常温下,植物油脂呈液态,称为油;动物油脂呈固态,称为脂肪。
功能:提供大量能量。
在正常情况下,每日需摄入50~60g油脂。
作用:维持生命活动的备用能源,重要的供能物质;促进脂溶性维生素的吸收;保护内脏。
5.蛋白质功能:是构成细胞的基本物质,是机体生长及修补受损组织的主要原料。
成人每天需60~90g。
存在:动物肌肉、皮肤、毛发、蹄、角的主要成分;植物的种子(如花生、大豆)。
构成:由多种氨基酸(如丙氨酸、甘氨酸等)构成。
6.维生素存在:水果、蔬菜、鱼类等。

初中化学第十章知识点第十章是初中化学中的化学实验章节,主要讲述了化学实验中的一些常见知识点和实验技巧。
下面是这一章的重点内容:1.实验室安全:化学实验中存在一些危险因素,因此在实验室中需要注意安全。
要穿着实验室服装,戴上安全眼镜和手套。
实验室中应保持干燥清洁,不要随意乱丢废弃物。
2.实验室常用仪器:常用的实验室仪器有实验室瓶、移液管、试管、玻璃棒、胶头滴管等。
这些仪器的使用需要一定的技巧和规范操作。
3.移液操作:移液是实验中常见的操作,使用移液管可以方便地进行液体的转移。
使用移液管时,要注意操作轻柔,尽量避免液滴带到吸头外部或尾端。
4.实验室常用试剂:实验室中有许多常用的试剂,如氢氧化钠、盐酸、氢氧化钾、稀硫酸等。
在使用这些试剂时,应该知道其性质和用途,遵守操作规范。
5.溶液的配制:实验中需要制备不同浓度的溶液。
溶液的配制要按照一定的比例和方法进行,通常可以通过称量或定容打标法配制。
在配制过程中,要注意工具的清洁,避免交叉污染。
6.酸碱中和反应:酸碱中和是指酸和碱反应生成盐和水的化学反应。
在实验中可以通过酸碱指示剂改变颜色来观察反应的进行。
酸碱中和反应具有放热的特点。
7.硬水与软水的实验:硬水中含有较多的钙、镁等离子,不易起泡和溶解肥皂。
软水中这些离子含量较低。
通过实验可以了解硬水和软水的性质和区别。
8.酸碱中和滴定实验:滴定实验是一种实验室常用的定量分析方法,用于确定溶液浓度。
滴定实验中需要使用量具,并根据滴定终点的颜色变化来判断反应是否结束。
9.气体的制取和收集:气体在实验中是常见的物质形态之一、气体的制取和收集可以通过实验装置实现,如气体瓶、集气瓶等。
在实验中要注意气体的防漏和防爆。
10.分离技术:实验中常使用一些分离技术,如过滤、蒸发、结晶、蒸馏、萃取等。
通过这些分离技术可以分离混合物中的不同物质,实现纯净物质的获取。

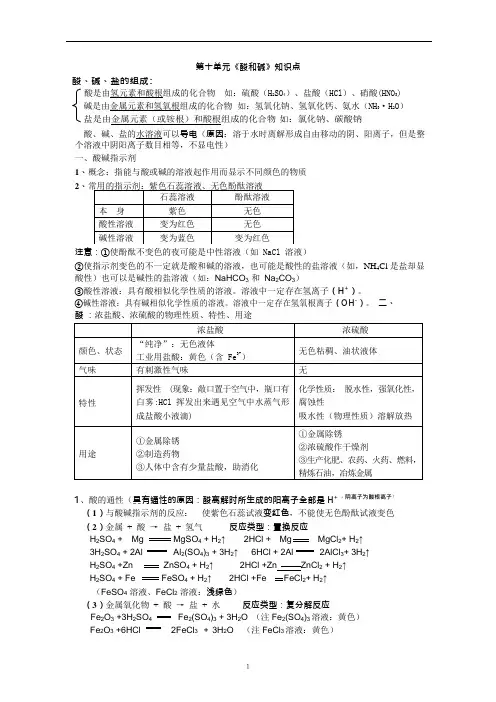
第十单元《酸和碱》知识点酸、碱、盐的组成:酸是由氢元素和酸根组成的化合物 如:硫酸(H 2SO 4)、盐酸(HCl )、硝酸(HNO 3) 碱是由金属元素和氢氧根组成的化合物 如:氢氧化钠、氢氧化钙、氨水(NH 3·H 2O ) 盐是由金属元素(或铵根)和酸根组成的化合物 如:氯化钠、碳酸钠 酸、碱、盐的水溶液可以导电(原因:溶于水时离解形成自由移动的阴、阳离子,但是整 个溶液中阴阳离子数目相等,不显电性) 一、酸碱指示剂1、概念:指能与酸或碱的溶液起作用而显示不同颜色的物质2、注意:①使酚酞不变色的夜可能是中性溶液(如 NaCl 溶液) ②使指示剂变色的不一定就是酸和碱的溶液,也可能是酸性的盐溶液(如,NH 4Cl 是盐却显 酸性)也可以是碱性的盐溶液(如:NaHCO 3 和 Na 2CO 3)③酸性溶液:具有酸相似化学性质的溶液。
溶液中一定存在氢离子(H +)。
④碱性溶液:具有碱相似化学性质的溶液。
溶液中一定存在氢氧根离子(OH -)。
二、酸 :浓盐酸、浓硫酸的物理性质、特性、用途1、酸的通性(具有通性的原因:酸离解时所生成的阳离子全部是 H + ,阴离子为酸根离子)(1)与酸碱指示剂的反应: 使紫色石蕊试液变红色,不能使无色酚酞试液变色 (2)金属 + 酸 → 盐 + 氢气 反应类型:置换反应 H 2SO 4 + Mg MgSO 4 + H 2↑ 2HCl + Mg MgCl 2+ H 2↑ 3H 2SO 4 + 2Al Al 2(SO 4)3 + 3H 2↑ 6HCl + 2Al 2AlCl 3+ 3H 2↑ H 2SO 4 +Zn ZnSO 4 + H 2↑ 2HCl +Zn ZnCl 2 + H 2↑ H 2SO 4 + Fe FeSO 4 + H 2↑ 2HCl +Fe FeCl 2+ H 2↑ (FeSO 4 溶液、FeCl 2 溶液:浅绿色)(3)金属氧化物 + 酸 → 盐 + 水 反应类型:复分解反应 Fe 2O 3 +3H 2SO 4 Fe 2(SO 4)3 + 3H 2O (注 Fe 2(SO 4)3 溶液:黄色) Fe 2O 3 +6HCl 2FeCl 3 + 3H 2O (注 FeCl 3 溶液:黄色)CuO + 2HCl CuCl2 + 2H2O (注CuCl2溶液:蓝色)CuO + H2SO4CuSO4 + H2O (注CuSO4溶液:蓝色)(4)碱+ 酸→ 盐+ 水反应类型:复分解反应(中和反应)HCl + NaOH NaCl + H2O 2HCl + Ca(OH)2CaCl2 + 2H2OH2SO4 + 2NaOH Na2SO4 + 2H2O(5)盐+ 酸→ 另一种盐+ 另一种酸反应类型:复分解反应H2SO4 + BaCl2BaSO4↓+ 2HCl (注BaSO4沉淀:白色,不溶于稀硝酸)2HCl + Na2CO32NaCl + CO2↑+ H2O2HCl + CaCO3CO2↑+ CaCl2 + H2OHCl + NaHCO3 H2O + NaCl +CO2↑HCl + AgNO3HNO3+ AgCl↓(注AgCl 沉淀:白色,不溶于稀硝酸)注意:①三大强酸:浓硫酸(易吸水),浓盐酸(易挥发),浓硝酸(易挥发)都密封保存。

第十单元化学与健康知识总结
第一节食物中的有机物
1.六大营养素:蛋白质、糖类、油脂、维生素、无机盐和水前四者是有机物,无机盐和水是无机物。
维生素、无机盐和水可被人体直接吸收。
2.有机化合物
化合物有机化合物(有机物)和无机化合物(无机物)。
有机化合物都含有碳元素,但是碳的氧化物(CO CO2)、碳酸H2CO3、碳酸盐Na2CO3等具有无机化合物的特点,属于无机化合物。
生活中常见的有机物甲烷CH4(最简单的有机物、相对分子质量最小的有机物)、乙酸CH3COOH(俗名:醋酸)、乙醇CH3CH2OH(俗名:酒精)、葡萄糖、蔗糖、淀粉、蛋白质等
有机物数目庞大的原因:原子的排列方式不同。
根据相对分子质量大小,有机物可分为小分子(如甲烷、乙醇、乙酸、葡萄糖)和有机高分子化合物(如蛋白质、淀粉等)
含碳、氢(含碳、氢、氧)的有机物在充分燃烧时,产物都是二氧化碳和水。
而在不充分燃烧时,产物是一氧化碳和水。
3.糖类
作用:是生命活动的主要供能物质(食物供给的总能量中60%~70%来自糖类)。
组成:由C、H、O三种元素组成。
又叫做碳水化合物。
常见的糖
淀粉:存在于植物种子或块茎中。
如稻、麦、马铃薯等。
淀粉的检验:淀粉遇碘水(I2)变蓝色。
葡萄糖(人体可直接吸收的糖)呼吸作用:C6H12O6+6O26CO2+6H2O
蔗糖:主要存在于甘蔗、甜菜中。
生活中白糖、冰糖、红塘中的主要成分是蔗糖。
4.油脂
分类:在常温下,植物油脂呈液态,称为油;动物油脂呈固态,称为脂肪。
功能:提供大量能量。
在正常情况下,每日需摄入50~60g油脂。
作用:维持生命活动的备用能源,重要的供能物质;促进脂溶性维生素的吸收;保护内脏。
5.蛋白质
功能:是构成细胞的基本物质,是机体生长及修补受损组织的主要原料。
成人每天需60~90g。
存在:动物肌肉、皮肤、毛发、蹄、角的主要成分;植物的种子(如花生、大豆)。
构成:由多种氨基酸(如丙氨酸、甘氨酸等)构成。
6.维生素
存在:水果、蔬菜、鱼类等。
作用:调节新陈代谢、预防疾病、维持身体健康。
缺维生素A会引发夜盲症;缺维生素C会引发坏血症。
多数在人体中不能直接合成,需从食物中摄取。
糖类、蛋白质、油脂的热值:脂肪>蛋白质>糖类
人体内含量最多的物质是水。
第二节化学元素与人体健康
在人体内含量超过0.01%的元素有11种,称为常量元素。
如氧、碳、氢、氮、钙等。
含量在0.01%以下的元素,称为微量元素。
如铁、铜、锌、氟、碘、硒等。
人体中的常量元素
钙
来源:奶类、绿色蔬菜、水产品、肉类、豆类
钙摄入量过多的表现:结石、骨骼变粗
缺钙的表现:(青少年)佝偻病、发育不良;(老年人)骨质疏松
99%存在于骨骼和牙齿中。
成人体内约含钙1.2kg,主要以羟基磷酸钙的形式存在。
钠和钾
Na+:存在于细胞外液,人体内含钠80~120g。
K+:存在于细胞内液,成人每千克含钾约2g。
作用:维持人体内的水分和维持体液恒定的pH。
人体中的微量元素必需元素20多种;汞、铅、镉等是对人体有害的元素。
即使是必需元素,也要合理摄入。
第三节远离有毒物质
蛋白质的性质(维持生长发育,组织更新)
蛋白质的变性(不可逆):破坏蛋白质的结构,使其变质。
引起蛋白质变质的因素:
物理:高温、紫外线等
化学:强酸、强碱、重金属盐(银离子、铜离子、汞离子、钡离子)、有机物(甲醛、酒精)等
应用:用甲醛水溶液(福尔马林)制作动物标本,使标本长期保存。
血红蛋白:由血红素(含亚铁离子)和蛋白质构成作用:运输氧气和二氧化碳的载体(血红蛋白+O2→氧合血红蛋白)
一氧化碳中毒的原因:血红蛋白与一氧化碳的结合能力比与氧气结合的能力强200倍。
结合了一氧化碳的血红蛋白不能再与氧气结合,人就会缺氧窒息而死亡。
香烟烟气中含有一氧化碳、尼古丁、焦油等有毒物质。
酶:酶是生物催化剂。
特点:高效性、选择性、专一性
蛋白质的检验:点燃,如果有烧焦羽毛的气味,就说明有蛋白质。
富含淀粉的食物容易发生霉变(产生黄曲霉素)。
只有温度达到280℃以上才能破坏黄曲霉素,所以霉变食物绝对不能食用。