有机反应类型及有机物化学性质总结
- 格式:docx
- 大小:100.90 KB
- 文档页数:5
有机化合物(烃)化学性质总结,专题二
有机化合物(烃)化学性质总结
物理性质小结:
1、常温下为气体的有:烃[C x H Y]:当x≤4时;卤代烃:只有一氯甲烷[CH3Cl]。
以上均为无色难溶于水。
含氧衍生物:只有甲醛[CH2O],无色易溶于水。
均为无色
气体。
2、常温下为液体的有:烃[C x H Y]:当x>4时。
卤代烃:除一氯甲烷外卤代烃。
烃的含氧衍生物[C x H Y O Z]:除CH2O(甲醛)外低级衍生物。
硝基苯。
溴苯。
一般无
色,油状,易挥发,比水的密度小(硝基苯、溴苯、四氯化碳的密度比水大)。
卤代烃:除CH3Cl为气体外其余常见的卤代烃为油状液体。
难溶于水。
3、常温下为固体的有:饱和高级脂肪酸、饱和高级脂肪酸甘油酯(油脂)、高级脂肪酸盐、所有糖类、所有高分子化合物、肽、三溴苯酚、三硝基苯酚、三硝基甲苯
等均为固体。
(所有的高分子化合物、油脂一定是混合物)。

高中化学有机知识点总结有机化学是化学的一个重要分支,研究的是含碳的化合物及其反应。
在高中化学学习中,有机化学是一个重要的内容,下面将对高中化学有机知识点进行总结。
一、有机物的基本概念。
有机物是由碳、氢和其他元素组成的化合物,是生命的基础,包括石油、天然气、煤炭等。
有机物可以分为饱和碳氢化合物、不饱和碳氢化合物和含官能团的化合物等几类。
二、有机物的命名。
有机物的命名是有一定规律可循的,一般按照主链选择、取代基前缀和后缀等规则进行命名。
例如,甲烷、乙烷、乙烯、乙炔等都是常见的有机物命名。
三、有机反应的基本类型。
有机反应主要包括加成反应、消除反应、取代反应和重排反应等几种基本类型。
在化学实验中,这些反应类型都有着重要的应用。
四、有机物的性质。
有机物的性质主要包括物理性质和化学性质两个方面。
物理性质包括熔点、沸点、溶解性等,而化学性质则包括燃烧、氧化、还原等。
五、有机物的应用。
有机物在生活和工业中有着广泛的应用,例如石油加工、合成材料、医药、染料等领域都有着重要的地位。
六、有机物的环境问题。
随着工业的发展,有机物的排放也带来了环境污染的问题。
例如,汽车尾气中的有机物排放对大气环境造成了一定的影响。
七、有机物的未来发展。
随着科学技术的不断进步,有机化学领域也在不断发展。
新材料、新能源、环保技术等都离不开有机化学的支持。
综上所述,高中化学有机知识点的总结涉及到有机物的基本概念、命名、反应类型、性质、应用、环境问题和未来发展等方面。
通过对这些知识点的了解和掌握,可以更好地理解有机化学的重要性和应用价值,为将来的学习和研究打下坚实的基础。

高中化学有机(yǒujī)反响(fǎnxiǎng)总结(zǒngjié)高中化学有机(yǒujī)反响(fǎnxiǎng)总结1、取代反响:有机物分子里的某些原子或原子团被其他原子或原子团所取代的反响。
⑴硝化反响:苯分子里的氢原子被NO2所取代的反响。
⑵磺化反响:苯分子里的氢原子被硫酸分子里的磺酸基〔SO3H〕所取代的反响。
⑶酯化反响:酸和醇起作用生成酯和水的反响。
⑷水解反响:一般指有机化合物在一定条件下跟水作用生成两种或多种物质的化学反响。
〔其中皂化反响也属于水解反响。
皂化反响:油脂在有碱存在的条件下水解,生成高级脂肪酸钠和甘油的反响。
〕水解反响包括卤代烃水解、酯水解、糖水解、|白质水解。
另:缩聚反响也属于取代反响。
2、加成反响:有机物分子中双键〔叁键〕两端的碳原子与其他原子或原子团所直接结合生成新的化合物的反响。
⑴油脂的氢化反响属于加成反响。
油脂的氢化:液态油在催化剂〔如Ni〕存在并加热、加压的条件下,跟氢气起加成反响,提高油脂的饱和度的反响,也叫油脂的硬化。
⑵水化反响:在有机化学中指分子中不饱和键〔双键或叁键〕或羰基在催化剂存在或不存在下和水分子化合的反响。
3、消去反响:有机化合物在一定条件下,从一个分子中脱去一个小分子〔如H2O、HBr等〕,而生成不饱和〔含双键和叁键〕化合物的反响。
4、聚合反响:由相对分子质量小的化合物分子结合成相对分子质量较大的高分子化合物的反响。
⑴加聚反响:由不饱和的相对分子质量小的化合物分子结合成相对分子质量较大的高分子化合物的反响。
这样的聚合反响同时也是加成反响,所以叫加聚反响。
⑵缩聚反响:由相对分子质量小的化合物分子结合成相对分子质量较大的高分子化合物,同时生成小分子〔如H2O、NH3、H某等分子〕的反响。
5、氧化反响:在有机反响中,通常把有机物分子中参加氧原子或失去氢原子的反响叫氧化反响。
6、复原反响:在有机反响中,通常把有机物分子中参加氢原子或失去氧原子的反响叫氧化反响。

高中化学中有机化学的知识点总结8篇第1篇示例:高中化学中有机化学是高中化学课程中的重要部分,主要研究有机物的结构、性质、合成方法和反应机理等内容。
有机化学知识是高中化学学习的难点,掌握有机化学知识对于高中化学学习和日常生活都有重要意义。
下面就是有机化学的一些重要知识点总结:1. 有机物的定义有机化学研究的是含有碳元素的化合物,碳元素是有机物的主要组成元素,因此有机物也被称为碳化合物。
有机物包括烃类、醇类、醛酮类、羧酸类等多种化合物。
2. 有机化合物的分类有机化合物主要分为脂肪烃、环烷烃、环烯烃、芳香烃、醇、醚、醛、酮、羧酸、酯等多种类别,每种类别都有其独特的特性和反应规律。
3. 有机物的结构有机物的结构包括分子式、结构式、键式和构象式等不同表示方法,通过这些表示方法可以清晰地描述有机物的分子结构和化学键构型。
4. 有机物的性质有机物具有多样性和复杂性的性质,包括物理性质(如沸点、熔点、密度等)和化学性质(如稳定性、溶解性、反应性等)。
5. 有机合成方法有机化学是有机合成的基础,有机合成方法包括加成反应、取代反应、消除反应、重排反应等多种方法,通过这些方法可以合成各种有机化合物。
6. 有机反应机理有机反应机理是研究有机反应过程中的原子或基团之间的结合和断裂规律,包括亲核取代、亲电取代、自由基取代等不同类型的有机反应机理。
7. 有机化学在生活中的应用有机化学在生活中有广泛的应用,例如食品添加剂、药物、化妆品、材料合成等领域都离不开有机化学知识。
第2篇示例:高中化学中有机化学的知识点总结有机化学是化学的一个重要分支,研究有机物的结构、性质、合成和反应规律。
在高中化学课程中,有机化学是一个重要的部分,学生需要掌握一定的有机化学知识。
下面我们来总结一下高中化学中有机化学的知识点。
1. 有机物的结构有机物是由碳和氢组成的化合物,其中碳是主要元素。
有机物的结构可以分为链状结构、环状结构和支链结构。
根据碳原子之间的连接方式不同,有机物可以是直链烷烃、环烷烃、烯烃、炔烃、芳香烃等不同类型。


有机物化学性质总结官能团与Na或K反应放出H2:醇羟基、酚羟基、羧基与NaOH溶液反应酚羟基、羧基、酯基、C-X键与 Na2CO3 溶液反应酚羟基(不产生CO2)、羧基(产生CO2)与NaHCO3溶液反应羧基与H2发生加成反应(即能被还原)碳碳双键、碳碳叁键、醛基、酮羰基、苯环不易与 H2 发生加成反应羧基、酯基能与H2O、HX、X2 发生加成反应碳碳双键、碳碳叁键能发生银镜反应或能与新制Cu(OH)2反应生成砖红色沉淀醛基使酸性KMnO4溶液褪色或使溴水因反应而褪色碳碳双键、碳碳叁键、醛基能被氧化(发生还原反应)醛基、醇羟基、酚羟基、碳碳双键碳碳叁键发生水解反应酯基、C-X键、酰胺键发生加聚反应碳碳双键与新制Cu(OH)2 悬浊液混合产生降蓝色生成物多羟基能使指示剂变色羧基使溴水褪色且有白色沉淀酚羟基遇FeCI3溶液显紫色酚羟基使酸性KMnO4溶液褪色但不能使溴水褪色苯的同系物使I2变蓝淀粉使浓硝酸变黄蛋白质12.有机物溶解性规律根据相似相溶规则,有机物常见官能团中,醇羟基、羧基、磺酸基、酮羰基等为亲水基团,硝基、酯基、C—X键等为憎水基团.当有机物中碳原子数较少且亲水基团占主导地位时,物质一般易溶于水;当有机物中憎水基团占主导地位时,物质一般难溶于水。
常见不溶于水的有机物:烃、卤代烃、酯、淀粉、纤维素不溶于水密度比水大:CCI4、溴乙烷、溴苯、硝基苯不溶于水密度比水小:苯、酯类、烃【复习】甲烷的化学性质:1.稳定性:通常情况下,甲烷的化学性质比较稳定,跟强酸、强碱不反应。
2.不能使酸性高锰酸钾溶液褪色—-不与强氧化剂反应,3.不能使溴水褪色(既不发生取代反应,也不发生加成反应)。
4.取代反应——卤代反应:CH4 + Cl2CH3Cl + HClCH3Cl + Cl2CH2Cl2 + HClCH2Cl2 + Cl2CHCl3 + HClCHCl3 + Cl2CCl4 + HCl【现象】1.黄绿色逐渐褪去2.试管内液面逐渐上升3.试管壁上有油状液滴生成5.氧化反应:①纯净的甲烷可在空气中安静的燃烧,火焰为明亮的蓝色,无黑烟CH4 + 2O2点燃CO2 + 2H2O②不纯的甲烷点燃会发生爆炸,所以点燃前必须检验纯度。

高考化学有机反应类型总结
高考化学中的有机反应类型是化学考试中的重要考点,也是学生需要掌握的重要知识点。
以下是对高考化学有机反应类型的总结:
一、取代反应
取代反应是有机化学中最常见的反应类型之一,它涉及到有机物分子中的原子或基团被其他原子或基团所取代。
例如,甲烷与氯气在光照条件下发生取代反应,生成氯代甲烷和氯化氢。
二、加成反应
加成反应是烯烃和炔烃与氢气、卤素或卤化氢等发生反应,生成饱和烃或卤代烃的反应。
例如,乙烯与氢气发生加成反应,生成乙烷。
三、消去反应
消去反应是有机化学中另一种常见的反应类型,它涉及到有机物分子中的羟基或卤素原子与相邻的碳原子上的氢原子结合,生成不饱和键的反应。
例如,乙醇发生消去反应,生成乙烯。
四、酯化反应
酯化反应是有机酸和醇发生反应,生成酯和水的反应。
例如,乙酸和乙醇发生酯化反应,生成乙酸乙酯和水。
五、水解反应
水解反应是有机酸或酯等在水中发生分解的反应。
例如,乙酸乙酯在酸性条件下发生水解反应,生成乙酸和乙醇。
六、氧化还原反应
氧化还原反应是有机化学中涉及电子转移的反应,包括氧化和还原两个过程。
例如,烯烃与臭氧发生氧化还原反应,生成醛或酮。
以上是对高考化学有机反应类型的总结,学生需要掌握每种反应类型的概念、原理和实例,以便能够正确理解和应用这些知识。
同时,学生还需要注意不同反应类型之间的联系和区别,以便能够更好地掌握有机化学的知识体系。

有机化学基础知识点归纳总结有机化学是研究有机化合物及其反应的科学,是现代化学的重要分支之一。
以下是有机化学基础知识点的归纳总结:1. 烷基和取代基:烷基指的是链状的碳氢化合物,而取代基则是在烷基上替换一个或多个氢原子的基团。
常见的取代基包括甲基、乙基、氯基、羟基等。
2. 性质和结构:有机化合物的物理和化学性质与其分子结构密切相关。
如碳氢化合物的熔点、沸点都随着分子量的增加而增加,而卤代烃的沸点则随着卤原子的原子量增加而增加。
3. 反应类型:有机化合物的反应类型包括加成反应、消除反应、置换反应、重排反应等。
加成反应指的是两个分子中的部分或全部原子互相连接的反应,如烯烃与卤代烃的加成反应。
消除反应指的是一个分子中的两个部位分离为不同分子的反应,如丙酮的酸催化消除反应。
置换反应指的是分子中的一个基团取代为其他基团的反应,如苯甲酸酯的酸催化酯化反应。
重排反应指的是某个化合物分子内部一种原子或团在分子内位置的改变,如烷基重排反应。
4. 覆盖率:化学反应可存在覆盖率的概念,指的是参与反应的反应物分子中,有多少个分子在反应前后都处于反应中心附近。
覆盖率越高,反应速率越快。
5. 难易度:有机反应的难易度受多个因素影响,如反应类型、反应物性质、反应条件等。
通常情况下,反应难度较高的反应物往往需要更为严苛的条件,如高温、高压、酸碱催化剂等。
6. 电子云结构:有机化合物中的原子间的化学反应往往受到电子云的影响。
电子云分布的极性与化学性质密切相关,官能团中的电子云结构不同,反应性质也会有所不同。
7. 立体化学:有机化合物中还有立体异构体的存在,这些异构体的反应性质和化学性质都不尽相同。
常见的立体异构体有手性异构体和立体异构体两类。
8. 基础性质:有机化合物中的一些化合物具有弱酸或弱碱性质,例如羧酸、醇、胺等。
这些化合物的酸碱性质可以通过pH值来描述,pH值越低,酸性越强,pH值越高,碱性越强。

高中化学所有有机化学的官能团性质,反应类型,引入官能团,反应条件一、卤基(卤原子):水解也称取代(氢氧化钠溶液),消去(氢氧化钠醇溶液)酚羟基:显色(Fecl3)羧基:和醇发生酯化(浓硫酸加热)还原(+H2)中和醇羟基:酯化,取代,消去CC双键和叁建:加成,聚合反应(加聚)羰基:银镜酯基:水解(生成醇和羧酸)苯基:加成,取代,磺化,硝化都能发生氧化反应(+O2点燃)同时带羟基和羧基的化合物还能发生缩聚取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。
加成反应:有机物分子里不饱和的碳原子跟其他原子或原子团直接结合的反应。
聚合反应:一种单体通过不饱和键相互加成而形成高分子化合物的反应。
加聚反应:一种或多种单体通过不饱和键相互加成而形成高分子化合物的反应。
消去反应:从一个分子脱去一个小分子(如水.卤化氢),因而生成不饱和化合物的反应。
氧化反应:有机物得氧或去氢的反应。
还原反应:有机物加氢或去氧的反应。
酯化反应:醇和酸起作用生成酯和水的反应。
水解反应:化合物和水反应生成两种或多种物质的反应(有卤代烃、酯、糖等)1.氧化反应:有机物得氧或去氢的反应。
甲烷燃烧CH4+2O2→CO2+2H2O(条件为点燃)甲烷隔绝空气高温分解甲烷分解很复杂,以下是最终分解。
CH4→C+2H2(条件为高温高压,催化剂)乙烯燃烧 CH2=CH2+3O2→2CO2+2H2O(条件为点燃)乙炔燃烧C2H2+3O2→2CO2+H2O (条件为点燃)苯燃烧 2C6H6+15O2→12CO2+6H2O (条件为点燃)乙醇完全燃烧的方程式C2H5OH+3O2→2CO2+3H2O (条件为点燃)乙醇的催化氧化的方程式2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)(这是总方程式)2. 取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。
甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HCl CH3Cl+Cl2→CH2Cl2+HClCH2Cl2+Cl2→CHCl3+HCl CHCl3+Cl2→CCl4+HCl (条件都为光照。

高中化学的归纳有机化学总结有机化学是化学科学中的一个重要分支,研究有机化合物的结构、性质、合成、反应和应用等方面。
在高中化学学习中,有机化学是一个非常重要的内容,本文将对高中有机化学的归纳总结进行探讨。
一、有机化学基础知识有机化学的基础知识是高中化学学习的重点,包括分子构建、键的类型、化学键的性质等。
分子构建是有机化学的基础,分子的构成元素和原子组成决定了有机化合物的性质。
有机分子中常见的键类型有共价键和极性共价键,它们的性质决定了分子的稳定性和反应性。
二、有机化学的反应类型有机化学的反应类型是高中化学学习中的重要内容。
常见的有机化学反应类型包括取代反应、加成反应、消除反应等。
取代反应是指有机化合物中一个原子或官能团被另一个原子或官能团所取代,这种反应一般以化学键的形式进行。
加成反应是指两个或多个分子相互作用形成新的化学键,而不改变原分子结构。
消除反应是指有机化合物中两个官能团结合脱离,生成一个双键或三键的反应。
三、有机化学的官能团官能团是有机化合物中具有特定化学性质的原子或原子团,不同的官能团对化合物的性质具有重要影响。
常见的有机化学官能团包括醇、酮、醛、酸、酯等。
醇是带有羟基(-OH)的化合物,具有亲水性和酸碱中性。
酮和醛由羰基(C=O)功能团构成,具有不同的化学性质。
酸是带有羧基(-COOH)的化合物,具有酸性。
酯是由酸和醇缩合而成,具有特定的酯基结构。
四、有机化学的命名规则有机化学的命名规则是高中化学学习中需要重点掌握的内容。
根据命名规则,有机化合物的命名主要包括链状碳骨架的命名和官能团的命名。
链状碳骨架的命名根据碳原子数和官能团的位置进行命名,而官能团的命名则依据官能团的特点和位置进行命名。
五、有机化学实验技术有机化学实验技术是高中化学学习中不可或缺的一部分,它包括有机合成方法、分离纯化技术和分析表征技术等。
有机合成方法是指通过化学反应得到目标有机化合物的方法,常见的有机合成方法包括酯化反应、醛缩合反应等。

有机化学十种反应类型详细总结有机化学是研究有机化合物及其反应的学科。
有机化学的基础是有机化合物的结构和性质,而反应则是有机化合物进行的化学变化过程。
有机化学中存在着多种不同类型的反应,下面将详细总结十种常见的有机化学反应类型。
1. 取代反应(Substitution Reaction):取代反应是指一个原子或功能团被另一个原子或功能团替代的反应。
例如,醇与卤代烃发生取代反应生成醚。
2. 加成反应(Addition Reaction):加成反应是指两个或多个分子中的一个或多个键被打开,产生新的化学键。
例如,烯烃与卤代烃发生加成反应生成卤代烃。
3. 消除反应(Elimination Reaction):消除反应是指一个分子中的两个官能团之间的键被断开,形成双键或三键。
例如,醇脱水生成烯烃为消除反应。
4. 氧化还原反应(Redox Reaction):氧化还原反应是指一个物质被氧化,同时另一个物质被还原。
例如,醛被氧化为酸为氧化还原反应。
5. 缩合反应(Condensation Reaction):缩合反应是指两个或多个分子结合成一个分子,同时释放出一些小分子。
例如,醛与酒发生缩合反应生成醚。
6. 活化反应(Activation Reaction):活化反应是指在化学反应之前,需要对反应物进行其中一种处理,以使其更容易发生反应。
例如,酸催化剂对醇进行质子化,使其活化。
7. 环化反应(Cyclization Reaction):环化反应是指化合物中的一个链或环上的一个官能团与同一分子中的另一个官能团反应,形成环状化合物。
例如,醛与醇反应生成缩酮的环化反应。
8. 迁移反应(Rearrangement Reaction):迁移反应是指一个原子、功能团或离子在分子中重新排列位置的反应。
例如,酸催化下的烯醇重排为迁移反应。
9. 加氢反应(Hydrogenation Reaction):加氢反应是指当氢气参与反应时,物质中的双键或三键被加氢生成相应的饱和化合物。
高中化学有机反应类型总结
高中化学有机反应类型主要包括以下几种:
1. 取代反应:有机化合物分子中某一原子或基团被其他原子或基团 (直接连接碳原子的原子或基团) 所取代的反应。
2. 加成反应:有机分子中双键或三键打开,两个或多个分子互相结合形成新的分子的反应。
3. 消去反应:有机分子中从一个分子中脱去一个或几个小分子,形成不饱和化合物的反应。
4. 氧化反应:分子得到氧原子或失去氢原子的反应,一般指高反应性物种对低反应性物种的氧化。
5. 还原反应:分子中某些原子或基团被还原,一般指低反应性物种对高反应性物种的还原。
在有机合成中,利用取代反应可以将卤代烷中的卤原子转化为羟基、氨基等官能团,从而制得用途广泛的醇、胺等有机物;加成反应则可以用来制备聚合物、涂料、橡胶等高分子材料;消去反应则常用于制备不饱和化合物,例如合成树脂、涂料等。
氧化反应和还原反应则可以用于制备药物、香料、染料等有机化合物。
完全有机化学反应类型小结有机化学是研究碳及其化合物的学科,其中反应种类繁多。
本文将通过对一些主要的有机化学反应类型的小结,帮助读者了解这些反应的特点和应用。
1. 双键反应双键反应是有机化学中最常见的反应类型之一。
其中,加成反应是通过将两个单体分子的双键上的原子或基团相互连接而形成新的化学键。
典型的加成反应包括烯烃和氢气的加成反应、烯烃和卤素的加成反应以及烯烃和醇的加成反应等。
此外,还有补充反应,即通过在双键上添加一个原子或基团来形成新的化学键。
如醛与水的补充反应、烯烃与氨的补充反应等。
2. 消除反应消除反应是通过将化合物中的两个官能团(通常是氢和卤素或其他官能团)排除,从而形成双键或三键。
典型的消除反应包括醇的脱水反应、醇的脱卤反应和醇的脱酸反应等。
消除反应是有机合成中常用的反应类型之一,可产生新的双键或三键,为合成目标化合物提供重要的途径。
3. 取代反应取代反应是有机化学中另一个重要的反应类型。
在取代反应中,一个官能团被另一个官能团取代。
典型的取代反应有卤代烃的取代反应、醇的取代反应和羧酸的取代反应等。
取代反应是有机合成中广泛应用的反应类型之一,通过合适的取代反应可以合成各种有机化合物。
4. 氧化还原反应氧化还原反应是有机化学中一种重要的反应类型,涉及电子的转移。
在氧化还原反应中,一个物种失去电子被氧化,而另一个物种获得电子被还原。
有机化学中的氧化还原反应通常涉及有机化合物的氧化和还原。
典型的氧化还原反应有醇的氧化、醛的还原以及烯烃的不对称还原反应等。
氧化还原反应在有机合成中具有广泛的应用,可以用于构建碳碳和碳氧化合物的新键。
5. 缩合反应缩合反应是通过两个或多个分子反应形成一个较大的分子。
典型的缩合反应包括醛的缩合反应、酮的缩合反应以及酯的缩合反应等。
缩合反应是一种重要的反应类型,在有机合成中有着广泛的应用。
总结:有机化学反应类型繁多,每种反应都具有独特的特点和应用。
本文对双键反应、消除反应、取代反应、氧化还原反应和缩合反应进行了小结。
有机化学反应类型总结有机化学反应是指有机化合物之间或有机化合物与无机化合物之间发生的化学反应。
根据反应类型的不同,有机化学反应可以分为取代反应、加成反应、消除反应、重排反应、氧化还原反应等多种类型。
下面我们就对这些反应类型进行总结。
1. 取代反应:取代反应是指有机化合物中的一个原子或基团被另一个原子或基团所替代的化学反应。
常见的取代反应有取代烷烃的卤代反应、醇的取代反应、芳香化合物的取代反应等。
这类反应的特点是原有的化学键被破坏,新的化学键形成。
2. 加成反应:加成反应是指两个或多个有机化合物中的原子或基团发生共价键的形成。
常见的加成反应有烯烃的加成反应、醛和酮的加成反应等。
这类反应的特点是原有的化学键保留,新的化学键形成。
3. 消除反应:消除反应是指有机化合物中的两个原子或基团通过失去一个共价键,并且同时失去一个或多个小分子的化学反应。
常见的消除反应有醇的脱水反应、酮和醛的缩合反应等。
这类反应的特点是原有的化学键被破坏,新的化学键形成。
4. 重排反应:重排反应是指有机化合物分子中原子或基团在分子内的重新排列,形成新的连接方式的化学反应。
常见的重排反应有醇的酸催化重排反应、烯烃的环状重排反应等。
这类反应的特点是原有的化学键保留,但原子或基团的位置发生变化。
5. 氧化还原反应:氧化还原反应是指有机化合物中的原子或基团的氧化态或还原态发生变化的化学反应。
常见的氧化还原反应有醇的氧化反应、烯烃的氢化反应等。
这类反应的特点是原有的化学键保留,但原子或基团的氧化态或还原态发生变化。
总的来说,有机化学反应是有机化合物之间或有机化合物与无机化合物之间发生的化学反应,它们根据反应类型的不同可以分为取代反应、加成反应、消除反应、重排反应、氧化还原反应等。
通过对这些反应类型的研究,人们可以进一步理解和掌握有机化学反应的规律和机理,并且有助于有机化学合成的设计和优化。
有机物性质归纳有机物是由碳和氢以及其他一些元素组成的化合物。
它们在自然界中广泛存在,并且在生物体内发挥重要的作用。
有机物的性质多种多样,可以根据不同的特征进行分类。
本文将对有机物的性质进行归纳,方便读者了解和掌握这一重要的化学知识。
1. 物理性质有机物的物理性质包括颜色、气味、溶解性、熔点和沸点等。
其中,颜色和气味是人们在日常生活中最容易感知的有机物性质。
有机物的颜色可以因其分子结构而有所不同。
一些有机物呈现出鲜艳的颜色,如染料和色素,而另一些则是无色或者白色的,如乙醇和蔗糖。
有机物的气味也因其分子结构而异。
有些有机物具有芳香气味,如香水和挥发油,而另一些则具有刺激性或难闻的气味,如苯酚和胆固醇。
溶解性是有机物的重要物理性质之一。
某些有机物可以溶解于水中,如醇类和酚类化合物,而另一些则不溶解于水,如烃类和脂肪类化合物。
有机物的熔点和沸点与其分子量、分子结构和分子间相互作用相关。
通常情况下,分子量较大的有机物具有高熔点和高沸点,而分子量较小的有机物则具有低熔点和低沸点。
2. 燃烧性质有机物的燃烧性质与其分子结构中的碳、氢和氧元素有关。
一般来说,有机物可以在氧气的存在下燃烧,产生二氧化碳和水。
有机物的燃烧是一种放热反应,可以产生大量的热能。
不同的有机物燃烧时产生的热能大小也不同,与其分子结构和氧含量有关。
有机物的燃烧还可以产生光和烟雾。
一些有机物在燃烧时会释放出明亮的火焰,并且伴随着黑色的烟雾,如木材和煤炭。
3. 化学性质有机物的化学性质包括酸碱性、氧化还原性、聚合反应和酯化反应等。
这些性质主要是由有机物中的化学键和它们之间的相互作用决定的。
一些有机物具有酸性或碱性。
酸性有机物在水溶液中会释放出氢离子,碱性有机物则会释放出氢氧根离子。
酸碱性的判断可以通过检验有机物在水中的pH值来确定。
有机物中的氧化还原反应是化学反应中的一个重要方面。
氧化反应是指有机物失去电子,而还原反应是指有机物获得电子。
这些反应可以产生新的有机物,并且释放出大量的能量。
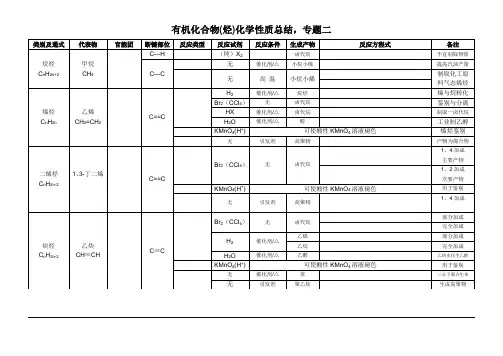
一、有机反应归类
有机反应官能团及类别反应条件重点反应方程式举例
取代反应
卤
代
反
应
烷烃(通式)光照
苯(通式)
及同系物
光照
催化剂
苯酚(-OH)
醇(-OH)加热
硝
化
反
应
苯及同系物浓硫酸、
加热
酯化
反应
酸(-COOH)
醇(-OH):
浓硫酸、加
热
水解
反应
卤代烃(-X)NaOH、水加
热
酯稀硫酸,加
热
碱、加热
CH3COOC2H5+H2O CH3COOH + C2H5OH
无机酸
△
CH3COOH+ CH3CH2OH CH3COOCH2CH3+H2O
浓硫酸
△
CH4+Cl2CH3Cl+HCl
光
CH2Cl2+Cl2CHCl3+HCl(CHCl3又叫氯仿)
光
C2H5—Br + H2O
C2H5—OH + HBr△
CH3
|
+Cl2
CH2Cl
△
糖类
稀酸
C 12H 22O 11+H 2O 2 C 6H 12O 6
分子间脱水
醇
浓硫酸,140℃
加成 反应
与H 2
(还原
反应) 烯烃、炔烃:
苯及同系物: 醛:
加热、 Ni 作催化剂
与X 2、HX 与
H 2O
烯烃:
炔烃:
加热
消去反应
卤代烃
NaOH 、醇加
热
醇
浓硫酸,加热170℃
氧化反应
有机物大多都能燃烧,碳碳双键、碳碳三键、苯的同系物、醛基都能被酸性高锰酸钾溶液氧化,乙醇能使重铬酸钾溶液变色。
醇
催化氧化
醛
催化氧化
CH 3—C —H +H 2 CH 3C H 2OH
O
催化剂 △
CH 3CH 2OH
H 2C=CH 2↑+H 2O 浓硫酸 170℃
CH 2=CH 2+Br 2
CH 2Br —CH 2Br CH 2=CH 2+ H 2 CH 3CH 3
催化剂
△
CH 2=CH 2+Br 2
CH 2Br
—CH 2Br
2CH 3—C —H+O 2 2CH 3COOH
O
催化剂 CH 2=CH 2+ H 2O CH 3CH 2OH
高温高压
催化剂
催化剂
被其他氧化
剂氧化
聚合
反应
加聚反应
缩聚反应n HOOC-COOH +n HOCH2-CH2OH HO[ OC-COOCH2CH2O]n H +(2n-1)H2O
中和反应中和反应
苯酚
羧酸CH3COOH CH3COO-+H+ 具有酸的通性
CH3COOH +NaOH = CH3COO Na+H2O
氨基酸NH2-CH2-COOH + NaOH NH2-CH2-COONa + H2O
置换反应醇
有
机
实
验(反应)
制取乙烯1、石蜡油分解制取乙烯
2、
制取乙炔
淀粉水解(C6H10O5)n + nH2O nC6H12O6
苯酚弱酸性
蛋白质盐析(可逆)、变性(不可逆)、颜色反应(遇浓硝酸变黄)、
CH3CHO +2Ag(NH3)2OH CH3COONH4+2Ag+3NH3+H2O
△
一定条件
CH2-CH2
n CH2=CH2 n
CaC2 + 2H2O HC CH↑+Ca(OH)2
CH3CHO+2Cu(OH)2CH3COOH+
△
CH3CHO+2Cu(OH)2+NaOH CH3COONa+Cu2O+3H2O
△
CH3CH2OH H2C=CH2↑+H2O
浓硫酸
170℃
水解反应(最终氨基酸)
二、烃基及其衍生物的相互转化
烃的衍生物的重要类别和主要化学性质:
类别通式代表物分子结构特点主要化学性质
卤代
烃
R—X溴乙烷
C2H5Br
C—X键有极性,
易断裂
1.取代反应:与NaOH溶液发生取代反应,生成
醇;
2.消去反应:与强碱的醇溶液共热,生成烯烃。
醇R—OH乙醇
C2H5OH
有C—O键和O—H
键,有极性;—OH
与链烃基直接相连
1.与钠反应,生成醇钠并放出氢气;
2.氧化反应:
O2:
生成CO2和H2O;氧化剂:生成乙醛;3.脱水反应:
140℃:乙醚;170℃:乙烯;4.酯化反应。
酚苯酚—OH直接与苯环相
连
1.弱酸性:与NaOH溶液中和;
2.取代反应:与浓溴水反应,生成三溴苯酚白色
沉淀;
3.显色反应:与铁盐(FeCl3)反应,生成紫色物
质
醛乙醛C=O双键有极性,
具有不饱和性
1.加成反应:与氢加成,生成乙醇;
2.氧化反应:
能被弱氧化剂氧化成羧酸(如银镜反应、还原氢
氧化铜)
羧酸乙酸受C=O影响,O—H
能够电离,产生H+
1.具有酸的通性;
2.酯化反应:与醇反应生成酯。
卤代烃
R—X
醇
R—OH
醛
R—CHO
羧酸
RCOOH
酯RCOOR’水解
水解
酯化
氧化
还原
氧化
酯化
水解
不饱和烃
加
成
消
去
消
去
加
成
CH3—C—OH
O
CH3—C—H
O
CH3—C—H
O
CH3—C—OH
O
R—C—OR’
O。