合成肽疫苗
- 格式:ppt
- 大小:891.50 KB
- 文档页数:2

6241卷第3猪场兽医VETERINARY猪口蹄疫作为一种高度传染性疾病,严重威胁了猪、牛、羊和其他偶蹄类动物的健康和畜牧业发展。
该病毒的传播迅速,引起的猪口蹄疫症状包括口腔和蹄部的溃疡,严重影响动物的生产性能和福利,导致经济损失和农业灾害。
为控制猪口蹄疫的传播,疫苗是最有效的手段之一。
近年来,二价合成肽疫苗作为一种新型疫苗备受瞩目。
相比传统灭活疫苗,二价合成肽疫苗具有更高的安全性和稳定性,因为它们不含活病毒或细菌成分,避免了病毒重组和恢复致病性的风险。
利用二价合成肽疫苗的设计原理,选择特定的抗原肽段,以激活机体免疫系统产生特异性抗体和T 细胞免疫反应,从而提供对猪口蹄疫病毒的保护。
为确保二价合成肽疫苗在猪口蹄疫防控中的有效性和安全性,抗体免疫评估检测显得尤为重要。
本综述旨在综合评估猪口蹄疫二价合成肽疫苗抗体免疫评估检测的研究进展,关注该疫苗的免疫原性和安全性评估结果,着重分析抗体水平和中和抗体产生的情况,并探讨猪口蹄疫二价合成肽疫苗抗体免疫评估检测张满义,梁 军,冯泽泰,齐 晓,蒲小峰,张志刚(新疆方牧生物科技有限公司,新疆 图木舒克 843900)基金项目:师市重大科技项目作者简介:张满义(1977—),男,河北沧州人,主要从事动物疫病防疫和检测工作在动物模型中对疫苗免疫效果的评价。
1 猪口蹄疫病毒猪口蹄疫病毒是一种非包膜的正链RNA 病毒,属于小RNA 病毒科,口蹄疫病毒属。
该病毒的基因组包含一个单股正链RNA ,编码了多个结构蛋白和非结构蛋白。
猪口蹄疫病毒具有高度变异性,主要通过飞沫、直接接触、污染物品等方式传播。
一旦进入宿主,病毒首先在呼吸道和消化道黏膜进行复制,然后侵入淋巴组织和血液循环,导致全身性感染。
在感染动物中,病毒在口腔和蹄部周围引起溃疡性病变,破坏动物的食欲、咀嚼和行动能力,严重影响生产性能。
2 二价合成肽疫苗2.1 二价合成肽疫苗概述二价合成肽疫苗是一类基于肽段的新型疫苗,用于诱导免疫系统对特定病原体产生免疫应答。

新型口蹄疫苗——合成肽疫苗核心提示:1、什么是合成肽疫苗? 合成肽疫苗(Syntheti Peptide Vaine)是用化学合成法人工合成具有抗原性的多肽而制成的疫苗。
通常合成的多肽参照了病毒蛋白抗原表位中的氨基酸序列,由多个B1、什么是合成肽疫苗?合成肽疫苗(Syntheti Peptide Vaine)是用化学合成法人工合成具有抗原性的多肽而制成的疫苗。
通常合成的多肽参照了病毒蛋白抗原表位中的氨基酸序列,由多个B细胞抗原表位和T 细胞抗原表位共同组成,并具有一定的空间结构。
合成肽技术已用于口蹄疫疫苗、狂犬病疫苗、乙肝疫苗、艾滋病疫苗和疟原虫疫苗等的设计,但目前成熟的只有口蹄疫合成肽疫苗。
2、猪口蹄疫合成肽疫苗的设计原理口蹄疫病毒的外壳由VP1、VP2、VP3、VP4四种结构蛋白及非结构蛋白构成,其中VP1蛋白作为口蹄疫病毒的最主要免疫抗原得到了全世界的认同,经动物试验发现,VP1上负责保护性免疫的氨基酸区域在129~169之间,所以可以利用化学合成法人工合成这段区域。
VP1蛋白的该区域并不是一个简单的线性结构,Aharya等发现,该区域暴露在病毒表面呈环状,即“G-H”环,该环是主要免疫性抗原,此环状结构具有同辅助性T细胞表面位点相结合的能力。
所以,口蹄疫合成肽疫苗必须解决合成这段区域的空间架构问题。
我们则通过合成肽的环化技术解决了这个问题。
口蹄疫的免疫基础包括B细胞免疫与T细胞免疫的交互作用。
VP1的保护性区域提供了B 细胞免疫的基础,而为了使设计的疫苗增加抗原性,在合成的VP1保护性环状构造上另外合成了一段辅助性T细胞表位,增强了T细胞免疫。
通过以上完善的设计,申联公司通过大量动物试验、中间试验与临床试验,证明该疫苗在免疫原性和安全性上明显优越于传统疫苗,最终在中国被批准为一类新兽药,成为全球第一个获得注册的该类疫苗。
3、合成肽疫苗与灭活疫苗有何区别?类型合成肽疫苗灭活疫苗免疫类型体液免疫、细胞免疫体液免疫、细胞免疫剂型油包水型水包油包水型免疫持续期临床试验检测抗体水平维持至少6个月临床试验检测抗体水平维持4个月左右不良反应基本无不良反应部分有过敏反应生物安全隐患无有带毒的隐患免疫剂量1l 2~3l灭活剂不使用氮丙啶类(有弱毒性)稳定性保存期内免疫原性保持不变随时间延长免疫原性会降低佐剂法国进口ntanide ISA 50V 法国进口206V或国产白油疫苗成份纯粹的合成肽灭活的全病毒、细胞培养物、细胞体碎片温度敏感性2-8℃保存,温度变化不影响其效力2-8℃保存,温度变化影响其效力生产方法固相化学合成单层细胞培养鉴别诊断可以鉴别野毒与疫苗产生的抗体干扰因素多,鉴别困难。

猪口蹄疫O型合成肽疫苗免疫效果试验作者:邓广金来源:《湖北畜牧兽医》2009年第07期摘要:为了更好地了解猪口蹄疫O型合成肽疫苗与灭活疫苗免疫后抗体水平之间的差异,在梅州市选择2个规模化养猪场,每个猪场分2组,对试验猪分别免疫猪口蹄疫O型合成肽疫苗和猪口蹄疫O型灭活疫苗,对接种疫苗的试验猪进行免疫应激观察,结果显示:注射合成肽疫苗试验猪未出现不良免疫副反应,说明用合成肽疫苗临床使用的安全性较高;采用猪O型口蹄疫VP1抗体检测试剂盒和正向间接血凝试验分别对使用上述两种口蹄疫疫苗免疫21d后的猪血清进行检测,结果表明:免疫猪口蹄疫O型合成肽疫苗用猪O型口蹄疫VP1抗体检测试剂盒检测,抗体阳性合格率达到92.50%,免疫猪口蹄疫O型灭活疫苗用正向间接血凝试验检测,免疫合格率为35.83%,说明猪口蹄疫O型合成肽疫苗接种后的免疫效果明显优于传统灭活疫苗。
关键词:合成肽疫苗;口蹄疫;抗体;正向间接血凝试验中图分类号:S852.5+2文献标识码:A文章编号:1007-273X(2009)07-0028-02口蹄疫是由口蹄疫病毒引起的急性、热性、高度接触性传染病,主要侵害偶蹄兽,偶见于人和其他动物。
临床上以口腔黏膜、蹄部及乳房皮肤发生水疱和溃疡为主要特征。
该病具有强烈的传染性,一旦发病,传播速度很快,往往造成大流行,不容易控制和消灭,带来严重的经济损失。
因此,世界动物卫生组织(OIE)一直将该病列为发病必须报告的A类动物疫病名单之首[1]。
目前对该病的防制主要是采用强制免疫、禁运、扑杀、消毒、封锁等措施,而免疫接种是最主要的也是最经济的防控措施。
目前,主要是研制和应用灭活疫苗[2],但该类灭活苗干扰因素多,对野毒与疫苗产生的抗体鉴别困难,而且疫苗的自身缺陷使之无法克服过敏反应和带毒的生物安全隐患问题[3],故许多学者把免疫谱广、免疫持续期长、安全性好的新型疫苗作为目前口蹄疫的主要研制方向。
猪口蹄疫O型合成肽疫苗是用固相多肽合成技术在体外人工合成含有口蹄疫病毒主要抗原位点的多肽[4],并连接人工合成的可激活辅助性T细胞的短肽,以此作为免疫原与进口佐剂混合乳化制成,能够很好的预防猪O型口蹄疫的发生。

免疫猪O型合成肽疫苗对怀孕、泌乳母猪的影响摘要为研究猪口蹄疫O型合成肽疫苗在母猪免疫上的应用,选择3个猪场怀孕1~90 d的母猪57头,怀孕90~110 d的母猪30头,泌乳母猪41头,使用猪口蹄疫O型合成肽疫苗(多肽2570+7309)进行免疫。
首免1.5 mL/头,间隔4周后二免2.0 mL/头,跟踪观察120 d。
结果表明:所有免疫母猪均未出现食欲减退、体温升高、流产、产死胎、停乳等不良反应,所有母猪的健康状况均良好,妊娠母猪产活仔率高达99%。
说明猪口蹄疫O型合成肽疫苗(多肽2570+7309)可安全使用于不同阶段的泌乳、怀孕母猪。
关键词怀孕母猪;泌乳母猪;猪口蹄疫O型合成肽疫苗;免疫反应口蹄疫是由口蹄疫病毒所引起的偶蹄动物的一种急性、热性、高度接触性传染病,主要特征是在口腔黏膜、蹄部、乳房、皮肤出现水疱,继而发生溃疡的一类传播速度极快的传染病[1]。
该病流行快,传播广,发病急,危害大,被世界动物卫生组织(OIE)列为A类传染病之首,我国也将其列为一类重大动物疫病。
同时,根据《动物防疫法》的要求,口蹄疫也是我国规定的重大动物疫病强制免疫病种之一。
但是在实际过程中,由于口蹄疫疫苗在免疫过程中极易产生较大的免疫反应,妊娠母猪尤为强烈[2-3]。
因此,很多村防疫员和兽医工作者对妊娠母猪都不予免疫,留下了很多免疫空白点和疫病隐患点。
为进一步了解口蹄疫疫苗对妊娠母猪是否有影响,开展了以下免疫试验。
1 材料与方法1.1 试验材料试验对象:选择石屏县3个猪场的健康无病、采食正常的怀孕母猪、泌乳母猪,品种为当地土杂母猪。
疫苗:申联生物医药(上海)有限公司生产的猪口蹄疫O型合成肽疫苗(多肽2570+7309),规格50 mL/瓶。
1.2 试验方法对怀孕母猪、泌乳母猪用猪口蹄疫O型合成肽疫苗共免疫2次,首免后4周进行第2次免疫,具体免疫程序见表1。
2 结果与分析对128头免疫猪口蹄疫O型合成肽疫苗的不同阶段的母猪跟踪观察120 d,结果发现,所有免疫猪口蹄疫O型合成肽疫苗的母猪均没有出现食欲减退、体温升高、流产、产死胎、停乳等不良反应,所有母猪的健康状况均良好[4]。



猪口蹄疫O型合成肽疫苗及其主要特点任巧玲;邢宝松;郭红霞【摘要】At present, foot-and-mouth disease is one of the animal diseases which seriously endan-ger Chinese pig industry,,and vaccination is an important prevention methord for this disease. New-ly developed Synthetic peptide vaccine of O-type foot-and-mouth disease in swine has aroused great attention for its high immunogenicity, good biological safety, differentiate infection from vacci-nation, and so on. Foot-and-mouth disease virus, the antigenic epitope of type O foot-and-mouth disease virus, and the research status of synthetic peptide vaccine of type O foot-and-mouth dis-ease of swine and its main characteristic are discussed in this article In order to provide refer-ences for the promotion and the application of this vaccination.%口蹄疫是当前严重危害我国养猪业的疾病之一,长期以来免疫接种是我国预防该病的重要措施。

分析合成肽疫苗项目在年的风险和可行性
标题:年份分析合成肽疫苗项目的风险和可行性
一、引言
随着科技的进步,生物技术领域的创新不断发展。
合成肽疫苗作为一种新型的疫苗形式,由于其设计灵活、特异性强、副作用小等优点,受到了广泛关注。
然而,任何新技术的研发都伴随着风险与挑战,本文将对在年份进行合成肽疫苗项目的风险和可行性进行深入探讨。
二、项目风险分析
1. 技术风险:虽然合成肽疫苗的技术理论已经较为成熟,但在实际操作中仍可能存在技术难题,如肽序列的选择、稳定性和免疫原性的优化等问题。
2. 市场风险:新疫苗的市场接受度难以预测,且可能会受到其他传统疫苗的竞争压力。
3. 法规风险:各国对于疫苗的审批制度严格,可能需要较长的时间和大量的资金投入。
4. 资金风险:疫苗研发是一个高投入、长周期的过程,需要足够的资金支持。
三、项目可行性分析
1. 技术可行性:近年来,生物信息学的发展为肽序列的设计提供了强大的技术支持,使得合成肽疫苗的研发成为可能。
2. 市场需求:随着人们健康意识的提高,对于安全有效的疫苗有着强烈的需求,特别是对于一些难治性疾病的预防,合成肽疫苗有着巨大的市场潜力。
3. 政策支持:政府对于科技创新的支持力度加大,尤其是生物医药领域,这为合成肽疫苗的研发提供了良好的政策环境。
四、结论
总的来说,在年份进行合成肽疫苗项目既面临着技术、市场、法规和资金等风险,同时也具备了技术、市场需求和政策支持等可行性的条件。
因此,我们需要充分评估风险,制定合理的应对策略,并积极利用有利条件,以实现项目的成功实施。

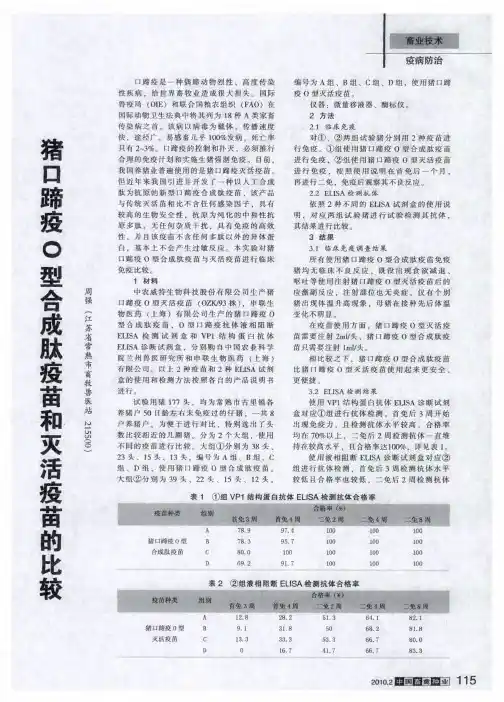
猪O型口蹄疫的新型合成肽疫苗和传统灭活疫苗的比较作者:史素云杨志彪来源:《农业开发与装备》 2015年第4期史素云1,杨志彪2*(1.上海交通大学农业与生物学院,上海 200240;2.申联生物医药(上海)有限公司,上海 200241)摘要:猪口蹄疫是由猪口蹄疫病毒引起的一种烈性传染病,传染性强,发病率高,给养猪业带来巨大的危害。
目前我国猪O型口蹄疫预防用疫苗主要为传统的灭活疫苗和新型的合成肽疫苗,本文对两种疫苗的生产工艺、免疫方式和免疫效果的比较进行综述,以期望为疫苗的合理选择与使用提供帮助。
关键词:合成肽疫苗;灭活疫苗;口蹄疫;新型疫苗;传统疫苗口蹄疫(food-and-mouth disease,FMD)俗名“口疮”、“蹄癀”,是由口蹄疫病毒引起的一种急性发热性高度接触性传染病,它能感染猪、牛、羊等偶蹄哺乳家畜,亦能感染野牛、鹿、羚羊、骆驼等野生动物,同时还能传染给人类,是一种及其重要的全球性动物传染病,危害及其严重。
世界卫生组织将其列为A类传染病,我国也将其列为一类动物疫病[1]。
目前已知的口蹄疫病毒包括A、O、C、Asia-I、SATⅠ、SATⅡ 和SATⅢ等7个没有交叉免疫保护的血清型,在长期的互相传播感染中又形成60余个亚型[2]。
猪口蹄疫以患猪的口、蹄等部位发生水泡性病变为主要特征,传播速度快,途径广,发病率几乎达到100%,死亡率只有2~3%。
猪口蹄疫的爆发流行可造成巨大的经济损失,世界各国对其防治均十分重视,目前我国对猪口蹄疫的控制和扑灭,主要措施是强制免疫。
目前我国猪O型口蹄疫免疫用疫苗主要为灭活疫苗和合成肽疫苗。
我国农业部批准的口蹄疫疫苗指定生产企业有7家,分别是金宇集团、中牧实业股份有限公司兰州生物药厂、中牧实业股份有限公司保山生物药厂、天康生物、中农威特生物科技股份有限公司、必威安泰和申联生物医药(上海)有限公司。
该7家企业均通过GMP验收,生产的两种猪口蹄疫O型疫苗均能够有效的防治猪O型口蹄疫。

新型疫苗的研发与生产技术分析在当今全球健康领域,新型疫苗的研发与生产技术正经历着前所未有的变革。
疫苗作为预防和控制传染病的重要手段,对于保障公众健康、促进社会发展具有不可估量的作用。
随着科学技术的不断进步,新型疫苗的研发和生产技术也在不断创新和完善,为人类对抗疾病带来了新的希望。
一、新型疫苗的研发技术1、基因工程技术基因工程技术是新型疫苗研发中的一项关键技术。
通过对病原体的基因进行分析和改造,科学家可以筛选出具有免疫原性的基因片段,并将其插入到合适的载体中,构建重组疫苗。
例如,利用基因工程技术研发的乙肝疫苗,具有纯度高、安全性好、免疫效果持久等优点。
2、合成肽疫苗技术合成肽疫苗是根据病原体的抗原表位,人工合成具有免疫活性的多肽。
这种疫苗具有成分明确、特异性强等优点。
但由于合成肽的免疫原性相对较弱,往往需要与佐剂联合使用,以增强免疫反应。
3、病毒载体疫苗技术病毒载体疫苗是将病原体的抗原基因插入到无害的病毒载体中,构建重组病毒。
当重组病毒感染人体细胞时,能够表达病原体的抗原,从而激发免疫反应。
常见的病毒载体包括腺病毒、痘苗病毒等。
4、核酸疫苗技术核酸疫苗包括 DNA 疫苗和 RNA 疫苗。
DNA 疫苗是将编码病原体抗原的 DNA 直接注入人体,使其在细胞内表达抗原;RNA 疫苗则是将编码抗原的 RNA 导入人体细胞,通过核糖体合成抗原蛋白。
核酸疫苗具有易于制备、成本低、免疫反应持久等优点,但也存在着一些潜在的风险,如核酸的稳定性和免疫原性的优化等问题。
二、新型疫苗的生产技术1、细胞培养技术细胞培养技术是疫苗生产中的常用方法之一。
通过培养动物细胞或昆虫细胞,使其感染病原体或表达疫苗抗原。
常用的细胞系包括vero 细胞、鸡胚成纤维细胞等。
细胞培养技术可以大规模生产疫苗,但需要严格控制细胞培养条件和质量,以确保疫苗的安全性和有效性。
2、发酵技术发酵技术主要用于生产细菌疫苗。
通过培养细菌,使其大量繁殖并表达疫苗抗原。
合成肽疫苗原理宝子们!今天咱们来唠唠合成肽疫苗这个超酷的东西的原理哈。
你知道吗,咱们的身体就像一个超级复杂又超级神奇的小宇宙。
里面有好多好多细胞呀,还有免疫系统这个超厉害的防御部队呢。
这个免疫系统啊,就像是身体的保镖,时刻警惕着那些外来的坏蛋,像细菌呀、病毒呀之类的。
那合成肽疫苗呢,它可是很有创意的一种疫苗哦。
咱先说说这个肽是啥。
肽啊,就像是一个个小小的积木块,是由氨基酸组成的。
氨基酸就像不同颜色和形状的小珠子,它们串在一起就变成了肽。
这些肽在我们身体里其实是有大作用的。
合成肽疫苗的原理呢,就像是给免疫系统送小抄一样。
你想啊,病毒或者细菌这些坏家伙,它们身上都有一些特殊的标记,就像它们的身份证一样。
这些标记其实就是一些蛋白质或者糖蛋白之类的东西。
科学家们就特别聪明啦,他们把这些坏家伙身份证上的关键信息,也就是一些特定的肽段,给找出来。
然后呢,就像做手工一样,在实验室里人工合成这些肽段。
这些合成出来的肽段,就相当于那些坏家伙身份证上的关键部分的复制品。
当把这些合成肽疫苗打到我们身体里的时候,我们的免疫系统就发现了这些外来的东西。
免疫系统里有一些细胞就像侦察兵一样,比如说巨噬细胞。
它们看到这些合成肽之后,就会觉得很奇怪,这不是我们身体里本来的东西呀。
于是呢,巨噬细胞就会把这个消息传递出去,告诉其他的免疫细胞,像T细胞和B细胞。
T细胞可是很厉害的呢,就像超级战士一样。
它们会被这些合成肽激活,然后开始发挥自己的威力。
有的T细胞会直接去攻击那些看起来像是带有这种合成肽标记的细胞,哪怕是正常细胞被病毒感染后有了这种标记,T细胞也不会放过它。
而B细胞呢,它会在这个刺激下开始制造一种叫做抗体的东西。
这个抗体啊,就像是专门为这些合成肽定制的小夹子。
一旦在身体里再遇到真正的病毒或者细菌,这些抗体就会像小夹子一样,紧紧地夹住那些坏家伙身上对应的标记,这样就可以把它们给困住啦。
然后其他的免疫细胞就可以一拥而上,把这些被抗体困住的坏家伙消灭掉。
合成肽疫苗名词解释
合成肽疫苗是一种利用合成化学方法合成的肽段,用作疫苗的活性成分。
肽疫苗是一种可用于预防或治疗疾病的疫苗,其基本成分是一些蛋白质的小片段,即肽段。
这些肽段通常由氨基酸组成,可以模拟病原体上的抗原决定簇,从而刺激人体免疫系统产生特异性免疫反应。
合成肽疫苗具有以下特点:
1. 合成肽疫苗可以根据需要设计和合成,可以选择特定的肽段作为疫苗抗原,从而更好地激活免疫系统。
2. 合成肽疫苗相对较稳定,容易保存和运输,不需要冷链条件即可使用。
3. 合成肽疫苗具有较高的安全性,因为只包含蛋白质的小片段,不含完整的病原体,因此副作用相对较少。
4. 合成肽疫苗可以用于针对不同疾病的预防和治疗,包括传染病、肿瘤等。
合成肽疫苗的制备过程包括肽段设计、化学合成、纯化和质量控制等步骤。
合成肽疫苗的研究和应用在疾病预防和治疗领域具有重要意义,可以为人类健康提供新的治疗选择。
带你认识猪O型口蹄疫合成肽疫苗(多肽9893)疫苗接种是被世界各国公认为最主要、最经济的口蹄疫预防手段,合成肽疫苗(synthetic peptide vaccine)是利用化学方法或基因工程手段,按抗原决定簇的天然蛋白质氨基酸序列人工合成病原微生物的保护性多肽(含有多个B细胞和T细胞抗原表位),并辅以适当载体与佐剂制备而成的一种新型基因工程疫苗。
理论上讲,该种疫苗是最为理想的安全新型疫苗。
针对口蹄疫病毒的合成肽疫苗研究最早也最成熟,早在1982年,研究人员Bittle J L等便将由人工合成的FMDV O型VP1蛋白第141-160位氨基酸合成肽段以共价键结合于钥孔戚血蓝蛋白(keyhole limpet hemacyanin,KLH)上制备出了第一例合成肽疫苗,试验证明,其能够诱导足够的抗体对牛和猪起到保护作用。
我们国内于2004年由中牧公司生产的FMD合成肽疫苗申请通过了一类兽用生物制品审查,并获得国内第一个合成肽疫苗的新药证书。
2008年随着国内流行毒株变化,适应新流行毒株的猪O型口蹄疫合成肽疫苗(多肽2570+7309)投入生产并被广泛使用。
与传统的疫苗相比,合成肽疫苗有其先天优势1、合成肽疫苗不存在散毒,生物安全度高。
2、合成肽疫苗因为是人工化学合成,所以抗原纯净度极高且含量精确稳定,传统疫苗在血清、细胞培养、灭活等过程中不可避免产生多种杂蛋白、内毒素等杂质。
3、合成肽疫苗免疫注射安全可靠,无副反应,几乎无免疫应激。
4、合成肽疫苗抗体阳性率高,抗体持续时间更长。
5、合成肽疫苗采用VP1蛋白中的一段多肽,不含非结构蛋白(NS蛋白),因此结合合成肽诊断试剂盒易将免疫抗体从感染抗体中区分开来。
2010年随着国内口蹄疫流行毒株变为缅甸98株为主,中牧股份投入研发的新一代猪口蹄疫O型合成肽疫苗(多肽98+93),并成功于2014年6月拿到新兽药证书。
中牧第三代合成肽疫苗(多肽98+93)相比上一代合成肽疫苗有了如下方面提升。
中国畜牧兽医 2022,49(8):3083-3090C h i n aA n i m a lH u s b a n d r y &V e t e r i n a r y Me d i c i ne 非洲猪瘟病毒P 72蛋白合成肽疫苗的构建及其免疫效力评估徐娅玲1,2,张霁辉1,2,牛 熙1,2,李 升1,2,黄世会3,冉雪琴3,王嘉福2(1.贵州大学生命科学学院,贵阳550025;2.贵州大学农业生物工程研究院,贵阳550025;3.贵州大学动物科学学院,贵阳550025)摘 要:ʌ目的ɔ构建非洲猪瘟病毒C A S 19-01/2019株(G e n B a n k 登录号:MN 172368.1)结构蛋白P 72的合成肽疫苗,通过免疫小鼠评估合成肽疫苗的免疫效力㊂ʌ方法ɔ利用P r o t P a r a m ㊁S O P MA 等软件分析P 72蛋白的理化性质与结构信息,通过A B C p r e d ㊁S VM t r i p ㊁I E D B 预测P 72蛋白的T 细胞与B 细胞抗原表位,筛选出显著的表位多肽区域,合成多肽辅以弗氏佐剂腹腔注射免疫小鼠,检测免疫组小鼠产生的特异性抗体㊁T 淋巴细胞亚群㊁脾脏淋巴细胞增殖㊁细胞因子白介素4(I L -4)㊁I L -2㊁γ干扰素(I F N -γ)㊁免疫球蛋白(I g G ),从体液免疫与细胞免疫角度评估合成肽的免疫效力㊂ʌ结果ɔ综合分析得出P 72蛋白是稳定性亲水蛋白,二级结构中α-螺旋㊁β-转角㊁延伸链㊁无规则卷曲分别占19.35%㊁5.42%㊁25.08%和50.15%㊂筛选出了P 72蛋白的8个优势抗原表位,626-634㊁520-528㊁298-306㊁203-211位氨基酸处为T 细胞抗原表位,587-606㊁232-251㊁110-129㊁39-58位氨基酸处为B 细胞抗原表位㊂整合优势表位合成2个多肽P 72-1与P 72-2,首次免疫小鼠14d 时可检测到P 72-1与P 72-2的特异性抗体,首免后28d 达到最高值,其最高抗体效价分别为1ʒ25600与1ʒ12800;免疫后小鼠T 淋巴细胞亚群C D 4+/C D 8+显著上升(P <0.05);脾脏淋巴细胞增殖试验结果显示,免疫组淋巴细胞数量均极显著升高(P <0.01);细胞因子I L -4㊁I L -2㊁I F N -γ含量均极显著增加(P <0.01)㊂ʌ结论ɔ本研究成功研制2种合成肽疫苗,在免疫效力上P 72-2高于P 72-1,二者都能产生高水平的特异性抗体,刺激脾脏淋巴细胞增殖,诱导产生细胞因子I L -4㊁I L -2㊁I F N -γ,本研究为非洲猪瘟合成肽疫苗研制奠定技术基础㊂关键词:非洲猪瘟病毒(A S F V );P 72蛋白;抗原表位;合成肽疫苗中图分类号:S 852.65+1文献标识码:AD o i :10.16431/j.c n k i .1671-7236.2022.08.024 开放科学(资源服务)标识码(O S I D ):收稿日期:2022-02-08基金项目:国家自然科学基金(31960641);贵州省科技创新人才团队项目(黔科合平台人才[2019]5615);贵州省 百 层次创新型人才培养项目(黔科合人才[2016]4012);贵州省科技支撑计划(黔科合支撑[2017]2585㊁黔科合支撑[2017]2587)联系方式:徐娅玲,E -m a i l :1782417907@q q .c o m ㊂通信作者王嘉福,E -m a i l :j f w a n g@g z u .e d u .c n C o n s t r u c t i o no f S y n t h e t i cP e p t i d eV a c c i n e o fA f r i c a nC l a s s i c a l S w i n e F e v e rV i r u s P 72P r o t e i na n dE v a l u a t i o no f I t s I m m u n eE f f i c a c yX U Y a l i n g 1,2,Z H A N GJ i h u i 1,2,N I U X i 1,2,L I S h e n g 1,2,HU A N GSh i h u i 3,R A N X u e qi n 3,WA N GJ i a f u 2(1.C o l l e g e o f L i f eS c i e n c e s ,G u i z h o uU n i v e r s i t y ,G u i y a n g 550025,C h i n a ;2.I n s t i t u t e o f A g r o -b i o e n g i n e e r i n g ,G u i z h o uU n i v e r s i t y ,G u i y a n g 550025,C h i n a ;3.C o l l e g e o f A n i m a lS c i e n c e ,G u i z h o uU n i v e r s i t y ,G u i y a n g 550025,C h i n a )A b s t r a c t :ʌO b j e c t i v e ɔT h e a i mo f t h i s s t u d y w a s t o c o n s t r u c t a s y n t h e t i c p e pt i d e v a c c i n e b a s e d o n pr o t e i nP 72i nA f r i c a n s w i n e f e v e r v i r u s (A S F V )s t r a i nC A S 19-01/2019(G e n B a n k a c c e s s i o nN o .:M I N 172368.1),a n d e v a l u a t e i t s i m m u n e e f f i c i e n c y b y i m m u n i z i n g mi c e .ʌM e t h o d ɔT h e p h y s i c o c h e m i c a l p r o p e r t i e s a n d s t r u c t u r a l i n f o r m a t i o no fP 72p r o t e i nw e r e a n a l y z e db yp r o gr a m s中国畜牧兽医49卷o fP r o t P a r a ma n dS O P MA.T h es i g n i f i c a n te p i t o p e s i n Ta n dBl y m p h o c y t e sw e r es c r e e n e db y A B C p r e d,S VM t r i p a n d I E D C B.T h e s y n t h e s i z e d p e p t i d e sw e r e i n j e c t e d i n t r a m u s c u l a r l y i n t om i c e w i t hF r e u n d sa d j u v a n t.A n t i b o d i e sa g a i n s tt h es y n t h e s i z e d p e p t i d e s,T l y m p h o c y t es u b s e t s, l y m p h o c y t e p r o l i f e r a t i o n,c y t o k i n e sc o n t e n t so f i n t e r l e u k i n4(I L-4),I L-2,i n t e r f e r o n-γ(I F N-γ) a n d i m m u n o g l o b u l i n(I g G)w e r e d e t e c t e du s i n g s e r u ma n d o t h e r t i s s u e f r o mt h e i m m u n i z e dm i c e, a n d t h e i m m u n e e f f i c a c y o f t h e s y n t h e t i c p e p t i d ew a s e v a l u a t e d f r o mt h e p e r s p e c t i v e s o f h u m o r a l i m m u n i t y a n d c e l l u l a r i m m u n i t y.ʌR e s u l tɔC o m p r e h e n s i v e a n a l y s i s s h o w e d t h a t P72p r o t e i nw a s a s t a b l eh y d r o p h i l i c p r o t e i n.I ns e c o n d a r y s t r u c t u r e,a l p h ah e l i x,b e t at u r n,e x t e n d e ds t r a n da n d r a n d o mc o i la c c o u n t e df o r19.35%,5.42%,25.08%a n d50.15%,r e s p e c t i v e l y.E i g h td o m i n a n t e p i t o p e s o f p r o t e i n P72w e r es e l e c t e d b y c o m p r e h e n s i v es o f t w a r ea n a l y s i s,i n c l u d i n g T c e l l e p i t o p e s626-634,520-528,298-306,203-211a m i n oa c i d s,a n dBc e l le p i t o p e s587-606,232-251, 110-129,39-58a m i n o a c i d s.T w o p e p t i d e s n a m e dP72-1a n dP72-2w e r e s y n t h e s i z e d b y i n t e g r a t i n g t h ed o m i n a n t e p i t o p e s t o g e t h e r.T h e s p e c i f i c a n t i b o d i e s a g a i n s t t h e s y n t h e s i z e d p e p t i d e s P72-1a n d P72-2w e r ed e t e r m i n e di ns e r u m o f m i c ea f t e r14d a y so ft h ef i r s t i m m u n i z a t i o n,r e a c h e dt h e h i g h e s t v a l u e o n t h e28t hd a y a f t e r t h e f i r s t i m m u n i z a t i o n,a n dh i g h e s t a n t i b o d y t i t e r sw e r e1ʒ25600 a n d1ʒ12800,r e s p e c t i v e l y.T h e v a l u e o f C D4+/C D8+o fT l y m p h o c y t e s u b s e t s i n i m m u n i z e dm i c e w e r e s i g n i f i c a n t l y i n c r e a s e d(P<0.05).T h e s p l e e n l y m p h o c y t e p r o l i f e r a t i o n t e s t s h o w e d t h a t t h e n u m b e r o f l y m p h o c y t e sw a s e n h a n c e d i nb o t h g r o u p s(P<0.01).C y t o k i n e s c o n t e n t s o f I L-4,I L-2 a n d I F N-γw e r ee x t r e m e l y s i g n i f i c a n t l y i m p r o v e d(P<0.01).ʌC o n c l u s i o nɔI nt h i ss t u d y,t w o s y n t h e t i c p e p t i d ev a c c i n e sw e r es u c c e s s f u l l y d e v e l o p e d.P72-2w a sh i g h e r t h a nP72-1i n i m m u n e e f f i c a c y,a n db o t hc o u l d p r o d u c eh i g hl e v e lo fs p e c i f i ca n t i b o d i e s,s t i m u l a t et h e p r o l i f e r a t i o no f l y m p h o c y t e s,i n d u c e t h e p r o d u c t i o no f c y t o k i n e s I L-4,I L-2a n d I F N-γ.T h i s s t u d y l a i da t e c h n i c a l f o u n d a t i o n f o r t h e d e v e l o p m e n t o fA f r i c a n s w i n e f e v e r v a c c i n e.K e y w o r d s:A f r i c a ns w i n ef e v e rv i r u s(A S F V);P72p r o t e i n;a n t i g e ne p i t o p e s;s y n t h e t i c p e p t i d e v a c c i n e非洲猪瘟(A f r i c a ns w i n e f e v e r,A S F)是由非洲猪瘟病毒(A f r i c a n s w i n e f e v e r v i r u s,A S F V)引起家猪㊁疣猪㊁欧洲野猪和美洲野猪等不同品种猪发病的急性㊁烈性传染病[1],主要症状为肺水肿㊁严重抑郁㊁高热㊁发绀㊁无食欲㊁多器官广泛出血等[2],对环境有极强的抵抗能力,在-20ħ112d后仍具有感染能力[3],中国动物病原微生物名录中将其列为一类动物疫病,该病首次发现于肯尼亚[4],后传播到西班牙㊁意大利㊁法国㊁格鲁吉亚㊁俄罗斯等国家[5-6],2018年初在中国辽宁省沈阳市首次暴发,由于其高致死性,对中国生猪养殖业造成巨大经济损失[7],但目前仍无有效疫苗预防,一旦发现,只能采取捕杀方式,因此对于A S F疫苗的研究尤为重要㊂目前,A S F的疫苗研发中病毒载体疫苗与减毒活疫苗免疫原性较强[8-9]㊂但病毒载体疫苗安全性尚不能完全确定,易突变为强毒株[10],减毒活疫苗可能会导致猪产生高热㊁食欲不振㊁轻微神经衰弱症状,部分猪甚至因感染而急性死亡[11]㊂因此,安全性更高的疫苗对于A S F至关重要㊂以抗原表位为基础设计的合成肽疫苗能诱导机体产生对特定表位的免疫反应,并避免其他可能导致过敏性反应的无关表位的潜在影响,具有极高的安全性[12]㊂P72蛋白作为A S F V主要的衣壳蛋白,有较多的抗原表位[13],2014年P h i l l i p s[14]通过基因定位发现该蛋白存在多个抗原反应区域㊂郭晶等[15]也通过P72多表位融合蛋白诱导机体产生了特异性抗体及其良好的免疫原性㊂有效的B细胞和T细胞表位可通过免疫信息学分析确定,但表位的免疫原性必须通过试验验证㊂因此,本研究通过生物信息学的方法评估和选择P72蛋白中能诱导B细胞和T细胞应答的抗原表位,制备合成肽疫苗,免疫小鼠,评估合成肽的免疫效力,以期为A S F合成肽疫苗研究提供理论依据㊂1材料与方法1.1氨基酸序列、试验动物A S F V C A S19-01/2019株(G e nB a n k登录号:48038期徐娅玲等:非洲猪瘟病毒P72蛋白合成肽疫苗的构建及其免疫效力评估MN172368.1)P72蛋白氨基酸序列(G e n B a n k登录号:Q G J83444.1);3~5周龄S P F级雌性健康B A L B/c小鼠(许可编号:E A E-G Z U-2021-P014)购自重庆腾鑫生物技术有限公司㊂1.2主要试剂弗氏完全与不完全佐剂(S i g m a公司);牛血清白蛋白(B S A)㊁E L I S A包被液㊁E L I S A终止液㊁T M B显色液㊁红细胞裂解液㊁小鼠脾脏细胞分离试剂盒(S o l a r b i o公司);R P M I-1640细胞培养基㊁100目与200目细胞筛㊁P B S㊁小鼠白细胞介素2(I L-2) E L I S A试剂盒㊁I L-4E L I S A试剂盒㊁小鼠免疫球蛋白G(I g G)E L I S A试剂盒㊁小鼠γ干扰素(I F N-γ) E L I S A试剂盒(湖南艾方生物科技有限公司);抗体C D3+㊁C D8+㊁C D4+(杭州联科生物技术股份有限公司);辣根过氧化物酶(H R P)标记的山羊抗小鼠I g G(G o a tA n t i-M o u s e I g G-H R P)(上海艾比玛特医药科技有限公司)㊂1.3方法1.3.1抗原表位分析利用E x P A S y在线分析工具P r o t P a r a m(h t t p s:ʊw e b.e x p a s y.o r g/ p r o t p a r a m/)预测P72蛋白分子质量㊁等电点㊁不稳定系数和半衰期;利用N e t p h o s在线软件(h t t p s:ʊs e r v i c e s.h e a l t h t e c h.d t u.d k/s e r v i c e.p h p N e t P h o s-3.1)预测其磷酸化位点;S O P MA(h t t p s:ʊn p s a-p r a b i.i b c p.f r/c g i-b i n/n p s a_a u t o m a t.p l?p a g e=n p s a _s o p m a.h t m l)预测其蛋白二级结构;利用I E D B在线软件(h t t p:ʊt o o l s.i m m u n e e p i t o p e.o r g/m a i n/)预测其T细胞抗原表位㊁表面可及性㊁可塑性㊁抗原及亲水性;利用A B C p r e d(h t t p s:ʊw e b s.i i i t d.e d u.i n/ r a g h a v a/a b c p r e d/)㊁S V M t r i p(h t t p:ʊs y s b i o.u n l.e d u/ S V M T r i P/)在线软件预测其B细胞抗原表位㊂1.3.2合成肽疫苗的构建根据预测的结果,将筛选的T细胞抗原表位与B细胞抗原表位以随机组合的方式进行整合,整合的肽段由南京金斯瑞生物科技有限公司偶联K L H蛋白合成多肽P72-1与P72-2㊂1.3.3小鼠免疫 3~5周龄S P F级B A L B/c 雌性小鼠30只,随机分为3组:P72-1㊁P72-2和P B S组每组10只㊂P72-1和P72-2组分别腹腔注射免疫合成肽疫苗P72-1和P72-2,P B S组腹腔注射免疫P B S作为阴性对照,共免疫3次,每隔14d 免疫一次,剂量50μg/只,首免佐剂为弗氏完全佐剂,二㊁三免佐剂为弗氏不完全佐剂㊂1.4免疫效果评估1.4.1特异性抗体检测采用E L I S A方法检测免疫后P72-1与P72-2特异性抗体,分别用10μg/m L 的P72-1与P72-2蛋白包被E L I S A板,经封闭液封闭后,加入以1ʒ10稀释于P B S中的免疫动物血清,37ħ孵育1h,P B S T洗3次,加入100μL H R P 标记的山羊抗小鼠I g G(1ʒ10000)37ħ孵育1h, P B S T洗3次,加入T M B显色液常温避光反应15m i n,加入100μL E L I S A终止液,酶标仪测定D450n m值,根据P/N(阳性D450n m值/阴性D450n m值)计算是否产生特异性抗体及其抗体效价,免疫组(P)/P B S组(N)>2.1即视为检测到特异性抗体㊂1.4.2脾脏淋巴细胞增殖试验每组随机取3只小鼠,断颈处死后浸泡于75%乙醇中10m i n,于超净工作台分离淋巴细胞,100μL/孔加到96孔细胞板中,用终浓度为10μg/m L的P72-1㊁P72-2刺激淋巴细胞,无抗原组为对照,37ħ㊁5%C O2条件下培养68h后每孔添加10μLC C K-8,37ħ放置1h,测定D490n m值,根据测量的吸光度,按照下式计算刺激指数(S I):S I=(特异性抗原刺激孔平均D490n m值-本底D490n m值)/(无抗原刺激孔平均D490n m值-本底D490n m值)㊂1.4.3流式细胞术检测T淋巴细胞亚群抽取首免56d后小鼠外周血于抗凝管内,加入20μL荧光标记流式抗体C D3+㊁C D4+㊁C D8+,混匀,室温避光放置20m i n后加入450μL溶血素,混匀,室温避光放置20m i n,流式细胞术检测外周血淋巴细胞亚群精准计数㊂1.4.4细胞因子检测采集P72-1㊁P72-2及P B S组小鼠首免后14㊁28和42d的血清100μL,根据试剂盒说明书检测细胞因子I L-2㊁I L-4和I F N-γ含量㊂1.4.5统计分析试验数据均用G r a p h P a d P r i s m 8.0软件进行分析,所有试验设置3个重复样品,用t检验进行差异显著性分析㊂试验结果以平均值ʃ标准差表示㊂P<0.05表示差异显著;P<0.01表示差异极显著㊂2结果2.1抗原表位分析结果P72蛋白的分子式为C3303H5036N904O948S18,分子质量为73154.89u,由646个氨基酸组成,平均亲水系数为-0.392,不稳定系数为38.30,是稳定性亲水蛋白,在哺乳动物中的半衰期为30h;其蛋白结构中含有88个磷酸化位点:31个丝氨酸(S e r)位点㊁7个苏氨酸(T h r)位点㊁50个酪氨酸(T y r)位点;5803中国畜牧兽医49卷二级结构中α-螺旋㊁β-转角㊁延伸链和无规则卷曲分别占19.35%㊁5.42%㊁25.08%和50.15%㊂通过I E D B㊁A B C p r e d㊁S VM t r i p在线软件预测B细胞与T细胞抗原表位,结果见表1㊁2,综合各项分析结果,最终确定P72-1由4条多肽组成,多肽序列位置587-606㊁520-528㊁203-211㊁39-58位氨基酸处;P72-2由4条多肽组成,多肽序列位置为626-634㊁298-306㊁232-251㊁110-129位氨基酸处㊂表1P72蛋白B细胞表位分析T a b l e1Bc e l l e p i t o p e s o fP72p r o t e i n编号N o.序列S e q u e n c e s位置P o s i t i o n分值S c o r e 1K P R E E Y Q P S G H I N V S R A R E F587-6060.93 2YM F I G L K P TWN I S D Q N P HQ P465-4840.92 3V S V E G T S G P L L C N I H D L H K P232-2510.94 4E R L Y E N V R F D V N G N S L D E Y S185-2040.90 5S QMG A H G Q L Q T F P R N G Y DWD126-1450.92 6L G A C H S S WQ D A P I Q G T S QMG110-1290.85 7S Y G K P D P E P T L S Q I E E T H L V39-580.84表2P72蛋白T细胞表位分析T a b l e2Tc e l l e p i t o p e s o fP72p r o t e i n编号N o.序列S e q u e n c e s位置P o s i t i o n分值S c o r e 1S A S A I N F L L626-6340.3 2S S I S D I S P V520-5280.3 3I T D A T Y L D I298-3060.3 4Y S S D V T T L V203-2110.3 2.2特异性抗体水平检测采用E L I S A方法分析每次免疫后小鼠血清中特异性抗体效价,合成肽疫苗免疫组小鼠接种后分别能检测到针对P72-1与P72-2的特异性抗体反应,且抗体水平明显高于P B S组,最高抗体水平出现在一免后28d,P72-1最高效价为1ʒ25600, P72-2最高效价为1ʒ12800,P B S组小鼠血清中未检测到特异性抗体(图1)㊂2.3脾脏淋巴细胞增殖试验由图2可知,合成肽疫苗免疫组的刺激指数均极显著高于P B S组(P<0.01);P72-1组高于P72-2组,但无显著性差异(P>0.05),表明P72-1㊁P72-2合成肽疫苗能诱导机体的特异性脾脏淋巴细胞增殖㊂图1免疫小鼠特异性抗体检测F i g.1D e t e c t i o no f s p e c i f i c a n t i b o d i e s i n i m m u n i z e dm i ce*,差异显著(P<0.05);**,差异极显著(P<0.01);无*,差异不显著(P>0.05)㊂下同*,S i g n i f i c a n t d i f f e r e n c e(P<0.05);**,E x t r e m e l y s i g n i f i c a n td i f f e r e n c e(P<0.01);N o*,N o s i g n i f i c a n t d i f f e r e n c e(P>0.05).T h e s a m e a sb l o w图2合成肽引起的脾脏淋巴细胞增殖F i g.2S p l e e n l y m p h o c y t e p r o l i f e r a t i o n i n d u c e d b y s y n t h e t i c p e p t i d e s2.4T细胞亚群检测小鼠分别免疫P72-1㊁P72-2㊁P B S制备的合成肽疫苗56d后,取外周血对T淋巴细胞亚群表达水平情况进行比较,结果见图3㊂由图3可知,P72-2组的C D4+T淋巴细胞的比例最高,达到77.0%,其次是P72-1组占比75.9%,P B S组为70.6%㊂C D8+T淋巴细胞的比例最高的是P B S组,为27.8%,P72-1与P72-2占比分别为22.6%和21.6%㊂将合成肽疫苗组与P B S组的C D4+/C D8+比值进行分析,结果见图4㊂由图4可知,合成肽疫苗组的C D4+/C D8+比值显著高于P B S组(P< 0.05),且P72-2显著高于P72-1(P<0.05),表明P72-1㊁P72-2能显著诱导体液免疫与细胞免疫, P72-2诱导能力更强㊂68038期徐娅玲等:非洲猪瘟病毒P 72蛋白合成肽疫苗的构建及其免疫效力评估图3 T 细胞亚群检测结果F i g.3 D e t e c t i o n r e s u l t s o fTc e l l s u b s e ts 图4 T 细胞亚群C D 4+/C D 8+比值F i g.4 C D 4+/C D 8+r a t i o o fTc e l l s u b s e t s 2.5 细胞因子检测取免疫后42d 小鼠血清,通过E L I S A 方法检测小鼠外周血中细胞因子I F N -γ㊁I L -2㊁I L -4的含量㊂由图5可知,与P B S 组相比,P 72-1和P 72-2组的I F N -γ㊁I L -2㊁I L -4含量均升高,其中P 72-1和P 72-2组的I L -4㊁I L -2含量在免疫后42d 时极显著升高(P <0.01),在免疫后28d 时,除P 72-1组I L -2含量显著升高外(P <0.05),其合成肽疫苗组检测值均极显著升高(P <0.01);在免疫后14d 时,P 72-2组I F N -γ与I L -4含量均显著升高(P <0.05),P 72-1组I L -4含量极显著升高(P <0.01);P 72-1与P 72-2组细胞因子I L -4㊁I L -2㊁I F N -γ各个检测值之间均存在差异,但只在I L -2上存在显著性差异,表现为P 72-2组显著或极显著高于P 72-1组(P <0.05;P <0.01)㊂A ,I L -2;B ,I F N -γ;C ,I L -4图5 合成肽引起的细胞因子变化F i g .5 C y t o k i n e c h a n g e s i n d u c e db y s y n t h e t i c p e pt i d e s 7803中国畜牧兽医49卷3讨论非洲猪瘟是一种高度传染的出血性疾病,病死率接近100%[16],近年来在非洲㊁欧洲㊁亚洲等地频繁暴发,严重影响了区域间的生猪及猪肉副产品的贸易流通,对全球养猪业造成灾难性的打击[17],但其病原体A S F V结构复杂且缺乏负责诱导保护性免疫抗原的知识,尚未研发出有效的非洲猪瘟疫苗㊂P72是A S F V的主要结构蛋白,基因序列高度保守,在病毒感染后期表达,对病毒衣壳的形成具有重要意义[18],已有许多研究利用P72蛋白作为候选抗原研制疫苗㊂谢灵志[19]利用P72蛋白制备重组腺病毒载体疫苗注射小鼠后,引起了小鼠淋巴细胞的增殖及细胞因子分泌,显著增强了机体的细胞免疫应答水平;C h e n等[20]通过反向遗传学方法表达P72蛋白构建的新城疫病毒r N D V/P72,不仅在小鼠模型中产生了高水平的特异性I g G抗体,还促进了T淋巴细胞的增殖,提升了机体的免疫应答水平;但目前对于P72蛋白优势抗原表位的免疫效力研究还鲜有报道,因此,本研究利用P72蛋白的优势抗原表位制备了合成肽疫苗P72-1与P72-2,并对其免疫效力进行评估㊂利用生物信息学方法预测㊁筛选蛋白抗原表位已成为表位疫苗研究的首选方法,不仅能提升疫苗的安全性,同时能保留较强的抗原性[21]㊂本试验利用生物信息学方法对P72蛋白抗原表位进行分析预测,经筛选得到8个优势抗原表位,与传统表位筛选过程比,此方法有工作量小㊁准确性高等优点,并已成功应用在猪O型口蹄疫病毒合成肽疫苗的研究中[22]㊂本研究制备的合成肽疫苗P72-1与P72-2包含的优势B细胞与T细胞抗原表位在机体内引起了良好的免疫反应,间接E L I S A结果表明,免疫小鼠在首免14d后就产生了高效价特异性抗体,这与E V-D68病毒的合成肽疫苗引起的特异性抗体效果一致[23],证明筛选的抗原表位具有良好的免疫原性㊂本研究通过对免疫组小鼠外周血及血清检测发现免疫组小鼠的T细胞亚群指数与细胞因子增殖情况显著高于对照组,表明疫苗显著提高了机体的免疫应答水平㊂此外,淋巴细胞的增殖试验作为反映机体淋巴细胞增殖的一种方法,能有效评价机体的免疫功能[24],本试验结果显示免疫后脾脏淋巴细胞显著增殖情况,表明疫苗显著提高了机体的细胞免疫应答水平㊂唐华[22]构建的A型口蹄疫病毒合成肽疫苗在小鼠体内导致T细胞亚群显著变化;孟媛等[25]制备的塞尼卡病毒V P1蛋白的亚单位疫苗在小鼠模型中引发了显著的细胞因子变化;魏冰[26]在研究T h表位合成肽对O型口蹄疫病毒合成肽疫苗的增效作用中发现小鼠T淋巴细胞的转化率显著上升㊂这些研究都表明了具有良好免疫效力的疫苗能显著激活机体的免疫应答,本研究基于优势抗原表位设计的合成肽疫苗P72-1与P72-2具有良好的免疫效力㊂尽管本试验制备的合成肽疫苗免疫小鼠后在小鼠体内有较好的免疫反应,但A S F V的感染机制尚未完全明确,且未进行猪的免疫效力评价及攻毒保护试验,后续研究中还需继续筛选更多抗原的优势表位来优化疫苗的设计,以期能获得更好的免疫保护效果㊂4结论本研究初步探索了A S F V P72蛋白合成肽疫苗的免疫效力,通过分析P72蛋白的结构和预测其抗原表位,成功构建了多肽疫苗P72-1与P72-2,通过免疫小鼠,表明该疫苗具有良好的免疫原性,为A S F V多肽疫苗的研制奠定技术基础㊂参考文献(R e f e r e n c e s):[1] WA N G N,Z HA O D,WA N GJ,e t a l.A r c h i t e c t u r eo fA f r i c a ns w i n ef e v e rv i r u sa n di m p l i c a t i o n sf o rv i r a la s s e mb l y[J].Sc i e n c e,2019,366(6465):640-644.[2] R E V I L L A Y,PÉR E Z-NÚÑE Z D,R I C H T J A.A f r i c a n s w i n e f e v e r v i r u s b i o l o g y a n d v a c c i n ea p p r o a c h e s[J].A d v a n c e si n V i r u s R e s e a r c h,2018,100:41-74.[3]刘海余.浅谈非洲猪瘟[J].猪业科学,2018,35(10):127.L I U H Y.D i s c u s s i o n o n A f r i c a n s w i n ef e v e r[J].S w i n e I n d u s t r y S c i e n c e,2018,35(10):127.(i nC h i n e s e)[4] A T UHA I R ED K,A F A Y O A M,O C HWO S,e ta l.M o l e c u l a r c h a r a c t e r i z a t i o na n d p h y l o g e n e t i cs t u d y o fA f r i c a n s w i n e f e v e r v i r u s i s o l a t e s f r o m r e c e n to u t b r e a k si n U g a n d a(2010-2013)[J].V i r o l o g yJ o u r n a l,2013,10:247.88038期徐娅玲等:非洲猪瘟病毒P72蛋白合成肽疫苗的构建及其免疫效力评估[5] D I X O NLK,S T A H LK,J O R IF,e t a l.A f r i c a ns w i n ef e v e r e p i d e m i o l og y a n d c o n t r o l[J].A n n u a l R e v i e wo fA n i m a lB i o s c i e n c e s,2020,8:221-246.[6] O N E I L L X,WH I T E A,R U I Z-F O N S F,e t a l.M o d e l l i n g t h e t r a n s m i s s i o n a n d p e r s i s t e n c e o fA f r i c a ns w i n ef e v e ri n w i l d b o a ri n c o n t r a s t i n g E u r o p e a ns c e n a r i o s[J].S c i e n t i f i c R e p o r t s,2020,10(1):5895.[7]王华,王君玮,徐天刚,等.非洲猪瘟的疫情分布和传播及其控制[J].中国兽医科学,201040(4):438-440.WA N G H,WA N GJ W,X U T G,e ta l.R e v i e w o ns p r e a d,t r a n s m i s s i o n a n d c o n t r o lo f A f r i c a n s w i n ef e v e r[J].C h i n e s eV e t e r i n a r y S c i e n c e,2010,40(4):438-440.(i nC h i n e s e)[8] L I U L,WA N G X,MA O R,e ta l.R e s e a r c h p r o g r e s so n l i v e a t t e n u a t e dv a c c i n e a g a i n s tA f r i c a ns w i n e f e v e rv i r u s[J].M i c r o b i a l P a t h o g e n e s i s,2021,158:105024.[9] S C A D E N A-F E R NÁN D E ZE,SÁN C H E Z-V I Z C AÍN OJM,V A N D E NB O R N E,e t a l.H i g hd o s e so f i n a c t i v a t e dA f r i c a n s w i n e f e v e rv i r u sa r es a f e,b u td on o t c o n f e rp r o t e c t i o na g a i n s tav i r u l e n tc h a l l e n g e[J].V a c c i n e s,2021,9(3):242.[10] WU K,L I UJ,WA N GL,e t a l.C u r r e n t s t a t e o f g l o b a lA f r i c a ns w i n ef e v e rv a c c i n ed e v e l o p m e n tu n d e rt h ep r e v a l e n c ea n d t r a n s m i s s i o n o f A S F i n C h i n a[J].V a c c i n e s,2020,8(3):531.[11] WA N G F,Z HA N G H,H O U L,e ta l.A d v a n c eo fA f r i c a n s w i n e f e v e r v i r u s i n r e c e n t y e a r s[J].R e s e a r c hi nV e t e r i n a r y S c i e n c e,2021,136:535-539.[12] L I M H X,L I M J,P O H C L.I d e n t i f i c a t i o n a n ds e l e c t i o n o f i m m u n o d o m i n a n t B a n dTc e l l e p i t o p e s f o rd e n g u e m u l t i-e p i t o p e-b a s e d v a c c i n e[J].M e d i c a lM i c r o b i o l o g y a n dI m m u n o l o g y,2021,210(1):1-11.[13]高瞻,邵军军,常艳燕,等.非洲猪瘟病毒p72蛋白抗原表位预测分析及多表位疫苗的构建[J].中国兽医杂志,2020,56(1):13-17.G A O Z,S HA O JJ,C HA N G Y Y,e ta l.E p i t o p ep r e d i c t i o na n a l y s i so fA f r i c a ns w i n ef e v e rv i r u s p72p r o t e i na n dc o n s t r u c t i o no fm u l t i-e p i t o p ev a c c i n e[J].C h i n e s e J o u r n a l o f V e t e r i n a r y M e d i c i n e,2020,56(1):13-17.(i nC h i n e s e)[14] P H I L L I P S M E.E p i t o p e m a p p i n g o fA f r i c a ns w i n ef e v e r v i r u s p72c a p s i d p r o t e i nu s i n gp o l y c l o n a l.s w i n es e r aa n d m o n o c l o n a la n t i b o d i e s[D].K a n s a s:K a n s a sS t a t eU n i v e r s i t y,2016.[15]郭晶,李重阳,孟庆玲,等.非洲猪瘟病毒多表位融合蛋白P72的构建㊁表达及免疫学特性研究[J].家畜生态学报,2019,40(6):60-65.G U O J,L I C Y,M E N G Q L,e t a l.R e s e a r c h o nc o n s t r u c t i o n,e x p r e s s i o n a nd i m m u n o l o g i c a l c h a r a c te r i s t i c so fm u l t i-e p i t o p e f u s i o na n t i g e nP72o fA f r i c a ns w i n ef e v e r v i r u s[J].J o u r n a l o f D o m e s t i c A n i m a lE c o l o g y,2019,40(6):60-65.(i nC h i n e s e)[16] G A L I N D OI,A L O N S OC.A f r i c a ns w i n e f e v e r v i r u s:Ar e v i e w[J].V i r u s e s,2017,9(5):103. [17]刘雪婷,王召阳,鑫婷,等.非洲猪瘟病毒B438L蛋白的原核表达及其多克隆抗体的制备与鉴定[J].中国畜牧兽医,2021,48(3):991-1000.L I U X T,WA N G Z Y,X I N T,e ta l.P r o k a r y o t i ce x p r e s s i o na n d p o l y c l o n a la n t i b o d i e s p r e p a r a t i o na n di d e n t i f i c a t i o n o f A f r i c a n s w i n e f e v e r v i r u s B438Lp r o t e i n[J].C h i n aA n i m a l H u s b a n d r y&V e t e r i n a r yM e d i c i n e,2021,13(3):991-1000.(i nC h i n e s e)[18] B O R C A M V,I R U S T A P,C A R R I L L O C,e ta l.A f r i c a n s w i n e f e v e r v i r u s s t r u c t u r a l p r o t e i n p72c o n t a i n s a c o n f o r m a t i o n a l n e u t r a l i z i n g e p i t o p e[J].V i r o l o g y,1994,201(2):413-418.[19]谢灵志.表达A S F V保护性抗原重组腺病毒载体疫苗的初步研制[D].扬州:扬州大学,2019.X I E L Z.P r e l i m i n a r y s t u d y o fr e c o m b i n a n ta d e n o v i r a lv e c t o r v a c c i n ee x p r e s s i n g A S F V p r o t e c t i v ea n t i g e n[D].Y a n g z h o u:Y a n g z h o uU n i v e r s i t y,2019.(i nC h i n e s e) [20] C H E N X,Y A N G J,J I Y,e t a l.R e c o m b i n a n tN e w c a s t l e d i s e a s e v i r u s e x p r e s s i n g A f r i c a n s w i n ef e v e rv i r u s p r o t e i n72i ss a f ea n di m m u n og e n i ci nm i c e[J].V i r o l o g i c aS i n i c a,2016,31(2):150-159.[21] G E R S H O N I J M,R O I T B U R D-B E R MA N A,S I MA N-T O V D D,e t a l.E p i t o p e m a p p i n g[J].B i o D r u g s,2007,21(3):145-156.[22]唐华.A型口蹄疫病毒A F72株合成肽疫苗的研究及其免疫效力的评估[D].北京:中国农业科学院,2013.T A N G H.S t u d y a n d i m m u n i t y a s s e s s m e n t o fs y n t h e t i c p e p t i d e v a c c i n e s a g a i n s t A F72s t r a i n o fF o o t-a n d-m o u t h d i s e a s e v i r u s t y p e A[D].B e i j i n g:C h i n e s eA c a d e m y o fA g r i c u l t u r a lS c i e n c e s,2013.(i nC h i n e s e)[23]陈俊伊.E V-D68V P1亚单位疫苗和多肽疫苗的免疫原性及保护性研究[D].重庆:重庆医科大学,2020.C H E NJ Y.I m m u n o g e n i c i t y a n d p r o t e c t i o no fE V-9803中国畜牧兽医49卷D68V P1s u b u n i tv a c c i n ea n d p e p t i d e v a c c i n e[D].C h o n g q i n g:C h o n g q i n g M e d i c a lU n i v e r s i t y,2020.(i nC h i n e s e)[24]闫宗斌,伍生军,杨静,等.猪附红细胞体e n o基因重组蛋白的制备及免疫效果研究[J].中国畜牧兽医,2020,47(7):2231-2238.Y A N Z B,WU SJ,Y A N G J,e ta l.P r e p a r a t i o no fr e c o m b i n a n t p r o t e i n o f M y c o p l a s m a s u i s e n o g e n e a n di t s i m m u n i t y e f f e c t[J].C h i n aA n i m a l H u s b a n d r y&V e t e r i n a r y M e d i c i n e,2020,47(7):2231-2238.(i nC h i n e s e)[25]孟媛,曾嘉庆,于成东,等.塞尼卡病毒V P1蛋白亚单位候选疫苗小鼠免疫评价[J].中国兽医学报,2021,41(11):2085-2090.M E N G Y,Z E N G J Q,Y U C D,e t a l.I m m u n ee v a l u a t i o n of c a n d i d a t e S e n e c a v i r u s V P1p r o t e i ns u b u n i t v a c c i n e i n m i c e[J].C h i n e s e J o u r n a l o fV e t e r i n a r y,2021,41(11):2085-2090.(i nC h i n e s e) [26]魏冰.两种T h表位合成肽对O型口蹄疫病毒合成肽疫苗免疫增效作用的研究[D].天津:天津农学院,2016.W E I B.S t u d y o n s y n e r g i s t i c e f f e c t o f t w oT h e p i t o p e ss y n t h e t i c p e p t i d e so nO-t y p eF o o t-a n d-m o u t hd i s e a s ev i r u ss y n t h e t i c p e p t i d e v a c c i n e[D].T i a n j i n:T i a n j i nA g r i c u l t u r a lU n i v e r s i t y,2016.(i nC h i n e s e)(责任编辑董晓云)0903。