氯化钠注射液生产过程质量控制要点
- 格式:docx
- 大小:16.12 KB
- 文档页数:1

(一)生产过程的质量控制生产数量保证了,质量必须合格,否则不能出厂,尤其是安全指标一点都不能含糊,如:热原、无菌、过敏、异常毒性、降压物质、鉴别项等,,有一样不合格都会要人命的,叫不准重做。
齐二药是假辅料、华源是无菌热原的问题。
现在对药品的质量要求的越来越严了,有一项不合格就算劣药,要没收非法所得,并处以货值1-3倍的罚款,要求生产的药品必须合格,生产合格率要达到100%是非常难的,尤其是生化药针剂更难,但这是每个企业永恒追求的目标。
产品的合格率指两方面:一个是批成品率、一是批次合格率。
(二)提高批成品率:设备必须好使:如有打瓶可能有玻璃屑、灌针有问题水针有碳化点、止灌不好使浪费药液、装量控制不好灌高了产量低、灌低了不合格等,最好刚灌装前十支应传出去灯检,有问题及时调整,没问题再正式灌装。
还有就是控制好含量,既保证含量合格又不浪费,这也要求药液混合均匀、溶解充分、取样有代表性、检验准确。
(三)如何提高批合格率:1 提高主要原辅料的内控质量标准:主要是化学原料药和使用量较大的辅料。
针剂用原辅料国家标准有的制定的不严格不科学,要用内控标准来补充,如有的品种原料不检热原,若原料带热原就有可能导致成品不合格,有的品种在原料生产时可能有毒性,这样的原料就应做异常毒性,因为制剂的工艺过程是无法除毒性物质的,降压物质也是一样,总之,成品要检的项目如果原料有可能带来就应检原料,内控标准就应制定相应的项目,采购时应先与厂家讲清楚,合同中应附带内控标准。
从源头控制产品质量。
2生化药提取原液应检测成品的相关项目,如高分子、过敏试验、降压物质、活性等。
当提取车间更换超滤柱子膜包时和改变工艺及时通知化验室,做溶液的过敏和高分子等,避免生产出的成品不合格,无法挽救,造成损失。
3 半成品的质量标准尤其是新品种的内控质量标准的制定,最近陆续有批准生产的新品种,必须制定科学合理的内控标准,制定时生产和质量共同商量,采购也要参与,原辅料采购时要执行。
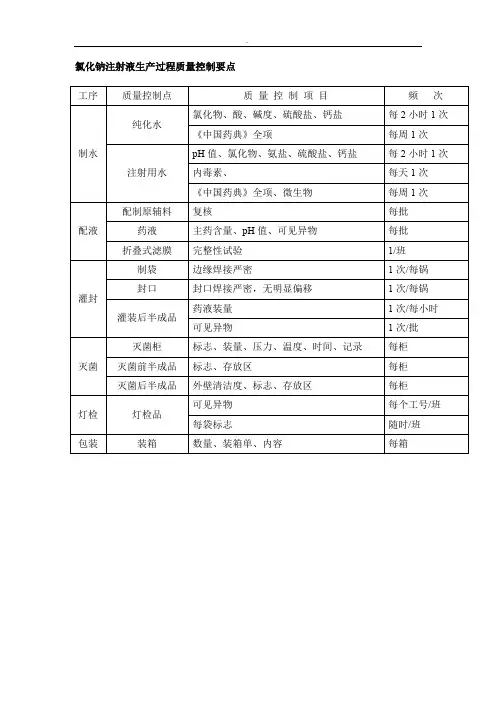


宁波市 xx 制药有限公司输液车间管理文件1. 目的:编制规范化、标准化的工艺规程,作为全面指导生产和控制质量的基准性技术文件。
2. 范围:葡萄糖氯化钠注射液生产和质量控制的全过程。
3. 责任3.1 输液车间负责生产全过程。
3.2 质量管理部门负责质量控制全过程。
3.3 工程部负责提供工艺用水、电、汽及洁净空气等。
4. 管理内容11-14.1 生产工艺流程其中:粗洗、浓配采用 10万级稀配、轧盖采用 1万级灌装、压塞采用局部 100级4.2 操作过程及工艺条件4.2.1 理瓶根据生产量准备相应数量的瓶子 , 脱去外包装后正立于理瓶台上,挑选出破损瓶子,待理瓶台集满瓶子后可开动理瓶机传送带,送瓶。
4.2.2 外洗4.2.2.1 开启饮用水水源,启动外洗机主机开关进行外洗操作。
4.2.2.2 检查经过外洗的输液瓶,将破损瓶及时挑出,放在指定地点。
4.2.3 粗洗4.2.3.1 开启电源;将水箱和储水箱注满水至溢水管顶部,水温控制到 50~ 60℃,开启水泵,打开喷淋水控制阀(以能将空瓶注满水为准 ,启动超声波、输液轨道和主机,进行粗洗操作。
4.2.3.2 操作过程中,碰到紧急情况,应按下紧急停车按钮,立即停车,检查调整后再开机。
4.2.4 精洗4.2.4.1 检查过滤后注射用水可见异物,合格后方可进行精洗操作。
4.2.4.2 打开电源开关,将储水罐注满水,水温控制到 50~60℃,调节新鲜水压力0.2~0.4MPa ,调节压缩空气控制阀至压力 0.2~0.4MPa ,打开水泵,调节循环水压至0.2~0.4MPa ,开启主机,进行精洗操作。
4.2.4.3 检查精洗后玻璃瓶可见异物合格,注射用水残存应不超过 2滴,输液瓶方可进行灌装。
4.2.4.4 精洗好的瓶子存放时间不超过 30分钟,否则重新清洗。
4.2.5 配料4.2.5.1 浓配4.2.5.1.1 核对原辅料品名、规格、批号、数量、检验报告单,确认无误后按生产指令书上的处方量进行称量,称量过程要有人复核。

页号:1/18目录1. 产品简介2. 处方和依据3. 产品工艺流程图4. 主要房间设备说明表5. 工艺质量监控点6. 原辅包装材料清单、质量标准及批量处方7. 工艺操作要求和技术参数8. 中间产品质量标准和贮存9. 成品质量标准和贮存10. 劳动组织与岗位定员11. 文件变更表12. 附件1. 产品简介1.1 品名氯化钠注射液1.2 代码 00-0091.3 剂型大容量注射剂1.4 规格 250ml:2.25g1.5 包装聚丙烯输液瓶装,40瓶/箱1.6 贮藏密闭保存1.7 有效期 36个月1.8 批次量 16000瓶/批1.9 生产线 J线2. 处方和依据2.1 处方氯化钠 9g ;注射用水加至1000ml2.2 依据国家食品药品监督管理局批件批准文号:国药准字H20093237页号:2/18文件名称:氯化钠注射液工艺规程编号及修订号:STP—03007 11 复印号:3. 产品工艺流程图D级区C级区C级背景下的A级区一般区页号:3/184. 主要房间设备说明表页号:4/18页号:5/18页号:6/18页号:7/185. 工艺质量监控点页号:8/18页号:9/186.原辅包装材料清单、质量标准及批量处方7. 工艺操作要求和技术参数7.1 浓配7.1.1 生产前检查:每日生产前检查生产设备、过滤器已清洁、灭菌,状态标志明显;所用称量器具、各类仪表、仪器在校验周期内,标志明显;上批清场应合格,并将上批清场合格证副本附于记录之前;每批生产前检查设备情况应正常;已撤去上批生产状态标志、无上批生产记录和与本批生产无关的遗留物,生产现场卫生整洁;换好本批生产状态标志,操作文件、批生产记录应齐全;本批所需原、辅料已备齐,并与称量记录一致。
7.1.2 原辅料的领用:车间领料人员按生产部下发的批生产指令的限料量由仓库领料至车间物流通道外清间。
所领到的原辅料脱除外包装后用纯化水擦拭清洁,然后用75%的乙醇擦拭消毒后进入缓冲间。


氯化钠注射药物的生产质量管理摘要无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药,包括无菌制剂和无菌原料药。
无菌药品的生产质量管理对于消费者在药品方面的安全使用有着极为重要的意义。
在此,以氯化钠注射药物为例,讲述无菌药物生产质量管理。
以最终灭菌药品氯化钠注射液为例,讲述其生产质量管理的具体内容。
一、厂区车间平面布置图工艺流程:(一)生产用物料包括原辅料、纯化水、注射用水、包装材料。
原辅料、包装材料(包括安瓿)应检验合格后使用。
纯化水为原水制得,清洗安瓿使用;注射用水为纯化水制得,清洗安瓿和配制使用,均应定时检查,制得后及时使用。
(二)纯化水、注射用水1、原水处理(纯化水的制备)原水处理方法有离子交换法、电渗析法及反渗透法。
离子交换法制得的去离子水可能存在热原、乳光等问题,主要供蒸馏法制备注射用水使用,也可用于洗瓶,但不得用来配制注射液。
2、注射用水的制备注射用水为蒸馏水或去离子水经蒸馏所得的水,又称重蒸馏水。
其质量要求见《中国药典》,除氯化物、硫酸盐、钙盐、硝酸盐、亚硝酸盐、二氧化碳、易氧化物、不挥发物与重金属按蒸馏水检查应符合规定外,还规定pH应为5.0~7.0,氨含量不超过0.00002%,热原检查应符合规定,应于制备后12h内使用。
(三)人员操作人员应身体健康,每年体检一次,并建立健康档案。
操作作人员按生产区域进行划分,严格遵守工作服穿戴制度,并不得将工作服穿出该区域。
不得将头发、胡须外露,不得化妆,不得佩带饰物、手表,操作前后、接触污物后均应洗手并且消毒。
工作服应定期清洗,更换。
(四)、领料按生产指令领取处方原料,核对物料品名,批号、规格、数量应相符,所领物料应有检验合格报告书。
(五)、配料领取的原料核对品名、批号、数量、合格证,按生产处方配料,装入清洁容器转入下一工序。
称量时需由第二人复核。
(六)、安瓿清洗将安瓿轩洗瓶机内,依次用饮用水、纯化水、注射用水进行清洗,清洗后干燥灭菌,置相应区域,检验合格后及时使用。


浅析注射剂生产质量的关键控制点摘要:注射剂作为医疗体系的重要组成,其在临床中的应用,能够有效患者的相关病症,提升人体对药物吸收速率,增强治疗成效。
为更好地发挥注射剂的临床价值,规避注射剂质量问题的出现,越来越多的医药生产企业,积极转变管理思路,在强调注射剂生产速率的同时,逐步强化生产质量的把控能力,形成完备的注射剂生产机制。
基于这种现状,文章着眼于注射剂生产的相关环节,重点把握生产质量控制的关键节点,旨在形成完善的生产质量控制体系,为后续生产、管理活动的开展提供参考。
关键词:注射剂;生产质量;质量管理;关键节点;控制举措前言注射剂作为医学用药方式,其能够通过注射等方式,快速进入患者体内,从而确保药物快速发挥功效,并且排除人体PH值、各类蛋白酶等因素的影响。
但是从生产角度来看,注射剂生产流程较为复杂,安全性以及适应性相对较低,因此有着较高的生产成本。
为保证注射剂的生产效率,提高合格率,排除相关因素对于注射剂生产活动的干扰,相关医药生产企业,尝试做好注射剂的质量管控工作,在确保注射剂临床安全性、稳定性的同时,管控生产成本支出,避免额外费用的产生。
1.注射剂概述对注射剂特点与技术要求的梳理,有助于工作人员形成正确的观念认知,准确把握注射剂生产的相关要求,为后续生产质量控制关键举措的研究与探讨创造了条件,进一步强化注射剂生产质量控制的效能。
注射剂作为一种溶液,其主要由无菌溶液以及药物成分构成,通过皮下注射等多种方式,快速进入人体,是目前主流的用药方式,很好地满足临床用药需求。
与传统的用药方式相比,注射剂表现出药效好、实用性高以及容易储存等特点,具体来看,注射剂的药效较为可靠,其通过注射,能够通过血液循环等方式,进入到人体内的相关组织、器官之中,因此注射剂的见效快,在较短的时间内,药效显现较为明显,尤其是注射剂不需要通过人体的胃肠道进行吸收,因此可以排除胃液、消化酶的影响,用药的剂量较为准确,不会出现用药过大或者过小的情况。

(一)生产过程的质量控制生产数量保证了,质量必须合格,否则不能出厂,尤其是安全指标一点都不能含糊,如:热原、无菌、过敏、异常毒性、降压物质、鉴别项等,,有一样不合格都会要人命的,叫不准重做。
齐二药是假辅料、华源是无菌热原的问题。
现在对药品的质量要求的越来越严了,有一项不合格就算劣药,要没收非法所得,并处以货值1-3倍的罚款,要求生产的药品必须合格,生产合格率要达到100%是非常难的,尤其是生化药针剂更难,但这是每个企业永恒追求的目标。
产品的合格率指两方面:一个是批成品率、一是批次合格率。
(二)提高批成品率:设备必须好使:如有打瓶可能有玻璃屑、灌针有问题水针有碳化点、止灌不好使浪费药液、装量控制不好灌高了产量低、灌低了不合格等,最好刚灌装前十支应传出去灯检,有问题及时调整,没问题再正式灌装。
还有就是控制好含量,既保证含量合格又不浪费,这也要求药液混合均匀、溶解充分、取样有代表性、检验准确。
(三)如何提高批合格率:1 提高主要原辅料的内控质量标准:主要是化学原料药和使用量较大的辅料。
针剂用原辅料国家标准有的制定的不严格不科学,要用内控标准来补充,如有的品种原料不检热原,若原料带热原就有可能导致成品不合格,有的品种在原料生产时可能有毒性,这样的原料就应做异常毒性,因为制剂的工艺过程是无法除毒性物质的,降压物质也是一样,总之,成品要检的项目如果原料有可能带来就应检原料,内控标准就应制定相应的项目,采购时应先与厂家讲清楚,合同中应附带内控标准。
从源头控制产品质量。
2生化药提取原液应检测成品的相关项目,如高分子、过敏试验、降压物质、活性等。
当提取车间更换超滤柱子膜包时和改变工艺及时通知化验室,做溶液的过敏和高分子等,避免生产出的成品不合格,无法挽救,造成损失。
3 半成品的质量标准尤其是新品种的内控质量标准的制定,最近陆续有批准生产的新品种,必须制定科学合理的内控标准,制定时生产和质量共同商量,采购也要参与,原辅料采购时要执行。

2017年04月浅析药用氯化钠生产过程中的质量控制王东强(天津长芦海晶集团有限公司,天津300457)摘要:为了提高药用氯化钠的纯度,保证其质量,提出一种药用氯化钠生产过程的质量控制方法。
首先详细分析了药用氯化钠的各个生产过程,然后对易出现的质量问题进行了分析,并提出了针对性的解决方案,从而保证了药用氯化钠的质量。
关键词:药用氯化钠;生产过程;质量控制;氯化钠是人体各项生理活动中不可缺少的一种化合物,相关研究表明,钠离子在成年人体内中的总量约为60克[1],其中80%左右分布在细胞外液中,氯离子在细胞外液中也有着广泛的分布[2]。
氯化钠的生理功能主要包括:(1)使细胞外液的渗透压保持合理的状态;(2)对人体内的酸碱平衡进行调节;(3)参与生成消化液;因此,在医学应用中,高纯度的氯化钠溶液更多的被当作人体的电解质补充液,补充人体中失去的水分和电解质[3]。
此外,氯化钠溶液还可以与其它药剂一起配制氯化钠注射液使用,产生不同的功效。
因此,如何提高药用氯化钠的纯度已经成为药用氯化钠生产过程中的一个核心课题,受到了越来越多人们的重视。
1药用氯化钠的生产过程原盐是药用氯化钠的主要生产原料。
原盐是由盐田晒制的海盐或者湖盐,其主要成分为氯化钠。
原盐在结晶的过程中会不可避免的夹杂着大量的泥沙和可溶性的钙盐、镁盐等杂质。
为了消除这些杂质,获得高纯度的药用氯化钠,需要对原盐的杂质进行过滤去除。
由于氯化钠的溶解度不会随着温度的变化而发生较大改变,因此,不能通过重结晶的方法获取高纯度的氯化钠,需要首先对原盐进行溶解,将不溶于水的杂质进行沉淀去除,然后再利用化学方法消除其它可溶性的钙盐、镁盐等杂质。
具体的生产过程如下所述:(1)Na 2SO 4的清除:在原盐溶液中加入BaCl 2溶液,它能够将溶液中的SO 42-转变为易沉淀的BaSO 4沉淀物,Na +转变为NaCl 。
相关化学反应式为:BaCl 2+Na 2SO 4=BaSO 4↓+2NaCl 。