高中化学必修三分子晶体和原子晶体.pdf
- 格式:pdf
- 大小:1.39 MB
- 文档页数:11



第2课时 共价晶体学业要求素养对接1.借助共价晶体模型认识共价晶体的结构特点。
2.能够从化学键的特征,分析理解共价晶体的物理特性。
微观探析:共价晶体的结构特点。
模型认知:建立共价晶体模型,并利用共价晶体模型进行相关计算。
[知 识 梳 理]一、共价晶体的结构和性质 1.共价晶体的结构特点 (1)构成微粒及作用力共价晶体⎩⎨⎧构成微粒:原子微粒间作用力:共价键(2)空间构型:整块晶体是一个三维的共价键网状结构,不存在单个的小分子,是一个“巨分子”。
2.共价晶体与物质的类别物质种类 实例某些非金属单质 晶体硼、晶体硅、晶体锗、金刚石等 某些非金属化合物 碳化硅(SiC)、氮化硅(Si 3N 4)、氮化硼(BN)等 某些氧化物二氧化硅(SiO 2)等3.共价晶体的熔、沸点(1)共价晶体由于原子间以较强的共价键相结合,熔化时必需破坏共价键,而破坏它们需要很高的温度,所以共价晶体具有很高的熔点。
(2)结构相似的共价晶体,原子半径越小,键长越短,键能越大,晶体的熔点越高。
【自主思考】1.含有共价键的晶体都是共价晶体吗?提示 共价晶体中都有共价键,但含有共价键的不一定是共价晶体。
如CO 2、H 2O等分子晶体中也含有共价键。
二、典型的共价晶体1.金刚石(1)碳原子采取sp3杂化,C—C—C夹角为109°28′。
(2)每个碳原子与周围紧邻的4个碳原子以共价键结合成正四面体结构,向空间伸展形成空间网状结构。
(3)最小碳环由6个碳原子组成,且最小环上有4个碳原子在同一平面内;每个碳原子被12个六元环共用。
2.晶体硅把金刚石中的C原子换成Si原子,得到晶体硅的结构,不同的是Si—Si键长>C—C 键长。
3.二氧化硅晶体(1)Si原子采取sp3杂化,正四面体内O—Si—O键角为109°28′。
(2)每个Si原子与4个O原子形成4个共价键,Si原子位于正四面体的中心,O原子位于正四面体的顶点,同时每个O原子被2个硅氧正四面体共用;每个O原子和2个Si原子形成2个共价键,晶体中Si原子与O原子个数比为1∶2。


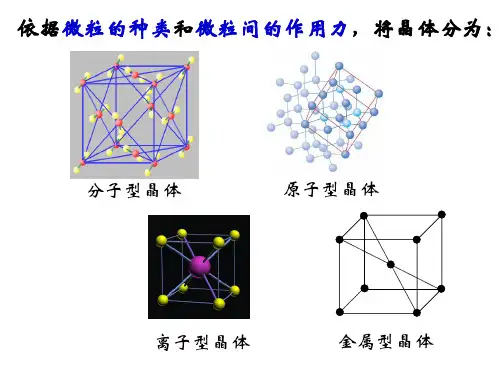


离子晶体、分子晶体和原子晶体[学法指导]在学习中要加强对化学键中的非极性键、极性键、离子键、晶体类型及结构的认识与理解;在掌握粒子半径递变规律的基础上,分析离子晶体、原子晶体、分子晶体的熔点、沸点等物理性质的变化规律;并在认识晶体的空间结构的过程中,培养空间想象能力及思维的严密性和抽象性。
同时,关于晶体空间结构的问题,很容易与数学等学科知识结合起来,在综合题的命题中具有广阔的空间,因此,一定要把握基础、领会实质,建立同类题的解题策略和相应的思维模式。
[要点分析]一、晶体固体可以分为两种存在形式:晶体和非晶体。
晶体的分布非常广泛,自然界的固体物质中,绝大多数是晶体。
气体、液体和非晶体在一定条件下也可转变为晶体。
晶体是经过结晶过程而形成的具有规则的几何外形的固体。
晶体中原子或分子在空间按一定规律周期性重复的排列,从而使晶体内部各个部分的宏观性质是相同的,而且具有固定的熔点和规则的几何外形。
NaCl晶体结构食盐晶体金刚石晶体金刚石晶体模型钻石C60分子二、晶体结构1.几种晶体的结构、性质比较2.几种典型的晶体结构:(1)NaCl晶体(如图1):每个Na+周围有6个Cl-,每个Cl-周围有6个Na+,离子个数比为1:1。
(2)CsCl晶体(如图2):每个Cl-周围有8个Cs+,每个Cs+周围有8个Cl-;距离Cs+最近的且距离相等的Cs+有6个,距离每个Cl-最近的且距离相等的Cl-也有6个,Cs+和Cl-的离子个数比为1:1。
(3)金刚石(如图3):每个碳原子都被相邻的四个碳原子包围,以共价键结合成为正四面体结构并向空间发展,键角都是109°28',最小的碳环上有六个碳原子。
(4)石墨(如图4、5):层状结构,每一层内,碳原子以正六边形排列成平面的网状结构,每个正六边形平均拥有两个碳原子。
片层间存在范德华力,是混合型晶体。
熔点比金刚石高。
(5)干冰(如图6):分子晶体。
(6)SiO2:原子晶体,空间网状结构,Si原子构成正四面体,O原子位于Si-Si键中间。