高三化学电解池
- 格式:pdf
- 大小:748.77 KB
- 文档页数:10
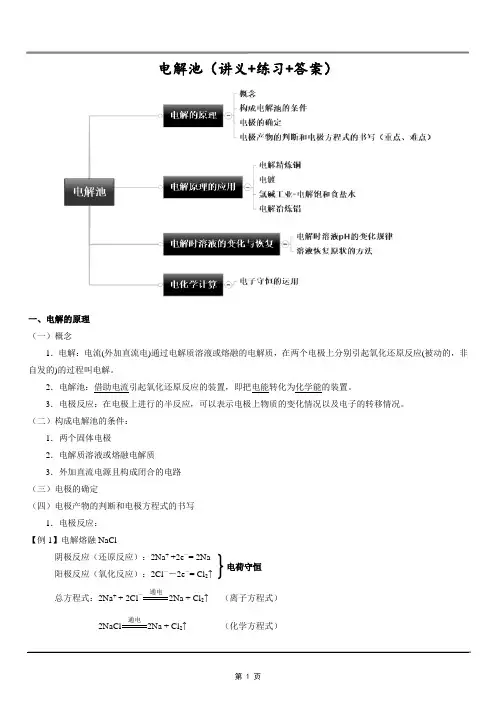
电解池(讲义+练习+答案)一、电解的原理(一)概念1.电解:电流(外加直流电)通过电解质溶液或熔融的电解质,在两个电极上分别引起氧化还原反应(被动的,非自发的)的过程叫电解。
2.电解池:借助电流引起氧化还原反应的装置,即把电能转化为化学能的装置。
3.电极反应:在电极上进行的半反应,可以表示电极上物质的变化情况以及电子的转移情况。
(二)构成电解池的条件:1.两个固体电极2.电解质溶液或熔融电解质3.外加直流电源且构成闭合的电路(三)电极的确定(四)电极产物的判断和电极方程式的书写1.电极反应:【例1】电解熔融NaCl阴极反应(还原反应):2Na+ +2e-= 2Na阳极反应(氧化反应):2Cl--2e-= Cl2↑总方程式:2Na+ + 2Cl-通电2Na + Cl2↑(离子方程式)2NaCl 通电2Na + Cl2↑ (化学方程式)电荷守恒2.电解时电极反应式的书写:①分析电解质溶液中存在的离子;②分析离子的放电顺序; ③确定电极、写出电极反应式; ④写出电解方程式。
【例2】电解CuCl 2的电极反应(1)分析电解质溶液中存在的离子CuCl 2溶液中存在哪些自由移动的离子? 。
(2)分析离子的放电顺序①阴极产物的判断(阴极材料(金属或石墨)总是受到保护)放电顺序为:Ag +>Hg 2+> Fe 3+>Cu 2+> H +(酸)>Pb 2+>Sn 2+>Fe 2+>Zn 2+> H +(水)Al 3+>Mg 2+>Na + >Ca 2+> K + ②阳极产物的判断如果是活性电极,则电极失去电子被溶解:活性电极﹥阴离子;如果是惰性电极,则放电顺序为:S 2->I ->Br ->Cl ->OH ->(NO 3-、SO 42-含氧酸根)>F -(惰性电极:C 、Pt 、Au 、Ti 等,即NO 3-、SO 42-,F -在水溶液中不放电)总结:活性电极>S 2->I ->Br ->Cl ->OH ->(NO 3-、SO 42-含氧酸根)>F -(3)确定电极、根据放电顺序写出电极反应式阴极:Cu 2+ +2e -= Cu(还原反应)阳极:2Cl --2e -= Cl 2↑ (氧化反应) (4)写出电解方程式:CuCl 2通电Cu+ Cl 2↑【变式训练】(1)书写用石墨做电极电解硫酸的电极方程式和电解池方程式。
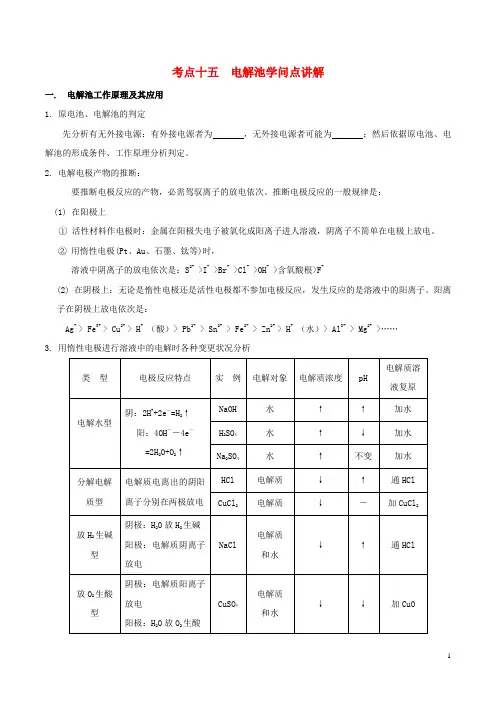
考点十五电解池学问点讲解一. 电解池工作原理及其应用1. 原电池、电解池的判定先分析有无外接电源:有外接电源者为,无外接电源者可能为;然后依据原电池、电解池的形成条件、工作原理分析判定。
2. 电解电极产物的推断:要推断电极反应的产物,必需驾驭离子的放电依次。
推断电极反应的一般规律是:(1) 在阳极上①活性材料作电极时:金属在阳极失电子被氧化成阳离子进人溶液,阴离子不简单在电极上放电。
②用惰性电极(Pt、Au、石墨、钛等)时,溶液中阴离子的放电依次是:S2- >I- >Br- >Cl- >OH- >含氧酸根>F-(2) 在阴极上:无论是惰性电极还是活性电极都不参加电极反应,发生反应的是溶液中的阳离子。
阳离子在阴极上放电依次是:Ag+ > Fe3+ > Cu2+ > H+(酸)> Pb2+ > Sn2+ > Fe2+ > Zn2+ > H+(水)> Al3+ > Mg2+>……3. 用惰性电极进行溶液中的电解时各种变更状况分析典例1(2025届内蒙古赤峰二中高三上学期其次次月考)某化学课外活动小组拟用铅蓄电池进行电絮凝净水的试验探究,设计的试验装置如图所示,下列叙述正确的是A. Y 的电极反应: Pb-2e- = Pb2+B.铅蓄电池工作时SO42-向 Y 极移动C.电解池的反应仅有2Al+6H2O 2Al(OH)3+3H2D.每消耗 103.5 gPb ,理论上电解池阴极上有0.5 molH2生成【答案】D典例2(2025届内蒙古自治区赤峰其次中学高三上学期其次次月考)某化学课外活动小组拟用铅蓄电池进行电絮凝净水的试验探究,设计的试验装置如图所示,下列叙述正确的是A. Y 的电极反应: Pb-2e- = Pb2+B.铅蓄电池工作时SO42-向 Y 极移动C.电解池的反应仅有2Al+6H2O2Al(OH)3+3H2↑D.每消耗 103.5 gPb ,理论上电解池阴极上有0.5 molH2生成【答案】D二. 电解原理在工业生产中的应用1.电解精炼反应原理(电解精炼铜)阳极(粗铜,含Fe、Zn、C等):Cu-2e—=Cu2+,阴极(纯铜):Cu2++2e—=Cu工作一段时间后,溶液中电解质的成分CuSO4、ZnSO4、FeSO4,Cu2+的浓度减小。


高考化学中的电解池解析电解池是化学中常见的实验装置,也是高考化学中的重要考点之一。
电解池的结构和原理对于理解电化学反应和电解概念至关重要。
本文将对高考化学中的电解池进行解析,从结构、原理、电解过程和相关实例等方面进行详细阐述,帮助考生深入理解电解现象。
一、电解池的结构和原理电解池是由电解槽、电极和电解质组成的。
电解槽一般由玻璃或陶瓷制成,分为阳极和阴极两个电极室,中间有隔膜或盐桥。
阳极和阴极通过电解质相互连接,形成电路。
电解质通常是溶于溶液或熔融态的离子化合物,可以导电。
电解池的原理是利用外加电源提供的电能,使阴极发生还原反应,阳极发生氧化反应,从而实现物质的电解过程。
二、电解过程在电解池中,通过外加电源,形成正负极电压差,使得阳极和阴极之间形成电势差。
阴极吸收电子,还原成金属或氢气等物质,称为还原反应。
阳极失去电子,发生氧化反应,生成氧气或非金属离子等物质。
电解过程涉及两个半反应:在阴极发生的还原反应和在阳极发生的氧化反应。
这两个半反应通过电子的转移实现了电解过程。
三、电解池的实例分析1. 水的电解水的电解是电解学中经典的实验,也是高考化学常见的考点。
在水的电解过程中,阴极发生还原反应,生成氢气;阳极发生氧化反应,生成氧气。
整个电解过程可以用下面的化学方程式表示:2H2O(l) → 2H2(g) + O2(g)2. 金属离子的电解金属离子的电解也是高考化学中常见的考题。
以铜离子的电解为例,铜离子在阴极处还原成金属铜,而阳极则发生氧化反应。
反应方程式如下:Cu2+(aq) + 2e- → Cu(s)4. 盐溶液的电解盐溶液的电解和水的电解类似,但是在溶液中存在离子化合物,会影响电解过程。
以氯化钠溶液的电解为例,根据离子电离和溶液中离子的浓度关系,电解过程可以得到以下反应方程式:2Na+(aq) + 2Cl-(aq) → 2Na(s) + Cl2(g)四、总结电解池是高考化学中的重要考点,正确理解电解池的结构和原理对于解答相关问题非常关键。

第三节电解池一、电解原理1、电解池:把电能转化为化学能的装置叫做电解池或电解槽。
2、电解:电流(外加直流电)通过电解质溶液而在阴阳两极引起氧化还原反应(被动的不是自发的)的过程3、放电:当离子到达电极时,失去或获得电子,发生氧化还原反应的过程。
反应条件:①连接直流电源②阴阳两极阴极:与电源负极相连;极:与电源正极相连。
③两极处于电解质溶液或熔融电解质中④两电极形成闭合回路4、电子流向:电源负极一电解池阴极一离子定向运动(电解质溶液)一电解池阳极一电源正极5、电极名称及反应:阳极:与直流电源的正极相连的电极,发生氧化反应失去电子;阴极:与直流电源的负极相连的电极,发生还原反应得到电子。
7、电解本质:电解质溶液的导电过程,就是电解质溶液的电解过程8、反应规律:阳极:活泼金属一电极失电子6“ Pt除外);惰性电极一溶液中阴离子失电子阴离子失电子能力:活泼金属(除Pt, Au)>S2->|->Br->Cl->OH->含氧酸根(NO3->SO42-)>F-阳离子得电子能力:Ag+>Hg2+>Fe3+>Cu2+>H+ (酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+ (水)>Al3+>Mg2+>Na+>Ca2+>K+ (即金属活泼性顺序表的逆向)规律:铝前(含铝)离子不放电,氢(酸)后离子先放电,氢(酸)前铝后的离子看条件。
9、四类电解型的电解规律(当阳极为惰性电极时)①电解水型(强碱,含氧酸,活泼金属的含氧酸盐),pH由溶液的酸碱性决定,溶液呈碱性则pH增大,溶液呈酸性则pH减小,溶液呈中性则pH不变。
电解质溶液复原一加适量水。
②电解电解质型(无氧酸,不活泼金属的无氧酸盐),无氧酸pH变大,不活泼金属的无氧酸盐pH不变。
电解质溶液复原一加适量电解质。
③放氢生碱型(活泼金属的无氧酸盐),pH变大。


高三化学知识点总结电解池高三化学知识点总结:电解池电解池是指进行电解反应的装置,由电解槽、电解质溶液和阳极、阴极等组成。
电解池在化学实验和工业生产中具有重要的应用价值。
接下来,本文将对高三化学中与电解池相关的知识点进行总结。
一、电解质与电解1. 电解质电解质是指能在溶液或熔融状态下导电的物质,包括电离度较高的无机盐、酸、碱等。
电解质的分类可分为强电解质和弱电解质,前者在溶液中能完全电离出正、负离子,后者只能部分电离。
2. 电解电解是指在电解质溶液或熔融电解质中,通过外加电压,使电解质分子或离子发生氧化还原反应,产生新的物质的过程。
电解的反应在阳极和阴极上分别进行。
二、电解质溶液中的电离与离子反应1. 电离过程当电解质溶解或熔融时,其分子或晶体中的离子会与溶剂分子发生作用,导致电解质溶液中存在离子。
这种过程称为电离,电解质溶液中的电离可用离解方程式表示。
举例:氯化钠溶液的电离方程式为NaCl(aq) → Na+(aq) + Cl-(aq)2. 离子反应在电解质溶液中,正离子和负离子可以发生离子反应。
离子反应通常以离子方程式表示。
举例:氯离子与银离子反应生成氯化银沉淀的离子方程式为Ag+(aq) + Cl-(aq) → AgCl(s)三、电解液的选择与电解质选择性1. 电解液的选择在进行电解实验时,选择合适的电解液十分重要。
一方面,电解液必须是电解质,能够导电;另一方面,电解液不能与阳极或阴极发生反应。
举例:在氯化钠溶液中进行电解制氯时,溶液中的离子反应较为复杂,因此选择氯化钠溶液作为电解液。
2. 电解质选择性电解质选择性指的是在电解质溶液中,电解出来的离子种类和比例受到电解质本身性质的影响。
不同电解质溶液在电解过程中产生的离子种类和比例可能不同。
举例:在氯化钠溶液中电解时,会得到氯气和氢气;而在硫酸铜溶液中电解时,会得到氧气和铜。
四、电解反应的规律与应用1. 电离度大小与电解质浓度电离度大小与电解质溶液浓度有关。


化学高三电解池知识点电解池是化学中重要的概念之一,也是高三化学考试的重要内容。
了解电解池的知识点对于理解电化学反应、电解质溶液以及电解过程中的原理和应用具有重要意义。
本文将从理论基础、电解质溶液的导电性、电解过程和常见电解池等几个方面进行论述。
一、理论基础1. 电解池的定义:电解池是进行电解反应的装置,通常由电解质溶液、两个电极(阴极和阳极)以及电源组成。
2. 电解质:电解质是指能在溶液中或熔融状态下导电的物质,可以分为强电解质和弱电解质。
3. 离子:在电解质溶液中,电解质分子会发生电离,形成正负离子,这些离子在电解过程中承担着重要的作用。
二、电解质溶液的导电性1. 强电解质和弱电解质的区别:强电解质在水中能完全电离成离子,产生较高的电导率;弱电解质只有部分分子电离成离子,导电性较弱。
2. 浓度和导电性的关系:电解质溶液的浓度越高,其中的离子浓度越大,所以导电性也随之增加。
3. 温度和导电性的关系:温度升高,电解质溶液的导电性也会增加,因为分子和离子的运动速度加快。
三、电解过程1. 阳极和阴极:在电解质溶液中,阳极是发生氧化反应的电极,阴极是发生还原反应的电极。
2. 氧化反应和还原反应:在电解过程中,阳极上的离子被氧化,失去电子;阴极上的离子被还原,获得电子。
3. 正负极的变化:在电解过程中,阳极通常会出现氧气或其他气体的产生,阴极则有金属的析出。
四、常见电解池1. 氯碱电解池:氯碱电解池是一种工业上常见的电解池,用于生产氯气、氢气和氢氧化钠。
在这个电解池中,氯化钠溶液被电解,产生氯气和氢气,同时生成氢氧化钠溶液。
2. 铜电解池:铜电解池是利用电解的方法从铜离子溶液中还原出纯铜金属的装置。
铜电解池广泛应用于冶金工业和电子工业中。
3. 锂电池和燃料电池:锂电池和燃料电池是利用电化学反应将化学能转化为电能的装置,广泛应用于移动电子设备和新能源汽车领域。
总结:电解池是进行电解反应的重要装置,掌握电解池的知识有助于理解电化学的基本原理和应用。

2024届高三化学知识点强化训练—电解池电解池是一种可以通过电解反应来产生化学变化的装置。
它由两个电极和一个电解质组成。
其中一个电极是阳极,通常由金属材料制成,另一个电极是阴极,通常是一个非金属材料。
电解质是一个可以导电的物质,通常是一个溶解在水中的盐或酸。
在电解过程中,电流从阳极流向阴极,从而产生化学反应。
在阳极,发生氧化反应,电子从金属离子中释放出来,金属离子转化为金属原子或者离子。
在阴极,通常发生还原反应,电子从溶液中的金属离子接收,形成金属原子或离子。
在电解中,阳极和阴极之间的电解质起着重要的作用。
它不仅提供了离子导体,还维持了电解过程的进行。
电解质的选择取决于所需的化学反应。
常见的电解质包括盐,酸和碱。
电解池在许多工业和实验室应用中都发挥着重要的作用。
例如,电镀就是使用电解池来在金属表面上形成一层薄膜,以提供耐磨损和防腐蚀的保护。
电解还可以用于制备金属和化学品,如制备纯铝和氯气。
在电解过程中,还会发生一些附加的反应,如水分解。
水分解是指水分子被电解分解成氢气和氧气。
这是由于电流产生的氢离子向阴极移动,而氢离子在阴极上接收电子并形成氢气。
类似地,氢离子在阳极上失去电子,产生氧气。
电解是一个重要的化学概念,在化学学科中有很多应用。
掌握电解的原理和方法,可以帮助我们理解许多化学过程和实验。
通过进行电解池的强化训练,可以提高我们对电解过程的理解和掌握,为化学学科的学习打下坚实的基础。
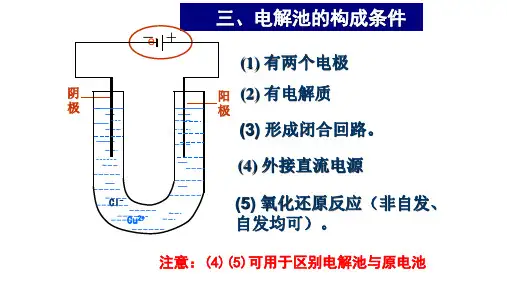
§5.3 电解、电解池一、定义:把电能转化为化学能的装置。
二、基本概念:阳极:与电源正极相连,发生氧化反应(失电子)。
阴离子向阳极移动;阴极:与电源负极相连,发生还原反应(得电子)。
阳离子向阴极移动。
三、原电池和电解池的区别:1、池型判断:有外加电源为电解池,无外加电源为原电池。
多池组合时,一般含活泼金属的池为原电池,其余是在原电池带动下的电解池。
2、电极判断:原电池——正极、负极;电解池——阴极、阳极。
电解池的阴极对应外加电源的负极,阳极对应外加电源的正极。
四、电解池放电顺序(与阳离子氧化性、阴离子还原性正相关):ⅠⅡ阳极:[S2- > > > ]>[ > 含氧酸根(如42-)> ]ⅢⅣ阴极:[> 3+ > 2+]>[> 2+ > 2+ > 3+ > 2+ >]Ⅰ与Ⅲ区:电解本身型如2Ⅰ与Ⅳ区:放氢生碱型如Ⅱ与Ⅲ区:放氧生酸型如4、3Ⅱ与Ⅳ区:电解水型如24、H24、第一组:电解本身型(2)值增大的原因:2本身是强酸弱碱盐,显酸性,电解浓度减小,故酸性随之减弱。
第二组:放氢生碱型()值减小的原因:本身是强碱弱酸盐,显碱性,电解又消耗,故碱性增强。
第三组:放氧生酸型(4)值减小的原因:4本身是强酸弱碱盐,显酸性,电解又消耗,故酸性增强。
第四组:电解水型(24)1、影响:阳极失电子逐渐溶解,溶液中的阴离子不能失电子。
阴极无影响。
2、原因:活泼金属单质的还原性强于溶液中各离子的还原性,造成失电子的变成金属单质而不是溶液中的阴离子。
第五组:电解H24铜作阳极,石墨作阴极1、两极的现象:阴极有大量气泡产生,阳极附近溶液出现蓝色。
2、两极的反应:阴极:2 + 2e = H2↑,阳极: - 2e = 2+(溶液变蓝)铜作阴极,石墨作阳极(铜无法发挥其还原性,故此情况下相当于电解水)1、两极的现象:两极都有气泡。
2、两极的反应:阴极:2 + 2e = H2↑,阳极2H2O - 4e = 2 + O2↑(铜在外加电源时可以置换出 H2↑)五、电解原理的应用:1、铜的电解精炼(1)粗铜所含杂质:、、、、等(2)粗铜的精炼:粗铜作阳极,纯铜作阴极,4溶液作电解液。
化学高考电解池知识点电解池是中的一个重要知识点,它涉及到许多基础概念以及实际应用。
本文将从电解池的定义、构成要素、电解质以及应用等方面来进行论述。
一、电解池的定义与构成要素电解池是指用来进行电解过程的装置,主要由两个电极、电解质和外部直流电源组成。
其中,电解质是用来提供带电离的离子,而电极则是通过与电解质发生反应,将电荷转移给电解质的物质。
在电解池中,通常将接通电源的电极称为阳极,而带正电离子的离子溶液对应的电极称为阴极。
这是因为在电解过程中,阳极通常会发生氧化反应,而阴极则会发生还原反应,从而使电解质的离子得到电荷转移。
二、电解质的选择及其溶液浓度的影响在电解质的选择上,通常选择具有良好电离性的盐类。
比如,电解铜(II)硫酸溶液中的铜离子和硫酸根离子就是电解池中的电解质。
此外,电解质溶液的浓度也会对电解过程产生一定的影响。
实验表明,在一定范围内,电解质溶液浓度的增大可以提高电流的强度,加快电解反应的速率。
这是因为溶液浓度越高,离子的含量也就越多,电子转移的机会就越大,因此电流的强度也会增加。
三、电解过程中的电极反应电解过程中,阳极和阴极上会发生许多有趣的化学反应。
阳极通常发生氧化反应,而阴极发生还原反应。
以电解铜(II)硫酸溶液为例,阳极上的化学反应是:Cu2+ + 2e- → Cu这是一种还原反应,铜离子得到电子之后被还原成了铜原子,并沉积到阳极上形成铜层。
而阴极上的化学反应是:Cu2+ + 2e- → Cu这是一种氧化反应,铜离子失去电子被氧化成了铜离子,并进一步溶解到溶液中。
四、电解过程的实际应用电解过程在实际应用中起到了非常重要的作用。
比如,可以利用电解铜(II)硫酸溶液来制备纯铜,或者利用电解氯化钠溶液来制备氯气和氢气等。
此外,电解还可以应用于电镀、电解制氢、电解合成有机化合物等领域。
通过调整电解池的条件,可以达到不同的电解效果,从而满足不同的实际需求。
综上所述,电解池是中的重要知识点,涉及到电解过程的定义、构成要素、电解质选择、溶液浓度影响以及电极反应等方面的内容。
电解池(讲义+练习+答案)一、电解的原理(一)概念1.电解:电流(外加直流电)通过电解质溶液或熔融的电解质,在两个电极上分别引起氧化还原反应(被动的,非自发的)的过程叫电解。
2.电解池:借助电流引起氧化还原反应的装置,即把电能转化为化学能的装置。
3.电极反应:在电极上进行的半反应,可以表示电极上物质的变化情况以及电子的转移情况。
(二)构成电解池的条件:1.两个固体电极2.电解质溶液或熔融电解质3.外加直流电源且构成闭合的电路(三)电极的确定(四)电极产物的判断和电极方程式的书写1.电极反应:【例1】电解熔融NaCl阴极反应(还原反应):2Na+ +2e-= 2Na阳极反应(氧化反应):2Cl--2e-= Cl2↑总方程式:2Na+ + 2Cl-通电2Na + Cl2↑(离子方程式)2NaCl 通电2Na + Cl2↑ (化学方程式)电荷守恒2.电解时电极反应式的书写:①分析电解质溶液中存在的离子;②分析离子的放电顺序; ③确定电极、写出电极反应式; ④写出电解方程式。
【例2】电解CuCl 2的电极反应(1)分析电解质溶液中存在的离子CuCl 2溶液中存在哪些自由移动的离子? 。
(2)分析离子的放电顺序①阴极产物的判断(阴极材料(金属或石墨)总是受到保护)放电顺序为:Ag +>Hg 2+> Fe 3+>Cu 2+> H +(酸)>Pb 2+>Sn 2+>Fe 2+>Zn 2+> H +(水)Al 3+>Mg 2+>Na + >Ca 2+> K + ②阳极产物的判断如果是活性电极,则电极失去电子被溶解:活性电极﹥阴离子;如果是惰性电极,则放电顺序为:S 2->I ->Br ->Cl ->OH ->(NO 3-、SO 42-含氧酸根)>F -(惰性电极:C 、Pt 、Au 、Ti 等,即NO 3-、SO 42-,F -在水溶液中不放电)总结:活性电极>S 2->I ->Br ->Cl ->OH ->(NO 3-、SO 42-含氧酸根)>F -(3)确定电极、根据放电顺序写出电极反应式阴极:Cu 2+ +2e -= Cu(还原反应)阳极:2Cl --2e -= Cl 2↑ (氧化反应) (4)写出电解方程式:CuCl 2通电Cu+ Cl 2↑【变式训练】(1)书写用石墨做电极电解硫酸的电极方程式和电解池方程式。