地球化学 实习二 实验二_pH-Eh关系图解的制作
- 格式:doc
- 大小:99.50 KB
- 文档页数:3
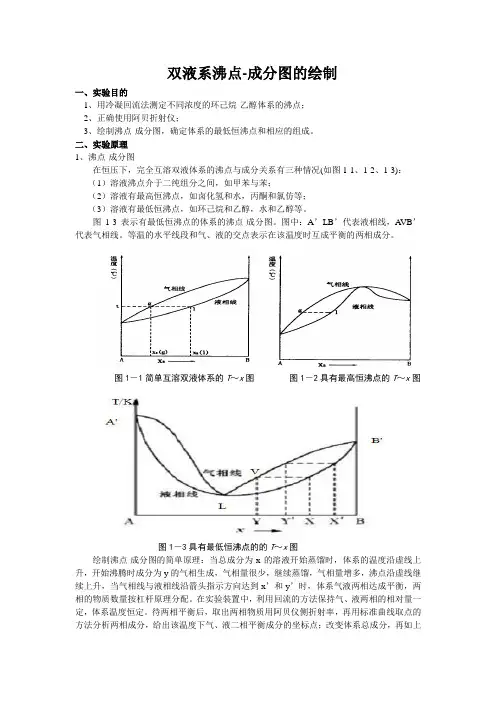
双液系沸点-成分图的绘制一、实验目的1、用冷凝回流法测定不同浓度的环己烷-乙醇体系的沸点;2、正确使用阿贝折射仪;3、绘制沸点-成分图,确定体系的最低恒沸点和相应的组成。
二、实验原理1、沸点-成分图在恒压下,完全互溶双液体系的沸点与成分关系有三种情况(如图1-1、1-2、1-3):(1)溶液沸点介于二纯组分之间,如甲苯与苯;(2)溶液有最高恒沸点,如卤化氢和水,丙酮和氯仿等;(3)溶液有最低恒沸点,如环己烷和乙醇,水和乙醇等。
图1-3表示有最低恒沸点的体系的沸点-成分图。
图中:A’LB’代表液相线,A VB’代表气相线。
等温的水平线段和气、液的交点表示在该温度时互成平衡的两相成分。
图1-1简单互溶双液体系的T~x图图1-2具有最高恒沸点的T~x图图1-3具有最低恒沸点的的T~x图绘制沸点-成分图的简单原理:当总成分为x的溶液开始蒸馏时,体系的温度沿虚线上升,开始沸腾时成分为y的气相生成,气相量很少,继续蒸馏,气相量增多,沸点沿虚线继续上升,当气相线与液相线沿箭头指示方向达到x’和y’时,体系气液两相达成平衡,两相的物质数量按杠杆原理分配。
在实验装置中,利用回流的方法保持气、液两相的相对量一定,体系温度恒定。
待两相平衡后,取出两相物质用阿贝仪侧折射率,再用标准曲线取点的方法分析两相成分,给出该温度下气、液二相平衡成分的坐标点;改变体系总成分,再如上法找出另一对坐标点。
将所有气相点和液相点连成气相线和液相线,即得T-x平衡图。
2、阿贝仪的使用阿贝仪利用了折射和全反射全反射原理设计而成。
将样品滴在棱镜上,旋转棱镜使目镜能看到半明半暗现象。
旋转补偿棱镜消除色散,在转动棱镜使明暗界线正好与目镜中的十字线交点重合,从标尺上直接读取折射率。
三、实验仪器及药品1、仪器恒沸点仪阿贝尔折射仪(WZS-I 940168)蒸馏瓶电阻丝变压器水银温度计(50~100℃,分度值0.1℃)恒温水浴装置5mL、20mL移液管滴瓶万分之一天平2、药品乙醇环己烷图1-4 恒沸点仪四、实验内容1、沸点和两相成分的测定1)洗净、烘干蒸馏瓶,加20mL乙醇使温度升高并沸腾,每隔30s记一次数据;2)待温度稳定3min后,记最终温度及大气压;3)断电,用两只滴管取支管口处气相冷凝液及蒸馏瓶中液体,用阿贝折射仪测折射率,气相冷凝液测1次,液相测2次;4)蒸馏瓶中依次加2mL、2mL、3mL、4mL、5mL环己烷,按上述方法测沸点及气液两相折射率;5)回收母液,少量环己烷洗蒸馏瓶3~4次,注入20mL环己烷,测纯沸点及气液两相折射率;6)再向蒸馏瓶中依次加0.5mL、0.5mL、0.5mL、2mL、5mL、5mL乙醇,分别测沸点及气、液两相折射率。

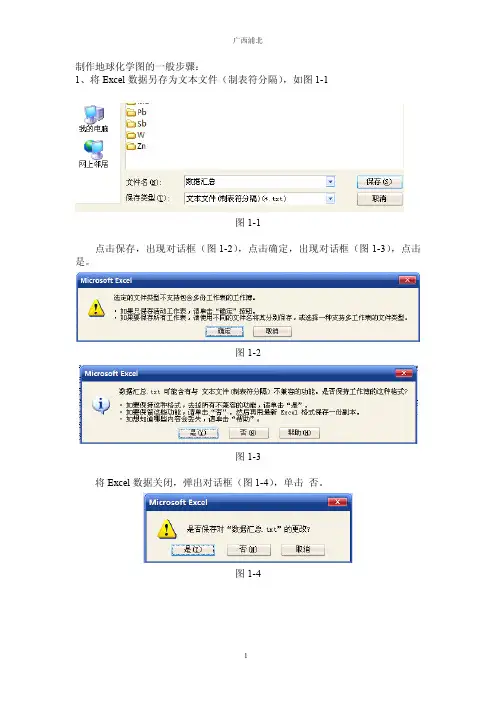

实验四地球化学制图
一实验目的与要求
通过实验,加深对地球化学场和地球化学异常的理解,掌握元素地球化学图和地球化学剖面图的绘制方法。
二实验内容与实验步骤:
(一)元素地球化学图(单元素含量等值线图)的绘制
作图步骤如下:
1 根据工作比例尺,并在相应的比例尺下的图纸上,用实心小圆点标注出测区内所有的采样点位置及其相应的位置编号(图1);
2 在每个采样点位置标出该点样品的元素含量分析结果,一张图上一般只标注一种元素,最多不超过两种元素;
3 按照对数或算数等间隔采用内插法勾绘等值线。
通常,如果异常强度很高(例如异常强度达到背景值的数倍、十数倍乃至上百倍)时,采用对数等间距;异常强度不高时,则采用算数等间距。
本实验以4ppm 为等值线间隔进行作图。
(二)地球化学剖面图的绘制
作图步骤如下:
1 元素含量按照一定的比例尺,绘出所在测线长度,并按照一定间距标出相应位置标号;
2 将剖面上采集样品的元素分析结果按照一定的纵向比例尺于剖面相应采集点位处的上方(与侧线水平轴线垂直方向)通过实心小圆点标出;
3 将相邻测点上对应的标志点用线段连接在一起,则会形成一条起伏变化的曲线,成为元素含量剖面图;
表1为内蒙某地Ⅴ号剖面采样点位及W元素的含量,请按照1:10000的横向比例尺,1:20(1cm=20ppm)的纵向比例尺绘制一张元素地球化学剖面图。
表1 内蒙某地Ⅴ号剖面采样点位及W元素的含量
实验报告要求内容:
一、实验目的与要求;
二、实验方法与步骤;
三、绘制地球化学剖面图;
四、绘制元素地球化学图;
图1 某区Co元素地球化学元素含量数据图。

学号:基础物理化学实验报告实验名称:电势-PH图的绘制班级:药学2班组号:1组实验人姓名:蔡慧同组人姓名:曾白霜、俞超文指导老师:杨平实验日期:湘南学院化学与生命科学系一、实验目的:(1)测定Fe3+/Fe2+ -EDTA 络合体系在不同PH 条件下的电极电势,绘制电势-PH 曲线(2)了解电势-PH 图的意义及应用(3)掌握电极电势,电池电动势和PH 的测量原理和方法二、主要实验原理,实验所用定律、公式:很多氧化还原反应不仅与溶液中离子的浓度有关,而且与溶液的pH 值有关,即电极电势与浓度和酸度成函数关系。
如果指定溶液的浓度,则电极电势只与溶液的pH 值有关。
在改变溶液的pH 值时测定溶液的电极电势,然后以电极电势对pH 作图,这样就可得到等温、等浓度的电势-pH 曲线。
对于Fe 3+/Fe 2+-EDTA 配合体系在不同的pH 值范围内,其络合产物不同,以Y 4-代表EDTA 酸根离子。
我们将在三个不同pH 值的区间来讨论其电极电势的变化。
1、高pH 时电极反应为Fe(OH)Y 2-+e FeY 2-+OH -根据能斯特(Nernst)方程,其电极电势为:φ=φ--2--2Fe(OH)Y OH FeY ln a a a F RT ⋅稀溶液中水的活度积K W 可看作水的离子积,又根据pH 定义,则上式可写成φ=φ-b 1-FRTm m F RT 303.2ln -2-2Fe(OH)Y FeY -pH (1)在EDTA 过量时,生成的络合物的浓度可近似看作为配制溶液时铁离子的浓度。
即 m FeY 2- ≈m Fe 2+ 。
在m Fe 2+ / m Fe 3+不变时,φ与pH 呈线性关系。
如图中的cd 段。
2、在特定的PH 范围内,Fe 2+和Fe 3+能与EDTA 生成稳定的络合物FeY 2-和FeY -,其电极反应为FeY - +e FeY 2-其电极电势为φ=φ --2FeY FeY ln a a F RT -(1) 式中,φ 为标准电极电势;a 为活度,a =γ·m(γ为活度系数;m 为质量摩尔浓度)。

一、实习背景与目的随着科技的不断进步,地球化学在资源勘探、环境保护、灾害预警等领域发挥着越来越重要的作用。
为了更好地将所学知识与实践相结合,提高我们的专业技能和综合素质,我们于[实习时间]在[实习单位]进行了为期[实习天数]的地球化学实习。
本次实习旨在通过实际操作,加深对地球化学理论知识的理解,提高野外勘查能力,培养团队协作精神。
二、实习内容与方法1. 实习内容(1)野外勘查:了解地球化学勘查的基本流程,掌握样品采集、分析、处理等方法。
(2)实验室分析:学习地球化学实验室的基本操作,包括样品前处理、仪器分析、数据处理等。
(3)地质地貌考察:观察实习区域的地形地貌特征,了解区域地质背景。
(4)地球化学异常分析:分析实习区域的地球化学异常特征,识别成矿有利地段。
2. 实习方法(1)野外勘查:采用实地考察、样品采集、仪器测量等方法。
(2)实验室分析:采用化学分析、仪器分析等方法。
(3)地质地貌考察:通过实地观察、地形地貌分析等方法。
(4)地球化学异常分析:采用地球化学数据处理、异常识别、成矿预测等方法。
三、实习过程与成果1. 野外勘查实习期间,我们深入实习区域,对地形地貌、地质构造、地球化学特征进行了详细考察。
通过实地采样,采集了土壤、水、岩石等样品,为后续分析提供了基础数据。
2. 实验室分析在实验室,我们学习了样品前处理、仪器分析、数据处理等基本操作。
通过对样品的分析,了解了实习区域的地球化学特征,为成矿预测提供了依据。
3. 地质地貌考察通过对实习区域的地形地貌考察,我们掌握了区域地质背景,为地球化学勘查提供了基础。
4. 地球化学异常分析通过对实习区域的地球化学异常分析,我们识别出多个成矿有利地段,为后续资源勘探提供了重要线索。
四、实习体会与收获1. 实习过程中,我们深刻认识到地球化学在资源勘探、环境保护、灾害预警等领域的重要作用。
2. 通过实际操作,我们对地球化学理论知识有了更深入的理解,提高了野外勘查能力。



《地球化学》实习二pH-Eh关系图解的制作一、实习目的1、掌握H2O对自然环境中Eh的控制作用。
2、掌握pH-Eh关系图解的制作方法。
3、了解pH-Eh关系图解在地球化学研究中的意义。
二、实习原理1、自然氧化-还原环境的极限氧化上限:H2O ⇔ 1/2O2 + 2H+ + 2e-E0=1.23V (P O2=0.21)E = E0 + (0.059/n)⋅log KE = 1.22 – 0.059pH还原上限:H2⇔ 2H+ + 2e-E0=0.00V (P H2=1)E = E0 + (0.059/n)⋅log KE = – 0.059pH2、pH-Eh关系图解以Eh为纵坐标,pH为横坐标,图示pH与Eh的关系。
以Fe3+-Fe2+、Fe(OH)3-Fe(OH)2、Fe2+-Fe(OH)3半反应为例,绘制pH-Eh关系图解。
三、实习内容1、绘制H2O的pH-Eh关系图解⑴H2O的电化学半反应方程式:(-)H2O→1/2 O2 +2H++ 2e- E0 =1.23 VE = 1.23 + 0.03 log[p O2]1/2[H+]2E = 1.22-0.059 pH当pH=4时,E=0.984当pH=9时,E=0.689(+)H2 → 2H+ + 2e- E0 =0.00VE =-0.059pH-(0.059/2)log p H2E =-0.059pH当pH=4时,E=-0.236当pH=9时,E=-0.5312、以Fe2+、Fe(OH)2、Fe3+、Fe(OH)3形式为例,绘制Fe的pH-Eh关系图解。
选定条件:[Fe2+]=1 M和[Fe2+]=10-3 M两种情形。
铁的Eh-pH相图编制;根据Fe2+→Fe3+反应形式分三段作图⑴当pH<2时,反应为:Fe2+ = Fe3++e- E0=0.77V线形为水平线,其上下为Fe3+、Fe2+优势场⑵当pH=2-10时,反应为:3 H2O + Fe2+ = Fe(OH)3 + 3H+ + e- E0= 1.06V;代入能斯特方程E = 1.06 +0.059log([H+]3/[ Fe2+])给定[Fe2+] = 1 mol, E = 1.06-0.177pH[Fe2+] =10-3 mol, E = 1.237-0.177pH⑶当pH>10时, 反应为:Fe(OH)2 + OH- = Fe(OH)3 + e- E0 = -0.56VE = -0.56 + 0.059 log[1/OH-] = 0.27 - 0.059pH⑷当pH<5.9时,反应为:Fe = Fe2++2e- E0=-0.41V给定[Fe2+] = 1 mol,E=E0,线形为水平线,其上下为Fe、Fe2+优势场;[Fe2+] =10-3 mol,E=E0-0.059 log(1/[ Fe2+])/2=-0.4985V,也为一条直线,其上下为Fe、Fe2+优势场。


地球化学实习主要流程步骤实习四概率分布型式的检验及背景值和异常下限的确定1.将实习用的数据新建一个文件夹,以自己的学号命名2.复制表4-1的数据,选择性粘贴→文本,然后保存。
文件→另存为→一共3个要点:保存的位置:自己建的文件夹里,必须和运行程序在同一级目录;文件名:推荐4-1;保存的文件类型:csv逗号分隔 (后缀必须是csv格式);然后以同样的操作方式复制表4-2的数据进行相同操作。
3.运行BASIC程序,得出结果4.以写字板方式(EXCEL)打开运行结果.5.简单解释一下相关参数的意思6.以相同的方式运行4-2的数据,得出运行结果.7.演示做作业。
复制实习4的作业到另外一个空白的WORD文档里,单独以自己的学号命名。
具体方式为:姓名+学号+实习内容的顺序。
比如:200701010326朱国勋No.18.开始填表:首先求出均值和方差,用各组组上限值(Xi),计算,以4-1为例:均值为1.46,方差为0.26,用EXCEL编辑公式=ROUND((A2-1.46)/0.26,2)9. 据值查标准正态概率分布函数表,得到各Xi点的累积概率F()。
10.计算Dn值,在F()的基础上加减13.6分组间隔频数f频率f累计频率∑fμ值概率F(μ)%临界曲线(上)临界曲线(下)0.77-0.97 3 3 3 -1.88 3.01 16.61 -10.590.97-1.17 9 9 12 -1.12 13.14 26.74 -0.461.17-1.37 22 22 34 -0.35 36.32 49.92 22.721.37-1.57 32 32 66 0.42 66.28 79.88 52.681.57-1.77 20 20 86 1.19 88.3 101.9 74.71.77-1.97 12 12 98 1.96 97.5 111.1 83.91.97-2.17 2 2 100 2.73 99.68 113.28 86.0811.建立画图的文件。
17. Eh-pH - DIAGRAMS (Pourbaix-diagrams)电位-pH图展现了液体中不同物种的热力学稳定区域,稳定区域根据pH以及电势提出,通常情况下,水的稳定区域上限和下限在图中用虚线表示。
传统上,这些图表取自不同的手册。
然而,在大多数手册中,这些图只能用于有限数量的温度、浓度和元素组合。
HSC Chemistry的Eh-pH模块,用户可以在选定的温度和浓度下快速、灵活、准确地绘图。
The Eh-pH-module is based on STABCAL - Stability Calculations for Aqueous Systems - developed by H.H. Haung, at Montana Tech., USA9,10.17.1 IntroductionEh-pH-diagram也被称为Pourbaix-diagram。
这些图中最简单的类型是基于一种元素和水溶液组成的化学系统,例如Mn-H2O系统。
系统可以包含溶解离子、固态氧化物、氢氧化物、氧化物等多种类型的物质。
Eh-pH图显示了这些物质在氧化还原电位- pH-坐标下的稳定性区域。
通常氧化还原电位轴是基于标准氢电极(SHE)刻度指定Eh,但也可以使用其他刻度。
系统的氧化还原电位表示它交换电子的能力。
当电位较高时(Eh > 0),系统倾向于将电子从物种中移除,这些条件可能存在于电解池阳极附近,但也可以通过一些氧化剂(Cu + H2O2 = CuO + H2O)生成。
在还原条件下,当电位较低(Eh < 0)时,系统能够向种提供电子,例如阴极或一些还原剂。
该体系的pH值描述了它向该物质提供质子(H(+a))的能力。
在酸性条件下(pH < 7),质子浓度高,在碱性条件下(pH > 7),质子浓度低。
通常在固定的Eh-pH条件下,大量不同的物质同时存在于水溶液中。
Pourbaix图通过只显示每个稳定区域中含量最高的优势物种,大大简化了这种情况。
17. Eh-pH - DIAGRAMS (Pourbaix-diagrams)电位-pH图展现了液体中不同物种的热力学稳定区域,稳定区域根据pH以及电势提出,通常情况下,水的稳定区域上限和下限在图中用虚线表示。
传统上,这些图表取自不同的手册。
然而,在大多数手册中,这些图只能用于有限数量的温度、浓度和元素组合。
HSC Chemistry的Eh-pH模块,用户可以在选定的温度和浓度下快速、灵活、准确地绘图。
The Eh-pH-module is based on STABCAL - Stability Calculations for Aqueous Systems - developed by H.H. Haung, at Montana Tech., USA9,10.17.1 IntroductionEh-pH-diagram也被称为Pourbaix-diagram。
这些图中最简单的类型是基于一种元素和水溶液组成的化学系统,例如Mn-H2O系统。
系统可以包含溶解离子、固态氧化物、氢氧化物、氧化物等多种类型的物质。
Eh-pH图显示了这些物质在氧化还原电位- pH-坐标下的稳定性区域。
通常氧化还原电位轴是基于标准氢电极(SHE)刻度指定Eh,但也可以使用其他刻度。
系统的氧化还原电位表示它交换电子的能力。
当电位较高时(Eh > 0),系统倾向于将电子从物种中移除,这些条件可能存在于电解池阳极附近,但也可以通过一些氧化剂(Cu + H2O2 = CuO + H2O)生成。
在还原条件下,当电位较低(Eh < 0)时,系统能够向种提供电子,例如阴极或一些还原剂。
该体系的pH值描述了它向该物质提供质子(H(+a))的能力。
在酸性条件下(pH < 7),质子浓度高,在碱性条件下(pH > 7),质子浓度低。
通常在固定的Eh-pH条件下,大量不同的物质同时存在于水溶液中。
Pourbaix图通过只显示每个稳定区域中含量最高的优势物种,大大简化了这种情况。
17. Eh - pH - DIAGRAMS (Pourbaix-diagrams)Eh—pH-diagrams show the thermodynamic stability areas of differentspecies in an aqueous solution。
Stability areas are presented as a function ofpH and electrochemical potential scales. Usually the upper and lower stabilitylimits of water are also shown in the diagrams with dotted lines。
Traditionally these diagrams have been taken from different handbooks12。
However,in most handbooks these diagrams are available only for alimited number of temperatures,concentrations and elementcombinations。
Eh-pH图显示不同物种在水溶液中的热力学稳定区。
稳定的地区作为一个潜在的尺度和电化学作用的pH值.通常上、水下稳定极限也与虚线图所示.传统上,这些图已从不同的handbooks12。
然而,在大多数手册这些图是只有数量有限的温度,浓度和元素组合.The Eh—pH module of HSC Chemistry allows the construction of diagramsin a highly flexible and fast way, because the user can draw the diagramsexactly at the selected temperature and concentration.HSC化学Eh-pH模块允许在一个高度灵活和快速的方式图解,因为用户可以画出图形,在选定的温度和浓度.The Eh—pH—module is based on STABCAL - Stability Calculations forAqueous Systems —developed by H。
《地球化学》实习二
pH-Eh关系图解的制作
一、实习目的
1、掌握H2O对自然环境中Eh的控制作用。
2、掌握pH-Eh关系图解的制作方法。
3、了解pH-Eh关系图解在地球化学研究中的意义。
二、实习原理
1、自然氧化-还原环境的极限
氧化上限:
H2O ⇔ 1/2O2 + 2H+ + 2e-E0=1.23V (P O2=0.21)
E = E0 + (0.059/n)⋅log K
E = 1.22 – 0.059pH
还原上限:
H2⇔ 2H+ + 2e-E0=0.00V (P H2=1)
E = E0 + (0.059/n)⋅log K
E = – 0.059pH
2、pH-Eh关系图解
以Eh为纵坐标,pH为横坐标,图示pH与Eh的关系。
以Fe3+-Fe2+、Fe(OH)3-Fe(OH)2、Fe2+-Fe(OH)3半反应为例,绘制pH-Eh关系图解。
三、实习内容
1、绘制H2O的pH-Eh关系图解
⑴H2O的电化学半反应方程式:
(-)H2O→1/2 O2 +2H++ 2e- E0 =1.23 V
E = 1.23 + 0.03 log[p O2]1/2[H+]2
E = 1.22-0.059 pH
当pH=4时,E=0.984
当pH=9时,E=0.689
(+)H2 → 2H+ + 2e- E0 =0.00V
E =-0.059pH-(0.059/2)log p H2
E =-0.059pH
当pH=4时,E=-0.236
当pH=9时,E=-0.531
2、以Fe2+、Fe(OH)2、Fe3+、Fe(OH)3形式为例,绘制Fe的pH-Eh关系图解。
选定条件:[Fe2+]=1 M和[Fe2+]=10-3 M两种情形。
铁的Eh-pH相图编制;根据Fe2+→Fe3+反应形式分三段作图
⑴当pH<2时,反应为:
Fe2+ = Fe3++e- E0=0.77V
线形为水平线,其上下为Fe3+、Fe2+优势场
⑵当pH=2-10时,反应为:
3 H2O + Fe2+ = Fe(OH)3 + 3H+ + e- E0= 1.06V;
代入能斯特方程E = 1.06 +0.059log([H+]3/[ Fe2+])
给定[Fe2+] = 1 mol, E = 1.06-0.177pH
[Fe2+] =10-3 mol, E = 1.237-0.177pH
⑶当pH>10时, 反应为:
Fe(OH)2 + OH- = Fe(OH)3 + e- E0 = -0.56V
E = -0.56 + 0.059 log[1/OH-] = 0.27 - 0.059pH
⑷当pH<5.9时,反应为:
Fe = Fe2++2e- E0=-0.41V
给定[Fe2+] = 1 mol,E=E0,线形为水平线,其上下为Fe、Fe2+优势场;
[Fe2+] =10-3 mol,E=E0-0.059 log(1/[ Fe2+])/2=-0.4985V,也为一条直线,其上下为Fe、Fe2+优势场。
⑸当pH>5.9时,反应为:
Fe+2 OH- = Fe(OH)2 + 2e- E0 = -0.89V
代入能斯特方程E = -0.89+0.059log(1/[OH-]3)E=-0.062-0.059pH
四、实习步骤
1、建立电化学半反应方程式,查阅相关参数。
2、以设定的条件计算pH-Eh的关系。
3、绘制pH-Eh关系图解。
4、圈定自然界pH-Eh的变化范围。
5、探讨pH-Eh关系图解在地球化学研究中的意义。
五、实习要求
每人完成一份实习报告。