第九章细胞骨架(cytoskeleton)
- 格式:doc
- 大小:89.50 KB
- 文档页数:11


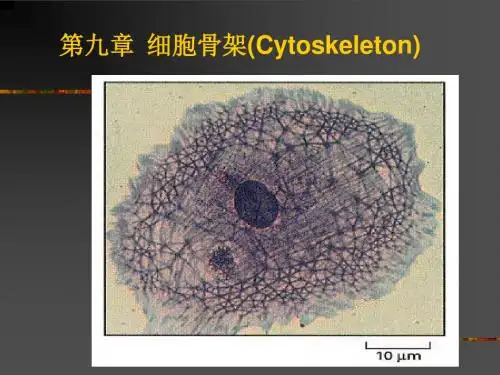






第九章细胞骨架(cytoskeleton)主要内容:1、细胞骨架的概念2、MT、MF、ZF的结构,组成及功能3、核骨架及染色体骨架的结构组成概述:cytoskeleton-真核细胞中的蛋白纤维网架体系细胞质骨架:MT、MF、IF狭义微梁广义功能形态观察→分子水平1928年,kiotzoff最初提出,1963年采用戌二醛固定后,才发现其存在。
第一节细胞质骨架一、微丝(micorfilament MF)又称激动蛋白纤维,真核cell中由肌动蛋白组成,d为7nm的骨架纤维。
(一)成份:肌动蛋白:43KD 哑铃状,存在于所有真核cell 中(哺孔类、鸟类)6种ß、r肌动蛋白在肌肉及非肌cell中基因由同一祖先基因进化而来(二)装配球形肌动蛋白(G-actTon)头→尾相接纤维形肌动蛋白CF-)有极性(+极较-极快)微丝是由一条肌动蛋白单体链形成的右手螺旋踏车行为(tread miwing)体外装配 F-action G-acton体内装配:装配取决于(1)单体的浓度;(2)成束,成网的程度;(3)微丝结合蛋白的调节(三)MF结合蛋白(naicrofilament associated pvotein)不同的MF含有不同的MF结合蛋白→独特结构1、肌肉收缩中的有关蛋白肌球蛋白:(myosin):450KD——4条多肽链——分子结构HMM HMM-S1 头部20nm ATPase 活性,构成组份的横桥与肌动蛋白分子结合360KD HMM-S2LMM 尾部130nm φ=2nm 150KD分子排列方式:平行交错排列→粗肌体尾一尾相对4000个分子/粗肌体H band原肌球蛋白(tropomyosin Tm)5-10% 64KD 长40nm两条多肽链形成â-螺旋肌动蛋白:Tm=7:1结合细肌丝肌钙蛋白:(troponin Tn)80KD3个亚基CapI: 32KD } 2个亚基存在于2线(封端蛋白) 36KD结合于actin的(+)报,防止ac+in解聚a——辅肌动蛋白200KD 粘着两条肌动Pr丝,横连成束组蛋白:116KD——另外使actin同质膜相联其它蛋白还有:titin mebulin dystrophin(伴肌动蛋白)(肌营养不良蛋白)细肌丝的分子结构(图9-4)→Fig 10-42、非肌细胞中的MFC结合蛋白肌球Pr 原肌球Pr a——辅肌动Pr 未发现肌钙Pr(四)MF特异性药物细胞松弛素:防止聚合,对解聚无影响,破坏MF三维结构。
第九章细胞骨架(Cytoskeleton)细胞骨架的概念细胞骨架是指存在于真核细胞中的蛋白纤维网架体系•有狭义和广义两种概念(1)在细胞质基质中包括微丝、微管和中间纤维。
(2 )在细胞核中存在核骨架-核纤层体系。
核骨架、核纤层与中间纤维在结构上相互连接,形成贯穿于细胞核和细胞质的网架体系。
第一节微丝(microfilament, MF)又称肌动蛋白纤维(actin filament),是指真核细胞中由肌动蛋白(actin)组成、直径为6-7nm的骨架纤维。
是由两条线性排列的肌动蛋白链形成的螺旋,形状如双线捻成的绳子。
一、微丝的组成与装配肌动蛋白(actin)是微丝的结构成分,大小为43KDa,外观呈哑铃状,这种actin又叫G-actin,由G-actin形成的微丝又称为F-actin。
(一)肌动蛋白的种类在哺乳动物和鸟类中,已至少发现6种肌动蛋白,其中4种称为-肌动蛋白,分布于横纹肌、心肌、血管平滑肌和肠道平滑肌。
另两种为-actin和-actin ,普遍存在于所有真核细胞中。
(二)肌动蛋白的存在形式与装配1、在缺乏离子时(Na+、K+),肌动蛋白成球形单体存在,球形肌动蛋白单体称为G-肌动蛋白。
2、在含有Mg2+和高浓度的Na+、K+的中性盐溶液中,G-actin装配成纤维状肌动蛋白,纤维状肌动蛋白也称为F-actin。
3、微丝的装配(1 )肌动蛋白单体具有极性,装配时单体呈头尾相接,成为具极性的微丝,既正极与负极之别。
(2)体外实验表明,具有极性的微丝在装配时,新的肌动蛋白单体加到微丝两端的速度不同,速度快的一端为正极,慢的一端为负极;去装配时,负极比正极快。
由于G-actin 在正极端装配,负极去装配,从而表现为踏车行为。
(3)体内装配时,MF呈现出动态不稳定性,主要取决于F-actin结合的ATP水解速度与游离的G-actin单体浓度之间的关系。
在一定条件下,微丝表现为一端因加上肌动蛋白单体而延长,另一端因肌动蛋白单体脱落而缩短,形成一种踏车现象。
第九章-细胞骨架(cytoskeleton)细胞骨架(cytoskeleton)是一种支持细胞形态并参与细胞运动、细胞分裂等生命活动的网络结构。
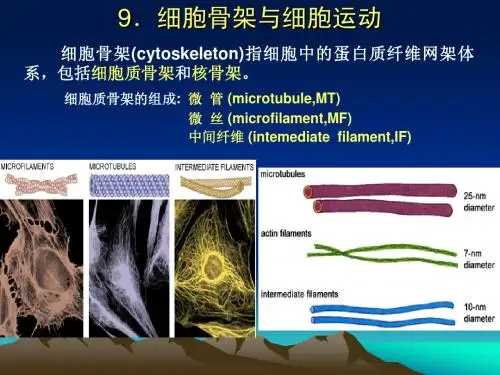
细胞骨架由细胞内的微丝(filament)、中间纤维(intermediate filament)和微管(microtubule)三种不同类型的蛋白纤维组成。
本文将分别介绍这三种蛋白纤维及其生物学功能。
微丝(filament)微丝是由直径约为0.7纳米的轻链和重链蛋白依序排列而成的,其长度可达几微米到数十微米。
微丝参与了许多细胞的活动,如细胞的贴附和收缩、细胞的定向运动、细胞分裂时的细胞质分裂等。
微丝在细胞内分布广泛,在细胞膜下、学问边缘、细胞质中均可看到它们的存在。
微丝的结构在细胞内具有动态性,微丝的动态平衡是在微丝生长和微丝解聚之间达到的。
微丝的生长是指微丝单元向氨基末端添加新的单元,微丝解聚剂解聚是指微丝单元从氨基末端依次解离。
微丝结构的多样性,使其在不同的细胞和组织中具有不同的生理和生理功能,其功能包括:1.细胞形态维持2.细胞内运动3.细胞分裂4.细胞外运动中间纤维(intermediate filament)中间纤维是由多种蛋白质复合物组成的、直径约为10纳米的蛋白质纤维,是细胞骨架中最稳定的一种类型。
与微丝相比,在细胞内时间较长,主要定位于细胞内稳定形态和细胞间连接等功能。
中间纤维具有多样性的物种、组织和细胞类型,它们的功能也很多,常见的包括:1.细胞特异性标记物2.相关细胞黏着3.细胞内物质运输4.参与细胞质形态维持5.参与细胞分裂过程微管(microtubule)微管是细胞骨架中直径最大的一类蛋白纤维,直径约为25纳米。
由两种蛋白质复合物丝状蛋白(tubulin)组成,是由 alpha 和 beta 两种 tubulin 蛋白以β特定的方向相互堆叠形成。
微管是一个高度动态的结构,依据其在细胞间操纵某些重要的细胞内形态变化,对于微管动态的研究成为细胞骨架领域的一个重要方向。
第九章细胞骨架(Cytoskeleton)第一篇:第九章细胞骨架(Cytoskeleton)2012年翟中和版《细胞生物学》考研参考笔记————安雨(整理)第九章细胞骨架(Cytoskeleton)主要内容:第一节细胞质骨架第二节细胞核骨架第一节细胞质骨架一、细胞骨架:是指真核细胞中的蛋白纤维网架体系,其概念有狭义与广义之分,1、狭义概念:指细胞质骨架,包括微丝、微管和中间纤维2、广义概念:包括细胞核骨架,细胞质骨架,细胞膜骨架和细胞外基质。
二、微丝(microfilament, MF)1、概念:又称肌动蛋白纤维(actin filament), 是指真核细胞中由肌动蛋白(actin)组成、直径为7nm的骨架纤维。
2、成分: 肌动蛋白(actin)是微丝的结构成分,外观呈哑铃状。
肌动蛋白的单体为球形分子,称为球形肌动蛋白G-actin(globular actin),它的多聚体称为纤维形肌动蛋白F-actin(fibrous actin)。
3、装配:1)MF是由G-actin单体形成的多聚体,肌动蛋白单体具有极性,装配时呈头尾相接, 故微丝具有极性,既正极与负极之别。
2)MF的解聚:在含有ATP和Ca2+以及低浓度的Na+, K+等阳离子溶液中,趋向于解聚。
3)MF的装配:在Mg2+和高浓度的Na+, K+等溶液中,趋向于装配。
4)倒踏车现象:微丝装配过程中,表现出一端因加亚单位而延长,同时,另一端因亚单位的脱落而简短的现象。
Actin is a globular protein that polymerize helicaly forming actin filaments(or microfilaments), which like the other two components of the cellular cytoskeleton form a three-dimensional network inside an eukariotic cell.Actin filaments provide mechanical support for the cell, determine the cell shape, enable cell movements(through pseudopods);and participate in certain cell junctions, in cytoplasmic streaming and in contraction of the cell during cytokinesis.In muscle cells they play an essential role, along with myosin, in muscle contraction.In the cytosol, actin is predominantly bound to ATP, but can also bind to ADP.An ATP-actin complex polymerizes faster and dissociates slower than an ADP-actin complex.Actin is also one of the most highly conserved proteins, differing by no more than 5% in species as diverse as algae and humans.The globular Actin is known as G-actin, while the filamentous polymer composed of G-actin subunits(a microfilament), is called F-actin.The microfilaments are the thinest component of the cytoskeleton, measuring only 7nm in diameter.Much like the microtubules, actin filaments are polar, with the plus(+)end elongating approximately 10 times faster than the minus(-)end.(Known as the treadmill effect).4、微丝结合蛋白1)肌肉收缩系统中的有关蛋白:肌球蛋白原肌球蛋白肌钙蛋白2)非肌肉细胞中微丝结合蛋白:肌球蛋白原肌球蛋白α-辅肌动蛋白5、微丝结合蛋白将微丝组织成以下三种主要形式:1)Parallel bundle: MF同向平行排列,主要发现于微绒毛与丝状伪足。
第九章细胞骨架(cytoskeleton)主要内容:1、细胞骨架的概念2、MT、MF、ZF的结构,组成及功能3、核骨架及染色体骨架的结构组成概述:cytoskeleton-真核细胞中的蛋白纤维网架体系细胞质骨架:MT、MF、IF狭义微梁广义功能形态观察→分子水平1928年,kiotzoff最初提出,1963年采用戌二醛固定后,才发现其存在。
第一节细胞质骨架一、微丝(micorfilament MF)又称激动蛋白纤维,真核cell中由肌动蛋白组成,d为7nm的骨架纤维。
(一)成份:肌动蛋白:43KD 哑铃状,存在于所有真核cell 中(哺孔类、鸟类)6种ß、r肌动蛋白在肌肉及非肌cell中基因由同一祖先基因进化而来(二)装配球形肌动蛋白(G-actTon)头→尾相接纤维形肌动蛋白CF-)有极性(+极较-极快)微丝是由一条肌动蛋白单体链形成的右手螺旋踏车行为(tread miwing)体外装配 F-action G-acton体内装配:装配取决于(1)单体的浓度;(2)成束,成网的程度;(3)微丝结合蛋白的调节(三)MF结合蛋白(naicrofilament associated pvotein)不同的MF含有不同的MF结合蛋白→独特结构1、肌肉收缩中的有关蛋白肌球蛋白:(myosin):450KD——4条多肽链——分子结构HMM HMM-S1 头部20nm ATPase 活性,构成组份的横桥与肌动蛋白分子结合360KD HMM-S2LMM 尾部130nm φ=2nm 150KD分子排列方式:平行交错排列→粗肌体尾一尾相对4000个分子/粗肌体H band原肌球蛋白(tropomyosin Tm)5-10% 64KD 长40nm两条多肽链形成â-螺旋肌动蛋白:Tm=7:1结合细肌丝肌钙蛋白:(troponin Tn)80KD3个亚基CapI: 32KD } 2个亚基存在于2线(封端蛋白) 36KD结合于actin的(+)报,防止ac+in解聚a——辅肌动蛋白200KD 粘着两条肌动Pr丝,横连成束组蛋白:116KD——另外使actin同质膜相联其它蛋白还有:titin mebulin dystrophin(伴肌动蛋白)(肌营养不良蛋白)细肌丝的分子结构(图9-4)→Fig 10-42、非肌细胞中的MFC结合蛋白肌球Pr 原肌球Pr a——辅肌动Pr 未发现肌钙Pr(四)MF特异性药物细胞松弛素:防止聚合,对解聚无影响,破坏MF三维结构。
作用机制:切断微丝并结合在微丝的“+”,抑制组装,导致解聚矸受MF功能。
鬼笔环肽:抑制解聚使actin稳定只与F-actin结合,不与actin结合,研究微丝的分布。
(五)功能肌肉收缩,变形运动,胞质分裂,信号传递,形态维持1、肌肉收缩→Fig10-6→Fig10-8赫蛋黎和汉森(Hoxley and hanson)1959年提出:N冲动→N末梢→突触小泡破裂→释放乙酰胆碱→与肌膜受体结合→肌膜去报化→动作电位→横小管系统→肌质网端池膜→端池膜透性改变→释放Ca2+(106-10-5m)→肌钙P r结合→构象变化→原肌球蛋白位移→暴露结合部位→此部位同肌球蛋白头部结合→横桥接触→肌动球Pr复合物(ATP→ADP+Pr)(肌球蛋白头部与缰胞丝的结合部位)肌球蛋白头部去磷酸化→向M倾向拉动细肌丝→头部构象变化→向M方向倾斜→肌动蛋白丝被移动→ATP复合物→头部离开actin→F-循环(10nm/ATP 50-100次/s )→冲动结束→肌质网透性降低→钙泵回收Ca2+→Ca2+同内表面隐钙蛋白相结合→收缩结束例:死后僵直,即因ATP耗尽之故肌肉收缩中ATP的来源ADP+磷酸肌酸磷酸肌酸酶 ATP+肌酸耗尽后→反馈调节→呼吸速率→糖酵解肌酸使肌肉酸痛,饮用功能型饮料(包含碱性电解质)可中和2、微绒毛3、应力纤维——是真核细胞中广泛存在的微丝束结构MF平行排列组成(同肌原纤维类似)actin myosin tm α-辅肌动Pr具收缩功能同附着有密切关系,形态发生,细胞分化,组成形成4、胞质溶胶——cell膜下有一层富含肌动蛋白纤维的区域,称为胞质溶胶二、微管(micrdtubwle)MT(一)形态结构微管是细胞质中由微管蛋白组装成的细长而有刚性的圆管状结构,广泛存在于各种真核细胞中,与维持细胞形态、细胞运动及细胞分裂有关。
内径φ-15nm 外径φ=24nm 壁厚约5nm 中空结构与其它蛋白共同装配成仿缍体、基核、中心粒、鞭毛、纤毛、轴突、神经管等(二)成分异二聚体上有秋水仙素和长春花碱的结合位点类型(三)微管相关蛋白(MAP)各种微管均由α、β微管蛋白异聚体组装,其结构与功能的差异主要取决于MAP 的不同,包括MAP1、MAP2、MAP4、tan蛋白(1)t蛋白:存在于神经的轴突中,具有热稳定性,加速聚俣,稳定微慢;(2)MAP:相对分子质量为270X103,杆状,对热敏感,存在于神经轴定树突;(3)MAP2:存在于神经树突出,在徽管间及徽管子中间纤维同形成横桥,使微管成束,与CAMP依赖性蛋白激酶高度亲和,二者结合,MAP2→磷酸化→抑制微管装配(4)MAP4相对分子质量200X103 ,广泛存在于各种细胞中,具高度热稳定性;(5)微管附属结构:纤毛、鞭毛中的动务蛋白臂,纤毛动力蛋白臂由9条多肽链构成,具ATP酶活性,是马达蛋白,为纤毛鞭毛的运动提供动力。
(四)微管的特性1、自我装配装配受微管浓度、PH值和温度影响←体外装配条件(1)α、β微管有很强亲和力,二聚体存在,达到一定浓度→装配(2)PH 6、9(3)离子浓度 [Ca2+]↑→微管解聚,内质网小泡回收Ca2+→微管装配(4)Mg2+ GTP 每一异二聚体上均有GTP Mg2+结合位点,可同1个GTP,1个Mg2+结合异二聚体 +GTP +GDP∴当微管两端的微管蛋白具GTP帽→装配GDP帽→解聚(2)体内微管装配动态①多余的微管蛋白单体+核糖体→微管蛋白的RNA解体②装配程序:α+β→异二聚体→首尾胡接→反纤维→片层1根短管→一端继续添加二聚体→微管延长方式:踏车运动:一定条件下,微管一端发生装配,微管延长,另端解聚,微管缩短。
∴微管化体内的装配与解聚在时空上高度有序微管与微管蛋白单体处于相对平衡某些细胞有永外性的生物:纤毛、鞭毛。
2、微管组织中心(MTOC)微管装配发生的区域——MTOR动物cell中:中心体是主要的微管组织中心。
高等植物cell中无中心体,但仍能形成纺缍体。
3、极性α和β异二聚体按一定的方向排列成微管,(1)从而使微管具一定的极性,微管的极时由本身的分子结构决定β(+)γ(一)。
(2)微管和生长有极性,其生长是通过向远离MTOC端不断添加异二聚体,微管蛋白的添加、释放,主要发生在“+”报。
微管的延长主要靠在”极组装GTP微管蛋白(五)微管的特异性药物1、抑制微管且装的药物秋水仙素(秋水酰胺)原理:形成蛋白异二聚体鬼曰素——秋水仙素的竞争性抑制剂原理:形成蛋白异二聚体——药物的综合物,改变异二聚体的结构,防止异二聚体的添加长春花碱2、稳定微管的药物柴相百分、重水——促微管的装配,但会使细胞分裂停滞在分裂期,有害。
(六)微管的功能1、维持细胞的形态细胞的形态是由微管及其他细胞骨架成分维持。
如:脊椎动物的细胞呈双面凸的椭圆形,这种形状是靠质膜下的微管来维持的,如用秋水仙素处理→细胞变圆。
另外,微管在纤毛、鞭毛、轴突的形成和维持中也有重要作用。
2、细胞内运输(1)神经元轴突运输两种蛋白:a、驱动蛋白:利用ATP向(+)极运输小泡b、胞质动力蛋白:驱动向(-)极的运输MT可作为高尔基体和其它小泡及颗粒运输的轨道 2nm/s(2)色素颗粒的运输如变色龙在皮肤和鱼类的鳞片中含特化的色素细胞细胞中色素颗粒MT细胞各处颜色变深(3)鞭毛和纤毛的运动细胞表面特化结构,可运动,结构基本相同“9+2”→PPt 10-14(纤毛运动中的微管滑动机制)4、纤维单体与染色体运动→纺锤体与微管(1)动粒微管动粒→两极(2)极微管两极发出在缍体中部互相重叠的MT(3)星体微管组成星体的微管(4)基粒与中心粒中心体是动物细胞中主要的微管组织中心,由一对垂直的中心粒及周围基质构成。
基粒——鞭毛和纤毛根部的类似结构F-actin平行排列,且有与膜相连为cell膜提供强度和韧度,维持细胞形状各种运动5、胞质分裂环在细胞分裂末期,actin与Myosin相对滑动二、微管(microtuble)MT(参见旧教案)功能:1、支架 2、细胞壁 3、鞭毛、纤毛 4、有丝分裂器 5、细胞内运输例:N轴突运输MT可作为高尔基体和其它小泡及颗粒运输的轨道2nm/s驱动蛋白:向(+)极运输小泡,水解ATP。
胞质动力蛋白:向(-)极运输。
→Fig 10-12三、中间纤维(IF)60年代中期:10nm介于粗细纤维,故称中间器(一)成分:5类→F4b 10-3具高度同源性,来源于同一基因家族结构IF Pv结构Fig 10-17 近年中间纤维新的分类:I——酸性角蛋白II——中性和碱性角蛋白III——波彤纤维Pr、结Pr胶质纤维性PrIV——神经无纤维蛋白V——核纤层PrVI——nestin(存在于N干cell中)(巢蛋白)(二)中间纤维Pr基因中间维维Pr基因含有内含子/外量子结构同型的基因几乎一致I——III型顺序上相似IV与I-III型有较大差别基因表达具有严格的组织特异性调控可能是在转录和转录后水平,规律尚不清(三)装配亚基→α-螺旋反向(or 顺向)平行}双股超螺旋(二聚体)→亚基→α-螺旋排列平交错四聚体(→八聚体)→厚纤维→8根原纤维→10mm IF(圆柱状)→P239(四)中间纤维结合蛋白(IFAP intermedicte filanent associated protein)→在结构和功能上与中间纤维有密切联系,但其本身不是IF结构组分的Pr确定IFAP的标准(1)在cell内与中间纤维共分布;(2)抗高盐与非离子去垢剂抽提;(3)与IF经历相同的解聚与重组周期;(4)在体外能与IF结合。
大约有15种(迄今为止)(P260白素)IFAP特性(1)具有IF类型特异性(2)IFAP的表达有细胞专一性(3)不同的IFAP可能存在于同一细胞中,与不同的IF组织状态相联系(4)某些IFAP的表达与缰胞的功能和发育状态有关功能:大多IFAP的功能尚不清楚(5)中间纤维的组织及动态变化(6)IF与细胞分化}研究中(自学)(7)IF在生物进化中的起源(8)功能很不清楚,因为未找到一种IF的特异性工具药,基于形态学观察推测可能:支架作用,cell核定位,参与传递cell内机械或分子的信息(核→膜与MRNA运输有关)。