氯化物中氯含量的测定莫尔法
- 格式:doc
- 大小:42.00 KB
- 文档页数:3

莫尔法测定可溶性氯化物中氯含量实验报告实验报告:莫尔法测定可溶性氯化物中氯含量一、实验目的:通过莫尔法测定方法,确定可溶性氯化物中氯离子的含量。
二、实验原理:莫尔法是一种常用的测定可溶性氯化物中氯离子含量的方法。
莫尔法的原理是利用硝酸银与氯化物反应生成沉淀的特点来测定氯离子的含量。
硝酸银与氯离子反应生成白色的沉淀AgCl,沉淀的重量可以用来计算溶液中氯离子的含量。
三、实验仪器与试剂:1.仪器:天平、锥形瓶、滴定管、分析天平。
2. 试剂:0.1 mol/L硝酸银溶液、0.1 mol/L氯化钠溶液。
四、实验步骤:1.实验前准备工作:用去离子水冲洗锥形瓶,使其内壁干净,放在烘箱中干燥。
2. 精确称取一定体积的0.1 mol/L氯化钠溶液,加入到锥形瓶中。
3. 分别取三个样品,分别滴加适量的0.1 mol/L硝酸银溶液,观察有无沉淀生成。
当滴加硝酸银溶液后出现白色沉淀时,停止滴加,记录滴加的体积。
4.将滴定后的锥形瓶放入烘箱中干燥至恒重。
5.重复以上步骤3-4,取得精确的实验数据。
五、数据处理:1.根据滴定的体积,计算出氯离子的摩尔浓度。
2.根据化学方程式,计算出沉淀AgCl的摩尔量。
3.根据沉淀的质量和摩尔量,计算样品中氯离子的摩尔量和质量百分含量。
六、结果与讨论:根据实验数据计算出每个样品中氯离子的质量百分含量,并进行数据对比和讨论。
七、实验误差分析:考虑到实验操作、试剂浓度、仪器精度等因素,对实验误差进行分析。
八、结论:通过莫尔法测定方法,成功测定了可溶性氯化物中氯离子的含量,并得到样品中氯离子的质量百分含量。
九、实验心得:通过本实验,我了解了莫尔法测定可溶性氯化物中氯含量的原理和操作方法。
同时,也提高了实验操作的技能和数据处理的能力。
这对我今后的科研工作和实验室操作能力提升都有很大帮助。

氯化物中氯含量的测定(莫尔法)一、实验目的1. 掌握用莫尔法测定氯化物中氯含量的方法及原理。
2. 掌握铬酸钾指示剂的正确使用。
3.掌握沉淀滴定法的操作。
二、实验原理可溶性氯化物中氯含量的测定常用莫尔法,该法在中性或弱碱性溶液中以K 2CrO 4为指示剂,AgNO 3标准溶液进行滴定。
AgCl 的溶解度小于Ag 2CrO 4的溶解度,因此溶液中先析出AgCl 沉淀,当氯离子定量转化为AgCl 沉淀后,过量的AgNO 3溶液就与溶液中的CrO 42-反应生成砖红色的Ag 2CrO 4沉淀,指示终点到达。
反应如下:滴定反应Ag + + Cl AgCl ↓白色(θsp K =1.8×10-10)指示反应2Ag + + CrO 42 -Ag 2CrO 4↓(θsp K =1.1×10-12)三、仪器和药品(略)四、实验步骤 1. 配制0. 01mol/L AgNO 3溶液(已配制)2. 0. 01mol/L AgNO 3溶液浓度的标定(已标定)3.试样的分析:准确称量0.1~0.2g 氯化物试样于烧杯中,用纯水溶解后定量转移入250mL 容量瓶中,用纯水稀至刻度、摇匀。
吸取试液25.00mL 溶液于锥形瓶中,加水25mL 稀释,加入1mL5%的K 2CrO 4,在不断摇动下用AgNO 3标准溶液滴定溶液转变为砖红色即为终点。
平行测定三次。
五、数据记录和处理称取试样质量: g100%00.250.250%100%33⨯=⨯=试样试样m M V C m m Cl Cl AgNO AgNO Cl操作注意事项1.必须控制好溶液酸度和指示剂用量!(为什么?)2.沉淀滴定,滴定过程中振摇锥形瓶力度稍大,以减少沉淀的吸附,防止终点提前,注意不能将液体摇出瓶外!3.滴定速度宜慢,否则形成过饱和溶液!。

实验17 氯化物中氯含量的测定(莫尔法)
氯化物中氯含量的测定(莫尔法)是用于测定氯化物中氯含量的有效方法。
它可以用于
碱式氯化物和酸式氯化物的测定,最常用于测定氯代烃中的氯含量。
它的原理是通过测定
氯含量和非氯含量的比例来确定氯含量,即将氯含量和非氯含量用莫尔法进行关联,建立
一个比例关系式来表达氯含量。
莫尔法测定氯化物中氯含量的程序大致如下:首先,取样0.1g,用50ml甲醇-水混合液稀释;其次,加入不同浓度的碘指示剂和铅的离子搭桥剂;接着,加一定浓度的碱,引
发氯化物的氯化反应,并产生相应的比例;最后,将采集到的反应液用计量管定量分装,
并用光度计测定吸光度,绘制莫尔法曲线,可以直观地得出氯含量数据。
莫尔法测定氯化物中氯含量的准确度得益于其独特的程序和技术,比如内标式校正法,确保氢氧化物离子的检测准确度,并能够在测定时反映样品中离子的稳定性。
仪器的精准
度和准确度也是决定氯含量测定的结果的重要因素,因此,如果使用不同的仪器,在莫尔
法测定之前,要校准检测仪器,使仪器能够按照标准要求进行准确的测定。
莫尔法测定氯化物中的氯含量,是根据样品的反应液的吸光度,通过构建莫尔法曲线,计算出样品中氯含量的测定方法。
它是一种简单、有效、准确的测定氯含量的方法,在实
际应用中受到广泛重视,经常用于氯代烃中氯含量的测定。

可溶性氯化物中氯含量的测定(莫尔法)1.学习AgNO3标准溶液的配制和标定。
2.掌握莫尔法测定氯的原理和方法。
【简单原理】可溶性氯化物中氯含量的测定常采用莫尔法,此方法是在中性或弱碱性溶滚中,以K2CrO4为指示剂,用AgNO3标准溶液进行滴定。
Ag+先与Cl-生成白色沉淀,过量一滴AgNO3溶液即与指示剂CrO42 -生成Ag2CrO4砖红色沉淀,指示终点,主要反应如下:Ag+ +Cl-= AgCI↓(白)Ksp=1.8×10-102Ag+ + CrO42 -= Ag2CrO4↓(砖红)Ksp=2.0×10-12最适宜的pH范围是6.5~10.5,如有NH4+存在,则pH需控制在6.5~7.2之间。
指示剂的用量对滴定有影响,一般以5×10-3 mol? L-l为宜。
有时须作指示剂的空白校正,取2 mL K2 CrO4溶液,加水100 mL,加与AgCl沉淀量相当的无Cl-的CaCO3,以制成和实际滴定相似的浑浊液,滴入AgNO3溶液至与终点颜色相同。
能与Ag+生成沉淀或与之配位的阴离子都干扰测定;能与指示剂CrO42-生成沉淀的阳离子也干扰测定;大量的有色离子将影响终点观察;易水解生成沉淀的高价金属离子也干扰测定。
【实验用品】试剂:NaCl基准试剂:使用前在500~600℃灼烧30 min,置于干燥器中冷却。
AgNO3化学纯;5%K2CrO4溶液;NaCl试样:粗食盐。
仪器:50mL酸式滴定管;250mL锥形瓶;25.00mL移液管;烧杯;250 mL容量瓶;洗瓶;500mL试剂瓶;量筒;电子天平;台秤;玻璃棒;滴管;橡皮洗耳球。
【实验内容】1.0.02 mol?L-1 NaCl标准溶液的配制准确称取0.22~0.25g基准试剂NaCl于小烧杯中,用蒸馏水溶解后,转移至250mL容量瓶中,稀释至刻度,摇匀。
2.0.02 mol?L-l AgNO3溶液的配制及标定称取1.7g AgNO3,溶解于500mL不含Cl-的蒸馏水中,贮于带玻璃塞的棕色试剂瓶中,放置暗处保存。


氯化物中氯含量的测定实验报告莫
尔法
1.实验目的:本实验旨在使用莫尔法测定氯化物中氯含量。
2.试剂和材料: (1)硝酸银溶液:将5克硝酸银溶于100毫升0.1M硝酸中; (2)柠檬酸溶液:将5克柠檬酸溶于100毫升1M柠檬酸中; (3)硝酸氢钾溶液:将18克硝酸氢钾溶于100毫升水中; (4)标准氯化钠溶液:将0.2
克氯化钠溶于100毫升水中; (5)反应混合液:将上述4
种溶液混合,分别添加20毫升、50毫升、80毫升、120毫升; (6)待测样品:将待测样品溶于100毫升水中。
3.实验原理:氯化物与银离子发生反应,形成一定量的AgCl沉淀,从而可以确定氯化物中氯含量。
4.实验步骤:(1)将反应混合液和待测样品各取10毫升分别滴入2个分支比色皿中;(2)将硝酸溶液滴入分支比色皿中,搅拌均匀;(3)将柠檬酸溶液滴入分支比色皿中,搅拌均匀;(4)将硝酸氢钾溶液滴入分支比色皿中,搅拌均匀;(5)将标准氯化钠溶液滴入分支比色皿中,搅拌均匀;(6)将比色皿放置于热水浴中,煮沸15分钟;(7)冷却后,用1000毫升水冲洗比色皿,
然后放置于光箱中;(8)比较反应混合液和待测样品的比色,据此计算出氯含量。
5.实验结果:根据实验测得,待测样品中氯含量为XXX ppm。

可溶性氯化物中氯含量的测定实验可溶性氯化物中氯含量的测定常采用莫尔法,此法是以K2CrO4为指示剂,用AgNO3标准溶液进行滴定。
其实验步骤为:一、配制0.100mol·L-1AgNO3溶液准确称取AgNO38.50g,溶于500mL不含氯离子的蒸馏水中,摇匀后,贮存于带玻璃塞的棕色试剂瓶中。
二、0.100mol·L-1AgNO3溶液的标定准确称取0.585g NaCl于100mL烧杯中,用蒸馏水溶解后,定量转移入100mL容量瓶中,加水稀释至刻度,摇匀。
取所配NaCl溶液25.00mL 3份,分别置于锥形瓶中,加25mL水,1mL 5% K2CrO4溶液,在不断摇动下用AgNO3溶液滴定,至溶液呈砖红色[2Ag++CrO===Ag2CrO4↓(砖红色)]。
实验测得三次所耗硝酸银溶液体积的平均值为26.32mL。
三、氯化物试样中氯的测定准确移取25.00mL氯化物试液3份,分别置于锥形瓶中,加入25mL水,1mL 5% K2CrO4溶液,在不断摇动下用AgNO3标准溶液滴定至溶液呈砖红色。
实验测得三次所耗硝酸银溶液的体积的平均值为VmL。
回答下列问题:(1)NaCl固体使用前,要将其置于坩埚中加热,并用不断搅拌,以除掉氯化钠晶体中的水。
(2)AgNO3溶液需要标定的主要原因是。
(3)指示剂CrO在溶液中存在下列的平衡:2H++2CrO2HCrO Cr2O+H2O,由此判断该滴定适宜的pH值范围可能是。
(填代号)A.1——6.5B.6.5——10.5C.10.5——14(4)用硝酸银滴定氯离子达到化学计量点时,c(Ag+)=c(Cl-),若此时要求不生成Ag2CrO4沉淀,c(CrO)最大不能超过mol·L-1,因此,实验中对指示剂的浓度有较高的要求。
(已知:K sp(AgCl)=1.8×10-10,K sp(Ag2CrO4)=1.8×10-12)(5)CrO的黄色对滴定终点的判断没有影响的原因是。

氯化物中氯含量的测定(莫尔法)莫尔法是一种测定氯化物中氯含量的方法,其步骤简单,操作方便,适用于大部分氯化物。
下面将详细介绍莫尔法的测定步骤及注意事项。
一、所需试剂和仪器:氢氧化银试液:将2.142g 次氯酸钾溶解于去离子水1000ml中,称取10 ml 滴加于去离子水中,以饱和为度加入氯化银,并振荡至误差小于1%。
过滤,保管于棕色玻璃分液漏斗中,遮光保存,使用时再加去离子水至饱和。
用时每0.025ml 饱和氢氧化银试液相当于1毫克氯离子量。
氯化铂及其钠盐:将氯铂酸钠转化为氯铂酸铂,并将其还原,得到氯化铂及其钠盐。
二、操作步骤:1.称取0.2~0.3g样品(精确称量),放入250ml锥形瓶中。
2.加入75ml去离子水,振荡至样品溶解,再加入2~3滴甲醛。
3.将棕色分液漏斗中的氢氧化银试液振荡,使其均匀混合,然后将0.025ml的饱和氢氧化银试液加入样品中,振荡,使反应均匀进行。
4.反应完成后,第一次滴加氯化铂钠盐溶液,每滴多量到10ml毫升底线附近,然后每滴2~3滴,振荡均匀,使样品中的氯化银溶解成氯银离子,氯离子与氯铱酸钠在氯化铂钠的还原作用下生成铂和氯离子,铂沉积于铁棒上,样品中的氯离子浓度随之下降。
5.当样品中氯离子几乎消耗完后,反应混合物中的铂粒聚集形成灰色沉淀,停止反应。
6.用带苯酚酚红指示剂的1mol/L NaOH滴定底物中未消耗的氢氧化银试液,直至酚红变色为止,计算氯离子含量。
用下式计算样品中氯离子含量:%Cl-=V1x0.0025x1.0084x1000/m其中:V1为氢氧化银试液的体积,0.0025为每滴饱和氢氧化银试液相当于1毫克氯离子量,1.0084为碳-氢氧化银试液的分子量,m为样品质量。
三、注意事项:1.样品的重量要精确称量,以确保结果的准确性。
2.仪器仪表要保持干燥,不能受到潮湿的影响。
3.振荡均匀,使反应混合物均匀分布。
4.滴定时不能滴过头,以免影响结果的准确性。
5.使用过程中应避免阳光直射,保持暗处。
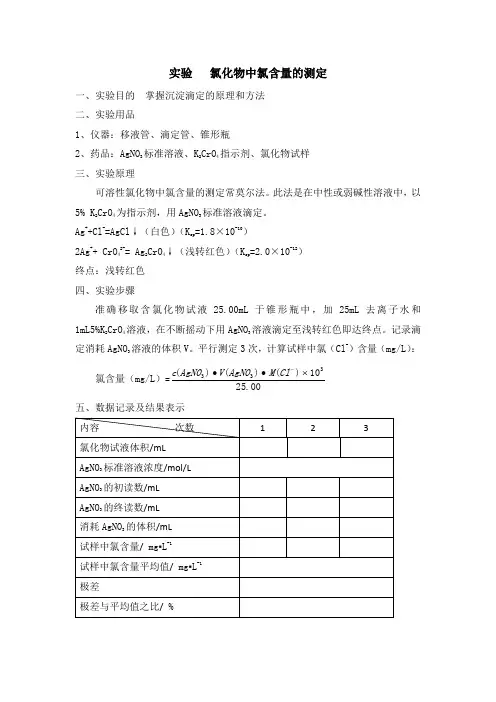
实验氯化物中氯含量的测定
一、实验目的 掌握沉淀滴定的原理和方法 二、实验用品
1、仪器:移液管、滴定管、锥形瓶
2、药品:AgNO 3标准溶液、K 2CrO 4指示剂、氯化物试样 三、实验原理
可溶性氯化物中氯含量的测定常莫尔法。
此法是在中性或弱碱性溶液中,以5% K 2CrO 4为指示剂,用AgNO 3标准溶液滴定。
Ag ++Cl -=AgCl ↓(白色)(K sp =1.8×10-10)
2Ag ++ CrO 42-= Ag 2CrO 4↓(浅转红色)(K sp =2.0×10-12) 终点:浅转红色 四、实验步骤
准确移取含氯化物试液25.00mL 于锥形瓶中,加25mL 去离子水和1mL5%K 2CrO 4溶液,在不断摇动下用AgNO 3溶液滴定至浅转红色即达终点。
记录滴定消耗AgNO 3溶液的体积V 。
平行测定3次,计算试样中氯(Cl -)含量(mg/L ):
氯含量(mg/L )=
00
.2510)()()(3
33⨯∙∙-Cl M AgNO V AgNO c
五、数据记录及结果表示
计算过程:
六、问题思考
1、AgNO
3
标准溶液用何种滴定管?
2、K
2CrO
4
指示剂的浓度过大或过小对测定结果有何影响?。

莫尔法测定可溶性氯化物中氯含量实验报告实验报告:莫尔法测定可溶性氯化物中氯含量一、实验目的本实验旨在掌握莫尔法测定可溶性氯化物中氯含量的原理和方法,了解实验过程中的影响因素和注意事项,提高实验操作技能和分析能力。
二、实验原理莫尔法是一种常用的沉淀滴定法,用于测定可溶性氯化物中氯含量。
该方法利用银离子与氯离子反应生成氯化银沉淀,通过滴定消耗的银离子量,计算出可溶性氯化物中的氯含量。
实验过程中需加入过量硝酸银溶液,以促使反应完全。
同时,为消除干扰离子(如硫酸根离子、亚硝酸根离子等)的影响,需加入掩蔽剂。
本实验采用铬酸钾作为掩蔽剂。
三、实验步骤1.准备试剂和仪器:硝酸银溶液(0.1mol/L)、铬酸钾溶液(50g/L)、氯化钠标准溶液(0.1mol/L)、酚酞指示剂(1g/L)、滴定管、容量瓶、三角瓶、电子天平等。
2.样品制备:称取适量可溶性氯化物样品于容量瓶中,加入适量蒸馏水溶解,摇匀。
3.滴定操作:将样品溶液移入三角瓶中,加入适量铬酸钾溶液和酚酞指示剂。
用硝酸银溶液滴定至终点,记录消耗的硝酸银溶液体积。
同时做空白实验,以消除试剂误差。
4.数据记录与处理:记录实验数据,包括样品质量、空白实验消耗硝酸银溶液体积、样品实验消耗硝酸银溶液体积等。
根据数据计算可溶性氯化物中氯含量。
四、实验结果与分析1.实验数据记录2.数据处理及分析根据实验数据,可得到可溶性氯化物中氯含量的平均值为:(69.5%+70.5%+68.5%)/3=69.5%通过分析实验数据,我们可以得出以下结论:(1)莫尔法测定可溶性氯化物中氯含量具有较高的准确性,适用于实际样品的分析。
(2)实验过程中需严格控制试剂用量和操作步骤,确保实验结果的可靠性。
(3)本实验采用铬酸钾作为掩蔽剂,有效消除了干扰离子对实验结果的影响。
(4)通过对不同样品的测定,可以发现不同来源的可溶性氯化物中氯含量存在一定差异,这可能与样品的地域、生产工艺等因素有关。
五、结论本实验通过莫尔法测定了可溶性氯化物中的氯含量,得到了较为准确的结果。

一、实验目的1. 学习氯化物中氯含量的测定方法,掌握莫尔法的基本原理和操作步骤。
2. 熟悉AgNO3标准溶液的配制和标定方法。
3. 掌握铬酸钾指示剂的正确使用。
4. 提高实验操作技能和数据分析能力。
二、实验原理莫尔法是一种常用的测定氯化物中氯含量的方法。
该法是在中性或弱碱性溶液中,以K2CrO4为指示剂,用AgNO3标准溶液滴定氯化物。
当氯离子与Ag+反应生成AgCl沉淀后,过量的Ag+会与CrO42-反应生成砖红色的Ag2CrO4沉淀,指示终点到达。
反应方程式如下:Ag+ + Cl- = AgCl↓2Ag+ + CrO42- = Ag2CrO4↓三、实验仪器与试剂1. 仪器:分析天平、移液管、滴定管、锥形瓶、烧杯、玻璃棒、洗瓶、滴定台等。
2. 试剂:AgNO3标准溶液(c=0.1mol/L)、NaCl基准物、5%K2CrO4溶液、氯化物试样、纯水等。
四、实验步骤1. 称量:准确称取一定量的氯化物试样(例如:0.2g)于烧杯中。
2. 配制溶液:用纯水溶解试样,定量转移入250mL容量瓶中,转移过程中玻棒下端靠住容量瓶颈内壁,烧杯口靠住玻棒,确保液体无洒落。
3. 标定AgNO3标准溶液:按照实验要求,配制一定浓度的AgNO3标准溶液,并标定其准确浓度。
4. 滴定:用移液管吸取一定量的试液溶液于锥形瓶中,加水25mL稀释,加入1mL5%的K2CrO4指示剂,不断摇动。
5. 滴定操作:将AgNO3标准溶液滴入锥形瓶中,直至出现砖红色沉淀,记录消耗的AgNO3标准溶液体积。
6. 计算氯含量:根据消耗的AgNO3标准溶液体积和浓度,计算试液中氯的含量。
五、实验数据与结果1. 实验数据:| 试样质量(g) | 消耗AgNO3标准溶液体积(mL) | AgNO3标准溶液浓度(mol/L) || :-----------: | :-------------------------: | :-----------------------: || 0.2 | 20.00 | 0.1 |2. 结果计算:氯含量(%)=(消耗AgNO3标准溶液体积×AgNO3标准溶液浓度×M(Cl-)/试样质量)×100%其中,M(Cl-)为氯的摩尔质量(35.5g/mol)。
预习与思考:1、复习理论书中沉淀溶解平衡与沉淀滴定法的相关知识,复习滴定管、容量瓶、移液管、分析天平的使用方法。
2、思考并回答下列问题①AgNO3标准溶液应贮于棕色瓶中并置于暗处,为什么?如何标定AgNO3标液的浓度?②利用莫尔法时为什么溶液的 pH需控制在6.5~10.5?实验中如何控制 pH在这个范围?③空白实验有何意义?④莫尔法中,以K2CrO4作为指示剂时,其浓度太大或太小对滴定结果有何影响?一、实验目的1、掌握莫尔法的原理和实验操作。
2、进一步学习滴定管、容量瓶、移液管、分析天平的使用方法。
二、实验原理莫尔法是测定可溶性氯化物中氯含量常用的方法。
此法是在中性或弱碱性溶液中,以K2CrO4为指示剂,用AgNO3标准溶液进行滴定。
由于AgCl沉淀的溶解度比 AgCrO4小,溶液中首先析出白色AgCl沉淀。
当氯离子定量转化为AgCl沉淀后,过量的AgNO3溶液即与CrO42-生成砖红色 AgCrO4沉淀,指示终点到达。
主要反应为:Ag+ + Cl- = AgCl (白色) Kθsp = 1.8×l0-102Ag+ + CrO42- = Ag2CrO4(砖红色) Kθsp= 2.0×10-12滴定必须在中性或弱碱性溶液中进行,最适宜pH范围在6.5-10.5之间。
如果有铵盐存在,溶液的pH范围在6.5-7.2之间。
指示剂的用量对滴定有影响,一般K2CrO4浓度以5 ×10-3 mol/L 为宜。
凡是能与Ag+生成难溶化合物或络合物的阴离子,如PO43-、AsO43-、AsO33-、S2-、SO32- 、CO32-、C2O42-等均干扰测定,其中H2S可加热煮沸除去,SO32-可用氧化成SO42-的方法消除干扰。
大量Cu2+、Ni2+、Co2+等有色离子影响终点观察。
凡能与指示剂 K2CrO4生成难溶化合物的阳离子也干扰测定,如Ba2+、Pb2+等。
Ba2+的干扰可加过量Na2SO4 消除。
可溶性氯化物中氯含量的测定-Mohr法
一、实验原理
Mohr法是一种常用的测定可溶性氯化物中氯含量的方法。
其基本原理是氯离子和硝酸银反应生成沉淀AgCl,然后用一定量的一价离子铬酸钾溶液溶解过量的硝酸银沉淀,再进一步滴定多余的银离子,根据乘法关系计算氯离子的含量。
Ag+ + Cl- → AgCl
2AgCl + K2CrO4 + H2SO4 → Ag2CrO4 + K2SO4 + 2HCl
2K2CrO4 + 4HCl → 4KCl + Cr2(SO4)3 + 3H2O
二、实验器材和试剂
1.硝酸银溶液(0.1mol/L)
2.铬酸钾溶液(精制)
3.硫酸
4.无水乙醇
5.硝酸
6.锥形瓶
7.点滴管
8.烧杯
9.玻璃棒
10. 称量器
三、实验步骤
1.将样品取适量加入烧杯中。
2.加入适量水,并搅拌使其充分溶解。
3.添加少量盐酸,同时加入2~3滴硝酸。
4.加入过量的硝酸银溶液(必须过量,使所有反应物被消耗,保证充分反应),至出现沉淀。
5.加入适量铬酸钾溶液搅匀,至沉淀转为红色溶液停止滴定。
6.进一步加入少量遮光剂,防止不必要的沉淀形成。
7.反应产物滴定至溶液变为黄色。
8.根据计算可得可溶性氯化物中氯离子含量。
四、注意事项
1.硝酸银溶液、铬酸钾溶液均应避免阳光直射,保存于避光地方。
2.样品的取量要充分考虑不同样品所含氯化物的含量之间的不同。
3.一定要保证反应充分,避免出现杂质干扰。
4.滴定前准备要充分,比如将管道等用稀盐酸洗净,用漏斗过滤去除杂质等。
氯化物中氯含量的测定氯化物中氯含量的测定(莫尔法)一、实验目的1.学习硝酸银溶液的标定方法;2.掌握沉淀滴定法中以K2CrO4为指示剂测定氯离子的方法和原理。
二、实验原理某些可溶性氯化物中氯含量的测定常采用莫尔法,即以K2CrO4为指示剂,用AgNO3标准溶液直接滴定待测试液中的C1-。
其主要反应式如下:Ag+ + Cl- = AgCl↓(白色) Ksp=1.8×10-10Ag+ + CrO42- = Ag2CrO4↓(砖红色)Ksp =2.0×10-12由于AgC1的溶解度小于Ag2CrO4,所以当AgC1定量沉淀后,微过量的Ag+即与CrO42-形成砖红色的Ag2CrO4沉淀,它与白色的AgC1沉淀一起,使溶液略带橙红色即为终点。
溶液的pH值控制在6.5~10.5。
三、仪器与试剂仪器:滴定分析常规仪器;试剂:0.05mol•L-1AgN03,K2CrO4指示剂,粗盐试样四、实验步骤1. 0.05mol•L-1AgN03的标定往小烧杯里准确称取0.7g左右 NaCl,加水溶解后,定量转移到250mL容量瓶中,用蒸馏水稀释至刻线,摇匀。
准确移取20 ml NaCl标准溶液至锥型瓶中,加水25mL,1mL5% K2CrO4溶液,在不断摇动下用AgNO3进行滴定,至白色沉淀中出现砖红色止。
以消耗的AgNO3标准溶液的体积及NaCl的量,计算出AgNO3标准溶液的浓度。
平行三次,同时做空白。
2.氯含量的测定在小烧杯里准确称取0.7g左右粗盐试样,加水溶解后,在250 mL容量瓶中定容。
准确移取20mLNaCl 试样溶液至锥型瓶中,加水25 mL,1 mL5% K2CrO4溶液,在不断摇动下用AgNO3进行滴定,至白色沉淀中出现砖红色止。
以消耗的AgNO3标准溶液的体积及粗盐的量,计算出试样中的氯含量。
平行三次,同时做空白。
五、数据记录及结果计算1.数据记录ⅠⅡⅢ空白NaCl的质量 (g)NaCl定容体积(mL)NaCl移取体积(mL)VAgNO3 终读数(mL)VAgNO3 初读数(mL)VAgNO3 减空白读数(mL)CAgNO3 (mol•L-1)CAgNO3平均值(mol•L-1)极差极差/平均值粗盐的质量 (g)粗盐定容体积(mL)粗盐移取体积(mL)VAgNO3 终读数 (mL)VAgNO3 初读数 (mL)VAgNO3 减空白读数 (mL)Cl %Cl % 平均值极差极差/平均值2.结果计算六、实验讨论与总结。
莫尔法测定可溶性氯化物中氯含量一、实验目的1、掌握沉淀滴定法的原理和实验操作。
2、掌握AgNO3标准溶液的配制和标定。
3、掌握莫尔法中指示剂的使用。
二、实验原理莫尔法是测定可溶性氯化物中氯含量常用的方法。
此法是在中性或弱碱性溶液中,以K2CrO4为指示剂,用AgNO3标准溶液进行滴定。
由于AgCl沉淀的溶解度比AgCrO4小,溶液中首先析出白色AgCl沉淀。
当AgCl定量沉淀后,过量一滴AgNO3溶液即与CrO42-生成砖红色AgCrO4沉淀,指示终点到达。
主要反应如下:Ag+ + Cl- = AgCl (白色) Ksp = 1.8×l0-102Ag+ + CrO42- = Ag2CrO4(砖红色) Ksp= 2.0×10-12滴定必须在中性或弱碱性溶液中进行,最适宜pH范围在6.5-10.5之间。
凡是能与Ag+生成难溶化合物或络合物的阴离子。
如PO43-、AsO43-、AsO33-、S2-、SO32-、CO32-、C2O42-等均干扰测定,其中H2S可加热煮沸除去,SO32-可用氧化成SO42-的方法消除干扰。
大量Cu2+ 、Ni2+、Co2+等有色离子影响终点观察。
凡能与指示剂K2CrO4生成难溶化合物的阳离子也干扰测定,如Ba2+、Pb2+等。
Ba2+的干扰可加过量Na2SO4消除。
Al3+、Fe3+、Bi3+、Sn4+等高价金属离子在中性或弱碱性溶液中易水解产生沉淀,会干扰测定。
三、试剂(1) NaCl基准试剂:AR,在500~600°C 灼烧30分钟后,于干燥器中冷却。
(2) AgNO3:固体试剂,AR。
(3) K2CrO4:5%水溶液。
四、实验步骤1、0.l mol/L AgNO3标准溶液的配制与标定用台称称取8.5 g AgNO3于50 mL烧杯中,用适量不含Cl-的蒸馏水溶解后,将溶液转入棕色瓶中,用水稀释至500 mL,摇匀,在暗处避光保存。
用减量法准确称取0.5-0.65g基准NaCl于小烧杯中,用蒸馏水(不含Cl-)溶解后,定量转入100mL容量瓶中,用水冲洗烧杯数次,一并转入容量瓶中,稀释至刻度,摇匀。
莫尔法测定可溶性氯化物中氯含量
一、实验目的
1、掌握沉淀滴定法的原理和实验操作。
2、掌握AgNO3标准溶液的配制和标定。
3、掌握莫尔法中指示剂的使用。
二、实验原理
莫尔法是测定可溶性氯化物中氯含量常用的方法。
此法是在中性或弱碱性溶液中,以K2CrO4为指示剂,用AgNO3标准溶液进行滴定。
由于AgCl沉淀的溶解度比AgCrO4小,溶液中首先析出白色AgCl沉淀。
当AgCl定量沉淀后,过量一滴AgNO3溶液即与CrO42-生成砖红色AgCrO4沉淀,指示终点到达。
主要反应如下:
Ag+ + Cl- = AgCl (白色) Ksp = 1.8×l0-10
2Ag+ + CrO42- = Ag2CrO4(砖红色) Ksp= 2.0×10-12
滴定必须在中性或弱碱性溶液中进行,最适宜pH范围在6.5-10.5之间。
凡是能与Ag+生成难溶化合物或络合物的阴离子。
如PO43-、AsO43-、AsO33-、S2-、SO32-、CO32-、C2O42-等均干扰测定,其中H2S可加热煮沸除去,SO32-可用氧化成SO42-的方法消除干扰。
大量Cu2+ 、Ni2+、Co2+等有色离子影响终点观察。
凡能与指示剂K2CrO4生成难溶化合物的阳离子也干扰测定,如Ba2+、Pb2+等。
Ba2+的干扰可加过量Na2SO4消除。
Al3+、Fe3+、Bi3+、Sn4+等高价金属离子在中性或弱碱性溶液中易水解产生沉淀,会干扰测定。
三、试剂
(1) NaCl基准试剂:AR,在500~600°C 灼烧30分钟后,于干燥器中冷却。
(2) AgNO3:固体试剂,AR。
(3) K2CrO4:5%水溶液。
四、实验步骤
1、0.l mol/L AgNO3标准溶液的配制与标定
用台称称取8.5 g AgNO3于50 mL烧杯中,用适量不含Cl-的蒸馏水溶解后,将溶液转入棕色瓶中,用水稀释至500 mL,摇匀,在暗处避光保存。
用减量法准确称取0.5-0.65g基准NaCl于小烧杯中,用蒸馏水(不含Cl-)溶解后,定量转入100mL容量瓶中,用水冲洗烧杯数次,一并转入容量瓶中,稀释至刻度,摇匀。
准确移取25.00 mL NaCl标准溶液三份于250 mL锥形瓶中,加水(不含Cl-)25 mL,加5% K2CrO4溶液1mL,在不断用力摇动下,用AgNO3溶液滴定至从黄色变为淡红色混浊(砖红色)即为终点。
根据NaCl标准溶液的浓度和AgNO3溶液的体积,计算AgNO3溶液的浓度及相对标准偏差。
2、试样分析
准确称取氯化物试样1.8-2.0 g于小烧杯中,加水溶解后,定量转入250 mL容量瓶中,用水冲洗烧杯数次,一并转入容量瓶中,稀释至刻度,摇匀。
移取此溶液25.00 mL 三份于250 mL锥形瓶中,加水(不含Cl-)25 mL,5% K2CrO4溶液1mL,在不断用力摇动下,用AgNO3溶液滴定至溶液从黄色变为淡红色混浊即为终点。
计算Cl-含量及相对平均偏差。
3、空白试验
即取25.00mL蒸馏水按上述2同样操作测定,计算时应扣除空白测定所耗AgNO3标准溶液之体积。
五、数据记录和处理
六、问题
1、配制好的AgNO3溶液要贮于棕色瓶中,并置于暗处,为什么?
2、空白测定有何意义?K2CrO4溶液的浓度大小或用量多少对测定结果有何影响?
3、能否用莫尔法以NaC1标准溶液直接滴定Ag+?为什么?。