溶解热的测定
- 格式:doc
- 大小:663.50 KB
- 文档页数:9

溶解热的测定溶解热是指在恒定压力下,单位质量固体物质在溶液中完全溶解时所放出或吸收的热量。
它是化学热力学中的一项重要物理量,与溶解过程的热力学性质和反应机理密切相关。
溶解热的测定方法有很多种,我们这里介绍两种典型的实验方法:计算比热容法和测定热效应法。
一、计算比热容法比热容法是根据热平衡原理,在温度为T1的热源中将样品加热至温度为T2,测定样品的质量m、热容Cp、初始温度T1和终末温度T2,从而计算出溶解热ΔH。
其计算公式为:ΔH = (Q2 - Q1) / m = Cp × (T2 - T1)其中,Q1和Q2分别表示样品在T1和T2温度下吸收的热量,Cp是样品的比热容,m是样品质量,ΔH为溶解热。
此外,由于固体在溶液中溶解时通常伴随着熔化,因此在计算时应将熔化热考虑在内,即:其中,ΔHm为熔化热,通常可以参考文献或手册给出的数据进行修正。
比热容法的优点是测量精度高,操作简单,但需要较精确的温度测量和热量测量,且需要考虑熔化热的影响。
二、测定热效应法测定热效应法是通过测量溶解过程中反应热量的变化来计算溶解热。
通常是在恒定压力下将固体样品加入到溶液中,测定反应热量和样品的质量,从而计算出溶解热ΔH。
其计算公式为:ΔH = Q / m其中,Q为反应过程中放出或吸收的热量,m为样品质量,ΔH为溶解热。
测定热效应法有多种实验方法,比如热量计法、差热分析法、反应热法等,不同的方法适用于不同类型的样品和反应体系。
其中,热量计法是一种较为常用的测定方法,其基本原理是通过测量加热物体的能量变化量来计算反应热量。
它的优点是可应用于各种类型的样品和反应体系,能够直接测定反应过程的热量变化,但需要一定的操作技能和仪器支持。
总之,溶解热的测定是化学热力学中的一项重要实验。
通过计算比热容法和测定热效应法等方法,可以获得溶解过程的热力学性质和反应机理,为化学工艺控制和工业生产提供重要的参考数据。


实验3 溶解热的测定一、实验目的1.用量热计简单测定硝酸钾在水中的溶解热。
2.掌握贝克曼温度计的调节和使用。
二、实验原理盐类的溶解往往同时进行着两个过程:一是晶格破坏,为吸热过程;二是离子的溶剂化,为放热过程。
溶解热是这两种热效应的总和。
最终是吸热还是放热,则由这两种热效应的相对大小来决定。
本实验在定压、不做非体积功的绝热体系中进行时,体系的总焓保持不变,根据热平衡,即可计算过程所涉及的热效应。
T C C W C W W M H m sol ∆⋅++-=∆][322111)( (3.1)式中: m Sol H ∆为盐在溶液温度和浓度下的积分溶解热,单位:kJ·mo1–1;1W 为溶质的质量,单位:kg ;T ∆为溶解过程的真实温差,单位:K ;2W 为水的质量,单位:kg ;M 为溶质的摩尔质量,单位:kg·mo1–1; 21C C 、分别为溶质和水的比热,单位:11--⋅K kg kJ ;3C 为量热计的热容(指除溶液外,使体系温度升高1℃所需要的热量) ,单位:kJ 。
实验测得W 1、W 2、ΔT 及量热计的热容后,即可按(3.1)式算出熔解热m Sol H ∆。
三、仪器与药品溶解热测量装置一套(如图3.1所示);500ml 量筒一个;KCl(A.R.) ;KNO 3(A.R.)四、实验步骤1.量热计热容的测定:本实验采用氯化钾在水中的溶解热来标定量热计热容3C 。
为此,先在干净的量热计中装入500m1蒸馏水,将与贝克曼温度计接好的传感器插入量热计中,放在磁力搅拌器上,启动搅拌器, 保持60-90转/分钟的搅拌速度,此时,数字显示应在室温附近,至图3.1溶解热测定装配图1.磁力搅拌器;2.搅拌磁子;3.杜瓦瓶;4.漏斗;5.传感器;6.SWC —IIC 数字贝克曼温度仪.温度变化基本稳定后,每分钟准确记录读数一次,连续8次后,打开量热计盖,立即将称量好的10克氯化钾(准确至0.01克)迅速加入量热计中,盖上盖,继续搅拌,每分钟记录一次读数,读取12次即可停止。

溶解热的测定一、 实验目的1、掌握溶解热的测定方法。
2、学习量热计的使用方法。
二、实验原理一定量的溶质溶解时产生的热效应与温度、压力和溶剂量有关,它随溶剂量的增加而增加,逐渐趋近一常数。
在25℃一大气压下一摩尔物质形成无限稀溶液时所产生的热效应叫摩尔溶解热。
溶解终了时正好形成饱和溶液则应注明“饱和溶液”溶解热。
通常盐类在水中溶解的摩尔比达1:300时、溶解热即趋于极值。
盐在水中溶解的过程可分为两步,即晶格的破环和离子的溶剂化。
前者为吸热过程;后者为放热过程。
总的能量得失决定溶解过程是吸热,还是放热。
即决定ΔH 是正值还是负值。
在计算溶液中进行的反应的热效应时各作用物和产物的溶解热同燃烧热、生成热一样,也是必要的热化学根据。
当实验在定压下,只作膨胀功的绝热体系中进行时,体系的总焓保持不变,根据热平衡原理,即可计算过程所涉及的热效应。
我们把保温瓶做成的量热计看成绝热体系,当把某种盐溶于瓶内一定量的水中时,可列出如下的热平衡式:gtM ]k gC GC [(H 21∆++-=∆溶解式中:ΔH 溶解—盐在溶液温度和浓度下的积分溶解热; G —水重量(克) C 1—水的比热(卡/克度) g —溶质重量(克) C 2—溶质的比热(卡/克度) M —溶质的分子量Δt —溶解过程的真实温差 K —量热计的热容实验测得G 、g 、Δt 、K 后即可按上式算出溶解热ΔH 。
三、仪器和药品1000毫升广口保温瓶 1个 精密温度计 1支 玻璃搅拌器 1支 100毫升移液管 1支 电吹风 1个氯化钾、硝酸钾、酒精 四、实验步骤量热计热容的测定:1、本实验采用已知氯化钾在水中的溶解热来标定量热计热容(不同温度下一摩尔氯化钾溶于200摩尔水中的积分溶解热)。
将干洁的保温瓶、温度计及搅拌器按图2-1装好,用移液管量取100毫升蒸馏水,经塞子上小孔注入瓶内,塞好小孔,准确测定水的温度(每隔30秒读一次,共读8次)打开塞子迅速将已称好的KC1(6.000克)倒入量热计内盖好塞子,立即搅拌,继续每隔30秒读一次温度,至温度不再下降,再读8次即可停止。

物化实验报告-溶解热的测定一、实验目的本实验旨在通过科学的测定方法,准确地得到溶解热数据,进一步理解溶解热现象和物质溶解过程中的热力学性质。
二、实验原理溶解热是指一定温度下,一定量的溶剂中溶质溶解时所需的热量。
通过测量溶解热,可以了解溶质和溶剂之间的相互作用、溶解过程的动力学性质等。
溶解热的测定有助于我们深入理解溶解现象和溶液的热力学性质。
本实验采用综合量热法测定溶解热。
综合量热法是一种通过测量热量和温度变化来确定溶解热的实验方法。
在实验过程中,需要精确控制温度变化和溶液浓度等因素,以减小误差。
三、实验步骤1.准备实验器材:恒温水浴、量热计、搅拌器、称量纸、电子天平、保温杯、热水浴、计时器等。
2.配制一定浓度的溶质溶液:用称量纸称取一定质量的溶质,加入热水浴中搅拌均匀,冷却至室温。
3.将量热计和保温杯放入恒温水浴中,确保其处于稳定状态。
4.将配制好的溶质溶液倒入保温杯中,记录初始温度T1。
5.开启搅拌器,将保温杯置于恒温水浴中,记录最终温度T2。
6.测量此过程中溶液的体积变化ΔV,计算溶液的密度ρ=m/ΔV(m为溶质的质量)。
7.根据综合量热法公式计算溶解热ΔH:ΔH = cm(T2-T1) +mΔTc·ΔV/ΔV·m·c·ΔT (c为水的比热容,m为溶质的质量,ΔTc为溶液的密度变化)。
四、实验数据分析通过本次实验,我们得到了一系列溶质的溶解热数据。
从数据中可以看出,不同溶质具有不同的溶解热。
这些数据有助于我们深入理解溶解现象和物质溶解过程中的热力学性质。
溶解热在化学、物理、生物等许多领域都有重要应用,例如化学反应过程的动力学分析、生物大分子的溶液性质研究等。
本实验方法具有较高的精度和可靠性,为后续相关领域的研究提供了有价值的参考数据。




溶解热的测定吴大维 2006030027 生64 同组实验者:王若蛟实验日期:2008年5月16日 提交报告日期:2008年5月30日指导教师:张连庆1 引言1.1 实验目的1.测量硝酸钾在不同浓度水溶液的溶解热,求硝酸钾在水中溶解过程的各种热效应。
2.掌握量热装置的基本组合及电热补偿法测定热效应的基本原理。
3.复习和掌握常用的测温技术。
1.2 实验原理 1.2.1 基本实验原理物质溶于溶剂中,一般伴随有热效应的发生。
盐类的溶解通常包含着几个同时进行的过程:晶格的破坏、离子或分子的溶剂化、分子电离(对电解质而言)等。
热效应的大小和符号决定于溶剂及溶质的性质和它们的相对量。
在热化学中,关于溶解过程的热效应,需要了解以下几个基本概念。
溶解热 在恒温恒压下,溶质B 溶于溶剂A(或溶于某浓度溶液)中产生的热效应,用sol H ∆表示。
摩尔积分溶解热 在恒温恒压下,1mol 溶质溶解于一定量的溶剂中形成一定浓度的溶液,整个过程产生的热效应。
用sol m H ∆表示。
sol sol m BHH n ∆∆=(1)式中, B n 为溶解于溶剂A 中的溶质B 的物质的量。
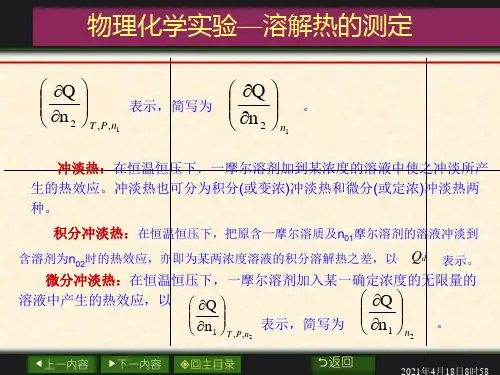
摩尔微分溶解热 在恒温恒压下,1mol 溶质溶于某一确定浓度的无限量的溶液中产生的热效应,以,,()A sol T P n B H n ∂∆∂表示,简写为()A sol n BHn ∂∆∂。
稀释热 在恒温恒压下,一定量的溶剂A 加到某浓度的溶液中使之稀释,所产生的热效应。
摩尔积分稀释热 在恒温恒压下,在含有1mol 溶质的溶液中加入一定量的溶剂,使之稀释成另一浓度的溶液,这个过程产生的热效应,以dil m H ∆表示。
21dil m sol m sol m H H H ∆=∆-∆ (2) 式中,2sol m H ∆、1sol m H ∆为两种浓度的摩尔积分溶解热。
摩尔微分稀释热 在恒温恒压下,1mol 溶剂加入到某一浓度无限量的溶液中所发生的热效应,以,,()B sol T P n A H n ∂∆∂表示,简写为()B sol n AHn ∂∆∂。

实验三溶解热的测定一、实验目的1. 了解电热补偿法测定热效应的基本原理,掌握电热补偿法的仪器使用。
2. 通过用电热补偿法测定硝酸钾在水中的积分溶解热,并用作图法求出硝酸钾在水中的微分冲淡热,积分冲淡热和微分溶解热。
二、基本原理一定量的物质溶于一定量的溶剂中所产生的热效应称为该物质的溶解热。
溶解热除了与溶剂量及溶质量有关外,还与体系所处的温度和压力有关。
溶解热分为两种:积分溶解热和微分溶解热。
积分溶解热是在恒温恒压下,1mol溶质溶于n1 mol溶剂中产生的热效应。
它是溶质溶解时所产生的热量总和,可由实验直接测定。
微分溶解热是在恒温恒压下,在大量给定浓度的溶液中加入1mol溶质时所产生的热效应。
它很难直接测定,但可间接的方法求得,即先求出在定量的溶剂中加入不同量的溶质时的积分溶解热,然后以积分溶解热△H (kJ·mol-1)为纵坐标,以溶质的量n1/n2(n1为溶剂的摩尔量,n2为溶质的摩尔量)为横坐标绘制图,如图所示(KNO3在H2O的积分溶解热)。
曲线上任一点的正切即为该浓度时的微分溶解热。
本实验是测定KNO3的溶解热,采用累加的方法先在纯溶剂中加入溶质,测出溶解热,然后在这溶液中再加入溶质,测出热效应,根据加入溶质的总量可求溶液的浓度,而各次热效应的总和即为该浓度下的溶解热。
KNO3溶解过程是吸热过程,可采用热补偿方法进行测定。
热补偿方法是根据溶解前后的温差,通电加热,使体系由温度的最低值沿原途径升高至原值,由消耗的电功可求出溶解的热效应,即:溶解热Q = I·V ·t ;(3.1)△H = Q / n2(3.2)式中:Q溶解热(焦耳);I为电流强度(安培);V为电压(伏特),t 为加热的时间(S), △H 积分溶解热(kJ·mol-1) ,n2为溶质的摩尔量(mol)。
三、仪器和试剂WLS-2数字恒流源、SWC-II D数字温度温差仪、量热器(含加热器)、可调速磁力搅拌器、秒表、蒸馏水、KNO3(A.R.)四、实验连接图五、操作步骤1. 在台式天平上称取216.2克蒸馏水于量热器中。
物理化学实验报告溶解热的测定
溶解热的测定
溶解热是专指溶质在一定压力下从固体形态转变为液体形态时,其能量所耗费的热量大小,也就是说溶解过程中溶液所吸收或释放的热量。
本次实验以NaCl为溶质,采用盐酸与碳酸钠溶液混合液体的方式,来测定它在溶解过程中的溶解热。
实验环境、设备及试剂
本实验室使用的温度测定设备为“风冷式热量卡尔托热量计”,溶质的试剂为氯化钠。
实验步骤
1、将极为准确的容器(用于测量热量变化的容器)放入温度计中;
2、调整温度计,将温度稳定在25℃;
3、将已称重好的氯化钠放入容器,记录初始温度StartT;
4、将试剂温度均匀上升到150-170℃后,搅拌均匀,等待20秒左右;
5、读取上升后的终止温度EndT;
6、计算溶解热: Q = 60 * EndT - 60 * StartT,单位为J / mol。
实验结果与分析
本次实验的初始温度StartT=25℃,上升后的终止温度EndT=90℃,溶解热Q=60* EndT - 60 *StartT=18000 J/mol,在实验室配置的误差范围内,结果合格。
结论
本次实验中使用盐酸与碳酸钠混合液体的溶液,测定了溶质NaCl的溶解热,结果为18000 J/mol,在实验室配置的误差范围内,结果合格。
溶解热的测定溶解热是指在一定压力和温度下,单位质量的物质从固态转变为溶解态所释放或吸收的热量。
溶解热是反映固体与溶液相互作用强度、稳定性的重要指标,对于理解化学反应、确定物质的结构等方面都具有重要的意义。
那么,如何测定溶解热呢?一、原理:通常我们使用定温法,即先将药品(固态)放在一定量的溶液中,使其达到热平衡,记录下溶解时药品和溶液的初温度和终温度,然后再测定空盛的控制试验,最后计算溶解热。
这个原理是根据热力学的一级定律,即能量守恒的原理。
药品溶解时所吸收的热量等于溶液放出的热量。
溶液放出的热量可以用溶液的比热容×质量×热效值(即水的热效值为4.18J/g℃)进行计算。
二、步骤:1.准备试样:将约1克左右的样品(需要精确称量)粉碎,过筛,放在干燥的试管中备用。
2.准备溶液:按照需求设置好溶液的浓度和体积,倒入烧杯中,通过恒温器加热到预设温度。
建议使用热水浴或恒温水槽来控制恒温器。
3.称量固态药品:将准备好的粉末样品逐个分配到干燥的试管中。
为确保精度,建议不要将样品直接放入溶液中。
4.测定初始温度:用铂电极在溶液中测定初始温度。
该步骤应与测定结束的温度差不大。
为提高测量精度,建议取平均值。
5.将药品加入溶液中:取准备好的样品试管,打开塞子,将药品逐渐加入溶液中,并立即关上塞子,摇晃试管,使药品完全溶解。
为确保精度,建议在药品完全溶解前不要移动试管或打开试管盖。
6.测量结束温度:用铂电极在溶液中测定药品和溶液的终温度。
该步骤应与测定初温度时间尽可能接近。
7.计算:计算公式为(热效值×溶液的质量×溶液的比热容)÷样品质量。
三、注意事项:1.样品需精确称量。
对于粉末样品,建议使用量筒来测量体积。
2.试管须干燥。
使用化学用品器皿干燥后,倒出任何剩余的物质。
试管晾干后再使用。
3.初始温度和结束温度的时间应该相同。
当测量结束温度时,需要多次测量,对测量数据进行求平均值。
溶解热的测定实验报告溶解热的测定实验报告引言:溶解热是指单位物质在溶剂中溶解时释放或吸收的热量。
它是研究溶解过程中能量变化的重要参数之一,对于了解溶解过程的热力学性质具有重要意义。
本实验旨在通过测定溶解热的方法,探究不同物质的溶解过程中的热力学特性。
实验部分:1. 实验原理:溶解热的测定可以通过定容热量计的方法进行。
在实验中,我们使用了恒温水浴槽来保持溶剂和溶质的温度稳定。
通过测量在溶解过程中溶液的温度变化,可以计算出溶解热的值。
2. 实验仪器和试剂:实验仪器:定容热量计、恒温水浴槽、温度计。
试剂:硫酸铜、氯化钠、氯化铵。
3. 实验步骤:(1)将定容热量计清洗干净,并用去离子水冲洗干净。
(2)将一定质量的溶质加入定容热量计中,记录下溶质的质量。
(3)将一定体积的溶剂加入定容热量计中,记录下溶剂的体积。
(4)将定容热量计放入恒温水浴槽中,使溶液温度达到恒定值。
(5)记录下溶液的初始温度。
(6)迅速将溶质加入到溶剂中,同时用玻璃棒搅拌均匀。
(7)记录下溶液的最高温度。
(8)根据实验数据计算出溶解热的值。
结果与讨论:通过实验测得的溶解热值如下:硫酸铜:-36.2 kJ/mol氯化钠:3.9 kJ/mol氯化铵:14.5 kJ/mol根据实验结果可以得出以下结论:1. 硫酸铜的溶解过程是吸热反应,即溶解热为负值。
这是因为在溶解过程中,硫酸铜与水发生了吸热反应,吸收了周围环境的热量。
2. 氯化钠的溶解过程是放热反应,即溶解热为正值。
这是因为在溶解过程中,氯化钠与水发生了放热反应,释放了热量。
3. 氯化铵的溶解过程是放热反应,即溶解热为正值。
这是因为在溶解过程中,氯化铵与水发生了放热反应,释放了热量。
实验中的误差主要来自于以下几个方面:1. 实验仪器的精确度:定容热量计和温度计的精确度会对实验结果产生影响。
在实验中,我们尽量选择精确度较高的仪器,以减小误差。
2. 实验操作的准确性:在实验过程中,对溶质和溶剂的质量和体积的测量需要准确无误,任何误差都会对最终结果产生影响。
溶解热的测定Determination of Heat of Solution一.实验目的1.用量热法测定KNO3的积分熔解热2.掌握量热法的基本测量方法3.了解测定溶解热的基本原理二.实验原理物质溶解时常伴随有热效应发生,此热效应称为该物质的溶解热。
积分溶解热又称定浓溶解热,为等温等压下一摩尔物质溶于一定量的溶剂中形成某浓度的溶液时,吸收或放出的热量。
积分溶解热可用量热法直接测定,通常看作是在绝热量热计中进行。
首先标定该量热系统的热容量,然后通过精确测量物质溶解前后因吸热或放热引起量热体系温度的变化,来计算溶解过程的热效应,并据此计算物质在该溶液温度、浓度下的积分溶解热。
ΔH标×W标/M标=C×ΔT标求出CΔH待测物=CMΔT待测物/W待测物三. 实验准备1. 仪器:500mL杜瓦瓶(或广口热水瓶),贝克曼温度计,0-50 ºС1/10刻度,秒表,磁力搅拌器,放大镜(放大6-9倍),短颈小玻璃漏斗(外径约2cm),电子天平,干燥器,蜡光纸,500mL 量筒。
2. 药品:AR干燥KCl和KNO3粉末(事先用称量瓶存放并置于干燥器中)。
四. 仪器使用【插入录像】1-溶解热测定装置的安装方法2-磁力搅拌器的使用方法3-电子天平的使用方法五.操作要点(各实验步骤中的操作关键点)1、装置仪器。
2、调节贝克曼温度计,使水银柱面处于刻度的上半部。
3、准确称取预先于105 ºС烘干并磨细的标准物KCl 7.5±0.01克和待测物KNO3 5.06克于蜡光纸上,包裹好置于干燥器中备用。
4、测定量热系统的热容。
5、测定KNO3的积分溶解热。
6、实验结束,洗净,晾干量热装置。
六.数据处理1、根据加样前后量热计温度的变化,绘制温度-时间图,利用雷诺校正图,求出ΔT KCl与ΔT KNO3。
2、由ΔT标和ΔH标(KJmol-1)求量热系统的热容3、由量热计的热容、W KNO3和ΔT KNO3计算硝酸钾的积分溶解热。
溶解热的测定一、实验目的1.用简单绝热式量热计测定KCl 的积分溶解热。
2.掌握量热实验中温差校正方法。
3.了解计算机在线检测温度、温差的原理及在溶解热实验中的实际应用。
二、实验原理溶解过程的温度变化用数字式贝克曼温度计测定,量热法测定积分溶解焓,通常是在具有良好绝热层的热量计中进行。
在恒压条件下,由于热量计是绝热系统,溶解过程中所吸收或放出的热全部由系统温度变化反映出来。
在热量计内,将某种盐类溶解于一定量的水中时,若测得溶解过程的温度变化△T,则该物质的溶解焓为:11222[()]sol m TM H m C m C C m ∆∆=-++式中为盐在溶液温度及浓度下的积分溶解焓;,分别为溶剂水和溶sol m H ∆1m 2m 质的质量;为溶质的摩尔质量; 分别为溶剂水、溶质的热容,为M 1C 2C T ∆溶解过程的真实温差,C 为热量计的热容。
盐类的溶解过程通常包含两个同时进行的过程:晶格的破坏和离子的溶剂化。
前者为吸热过程,后者为放热过程,溶解热时这两种热效应的总和。
因此,盐溶解过程吸热还是放热,由这两个热效应得相对大小决定。
溶解热的测定在绝热式量热计中进行。
为恒压条件下,过程中吸收或放出的热全部由系统的温度变化反映出来。
为求KCl 溶于水过程的热效应,可根据盖斯定律,将实际过程分解成两步进行。
在恒压下,溶解过程放出的热p Q (即焓变H ∆)为上述设计的两个过程焓变(1H ∆和2H ∆)之和,即12H H H ∆=∆+∆ (1)因为量热计为绝热系统,0p Q H =∆=,所以在1t ℃下KCl 溶解的恒压热效应1H ∆为12221()H H K t t ∆=-∆=-- (2)式中K 是量热计与KCl 水溶液所组成体系得总热容,21()t t -为KCl 溶解过程系统的温度变化值t ∆溶解。
常用的积分溶解热是指等温等压下,将一摩尔溶质溶解于一定量溶剂中形成一定浓度溶液的热效应。
设将质量为m 的KCl 溶解于一定体积的水中,KCl 的摩尔质量为M ,则在此浓度下KCl 的积分溶解热为:1sol m H M KMH t m m ∆∆==-∆溶解(3)K 值可由电极法求取。
实验一 溶解热的测定一、目的1、了解电热补偿法测定热效应的基本原理及仪器使用。
2、测定硝酸钾在水中的积分溶解热,并用作图法求得其微分稀释热、积分稀释热和微分溶解热。
3、初步了解计算机采集处理实验数据、控制化学实验的方法和途径。
二、基本原理1、物质溶解于溶剂过程的热效应称为溶解热。
它有积分(或变浓)溶解热和微分(或定浓)溶解热两种。
前者是1 mol 溶质溶解在n 0 mol 溶剂中时所产生的热效应,以Q s 表示。
后者是1 mol 溶质溶解在无限量某一定浓度溶液中时所产生的热效应,即0,,s T p n Q n ∂⎛⎫⎪∂⎝⎭。
溶剂加到溶液中使之稀释时所产生的热效应称为稀释热。
它也有积分(或变浓)稀释热和微分(或定浓)稀释热两种。
前者是把原含1 mol 溶质和n 01 mol 溶剂的溶液稀释到含溶剂n 02 mol 时所产生的热效应,以Q d 表示,显然,Q d = Q s ,n02 – Q s ,n01。
后者是1 mol 溶剂加到无限量某一定浓度溶液中时所产生的热效应,即0,,s T p nQ n ⎛⎫∂⎪∂⎝⎭。
2、积分溶解热由实验直接测定,其它三种热效应则需通过作图来求:设纯溶剂、纯溶质的摩尔焓分别为H *m ,A 和H *m ,B ,一定浓度溶液中溶剂和溶质的偏摩尔焓分别为H m ,A 和H m ,B ,若由n A mol 溶剂和n B mol 溶质混合形成溶液,则混合前的总焓为 H = n A H *m ,A + n B H *m ,B 混合后的总焓为 H ΄ = n A H m ,A + n B H m ,B此混合(即溶解)过程的焓变为 ΔH = H ΄ – H = n A (H m ,A – H *m ,A )+ n B (H m ,B – H *m ,B ) = n A ΔH m ,A + n B ΔH m ,B根据定义,ΔH m ,A 即为该浓度溶液的微分稀释热,ΔH m ,B 即为该浓度溶液的微分溶解热,积分溶解热则为: ,,0,,As m A m Bm AmBB Bn H Q H H n HHn n ∆==∆+∆=∆+∆ 故在Q s ~ n 0图上,某点切线的斜率即为该浓度溶液的微分稀释热,截距即为该浓度溶液的微分溶解热。
实验七 溶解热的测定一、实验目的1.掌握采用电热补偿法测定热效应的基本原理。
2.用电热补偿法测定硝酸钾在水中的积分溶解热,并用作图法求出硝酸钾在水中的微分溶解热、积分稀释热和微分稀释热。
3.掌握溶解热测定仪器的使用。
二、实验原理物质溶解过程所产生的热效应称为溶解热,可分为积分溶解热和微分溶解热两种。
积分溶解热是指定温定压下把1mol 物质溶解在n 0mol 溶剂中时所产生的热效应。
由于在溶解过程中溶液浓度不断改变,因此又称为变浓溶解热,以△sol H 表示。
微分溶解热是指在定温定压下把1mol 物质溶解在无限量某一定浓度溶液中所产生的热效应,以表示.在溶解过程中浓度可视为不变,因此又称为定浓度溶解热,以0,,)(n p T sol nH∂∆∂表示,即定温、定压、定溶剂状态下,由微小的溶质增量所引起的热量变化。
稀释热是指溶剂添加到溶液中,使溶液稀释过程中的热效应,又称为冲淡热。
它也有积分(变浓)稀释热和微分(定浓)稀释热两种。
积分稀释热是指在定温定压下把原为含1mol 溶质和n 01mol 溶剂的溶液冲淡到含n 02mol 溶剂时的热效应,它为两浓度的积分溶解热之差。
微分稀释热是指将1mol 溶剂加到某一浓度的无限量溶液中所产生的热效应,以n p T sol n H,,0)(∂∆∂表示,即定温、定压、定溶质状态下,由微小的溶剂增量所引起的热量变化。
积分溶解热的大小与浓度有关,但不具有线性关系。
通过实验测定,可绘制出一条积分溶解热△sol H 与相对于1mol 溶质的溶剂量n 0之间的关系曲线,如图1所示,其他三种热效应由△sol H~n 0曲线求得。
设纯溶剂、纯溶质的摩尔焓分别为H m1和H m2,溶液中溶剂和溶质的偏摩尔焓分别为H 1和H 2,对于由n 1mol 溶剂和n 2mol 溶质组成的体系,在溶质和溶剂未混合前,体系总焓为:图1H=n 1 H m1+n 2 H m2 (1)将溶剂和溶质混合后,体系的总焓为:H’= n 1 H 1+n 2 H 2 (2)因此,溶解过程的热效应为:△H=n 1(H 1-H m1)+n 2(H 2-H m2)=n 1△H 1+n 2△H 2 (3)在无限量溶液中加入1mol 溶质,(3)式中第一项可以认为不变,在此条件下所产生的热效应为(3)式中第二项中的△H 2,即微分溶解热。
同理,在无限量溶液中加入1mol 溶剂,(3)式中第二项可以认为不变,在此条件下所产生的热效应为(3)式中第一项中的△H 1,即微分稀释热。
根据积分溶解热的定义,有:△sol H=2H n (4)将(3)式代入,可得:△sol H=21n n △H 1+△H 2=n 01△H 1+△H 2 (5)此式表明,在△sol H~n 0曲线上,对一个指定的n 01,其微分稀释热为曲线在该点的切线斜率,即图1中的AD/CD 。
n 01处的微分溶解热为该切线在纵坐标上的截距,即图1中的OC 。
在含有1mol 溶质的溶液中加入溶剂,使溶液量由n 01mol 增加到n 02mol ,所产生的积分溶解热即为曲线上n 01和n 02两点处△sol H 的差值。
本实验测硝酸钾溶解在水中的溶解热,是一个溶解过程中温度随反应的进行而降低的吸热反应,故采用电热补偿法测定。
实验时先测定体系的起始温度,溶解进行后温度不断降低,由电加热法使体系复原至起始温度,根据所耗电能求出溶解过程中的热效应Q 。
(6)式中,I 为通过加热器电阻丝(电阻为R )的电流强度(A),V 为电阻丝两端所加的电压(V),t 为通电时间(s)。
三、仪器和试剂1.仪器SWC-RJ 一体式溶解热测量装置(如右图,具体参数为:加热功率:0~12.5W 可调;温度/温差分辨率:0.01℃/0.001℃;计时时间范围:0~9999 S ;输出:RS232C 串行口)称量瓶8只,毛刷1个,电子分析天平,台秤2.试剂硝酸钾固体(A.R.已经磨细并烘干)四、实验步骤1.称样取8个称量瓶,先称空瓶,再依次加入约为2.5、1.5、2.5、3.0、3.5、4.0、4.0、4.5 g的硝酸钾(亦可先去皮后直接称取样品),粗称后至分析天平上准确称量,称完后置于保干器中,在台天平上称取216.2 g蒸馏水于杜瓦瓶内。
具体数据记录见五中,称量瓶洗净吹干后,一定要称量空瓶的质量,由于没有保干器,所以称量以后要马上盖上盖子。
蒸馏水称量了218.2g。
2.连接装置如右图所示,连接电源线,打开温差仪,记下当前室温。
将杜瓦瓶置于测量装置中,插入探头测温,打开搅拌器,注意防止搅拌子与测温探头相碰,以免影响搅拌。
将加热器与恒流电源相连,打开恒流电源,调节电流使加热功率为2.5瓦,记下电压、电流值。
同时观察温差仪测温值,当超过室温约0.5℃时按下“采零”按钮和“锁定”按钮,并同时按下“计时”按钮开始计时。
当前室温是15.6℃,注意要放入搅拌子。
当显示温度超过室温0.5℃后,按下“状态转换”按钮,系统自定采零并开始计时,加热功率为2.30W左右。
3.测量将第一份样品从杜瓦瓶盖口上的加料口倒入杜瓦瓶中,倒在外面的用毛刷刷进杜瓦瓶中。
此时,温差仪显示的温差为负值。
监视温差仪,当数据过零时记下时间读数。
接着将第二份试样倒入杜瓦瓶中,同样再到温差过零时读取时间值。
如此反复,直到所有的样品全部测定完。
采零后要迅速开始加入样品,否则升温过快可能温度回不到负值。
加热速度不能太快也不能太慢,要保证温差仪的示数在-0.5℃以上。
具体数据记录见五中。
4.称空瓶质量在分析天平上称取8个空称量瓶的质量,根据两次质量之差计算加入的硝酸钾的质量。
实验结束后,打开杜瓦瓶盖,检查硝酸钾是否完全溶解。
如未完全溶解,要重做实验。
倒去杜瓦瓶中的溶液(注意别丢了搅拌子),洗净烘干,用蒸馏水洗涤加热器和测温探头。
关闭仪器电源,整理实验桌面,罩上仪器罩。
具体数据记录见五中,打开杜瓦瓶盖发现KNO3已完全溶解,证明实验成功。
五、数据记录和处理室温15.6℃ 大气压力(kPa):102.801.数据记录本实验记录的数据包括水的质量、8份样品的质量、加热功率以及加入每份样品后温差归零时的累积时间。
2.将数据输入计算机,计算n水和各次加入的KNO3质量、各次累积加入的KNO3的物质的量。
根据功率和时间值计算向杜瓦瓶中累积加入的电能Q。
sol0用以下计算式计算各点的Δsol H 和n 0:Δsol H=3KNO n Q(7)n 0=0n n (8) 瓶号 1 2 3 4 5 6 7 8 Δsol H/KJ/mol36.953 36.161 35.978 35.277 34.674 34.041 33.283 32.336n 0/mol 494.55 308.21 185.58 126.49 90.652 68.797 55.654 45.984 在origin 中绘制Δsol H~n 0关系曲线,并对曲线拟合得曲线方程。
使用多项式拟合进行二次拟合,得到如下图:可见拟合度并不好,故采用 三次拟合使用多项式拟合进行二次拟合,R-Square(COD) SD N P----------------------------------------------------0.88271 0.63253 8 0.00471得到如下图:Polynomial Regression for DATA1_B:Y = A + B1*X + B2*X^2 + B3*X^3Parameter Value Error------------------------------------------------------------A 30.10599 0.55534B1 0.06744 0.01047B2 -2.34981E-4 4.86045E-5B3 2.56103E-7 6.11745E-8------------------------------------------------------------R-Square(COD) SD N P------------------------------------------------------------0.97821 0.30485 8 8.84128E-4------------------------------------------------------------ 拟合度达到0.98,所以采用三次拟合。
得到的曲线方程为y =30.10599+0.06744x-2.34981E-4x2 +2.56103E-7x34.积分熔解热,积分稀释热,微分熔解热,微分稀释热的求算=80、100、200、300、400代入3中的曲线方程,求出溶液在这几点处将n的积分溶解热。
值代入所得的导函数,求出这几将所得曲线方程对n0求导,将上述几个n个点上的切线斜率,即为溶液n在这几点处的微分稀释热:求得一阶导数方程为y′=0.06744-4.69962E-4x +7.68309E-7x2利用一元函数的点斜式公式求截距,可得溶液在这几点处的微分溶解热。
最后,计算溶液n为80→100,100→200,200→300,300→400时的积分稀释热。
六、注意事项1.实验开始前,插入测温探头时,要注意探头插入的深度,防止搅拌子和测温探头相碰,影响搅拌。
另外,实验前要测试转子的转速,以便在实验室选择适当的转速控制档位。
2.进行硝酸钾样品的称量时,称量瓶要编号并按顺序放置,以免次序错乱而导致数据错误。
另外,固体KNO3易吸水,称量和加样动作应迅速。
3.本实验应确保样品完全溶解,因此,在进行硝酸钾固体的称量时,应选择粉末状的硝酸钾。
4.实验过程中要控制好加样品的速度,若速度过快,将导致转子陷住不能正常搅拌,影响硝酸钾的溶解;若速度过慢,一方面会导致加热过快,温差始终在零以上,无法读到温差过零点的时刻,另一方面可能会造成环境和体系有过多的热量交换。
5.实验是连续进行的,一旦开始加热就必须把所有的测量步骤做完,测量过程中不能关掉各仪器点的电源,也不能停止计时,以免温差零点变动及计时错误。
6.实验结束后应杜瓦瓶中是否有硝酸钾固体残余,若硝酸钾未全部溶解,则要重做实验。
七、实验讨论1.固体KNO3易吸水,故称量和加样动作应迅速。
实验书中要求固体KNO3在实验前务必研磨成粉状,并在110℃烘干,而在实验中并没有将样品进行烘干,只是盖上了盖子,故而带来误差。
但考虑到实验是在冬天进行,气候干燥,故此影响不大。
2.为了使KNO3固体在加入杜瓦瓶时不撒出来,可以在加料口出加上一个称量纸卷成的漏斗。
但是这样操作会使一些药品聚集在纸漏斗口处,所以每次加完药品都要抖一抖称量纸,使样品全部进入杜瓦瓶。