2020高中化学竞赛 无机及分析化学第八章 配位化合物和配位滴定共66张
- 格式:ppt
- 大小:2.98 MB
- 文档页数:66

高中化学竞赛专题练习配位化合物1、画出下列配合物可能有的旋光异构体的结构。
(1)[FeCl2(C2O4)en] ;(2) [Co(C2O4)3]3-;(3)[Co(en)2Cl2]+。
2、一些顺式铂的配合物可以作为活性抗癌药剂,如cis-PtCl4(NH3)2、cis-PtCl2(NH3)2、cis-PtCl2(en)等。
实验测得它们都是反磁性物质,试用杂化轨道理论说明它们的成键情况,指出它们是内轨型配合物还是外轨型配合物。
3、已知下列配合物的磁矩,根据价键理论指出各中心离子的价层电子排布、轨道杂化类型、配离子空间构型,并指出配合物属内轨型还是外轨型。
(1) Mn(CN)63-(μ=2.8 B.M); (2) Co(H2O)62+(μ=3.88 B.M);4、实验测得配离子Co(NH3)63+是反磁性的,问它属于什么几何构型?根据价键理论判断中心离子采取什么杂化状态?5、通过计算说明,在标准状况下金难溶于水,但用氰化钠溶液却可以浸取金矿砂中的金。
已知E°(Au+/Au)=1.69V,E°(O2/OH-)=0.401V,K稳°[Au(CN)2-]=2×10386、已知E°(Fe3+/Fe2+)=0.771V,E°(I2/I-)=0.535V,在标准状况下Fe3+可以将I-氧化为单质I2。
通过计算说明在标准状况下,下列反应能否自发进行?2Fe(CN)63-+2I-=Fe(CN)64-+I2已知K稳°(Fe(CN)63-)=1.0×1042,K稳°(Fe(CN)64-)=1.0×1035。
7、已知E°(Fe3+/Fe2+)=0.771V,E°(Sn4+/Sn2+)=0.14V,K稳°(FeF3)=1.15×1012。
通过计算说明,下列氧化还原反应在标准状态下能否发生。

中学化学竞赛试题资源库——配位平衡和滴定A组1.下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。
在一定条件下,Ni可以与CO(g)发生如下反应:Ni(s)+4CO(g)Ni(CO)4(g)但Ni粉中的杂质不与CO(g)发生反应。
玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,右端的主要物质是A 纯Ni(s)和Ni(CO)4(g)B 纯Ni(s)和CO(g)C 不纯Ni(s)和CO(g)D 不纯Ni(s)和Ni(CO)4(g)2.CuCl2溶液有时呈黄色,有时呈黄绿色,有时却是蓝色,这是因为CuCl2的水溶液中存在如下平衡:[Cu(H 2O)4]2+(蓝色)+4Cl-[CuCl4]2-(黄色)+4H2O 要使一份黄色的CuCl2溶液变成黄绿色或蓝色,可以往溶液中加入A NaCl溶液B 水C AgNO3溶液D Na2S溶液3.CuCl2溶液有时呈黄色,有时呈黄绿色或蓝色,这是因为在CuCl2的水溶液中存在如下平衡:[Cu(H 2O)4]2+(蓝色)+4Cl-[CuCl4]2-(黄色)+4H2O 现欲使溶液由黄色变成黄绿色或蓝色,请写出两种可采用的方法:①,②。
4.对人体新陈代谢起重要作用的血红蛋白是铁的配合物,配合物中含有位置可互相置换的O2和H2O分子,血红蛋白在肺部结合O2,然后随血液输送到体内需氧部位,在那里,O2便被H2O取代出来。
(如右图)通常在铁的配合物中结合有各种小分子,如O2、H2O和CO等,它们结合力的强弱顺序为CO O 2≈H2O。
据此,请简要分析使用家用燃气热水器,为什么有时会出现伤亡事故。
(1)若热水器的燃气主要成分为丙烷(C3H8),燃烧时的化学方程式为。
(2)发生窒息伤亡事故的人为原因是,所发生反应的化学方程式为__________________________。
(3)人体中毒的直接原因是。
5PbCl2于1.00mol/L HCl溶解度最小,请说出可能原因。





促敦市安顿阳光实验学校配位化合物1. 熟悉配位化合物的基本概念、组成和命名;2. 熟悉配位化合物的价键理论,会进行一般配离子结构判断和磁性计算;理解晶体场理论的要点,弄清八面体场、四面体场面四边形场中 d轨道的分裂;理解分裂能和晶体场稳化能概念;4. 了解配位化合物顺反异构和旋光异构概念,初步上述两种异构体的判断;5. 熟悉配位实体热力学稳性中的有关概念。
7.1维尔纳学说的要点:●大多数化学元素表现出两种类的化合价,即主价和副价;●元素形成配合物时倾向于主价和副价都能得到满足;●元素的副价指向空间确的方向。
一.配位实体和络合物需要强调配位实体所带的电荷时,也可将其叫作络离子(Complex ion)。
这就是说,“络合物”和“络离子”都是“配位实体”的同义。
二.配位化合物配位化合物(Coordination compound) 指包含配位实体在内的整个化合物。
中心离子或原子:正离子(多)金属元素(多)中性原子(少)非金属元素(少)三.配位体和配位原子与中心原子结合的分子或离子(如例中的NH3分子、CO分子和CN-离子)叫做配位体(Ligand), 配位体中与中心原子直接键合的原子叫配位原子(如配位体NH3中的N原子,配位体CN-和CO中C原子)。
配位体又因含有的配位原子数目不同分为单齿配位体 (Monodentate ligand) 和多齿配位体 (Polydentate ligand) 。
四.配位数与中心离子(或原子)成键的配位原子的总数五.螯合物和金属大环配合物螯合物(Chelate)是多齿配位体以2个或2个以上配位原子配位于金属原子而形成的一种环状络合物 (环中包含了金属原子)。
能用作多齿配体的试剂叫螯合剂(Chelating agent)。
六.化学式的书写和配合物的命名命名原则:按照无机专业会制的规则命名;●含络离子的配合物:阴离子名称在前,阳离子名称在后,阴、阳离子名称之间加“化”字或“酸”字。

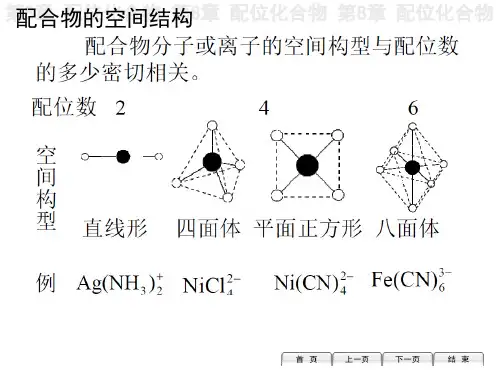


第八章思考题与习题参考答案一、选择题1. 在给出的4个选项中,请选出1个正确答案。
(1)已知sp K (AB)=4.0×10-10;sp K (A 2B)=3.2×10-11,则两者在水中的溶解度关系为( A )A. S (AB )< S (A 2 B )B. S (AB )>S (A 2 B )C. S (AB )=S (A 2 B )D. 不能确定 (2)Mg (OH )2沉淀在下列溶液中溶解度最大的是( B ) A. 纯水 B. 在0.1mol ·L -1 HCl 中 C. 在0.1mol ·L -1 NH 4Cl 中 D. 在0.1mol ·L -1 Mg Cl 2 中 (3)莫尔法测定Cl -和Ag +时,所用滴定剂分别为( B ) A. AgNO 3,Na Cl B. AgNO 3,AgNO 3 C. AgNO 3,KSCN D. AgNO 3,NH 4SCN(4)用佛尔哈德法测定溶液中Cl -时,所选用的指示剂为( D ) A. K 2CrO 4 B. 荧光黄 C. 曙红 D. 铁铵矾(5) 佛尔哈德法测定Cl -时,溶液中没加有机溶剂,在滴定过程中使结果( A ) A. 偏低 B.偏高 C.无影响 D. 正负误差不定 二、填空题2.相同温度下,HAc 在N a Ac 溶液中的解离度小于纯水中的解离度,CaCO 3在Na 2CO 3溶液中的溶解度小于其在纯水中的溶解度,这种现象可用_同离子效应__来解释。
3.分步沉淀的次序不仅与溶度积常数及沉淀的 类型 有关,而且还与溶液中相应离子 浓度 有关。
;4.BaSO 4和Mg(OH)2的θsp K 分别为1.1×10-10和5.6×10-12,两者在水中溶解度为1.05×10-5 , 1.1×10-4 。
;三、简答题6.试用溶度积规则解释下列事实解:(1)CaCO3沉淀溶于稀HCl :CaCO3Ca2++CO32-,在稀HCl中存在H+,能与CO32-结合生成HCO3-和H2CO3,导致平衡向右移动,直到完全溶解。