材料化学5鲍林原则
- 格式:ppt
- 大小:3.30 MB
- 文档页数:43

第二章晶体学终极重点:1、晶体特征,晶体与非晶体区别 2、晶向与晶面指数确定步骤1.晶体的性能特征:均一性,各向异性,自限性,对称性,最小内能性;2.对称操作与对称要素:对称轴,对称面,对称中心,倒转轴;3.晶向指数与晶面指数:确定步骤;4.球体的堆积:六方,面心立方,体心立方5.鲍林规则;6.各种典型晶体构型;7.硅酸盐晶体结构与实例:岛状,链状,层状,架状;8.同质多晶现象:可逆转变,不可逆转变,重建型转变,位移型转变。
1.晶体的性能特征:均一性,各向异性,自限性,对称性,最小内能性(1)晶体的基本特征晶体的性能特征结晶均一性:在晶体内部任意部位上具有相同的性质;各向异性:在晶体不同方向上表现出的性质差异;自限性:能够自发形成封闭的凸几何多面体外形的特性;对称性:晶体中的相同部分(晶面,晶棱,等等)以及晶体的性质能够在不同方向或位置上有规律地重复;最小内能性:在相同的热力学条件下,晶体与同组成的气体、液体及非晶态固体相比具有最小内能,即最为稳定。
(2)对称操作与对称要素:对称操作:使晶体的点阵结构和性质经过一定程序后能够完全复原的几何操作;对称要素:实施对称操作所依赖的几何要素(点,线,面等);1.旋转操作与对称轴:一个晶体如能沿着某一轴线旋转360 / n(n = 1, 2, 3, 4, 6)后使晶体位置完全回复原状,则该晶体具有n 重对称轴;2.反映操作和对称面:一个晶体中如果存在某一个平面,使平面两边进行反映操作,而令晶体复原,则这个平面称为对称面;3.反演操作和对称中心:一个晶体中央在某一个几何点,使晶体外形所有晶面上各点通过该几何点延伸到相反方向相等距离时,能够使晶体复原的操作。
该几何点称为对称中心。
4.旋转反演操作和对称反轴:旋转之后进行反演使晶体复原的操作;只有4¯是新的独立对称要素。
(3)晶向指数与晶面指数:确定步骤晶向指数:以晶胞的某一阵点O为原点,过原点O的晶轴为坐标轴x,y,z,以晶胞点阵矢量的长度作为坐标轴的长度单位;过原点O作一直线OP,使其平行于待定晶向;在直线OP上选取距原点O最近的一个阵点P,确定P点的3个坐标值;将这3个坐标值化为最小整数u,v,w,加以方括号,[ u v w ]即为待定晶向的晶向指数。
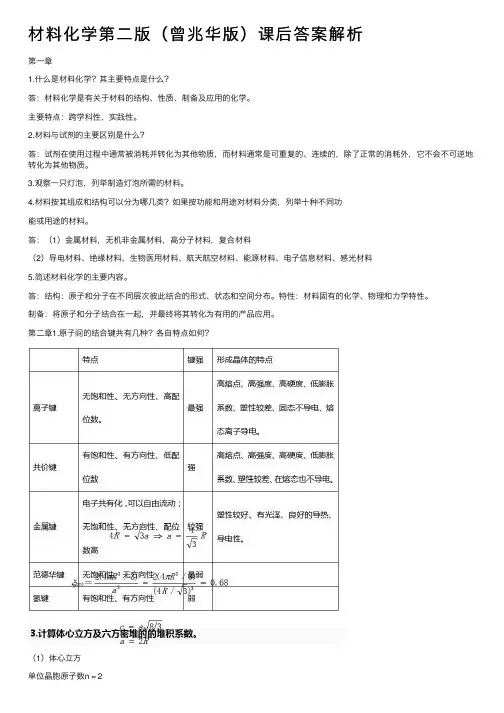
材料化学第⼆版(曾兆华版)课后答案解析第⼀章1.什么是材料化学?其主要特点是什么?答:材料化学是有关于材料的结构、性质、制备及应⽤的化学。
主要特点:跨学科性,实践性。
2.材料与试剂的主要区别是什么?答:试剂在使⽤过程中通常被消耗并转化为其他物质,⽽材料通常是可重复的、连续的,除了正常的消耗外,它不会不可逆地转化为其他物质。
3.观察⼀只灯泡,列举制造灯泡所需的材料。
4.材料按其组成和结构可以分为哪⼏类?如果按功能和⽤途对材料分类,列举⼗种不同功能或⽤途的材料。
答:(1)⾦属材料,⽆机⾮⾦属材料,⾼分⼦材料,复合材料(2)导电材料、绝缘材料、⽣物医⽤材料、航天航空材料、能源材料、电⼦信息材料、感光材料5.简述材料化学的主要内容。
答:结构:原⼦和分⼦在不同层次彼此结合的形式、状态和空间分布。
特性:材料固有的化学、物理和⼒学特性。
制备:将原⼦和分⼦结合在⼀起,并最终将其转化为有⽤的产品应⽤。
第⼆章1.原⼦间的结合键共有⼏种?各⾃特点如何?(1)体⼼⽴⽅单位晶胞原⼦数n = 2(2)六⽅密堆n=6(3)⾯⼼⽴⽅n=410. 单质Mn有⼀种同素异构体为⽴⽅结构,其晶胞参数为0.6326nm,密度= 7.26 g cm-3,原⼦半径r = 0.112nm,计算Mn晶胞中有⼏个原⼦,其堆积系数为多少?74.)3(3812)3/4(6)2321(6)3/4(6=33hcp==R a a c RππξR a a R 2 4 2 4== 74 . ) 2 / 4 ( )3 / 4 (4 )3 / 4 (433fcc==RRaRππξ11. 固溶体与溶液有何异同?固溶体有⼏种类型?固体溶液与液体溶液的共同点:均具有均⼀性、稳定性,均为混合物,均存在溶解性问题(对固态溶液称为固溶度,对液体溶液称为溶解度);(1)均⼀性:溶液各处的密度、组成和性质完全⼀样;(2)稳定性:温度不变,溶剂量不变时,溶质和溶剂长期不会分离;(3)混合物:溶液⼀定是混合物。


1、鲍林规则:鲍林根据已测定的晶体结构数据和晶格能公式所反映的关系,提出的判断离子化合物结构稳定性的规则,共包含五条规则。
2、晶体:质点在三维空间作有序排列的固体晶胞:是晶体结构中的最小单元。
3、晶子学说:玻璃结构是一种不连续的原子集合体,即无数“微晶”分散在无定形介质中。
无规则网络学说:玻璃的结构与相应的晶体结构相似,同样形成连续的三维空间网络结构。
但玻璃的网络与晶体的网络不同,玻璃的网络是不规则的、非周期性的4、扩散型相变:在相变时,依靠原子或离子的扩散来进行的相变。
非扩散型相变:相变过程不存在原子离子的扩散,或虽存在扩散但不是相变所必须的或不是主要过程的相变。
5、热缺陷:也称本征缺陷,指由热起伏的原因所产生的空位和间隙质点。
杂质缺陷:也称组成缺陷,是由外加杂质的引入所产生的缺陷。
6、点缺陷:亦称为零维缺陷,缺陷尺寸为原子大小数量级,包括空位、间隙原子、杂质原子和色心等。
线缺陷:亦称一维缺陷或位错,是指在一维方向上偏离理想晶体中的周期性、规则性排列所产生的缺陷,包括棱位错和螺形位错;7、烧结:一种或多种固体粉末经过成型,在加热到一定温度后开始收缩,在低于熔点温度下变成致密、坚硬的烧结体,这个过程叫烧结。
固相反应:固体直接参与反应并起化学变化,同时至少在固体内部或外部的一个过程中起控制作用。
8、肖特基缺陷:质点由表面位置迁移到新的表面位置,在晶体表面形成新的一层,同时在晶体内部留下空位,其特征是正负离子空位成比例出现。
弗伦克尔缺陷:质点离开正常格点后进入到晶格间隙位置,其特征是空位和间隙质点成对出现。
9、硼反常现象:当数量不多的碱金属氧化物同氧化硼一起熔融时,碱金属所提供的氧不象熔融玻璃中作为非桥氧出现在结构中,而是使硼氧三角体转变为桥氧组成的硼氧四面体,致使玻璃从原来两度空间的层状结构转变为三度空间的架状结构,从而加强了网络结构,并使玻璃的各种物理性能变好。
这与相同条件下的硅酸盐玻璃相比,其性能随碱金属或碱土金属加入量的变化规律相反,所以称之为硼反常现象10、均匀成核:晶核从均匀的单相熔体中产生的几率处处相同的成核过程。

鲍林规则和价键理论1928年,鲍林根据当时已测定的晶体结构数据和晶格能公式所反映的关系,提出了判断离子化合物结构稳定性的规则──鲍林规则。
鲍林规则共包括五条规则:鲍林第一规则:在离子晶体中,在正离子周围形成一个负离子多面体,正负离子之间的距离取决于离子半径之和,正离子的配位数取决于离子半径比。
鲍林第二规则:在一个稳定的离子晶体结构中,每一个负离子电荷数等于或近似等于相邻正离子分配给这个负离子的静电键强度的总和,其偏差≤1/4价。
鲍林第三规则:在一个配位结构中,共用棱,特别是共用面的存在会降低这个结构的稳定性。
其中高电价,低配位的正离子的这种效应更为明显。
鲍林第四规则:若晶体结构中含有一种以上的正离子,则高电价、低配位的多面体之间有尽可能彼此互不连接的趋势。
鲍林第五规则:在同一晶体中,组成不同的结构基元的数目趋向于最少。
鲍林(Pauling)规则是根据离子晶体的晶体化学原理,通过对一些较简单的离子晶体结构进行分析,总结归纳出的五条规则。
氧化物晶体及硅酸盐晶体大都含有一定成分的离子键,因此,在一定程度上可以根据鲍林规则来判断晶体结构的稳定性。
第一规则实际上是对晶体结构的直观描述,如NaCl晶体是由[NaCl6]八面体以共棱方式连接而成。
利用第二规则可以判断晶体是否稳定,同时也可以判断共用一个顶点的多面体的数目。
例如,在CaTiO3结构中,Ca2+、Ti4+、O2-离子的配位数分别为12、6、6。
O2-离子的配位多面体是[OCa4Ti2],则O2-离子的电荷数,与O2-离子的电价相等,故晶体结构是稳定的。
又如,一个[SiO4]四面体顶点的O2-离子还可以和另一个[SiO4]四面体相连接(2个配位多面体共用一个顶点),或者和另外3个[MgO6]八面体相连接(4个配位多面体共用一个顶点),这样可使O2-离子电价饱和。
第三规则又称为多面体共顶、共棱、共面规则。
两个配位多面体连接时,随着共用顶点数目的增加,中心阳离子之间距离缩短,库仑斥力增大,结构稳定性降低。






鲍林关于估算含氧酸酸性强弱的两条规则是什么?它们对化学研究有何指导价值?鲍林提出两条规则用以粗略估算含氧酸O p E(OH)q的p K a○一值, 含氧酸通式中的p 和q分别代表末端氧原子和羟基的数目。
1. 电中性氧合酸的p K a○一≈8-5p。
即p=0时p K a○一≈8;p=1时p K a○一≈3;p=2时p K a○一≈-2。
2. 多元酸(q>1)多步质子转移反应的p K a○一值逐级增加5。
例如硫酸(O)2S(OH)2(p=2, q=2)的p K a1○一≈-2,而p K a2○一≈+3。
这些规则的成功可由表1提供的实例得到支持,估算值与实验值之间的误差仅约±1。
实际工作中通常不要求用鲍林规则得到p K a○一值,因为与其这样, 倒不如从化学手册中去查找。
鲍林规则也不能用来解释化学现象,而规则本身倒是需要作解释。
例如, 根据鲍林规则, 一个具体酸的强弱似乎与通式中的E无关, 这在化学上是难以理解的。
表1 鲍林规则应用选例鲍林规则最有趣的用途也许是发现结构异常现象, 如果实验值与估算值差异太大, 则可能是结构异常的一种信息。
例如H2CO3, 估算的p K a○一为3, 显著偏离了实验值6.4。
后来研究证实, 这种偏离是因为处理实验数据时直接将溶于水中的CO2浓度当作H2CO3浓度,而实际溶解的CO2大约只有1%转化为H2CO3。
如果采用H2CO3的实际浓度,算得的数值约为3.6, 与估算值的误差在±1之内。
另外的例子有如亚磷酸,实验值更接近于表中p=1的那个估算值。
这一事实暗示分子中存在一个末端氧原子。
根据亚磷酸的化学式H3PO3,似乎不存在末端氧原子[P(OH)3], 容易给人造成错觉以为它是个三元酸。
研究表明, 亚磷酸实际上是个二元酸,其中含有一个末端氧原子和一个与磷原子直接键合的氢原子。
1。
一、填空硅酸盐结构:岛状结构层状结构组群状结构链状结构架状结构晶格能影响因素:离子半径离子电荷电子层构型固溶体种类:填隙型置换型决定离子晶体结构的基本因素:球体最紧密堆积配位数离子的极化电负性固溶体影响因素:离子尺寸晶体的结构类型电负性非化学计量化合物:阴离子空位型阳离子填隙型阴离子填隙型阴离子空位型位错类型:刃位错螺型位错熔融三种冷却过程:结晶化玻璃化分相玻璃冷却速率的影响因素:过冷度熔体黏度晶核形成速率晶核成长速率玻璃在熔点的黏度越高越易形成玻璃,Tg/Tm〉2/3时易形成玻璃3T图中3T:时间温度转变分子引力:定向力色散力诱导力热缺陷:弗伦克尔缺陷肖特基缺陷固体表面影响因素:表面粗糙度表面微裂纹晶界:小角度晶界大角度晶界润湿现象:附着润湿铺展润湿浸渍润湿润湿的影响因素:粗糙度吸附膜熔体黏度的影响因素:温度熔体组成扩散机制:直接易位环形易位间隙扩散准间隙扩散空位扩散由点缺陷(肖特基和弗兰克尔缺陷)引起的扩散为本征扩散,空位来源于掺杂而引起的扩散为非本征扩散。
黏附的影响因素:润湿性黏附功黏附面的张力相容性和亲和性固相反应速率:化学反应速率扩散速率烧结气氛:还原性氧化性中性固态相变:一级相变二级相变从熔体中析晶的过程分二步完成,首先是成核,然后就是晶体生长过程。
均匀成核的成核速率由受核化位垒影响的成核率因子和受原子扩散影响的成核率因子所决定的。
固体质点扩散的推动力:化学位梯度液-固相变过程的推动力:过冷度烧结过程的推动力:粉料表面能的降低二、名词解释晶格能:在0K时1mol离子化合物的各离子拆散成气体所需的能量配位数:与一个原子或离子直接相邻的原子或离子数离子极化:离子正负电荷的重心发生偏离产生偶极矩的现象同质多晶:物质在不同温度、压力等热力学条件下呈现不同的晶体结构点缺陷:在空间各方向上的尺度远小于晶体、晶粒尺度的缺陷热缺陷:由晶体内部质点热运动而形成的缺陷肖特基缺陷:原子离开平衡位置迁移至晶体表面格点位置,晶体内仅留有空隙的缺陷弗伦克尔缺陷:原子离开平衡位置进入晶格间隙形成的缺陷杂质缺陷:杂质原子进入晶格形成的结构缺陷固溶体:固体作为溶剂溶有其他数量可变的杂质原子,并形成的单一均匀的晶态固体位错:晶体的一维晶格缺陷刃位错:滑移方向与位错线垂直的位错螺位错:滑移方向与位错线平行的位错非化学计量化合物:化合物中不遵循整数比,同种物质组成在一定范围内变动的化合物晶子学说:玻璃中有大量微晶的存在,晶子仅在内部有晶体结构,晶子分散在无定形介质中,向无定形介质过渡中无明显界限无规则网络学说:原子在玻璃和晶体中都形成了连续、三维空间网络结构,它们结构单元为三面体或四面体,但玻璃中的网络无周期性和规则性单键强度:化合物解离能比化合物的配位数的商网络形成剂:单键强度〉335KJ/mol的可形成玻璃的氧化物网络变性剂:单键强度〈250KJ/mol,不能单独形成玻璃的氧化物固体表面能:产生单位新表面所消耗的等温可逆功松弛:表面表面质点通过电子云极化变形来降低表面能的过程晶界应力:在晶界上由于质点排列不规则使质点距离不均匀而形成的微观机械应力气体在固体表面的吸附:气体分子在固体表面上发生的浓集现象,物理吸附无电子转移,化学吸附有电子转移,形成化学键表面张力:由表面层分子引力不均引起的作用于物质表面使表面积缩小的力接触角:固固之间或固液之间接触时产生的夹角晶界结构:不同生长方向的晶粒在相遇时形成的具有一定特征的边界结构润湿角:固液接触时,固相水平线与液相的切线相交的夹角孪晶界:两个晶体沿一个公共晶面构成镜面对称的位向关系扩散通量:单位时间内垂直通过扩散方向x的单位面积的物质流量无序扩散:原子或离子的无规则扩散迁移运动晶界扩散:沿边界或界面发生的扩散表面扩散:在晶体表面发生的本征扩散:仅仅由本身的点缺陷作为迁移载体的扩散非本征扩散:由杂质引起的缺陷进行的扩散自扩散:纯组分晶体中,不依赖浓度梯度的扩散互扩散:两种组分扩散通量大小相等,方向相反的扩散方式稳定扩散:扩散物质的浓度不随时间变化的扩散过程不稳定扩散:扩散物质的浓度随时间变化的扩散过程扩散活化能:一级相变:临界温度下自由能关于温度、压力的一次导数不连续的一类相变二级相变:临界温度下自由能一次导数连续而二次导数不连续的一类相变玻璃析晶:当玻璃熔体冷却在析晶温度范围时,由于晶核形成速率和晶体生长速率较大而导致玻璃析出晶体的过程。
鲍林酸碱经验规律反例一、引言鲍林酸碱经验规律(Pauling"s Acid-Base Experience)是著名化学家鲍林(Linus Pauling)于1923年提出的一个描述酸碱性质的经验规律。
尽管该规律在许多情况下都能较好地解释酸碱现象,但仍存在一些反例。
本文将探讨这一规律的概述、局限性及补充应用。
二、鲍林酸碱经验规律概述1.定义鲍林酸碱经验规律是指在溶液中,酸和碱的强弱与其离子化程度成反比。
换句话说,离子化程度越高,酸或碱的强度越弱。
2.规律内容根据这一经验规律,酸的离子化程度越高,其酸性越弱;碱的离子化程度越高,其碱性越弱。
此外,规律还表明,在同一周期中,从左向右,元素的氧化态酸性逐渐增强,还原态碱性逐渐增强;在同一族元素中,从上向下,氧化态酸性减弱,还原态碱性减弱。
3.适用范围鲍林酸碱经验规律适用于大多数无机酸碱和有机酸碱,但在一些特殊情况下,规律可能不成立。
三、鲍林酸碱经验规律的局限性1.反例一:不符合规律的酸碱性质在某些情况下,有些酸碱的性质与鲍林酸碱经验规律不符。
例如,氯酸(HClO)的酸性比硫酸(H2SO4)弱,而根据经验规律,氯酸的酸性应该比硫酸强。
2.反例二:不符合规律的酸碱反应有些酸碱反应也不符合鲍林酸碱经验规律。
例如,氢氧化铝(Al(OH)3)与盐酸(HCl)反应生成氯化铝(AlCl3)和水(H2O),这个反应中的酸碱性质与经验规律不符。
四、鲍林酸碱经验规律的补充与应用1.氢键对规律的影响氢键是影响酸碱性质的一个重要因素。
在某些含有氢键的化合物中,鲍林酸碱经验规律可能不适用。
例如,在水溶液中,氟化氢(HF)的酸性比硫酸(H2SO4)强,这是因为HF中的氢键作用较强,使得其离子化程度较低。
2.规律在实际应用中的优化在实际应用中,可以根据鲍林酸碱经验规律对酸碱性质进行预测和分析。
然而,当遇到反例时,需要结合其他理论和方法,如分子轨道理论、电子供体-受体理论等,对规律进行补充和优化。
当代杰出的化学家——鲍林在当今全世界化学家中,鲍林可以称得上是最杰出的代表人物,他的研究工作范围非常广泛,许多方面都处于领先的地位,如:①他对化学键本质有深入的研究,首先提出化学键可能有一种混合特性,即既含有共价性,又含有离子性;②第一个提出“电负性”概念,并确定了元素的电负性值,有助于预见各种化合物的共价性和离子性程度;③把“共振”这个术语用于化学键理论;④首先提出氢键在本质上和程度上与共价键以及范德华力不同;⑤第一个提出蛋白质分子具有螺旋状结构。
鲍林还是少有的获得过两次诺贝尔奖金的科学家之一。
1901年2月28日,莱纳斯·鲍林出生于美国西部俄勒冈州的波特兰市,父亲是一位药剂师。
在他的幼年时期,他对于观察父亲在药房里配制各种粉剂和药膏非常感兴趣。
不幸的是,在他九岁的时候,父亲就去世了,但是父亲的影响仍然在促使他爱好和学习化学。
在鲍林十一、二岁时,他的好友杰弗里经常邀请他到后者的家里,让鲍林看一些有趣的化学实验。
鲍林记得最清楚的实验乃是将糖与氯酸钾混合,然后加上几滴浓硫酸,立刻发生了剧烈的反应,一面冒着热的水蒸气,一面生成了膨松的像发面一样的黑色碳粒。
鲍林还从父亲的朋友(他们也都是药剂师)处得到了很多化学药品,于是他自己也做起了化学实验。
在高中时,化学老师不但让鲍林做有机化学实验,他还做了一系列定性分析实验。
后来,鲍林居然能够协助老师对学校买来的煤和油进行量热测定。
鲍林在俄勒冈州州立学院学习的专业是化学工程,1922年获学士学位。
但是他已经认识到自己所要选择的职业是化学,而不是工程。
于是,他申请到加州理工学院学习,他被允许作为兼任助教工作的研究生。
由于他的努力,1925年获该校哲学博士学位。
毕业后,曾往欧洲留学,1927年回母校任教,1931年升任教授。
他在加州理工学院一直工作到1963年。
1963—1967年他担任加州圣巴巴拉民主学院研究中心的物理学和生物学教授。
1967—1969年任圣地亚哥的加利福尼亚大学化学系教授。
鲍林陶瓷结晶五原则鲍林陶瓷结晶五原则是针对陶瓷结晶制备过程中的关键性问题所提出的五条指导性原则。
1. 晶种选择原则在陶瓷结晶制备过程中,晶种选择是非常关键的一步。
在选择晶种时,需要考虑到晶种的晶形、晶体大小、溶解度等因素,并预先进行一些实验性的测试,以确定最适合的晶种。
2. 溶液配制原则溶液的配制是影响陶瓷结晶制备结果的关键因素。
鲍林在此提出了“离心原则”,即在溶液中添加聚乙烯醇等高分子物质,以提高溶解度并促进结晶的产生。
此外,还需要考虑到溶液的浓度、溶剂选择等因素,以保证制备出的陶瓷结晶符合要求。
3. 温度控制原则温度是影响陶瓷结晶过程的重要因素之一。
在制备过程中,需要掌握好加热升温的速率、保持温度的稳定性,以及降温的速率等因素,以确保结晶过程的平稳进行。
4. 颗粒控制原则颗粒控制也是陶瓷结晶制备过程中的关键。
主要包括晶体颗粒大小的控制以及晶体分散均匀度的控制。
鲍林认为,在制备过程中应尽量控制晶体颗粒的大小和分布,以保证制备出的陶瓷结晶质量的稳定性并提高制备效率。
5. 洗涤处理原则洗涤处理也是陶瓷结晶制备过程中不可忽视的一环。
洗涤可以去除余胶等杂质,并保证结晶质量的稳定性。
鲍林指出,洗涤时间、洗涤次数以及洗涤液的选取等因素都会影响到最终的陶瓷结晶质量。
总之,鲍林陶瓷结晶五原则是在陶瓷结晶制备过程中具有指导意义的五条原则,可以帮助制备者更好地掌握陶瓷结晶制备过程,并制备出符合要求的陶瓷结晶。
但需要注意的是,制备陶瓷结晶是一个极为复杂的过程,不仅需要掌握以上五条原则,还需要不断完善和改进制备工艺,以逐渐提高陶瓷结晶的制备水平和质量。
鲍林规则含氧酸公式
根据鲍林规则,含氧酸的化学公式是R-COOH,其中R表示有机物,COOH表示羧基,这里的C都表示碳原子,O表示含氧酸的特征氧原子,H表示羧基的机构的氢原子。
这是由于碳原子需要有四个化学键,这样它才能够吸收属于它的共价键,将原子两两结合起来形成一个整体,而当碳原子被氧原子所限制的时候,就会形成一个羧基,这样就
形成了含氧酸的结构。
另外,所谓含氧酸,指的是一种注入氧气的有机物,他们可以被温室
气体所沉降,也可以被酸雨所分解,甚至还可以作为医药材料来使用。
含氧酸的分子结构也被称为“共价结构”,因为它们的氧原子可以通过
电子传递而形成的多个共价键,才能形成具有稳定性的结构。
而这些
由共价键形成的结构称为酸-酯类化合物,其中还包括水杨酸、青酸、
苯甲酸等等。
这些酸性物质易溶于水,可以被其他物质所解离,也可
以在环境中得到稳定存在。
鲍林规则可以帮助人们更好地理解含氧酸的特征,也能够用于研究含
氧酸的性质,如其水溶性,酸度等。
其中,“鲍林规则”是一种化学途径,用于研究分子的化学结构的稳定度,可以提供有关含氧酸结构的
指导。
根据鲍林规则,含氧酸的稳定性会随着有机物的分子量的增加
而增强,而当碳原子被2至4个氧原子所限制时,能够形成最稳定的
羧基结构,这也是其能够和其他物质形成共价键的原因所在。
因此,
鲍林规则对于研究氧酸的结构特性具有重要的意义。