配位定习题课
- 格式:ppt
- 大小:450.51 KB
- 文档页数:37

第二章误差和分析数据处理1.指出下列各种误差是系统误差还是偶然误差?如果是系统误差,请区别方法误差、仪器和试剂误差或操作误差,并给出它们的减免办法。
(1)砝码受腐蚀;(2)天平的两臂不等长;(3)容量瓶与移液管未经校准;(4)在重量分析中,试样的非被测组分被共沉淀;(5)试剂含被测组分;(6)试样在称量过程中吸湿;(7)化学计量点不在指示剂的变色范围内;(8)读取滴定管读数时,最后一位数字估计不准;(9)在分光光度法测定中,波长指示器所示波长与实际波长不符。
(10)在HPLC测定中,待测组分峰与相邻杂质峰部分重叠。
答:(1)系统误差;校准砝码。
(2)系统误差;校准仪器。
(3)系统误差;校准仪器。
(4)系统误差;控制条件扣除共沉淀。
(5)系统误差;扣除试剂空白或将试剂进一步提纯。
(6)系统误差;在110℃左右干燥后称重。
(7)系统误差;重新选择指示剂。
(8)偶然误差;最后一位是估计值,因而估计不准产生偶然误差。
(9)系统误差;校准仪器。
(10)系统误差;重新选择分析条件。
2.表示样本精密度的统计量有哪些? 与平均偏差相比,标准偏差能更好地表示一组数据的离散程度,为什么?3.说明误差与偏差、准确度与精密度的区别和联系。
4.什么叫误差传递?为什么在测量过程中要尽量避免大误差环节?5.何谓t分布?它与正态分布有何关系?6.在进行有限量实验数据的统计检验时,如何正确选择置信水平?7.为什么统计检验的正确顺序是:先进行可疑数据的取舍,再进行F检验,在F检验通过后,才能进行t检验?8.说明双侧检验与单侧检验的区别,什么情况用前者或后者?9.何谓线性回归?相关系数的意义是什么?10.进行下述运算,并给出适当位数的有效数字。
(1)41016.614.1510.452.2⨯⨯⨯ (2)0001120.010.514.2101.3⨯⨯ (3)002034.0512.21003.40.514⨯⨯⨯- (4)050.11012.21.80324.02⨯⨯⨯(5)5462.31050.78940.142.551.22856.23-⨯⨯-+⨯(6) pH = 2.10 , 求[H +] = ?(2.54×10-3;2.98×106;4.02;53.0;3.144;7.9×10-3mol/L ) 11.两人测定同一标准试样,各得一组数据的偏差如下: (1)0.3 -0.2 -0.4 0.2 0.1 0.4 0.0 -0.3 0.2 -0.3 (2)0.10.1-0.60.2-0.1-0.20.5-0.20.30.1① 求两组数据的平均偏差和标准偏差;② 为什么两组数据计算出的平均偏差相等,而标准偏差不等?③ 哪组数据的精密度高? (①1d =0.24,2d =0.24,S l =0.28,S 2=0.31。

分析化学(第五版)课后习题答案第二章 误差及分析数据的统计处理3. 某矿石中钨的质量分数(%)测定结果为:20.39,20.41,20.43。
计算标准偏差s 及置信度为95%时的置信区间。
答:分析结果的平均值x =20.41%()()()()2412043204120412041203920122212......-+-+-=--=∑=n xxs ni i=0.02%n=3,置信度为95%时,t = 4.303,有μ=nts x ±= (20.410.05)%7. 有一标样,其标准值为0.123%,今用一新方法测定,得四次数据如下(%):0.112,0.118,0.115和0.119,判断新方法是否存在系统误差。
(置信度选95%) 答:x =0.116%,s=0.003%n=6,置信度为95%时,t = 3.182,有t 计算=n sx μ-=4003012301160⨯-...=4.667> t新方法存在系统误差,结果偏低。
11.按有效数字运算规则,计算下列各式: (1) 2.187×0.854 + 9.6×10-5 - 0.0326×0.00814; (2) 51.38/(8.709×0.09460);(3);(4)688103310161051---⨯⨯⨯⨯... 解:(1)1.868;(2)62.36;(3)705.2 ;(4)1.7×10-5。
第三章 滴定分析3.7. 计算下列溶液滴定度,以g·mL -1表示:(1) 以0.2015 mol·L -1HCl 溶液,用来测定Na 2CO 3,NH 3 (2) 以0.1896 mol·L -1NaOH 溶液,用来测定HNO 3,CH 3COOH 解: (1) 根据反应式Na 2CO 3 + 2HCl = H 2CO 3 + NaCl NH 3·H 2O + HCl = H 2O + NH 4 Cl 可以得到关系式 n Na 2CO 3 = HCl n 21, HCl NH n n =3, 所以=11000232-⋅⨯⨯L mL M c CO Na HCl =0.01068g/mL=110003-⋅⨯LmL M c NH HCl =0.003432g/mL(2) 根据NaOH 与HNO 3的反应可知 n NaOH =n HNO3 根据NaOH 与CH 3COOH 的反应可知 n NaOH =n CH3COOH所以=110003-⋅⨯LmL M c HNO NaOH = 0.01195g/mL ;=110003-⋅⨯L mL M c COOHCH NaOH = 0.01138g/mL3.8. 计算0.01135 mol·L -1HCl 溶液对CaO 的滴定度。

第六章配位滴定法计算pH=5时EDTA的酸效应系数αY(H)。
若此时EDTA各种存在形式的总浓度为·L-1,则[Y4-]为多少pH=5时,锌和EDTA配合物的条件稳定常数是多少假设Zn2+和EDTA的浓度皆为10-2 mol·L-1(不考虑羟基配位等副反应)。
pH=5时,能否用EDTA标准溶液滴定Zn2+假设Mg2+和EDTA的浓度皆为10-2 mol·L-1,在pH=6时,镁与EDTA配合物的条件稳定常数是多少(不考虑羟基配位等副反应)并说明在此pH条件下能否用EDTA 标准溶液滴定Mg2+。
如不能滴定,求其允许的最小pH。
试求以EDTA滴定浓度各为mol·L-1的Fe3+和Fe2+溶液时所允许的最小pH。
计算用mol·L-1 EDTA标准溶液滴定同浓度的Cu2+离子溶液时的适宜酸度范围。
称取0.1005g纯CaCO3溶解后,用容量瓶配成100mL溶液。
吸取25mL,在pH﹥12时,用钙指示剂指示终点,用EDTA标准溶液滴定,用去。
试计算:(1)EDTA溶液的浓度;(2)每毫升EDTA溶液相当于多少克ZnO和Fe2O3。
用配位滴定法测定氯化锌(ZnCl2)的含量。
称取0.2500g试样,溶于水后,稀释至250mL,吸取,在pH=5~6时,用二甲酚橙作指示剂,用mol·L-1 EDTA标准溶液滴定,用去。
试计算试样中含ZnCl2的质量分数。
称取1.032g氧化铝试样,溶解后移入250mL容量瓶,稀释至刻度。
吸取,加入T Al2O3=mL的EDTA标准溶液,以二甲酚橙为指示剂,用Zn(OAc)2标准溶液进行返滴定,至红紫色终点,消耗Zn(OAc)2标准溶液。
已知1mL Zn(OAc)2溶液相当于EDTA溶液。
求试样中Al2O3的质量分数。
用mol·L-1 EDTA标准溶液滴定水中钙和镁的含量,取水样,以铬黑T为指示剂,在pH=10时滴定,消耗EDTA 。
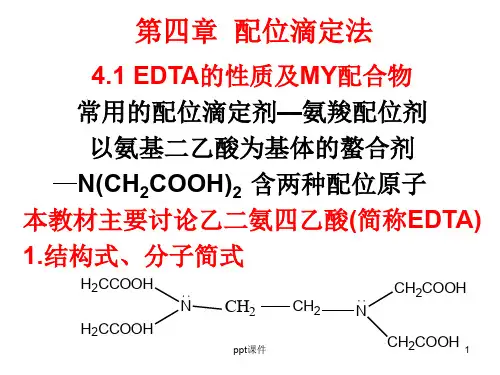

第六章 配位滴定法思考题与习题1.简答题:(1)何谓配位滴定法?配位滴定法对滴定反应有何要求?答:以配位反应为基础的地点分析方法称为配位滴定法。
配位滴定法要求配位反应按一定的反应式定量进行,且能进行完全;反应必须迅速;可以用适当的方法确定终点。
(2)EDTA 与其金属离子配合物的特点是什么?答:E DT A具有广泛的配位性能;EDTA 与金属离子配位时可生成的螯合物稳定性高,配位反应的完全程度高;E DTA 与金属离子形成配位化合物的配位比几乎均为1:1;ED TA 与金属离子形成的配合物大多能溶于水;配位反应迅速;EDTA 与无色离子形成的配合物也无色,便于用指示剂确定终点。
(3)配位滴定可行性的判断条件是什么?答:MYM K c lg ≥6 (4)配位滴定中可能发生的副反应有哪些?从理论上看,哪些对滴定分析有利?答:配位滴定副反应包括:EDTA 的酸效应,金属离子的水解效应,金属离子与其他配位剂的配位反应,干扰离子效应,配合物与氢离子、氢氧根离子的副反应等。
配合物与氢离子、氢氧根离子的副反应对滴定分析有利。
(5)何谓指示剂的封闭现象?怎样消除封闭?答:如果指示剂与某些金属离子形成的配位化合物极其稳定,以至于加入过量的滴定剂也不能将金属离子从金属-指示剂配合物中夺取出来,溶液在化学计量点附近就没有颜色变化,这种现象称为指示剂受到了封闭。
可加掩蔽剂消除指示剂的封闭现象。
(6)提高配位滴定选择性的条件与措施有哪些?答:1)控制酸度;2)分别采用配位掩蔽法、沉淀掩蔽法、氧化还原掩蔽法掩蔽干扰离子;3)分离干扰离子。
2.名词解释(1)酸效应答:由于H +的存在使配位剂参加主反应能力降低的现象。
(2)酸效应系数答:定量表示酸效应进行的程度的系数称为酸效应系数。
(3) 配位效应答:由于存在其他配位剂L 与金属离子M 配位使金属离子参加主反应能力降低的现象。
(4)配位效应系数答:定量表示配位效应进行的程度的系数称为配位效应系数。

一、单选题(共20小题)1.以EDTA为滴定剂,下列叙述中哪项是错误的()A.在酸度较高的溶液中,可能形成MHY络合物B.在碱度较高的溶液中,可能形成MOHY络合物C.不论形成MHY或MOHY均有利于滴定反应D.不论形成MHY或MOHY均不有利滴定反应2. 配位滴定中,关于EDTA的副反应系数αY(H)的说法中正确的是()A. αY(H)随酸度的减小而增大B. αY(H)随pH值增大而增大C. αY(H)随酸度增大而增大D. αY(H)与pH值的变化无关3. 在非缓冲溶液中用EDTA滴定金属离子时,溶液的pH值将()A. 与金属离子种类有关B. 降低C. 不变D. 升高4.以EDTA滴定同浓度的金属离子M,已经在滴定终点时∆pM'=±0.2,K'MY=109.0,若要求误差TE≤0.1%,则被测离子M的最低原始浓度是多少?A. 0.010 mol⋅L-1B. 0.020 mol⋅L-1C. 0.0010 mol⋅L-1D. 0.0020 mol⋅L-15. 当M与N离子共存时,欲以EDTA滴定其中的M离子,若C M=0.1C N,要准确滴定M(E≤0.1%,∆pM'=0.3)则要求△lgK(lgK MY-lgK NY)值至少大于()A. 6B. 5C. 7D. 46.当金属离子M、N共存时,欲以EDTA测定其中的M,若c M=10c N,E≤0.5%,∆pM'=±0.3,则要求∆lgK为多少:A. 5B. 6C. 4D. 77. 用EDTA滴定Bi3+时,可用于掩蔽Fe3+的掩蔽剂是()A. 三乙醇胺B. KCNC. 草酸D. 抗坏血酸8. 已知K CuY>K ZnY>K MgY。
EDTA的浓度采用锌作基准物标定。
若配制EDTA溶液中蒸馏水中含有少量Cu2+,并用该EDTA溶液在pH = 10的介质中滴定Mg2+,测定的结果将会()A. 不变B. 变大C. 变小D. 不确定9.采用滴定法测定Al3+的含量时,欲在pH=5.5条件下以某一金属离子的标准溶液滴定过量的EDTA,此金属离子标准溶液最好选用()A. Ca2+B. Zn2+C. Ag+D. Al3+10.Fe3+、Al3+、Mg2+和Ca2+混合溶液中,用EDTA测定Mg2+、Ca2+的含量时,为了消除Fe3+和Al3+(含量较高)的干扰,一般采用()A. 沉淀分离法B. 控制酸度法C. 络合掩蔽法D. 溶剂萃取法11.在pH=10时,以铬黑T为指示剂,用EDTA滴定Ca2+、Ma2+总量时,Al3+、Fe3+等的存在会使得指示剂失效,这种现象称为指示剂的()A. 僵化B. 封闭C. 变质D. 变性12.已知某金属指示剂(HR)的pKa=3.5,其共轭酸型体为紫红色,其共轭碱型体为亮黄色。

第三节 离子键、配位键与金属键 练习题学校:___________姓名:___________班级:___________考号:___________一、单选题1.下列关于溶液的说法正确的是A .透明的中性溶液中,能大量共存 334K Fe NO MnO ++--、、、B .84消毒液中通入少量:2SO 22232ClO SO H O 2HClO SO --++=+C .稀硫酸中逐滴加入等浓度溶液,溶液的导电性始终不变 2Ba(OH)D .向溶液中逐滴加入浓氨水,先有蓝色沉淀,最后得深蓝色溶液4CuSO 2.现代工艺冶金过程中会产生导致水污染的CN -,在碱性条件下,H 2O 2可将其转化为碳酸盐和一种无毒气体。
关于该转化反应,下列说法不正确的是A .氰化物有毒,CN -易与人体内的Fe 2+、Fe 3+形成配合物B .处理1molCN -,消耗2.5molH 2O 2C .反应中每转移10mol 电子生成22.4L 无毒气体D .用H 2O 2处理后的废水呈碱性,不可直接排放 3.下列说法正确的是A .基态氮原子的价电子排布图:B .甲醛(HCHO)和光气()分子中:键角2COCl H C H Cl C Cl ∠--<∠--C .四硼酸根离子(含B 、O 、H)的球棍模型如图,配位键存在于4、5和4、6原m X -子之间4.下列反应过程中无配合物形成的是 A .配制银氨溶液B .向澄清石灰水中通入过量 2COC .向溶液中滴加过量氨水 4CuSOD .向溶液中加入KSCN 溶液 3FeCl 5.下列有关说法错误的是A .晶体中,和之间通过静电作用形成离子键 2MgCl 2Mg +Cl -B .中氢原子与氯原子通过共用电子形成共价键 HClC .氨气是共价化合物,电子式为D .氯化钠是离子化合物,电子式为6.由于核外有空的d 轨道,可与一些配体形成配位数为6的配离子。
某同学用淡紫色的3Fe +晶体进行如下实验:()323Fe NO 9H O ⋅已知:为浅紫色,为红色,为无色。

习题第五章1. 酸度是指 H +的活度 ,常用 pH 表示;酸的浓度是指 酸的分析浓度 ,等于 c ,其单位用 mol/L 表示。
2. 根据酸碱质子理论,OH ‾ 的共轭酸是 H 2O ,HAc 的共轭酸是 H 2Ac + 。
3. 某弱酸H 2A 的pK a1 = 2.0,pK a2 = 5.0,当[H 2A] = [A 2-] 时,溶液的pH 值是 3.5 。
4. 浓度为C HAc (mol/L)的HAc 溶液中加入C HCl (mol/L)HCl 和C NaOH (mol/L)NaOH 后的质子 条件式是( D )A. [H +] + C HCl = [Ac -] + C NaOH + [OH -]B. [H +] = [Ac -] + C NaOH + C HCl + [OH -]C. [H +] + C NaOH + C HCl = [Ac -] + [OH -]D. [H +] + C NaOH = [Ac -] + [OH -] + C HCl5. 用0.1000 mol/L 的NaOH 滴定0.1000 mol/L 的HAc K a =1.7×10-5,化学计量点的pH 值是( A )。
A. 8.73B. 5.27C. 7.00D. 9.006.用0.1mol/L HCl 滴定0.1mol/L NaOH 时的pH 突跃范围是9.7~4.3,用0.01mol/L HCl 滴定0.01mol/L NaOH 的突跃范围是( C )A. 9.7~4.3B. 8.7~4.3C. 8.7~5.3D. 10.7~3.37. 用0.100 mol/L HCl 滴定同浓度NH 3溶液(pK b = 4.74)时,pH 突跃范围为6.3~4.3。
若用0.100 mol/L HCl 滴定同浓度的某碱液B (pK b = 3.74)时,pH 突跃范围为 7.3~4.3 。
8. 通常以_cK a ≥10-8 _作为判断一元弱酸能否直接进行准确滴定的条件。


习题课试题一、选择题1、下列有关随机误差的论述中,正确的是()A、在消除了随机误差后,总体平均值就是真值。
B、随机误差具有单向性。
C、随机误差是定量分析中主要的误差来源。
D、随机误差在定量分析中是不可避免的。
2、用Na2CO3作基准物质标定HCl时,如Na2CO3含有少量NaHCO3,则使标出的HCl浓度()A、偏高B、偏低C、视使用的指示剂而定D、无影响3、滴定分析要求相对误差为±0.1%,若称取试样的绝对误差为0.0002g,则一般至少称取试样为()A、0.1gB、0.2gC、0.3gD、0.4g4、实验室两位新分析人员对同一样品进行分析,得到两组分析结果。
考察两组结果的精密度是否存在显著性差异,应采用的检验方法是()A、t检验法B、Q检验法C、T检验法D、F检验法5、已知H3PO4的pKa1、pKa2、pKa3分别是2.12、7.20、12.36,则PO43 -的pKb 为()A、11.88B、6.80C、1.64D、2.126、有一瓶化学试剂的标签为红色,其英文字母的缩写为()A、G.R.B、A.R.C、C.P.D、B.R.7、用双指示剂法测定某含有NaOH或NaHCO3或Na2CO3或某任意混合物样品,若V2>V1>0,则溶液的组成为()A、NaOHB、NaHCO3 +Na2CO3C、NaHCO3D、NaOH +Na2CO38、下列计算结果应以几位有效数字报出()1000 0359.22143.24652.214508.251001.0⨯⨯⨯-⨯)(A、六位B、五位C、四位D、三位9、EDTA与金属离子生成螯合物时,其螯合比一般为()A、1:1B、1:2C、1:4D、1:610、当M与Y反应时,溶液中有另一配位剂L存在,若αM(L)=1时表示( )A、M与L没有副反应B、M与L有较大的副反应C、M无副反应D、[M’] ≠[M]11、在pH=10.0的氨性溶液中,已计算出αZn(NH3)=105.49,αY(H)=100.45;则在此条件下,lgK ZnY’为()(已知:lgK ZnY=16.50)A、11.01B、16.00C、10.56D、22.4912、在金属离子M和N等浓度的混合液中,以HIn为指示剂,用EDTA标准溶液直接准确滴定其中的M离子(TE%≤0.1%),要求()A、pH=-lgK MY’B、K MY’<K MIn’C、lgK MY-lgK NY≥6D、NIn与MIn的颜色有显著的差别13、电极电位对判断氧化还原反应的性质很有用,但它不能判别()A、氧化还原反应的速率B、氧化还原反应的方向C、氧化还原能力大小D、氧化还原的完全程度14、在氧化还原滴定中,如m=n=2,要使化学计量点时反应的完全程度达到99.9%,两个电对的标准电位的最小差值为()A、0.354VB、0.266VC、0.177VD、0.148V15、用EDTA滴定Ca2+、Mg2+,若溶液中存在少量Fe3+和Al3+将对测定有干扰,消除干扰的方法是()A、加KCN掩蔽Fe3+,加NaF掩蔽Al3+B、加抗坏血酸将Fe3+还原为Fe2+,加NaF掩蔽Al3+C、采用沉淀掩蔽法,加NaOH沉淀Fe3+和Al3+D、在酸性条件下,加入三乙醇胺,再调到碱性以掩蔽Fe3+和Al3+二、填空题1、在滴定分析中所用的标准溶液浓度不必过大,其原因是;也不必过小,其原因是。

复习提纲:第六章 配位滴定法1. 配位滴定法概述配位反应的定义及相关术语(掌握);无机配位剂的特点,逐级稳定常数K ,累计稳定常数β,各级配合物的型体分布公式及优势型体的判断(掌握);有机配位剂的特点,乙二胺四乙酸的特点及其标准溶液的配制及注意事项(掌握) 2. 副反应及条件稳定常数副反应系数及条件稳定常数的计算(掌握) 3. 配位滴定曲线滴定曲线的横纵坐标;sp 时:[ M ' ]=[ Y ' ]=()'MY sp K /M c ;[ M ]≠[ Y ](掌握)影响配位滴定突跃的因素(与强碱滴定弱酸相似)及配位滴定可行性条件(掌握); 最高允许酸度和最低允许酸度的计算(掌握);辅助络合剂的作用(掌握) 4. 金属指示剂作用原理、基本要求及适用pH 范围的确定(掌握);指示剂变色点等相关内容(了解);配位滴定中控制pH 的目的及使用缓冲液的原因(了解);间接指示剂的原理(掌握);指示剂使用时的注意事项(掌握)5. 混合离子的选择性测定控制酸度法:∆lgK+∆lgc ≥6 (E t ≤0.1%,∆pM '=±0.2);∆lgK+∆lgc ≥5 (E t ≤0.3%,∆pM '=±0.2)(掌握);配位、沉淀、氧化还原掩蔽法和其他氨酸配位剂(掌握课件的例子)6. 配位滴定的方式及应用 直接滴定、返滴定、置换滴定和间接滴定(掌握课件的例子)一、单选题(共20小题)1. 以EDTA 为滴定剂,下列叙述中哪项是错误的( )A.在酸度较高的溶液中,可能形成MHY 络合物B.在碱度较高的溶液中,可能形成MOHY 络合物C.不论形成MHY 或MOHY 均有利于滴定反应D.不论形成MHY 或MOHY 均不有利滴定反应2. 配位滴定中,关于EDTA 的副反应系数αY(H)的说法中正确的是( ) A. αY(H)随酸度的减小而增大 B. αY(H)随pH 值增大而增大 C. αY(H)随酸度增大而增大D. αY(H)与pH 值的变化无关3. 在非缓冲溶液中用EDTA 滴定金属离子时,溶液的pH 值将( ) A. 与金属离子种类有关B. 降低C. 不变D. 升高4. 以EDTA 滴定同浓度的金属离子M ,已经在滴定终点时∆pM '=±0.2,K 'MY =109.0,若要求误差TE ≤0.1%,则被测离子M 的最低原始浓度是多少? A. 0.010 mol ⋅L -1B. 0.020 mol ⋅L -1C. 0.0010 mol ⋅L -1D. 0.0020 mol ⋅L -15. 当M 与N 离子共存时,欲以EDTA 滴定其中的M 离子,若c M =0.1c N ,要准确滴定M (E ≤0.1%,∆pM '=0.2)则要求△lgK (lgK MY -lgK NY )值至少大于( ) A. 6B. 5C. 7D. 46.当金属离子M 、N 共存时,欲以EDTA 测定其中的M ,若c M =10c N ,E ≤0.3%,∆pM '=±0.2,则要求∆lgK 为多少: A. 5B. 6C. 4D. 77. 用EDTA 滴定Bi 3+时,可用于掩蔽Fe 3+的掩蔽剂是( ) A. 三乙醇胺B. KCNC. 草酸D. 抗坏血酸8. 已知K CuY >K ZnY >K MgY 。
配位化学答案【篇一:配位化学补充习题及答案】1. 画出下列配合物和配合离子的几何结构: (a) [pt(en)2]2+;(b) 顺-二水二草酸合铁(iii)离子; (c) 反-二氯二联吡啶;(d) 四碘合汞(ii)离子;(e) [mo(en)3]3+;(f) 五氨一氯合钒(ii)离子;(g) 顺-二氨二硫氰酸根合钯(ii)。
2. co(nh3)5(so4)br有两种异构体,一种为红色,另一种为紫色。
两种异构体都可溶于水形成两种离子。
红色异构体的水溶液在加入agno3后生成agbr沉淀,但在加入bacl2后没有baso4沉淀。
而紫色异构体具有相反的性质。
根据上述信息,写出两种异构体的结构表达式。
3. 某一锰的配合物是从溴化钾和草酸阴离子的水溶液中获得的。
经纯化并分析,发现其中含有(质量比)0.0% 锰,28.6% 钾,8.8% 碳和29.2% 溴。
配合物的其它成分是氧。
该配合物水溶液的电导性与等摩尔浓度的k4[fe(cn)6]相同。
写出该配合物的化学式,用方括号表示配位内界。
4. 下列化合物中,中心金属原子的配位数是多少?中心原子(或离子)以什么杂化态成键?分子或离子的空间构型是什么? ni(en)2cl2 ,fe(co)5 , [co(nh3)6]so4, na[co(edta)].5. 硫酸亚硝酸根五氨合钴(iii)的化学式是(1)___________;(nh4)3[crcl2(scn)4]的学名是(2)____________;6 判断题:( (1)配位键都是由金属离子接受电子对形成的;(2)多数配离子能存在于水溶液中;(3)含两个配位原子的配体称螯合体;(4)通常情况下外轨型配合物的配位原子比内轨型配合物的配位原子的电负性大。
7. 选择题:(1)下列说法正确的是()。
(a)只有金属离子才能作为配合物的形成体; (b)配位体的数目就是形成体的配位数; (c)配离子的电荷数等于中心离子的电荷数;(d)配离子的几何构型取决于中心离子所采用的杂化轨道类型。
无机及分析化学第三次习题课习题一、物质结构基础1、下列四种电子构型的元素中,其离子状态在水溶液中呈无色的是(D)(A)2、8、18、1 (B)2、8、14、2 (C)2、8、16、2 (D)2、8、18、2 2、在下列所示的电子排布中,哪些是激发态原子(BC),哪些是不存在的(E)。
(A)1s22s22p6 (B) 1s22s23s1 (C) 1s22s14d1(D)1s22s22p63s1(E) 1s22s22p52d13s13、屏蔽效应起着(B)(A)对核电荷的增强作用(B)对核电荷的抵消作用(C)正负离子间的吸引作用(D)正负离子间电子层的排斥作用4、已知当氢原子的一个电子从第二能级跃迁至第一级时,发射出光子的波长是121.6nm,可计算出氢原子中电子的第二能级与第一能级的能量差应为(A)(A)1.63×10-18J (B)3.26×10-18J(C)4.08×10-19J (D)8.15×10-19J5、说明电子运动时确有波动性的著名实验是(D)(A)阴极射线管中产生的阴极射线(B)光电效应(C)α粒子散射实验(D)戴维逊—盖革的电子衍射实验6、镧系元素都有同样的6s2电子构型,但它们在(D)填充程度不同。
(A)6p能级(B)5d能级(C )4d能级(D)4f能级7、A原子基态的电子排布为[Kr]4d105s25p1,它在周期表中位于(B),B原子基态的电子排布为[Kr]4d105s1,它在周期表中位于(E),C原子基态的电子排布为[Ar]3d74s2,它在周期表中位于(D)(A)s区IA (B)p区III A (C)d区ⅥB (D)d区ⅧB(E)ds区IB (F)p区V A8、He+离子中3s、3p、3d、4s轨道能量关系为(D)(A)3s<3p<3d<4s (B)3s<3p<4s<3d(C)3s=3p=3d=4s (D)3s=3p=3d<4s9、量子数n=3,m=0时,可允许的最多电子数为(B)(A)2 (B)6 (C)8 (D)1610、价电子构型为4d105s1的元素,其原子序数为(D)(A)19 (B)29 (C)37 (D)4711、某原子在第三电子层中有10个电子,其电子构型为(C)(A)[Ne]3s23p33d54s2 (B)[Ne]3s23p63d104s2(C)[Ne]3s23p63d24s2 (D)[Ne]3s23p64s212、3d电子的径向分布函数图有(A)(A)1个峰(B)2个峰(C)3个峰(D)4个峰13、下列物质在水溶液中溶解最小的是(D)(A)NaCl (B)AgCl (C)CaS (D)Ag2S14、下列化合物熔点高低顺序为(C)(A)SiO2>HCl>HF (B)HCl>HF>SiO2(C)SiO2>HF>HCl (D)HF> SiO2>HCl15、下列微粒半径由大到小的顺序是(A)(A)Cl-、K+、Ca2+、Na+(B)Cl-、Ca2+、K+、Na+(C )Na +、K +、Ca 2+、Cl - (D )K +、Ca 2+、Cl -、Na +16、在下列化合物中,( C )不具有孤对电子。
配位滴定法习题1.计算pH5时,EDTA的酸效应系数及对数值,若此时EDTA各种型体总浓度为0.02mol/L,求[Y4 -]2. 在0.10mol/L的AL3+溶液中,加入F-形成ALF63-,如反应达平衡后,溶液中的F-浓度为0.01mol/L,求游离AL3+的浓度?3.在pH=11.0的Zn2+-氨溶液中,[NH3]= 0.10mol/L,求αM4.计算pH=2和pH=5时,ZnY的条件稳定常数5.计算pH=5的0.1mol/L的ALF63-溶液中,含有0.01mol/L游离F-时,AL Y-条件稳定常数6.在NH3-NH4CL缓冲溶液中(pH=9),用EDTA滴定Zn2+,若[NH3]=0.10mol/L,并避免生成Zn(OH) 2沉淀,计算此条件下的lgK’ZnY7.EBT为有机弱酸,其Ka1=10-6.3,Ka2=10-11.6,Mg-EBT络合物的稳定常数KMg-EBT =107.0,Mg-EDTA的稳定常数KMg-EDTA=108.64。
当pH=10.0时(1)求Mg-EBT络合物的条件稳定常数?(2)用方程式表明EDTA滴定镁时,铬黑T指示剂的作用原理。
8.铬黑T与Mg2+的配合物的lgKMgIn为7.0,铬黑T的累计常数的对数值为lgβ1=11.6和lgβ2=17.9,试计算pH=10.0时铬黑T的pMgt值。
9.在pH=10的氨性缓冲溶液中,[NH3]=0.2mol/L,以2.0×10-2mol/L的EDTA滴定2.0×10-2mol/L的Cu2+溶液,计算化学计量点时的pCu’。
如被滴定的是2.0×10-2mol/L的Mg2+溶液,计算化学计量点时的pMg’。
10.在pH10.0的氨性溶液中,用0.020mol/L的EDTA滴定同样浓度的Mg2+,计算以铬黑T 为指示剂滴定到变色点pMgt时的TE%为多少?11.在pH=10.00的氨性缓冲溶液中,以EBT为指示剂,用0.020mol/L的EDTA滴定0.020mol/L 的Zn2+,终点时游离氨的浓度为0.20mol/L,计算终点误差。
分析化学(第五版)课后习题答案第二章 误差及分析数据的统计处理3. 某矿石中钨的质量分数(%)测定结果为:20.39,20.41,20.43。
计算标准偏差s 及置信度为95%时的置信区间。
答:分析结果的平均值x =20.41%()()()()2412043204120412041203920122212......-+-+-=--=∑=n xxs ni i=0.02%n=3,置信度为95%时,t = 4.303,有μ=nts x ±= (20.410.05)%7. 有一标样,其标准值为0.123%,今用一新方法测定,得四次数据如下(%):0.112,0.118,0.115和0.119,判断新方法是否存在系统误差。
(置信度选95%) 答:x =0.116%,s=0.003%n=6,置信度为95%时,t = 3.182,有t 计算=n sx μ-=4003012301160⨯-...=4.667> t新方法存在系统误差,结果偏低。
11.按有效数字运算规则,计算下列各式: (1) 2.187×0.854 + 9.6×10-5 - 0.0326×0.00814; (2) 51.38/(8.709×0.09460);(3);(4) 688103310161051---⨯⨯⨯⨯... 解:(1)1.868;(2)62.36;(3)705.2 ;(4)1.7×10-5。
第三章 滴定分析3.7. 计算下列溶液滴定度,以g·mL -1表示:(1) 以0.2015 mol·L -1HCl 溶液,用来测定Na 2CO 3,NH 3 (2) 以0.1896 mol·L -1NaOH 溶液,用来测定HNO 3,CH 3COOH 解: (1) 根据反应式Na 2CO 3 + 2HCl = H 2CO 3 + NaCl NH 3·H 2O + HCl = H 2O + NH 4 Cl 可以得到关系式n Na 2CO 3 = HCl n 21, HCl NH n n =3,所以=11000232-⋅⨯⨯L mL M c CO Na HCl =0.01068g/mL=110003-⋅⨯LmL M c NH HCl =0.003432g/mL(2) 根据NaOH 与HNO 3的反应可知 n NaOH =n HNO3 根据NaOH 与CH 3COOH 的反应可知 n NaOH =n CH3COOH 所以=110003-⋅⨯LmL M c HNO NaOH = 0.01195g/mL ;=110003-⋅⨯L mL M c COOHCH NaOH = 0.01138g/mL3.8. 计算0.01135 mol·L -1HCl 溶液对CaO 的滴定度。
配位滴定法课后练习题及参考答案配位滴定法课后练习题及参考答案一、选择题1.直接与金属离子配位的EDTA型体为()(A)H6Y2+ (B)H4Y(C)H2Y2-(D)Y4-2.一般情况下,EDTA与金属离子形成的络合物的络合比是()(A)1:1 (B)2:1 (C)1:3 (D)1:23.铝盐药物的测定常用配位滴定法。
加入过量EDTA,加热煮沸片刻后,再用标准锌溶液滴定。
该滴定方式是()。
(A)直接滴定法(B)置换滴定法(C)返滴定法(D)间接滴定法4.αM(L)=1表示()(A)M与L没有副反应(B)M与L的副反应相当严重(C)M的副反应较小(D)[M]=[L]5.以下表达式中正确的是()(A)>(B)>(C)>(D)>6.用EDTA直接滴定有色金属离子M,终点所呈现的颜色是()(A)游离指示剂的颜色(B)EDTA-M络合物的颜色(C)指示剂-M络合物的颜色(D)上述A+B的混合色7.配位滴定中,指示剂的封闭现象是由()引起的(A)指示剂与金属离子生成的络合物不稳定(B)被测溶液的酸度过高(C)指示剂与金属离子生成的络合物翁定性小于MY的稳定性(D)指示剂与金属离子生成的络合物稳定性大于MY的稳定性8.下列叙述中错误的是()(A)酸效应使络合物的稳定性降低(B)共存离子使络合物的稳定性降低(C)配位效应使络合物的稳定性降低(D)各种副反应均使络合物的稳定性降低9.用Zn2+标准溶液标定EDTA时,体系中加入六次甲基四胺的目的是()(A)中和过多的酸(B)调节pH值(C)控制溶液的酸度(D)起掩蔽作用10.在配位滴定中,直接滴定法的条件包括( )≤8 (B)溶液中无干扰离子(A)>(C)有变色敏锐无封闭作用的指示剂(D)反应在酸性溶液中进行11.测定水中钙硬时,Mg2+的干扰用的是( )消除的。
(A)控制酸度法(B)配位掩蔽法(C)氧化还原掩蔽法(D)沉淀掩蔽法12.配位滴定中加入缓冲溶液的原因是()(A)EDTA配位能力与酸度有关(B)金属指示剂有其使用的酸度范围(C)EDTA与金属离子反应过程中会释放出H+>(D)会随酸度改变而改变>13.产生金属指示剂的僵化现象是因为()(A)指示剂不稳定(B)MIn溶解度小(C)KˊMIn < KˊMY (D)KˊMIn >KˊMY14.已知M=81.38g/mol,用它来标定0.02mol的EDTA溶液,宜称取ZnO为()ZnO(A)4g(B)1g (C)0.4g (D)0.04g15.某溶液主要含有Ca2+、Mg2+及少量Al3+、Fe3+,今在pH=10时加入三乙醇胺后,用EDTA滴定,用铬黑T为指示剂,则测出的是( )(A)Mg2+的含量(B)Ca2+、Mg2+的含量(C)Al3+、Fe3+的含量(D) Ca2+、Mg2+、Al3+、Fe3+的含量二、填空题1.EDTA是()的英文缩写,配制EDTA标准溶液时,常用()。
武汉大学版无机化学课后习题答案(第三版)第13章配位化学原理配位化学基础1.某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3亦不产生沉淀,以强碱处理并没有NH3放出,写出它的配位化学式。
解[Pt(NH3)2Cl4]2.下列化合物中哪些是配合物?哪些是螯合物?哪些是复盐?哪些是简单盐?(1)CuSO4·5H2O(2)K2PtCl6(3)Co(NH3)6Cl3(4)Ni(en)2Cl2(5)(NH4)2SO4·FeSO4·6H2O(6)Cu(NH2CH2COO)2(7)Cu (OOCCH3)2(8)KCl·MgCl2·6H2O解配合物:K2PtCl6,Co(NH3)6Cl3,CuSO4·5H2O螯合物:Ni(en)2Cl2,Cu(NH2CH2COO)2复盐:(NH4)2SO4·FeSO4·6H2OKCl·MgCl2·6H2O简单盐:Cu(OOCH3)23.命名下列各配合物和配离子:(1)(NH4)3[SbCl6](2)Li[AlH4](3)[Co(en)3]Cl3(4)[Co(H2O)4Cl2]Cl(5)[Cr(H2O)4Br2]Br·2H2O(6)[Cr(H2O)(en)(C2O4)(OH)(7)Co(NO2)6]3-(8)[Co(NH3)4(NO2)C]+(9)[Cr(Py)2(H2O)Cl3](10)[Ni(NH3)2(C2O4)]解(1)六氯合锑(III)酸铵(2)四氢合铝(III)酸锂(3)三氯化三(乙二胺)合钴(III)(4)氯化二氯·四水合钴(III)(5)二水合溴化二溴·四水合钴(III)(6)羟·水·草酸根·乙二胺合铬(III)(7)六硝基合钴(III)配阴离子(8)氯·硝基·四氨合钴(III)配阳离子(9)三氯·水·二吡啶合铬(III)(10)二氨·草酸根合镍(II)4.指出下列配合物的空间构型并画出它们可能存在的立体异构体:(1)[Pt(NH3)2(NO2)Cl](2)Pt(Py)(NH3)ClBr](3)Pt(NH3)2(OH)2Cl2](4)NH4[Co(NH3)2(NO2)4](5)[Co(NH3)3(OH)3](6)[Ni(NH3)2Cl2](7)[Cr(en)2(SCN)2]SCN(8)[Co(en)3]Cl3(9)[Co(NH3)(en)Cl3](10)[Co(en)2(NO2)2]Cl2解(1)[Pt(NH3)2(NO2)Cl]平面正方形2种异构体H3NNO2H3NNO2PtPtH3NClH3NCl(2)[Pt(Py)(NH3)ClBr]平面正方形3种异构体ClPyClNH3PtPtBrNH3BrPyClNH3PtPyBr(3)[Pt(NH3)2(OH)2Cl2]八面体5种异构体NH3NH3NH3HOClClNH3HOClClOHClOHHONH3NH3OHNH3OHClClNH3HONH3ClNH3HONH3OHCl(4)[Co(NH3)2(NO2)4]-八面体2种异构体NH3NH3O2NNO2O2NNH3O2NNO2O2NNO2NH3NO2(5)[Co(NH3)3(OH)3]八面体2种异构体OHOHHN3OHH3NOHH3NOHH3NNH3NH3OH(6)[Ni(NH3)2Cl2]四面体无异构体(7)[Cr(en)2(SCN)2]SCN[Cr(en)2(SCN)2]-八面体2种异构体SCNSCNNCSenenenSCNen(8)[Co(en)3]Cl3[Co(en)3]3+八面体2种异构体(9)[Co(NH3)(en)Cl3]八面体2种异构体(10)[Co(en)2(NO2)2]Cl2[Co(en)2(NO2)2]2+八面体2种异构体5.某金属离子在八面体弱场中的磁距为4.90B.M。