01【课堂笔记】《蛋白质与酶工程》-酶的分离与纯化02部分
- 格式:pdf
- 大小:432.87 KB
- 文档页数:5

蛋白质和酶的分离纯化及鉴定蛋白质是生命体中的重要物质基础之一。
从分子水平上认识生命现象,已成为现代生物学发展的主要方向。
要研究蛋白质,首先要得到高度纯化的目的蛋白。
蛋白质在组织或细胞中一般都是以复杂的混合物形式存在,每种类型的细胞都含有上千种不同的蛋白质。
要想从成千上万种蛋白质混合物中纯化出目的蛋白,就要根据蛋白质的理化性质不同设计出合理的分离方法。
目前研究为止酶除核酶外本质都是蛋白质,因此酶的分离纯化方法基本是采用蛋白质的分离纯化方法,但是酶的活性受到多种因素的影响,因此酶的分离纯化比一般的蛋白质要求更高。
一、质分离纯化的一般原则1. 原料的选择原则:来源方便,成本低,易操作、安全的原料。
蛋白分布:体液、组织、细胞定位2. 破碎方法:(1) 机械方法:通过机械运动产生的剪切力的作用,使细胞或组织破碎的方法。
如:捣碎法、研磨、匀桨法(2) 物理方法:通过温度、压力、声波等各种物理因素的作用,使组织细胞破碎的方法。
如:反复冻融、渗透压、超声破碎(3) 化学方法:通过各种化学试剂对细胞膜的作用,使细胞破碎的方法.如:甲苯、丙酮、氯仿和非离子型的表面活性剂(Triton和Tween)(4) 酶促法:溶菌酶、蜗牛酶等3. 目的蛋白或酶的特异、快速、精确的定性或定量方法4. 先粗后细,分级分离粗分:将得到的蛋白溶液先利用简单、快速、易处理的方法除去大部分杂蛋白。
如: 盐析、离心、有机溶剂沉淀等。
精制:利用蛋白质性质的差异,采用不同的方法,如:离子交换层析、分子筛、吸附层析、亲和层析、电泳、离心、结晶等方法进一步纯化。
5. 避免蛋白质的变性(pH、适合的温度和缓冲体系等)二、常用的蛋白质的分离纯化技术可以根据各种蛋白质的结构、理化性质不同设计分离方法。
(一)根据蛋白质的溶解度不同进行分离1. 蛋白质盐析蛋白质属于生物大分子之一,分子量从1万至100万之巨,其分子的直径可达1-100nm,为胶粒范围之内。
蛋白质的表面电荷和水化膜是其主要的稳定性因素。

蛋白质与酶的分离与纯化摘要本文主要介绍蛋白质与酶的分离与纯化方法,包括一些常用的技术和步骤。
首先介绍蛋白质和酶的定义和特性,然后探讨蛋白质与酶分离和纯化的重要性。
接着分析了三种常用的分离与纯化方法,包括盐析、层析和电泳。
最后总结了每种方法的特点和适用范围,并对未来的研究方向进行了展望。
1. 引言蛋白质和酶是生物体内最重要的分子之一,参与了生命体的许多重要生物学过程。
为了研究和了解蛋白质和酶的功能和结构,分离和纯化方法至关重要。
2. 蛋白质与酶的定义和特性蛋白质是由氨基酸残基组成的大分子化合物,具有多种功能,如催化反应、传递信号和提供结构支持等。
酶是一类特殊的蛋白质,能够催化生物体内的化学反应。
3. 蛋白质与酶分离和纯化的重要性蛋白质与酶的分离和纯化是研究其功能、结构和性质的基础。
只有纯化后的蛋白质和酶才能够进行进一步的研究和分析。
4. 盐析方法盐析是利用蛋白质和酶与盐的相互作用进行分离的方法。
通过控制溶液中的盐浓度,可以使蛋白质和酶从溶液中沉淀出来。
5. 层析方法层析是利用分离剂在固定的层析材料上进行分离的方法。
根据蛋白质和酶的性质和大小,可以选择不同类型的层析材料进行分离。
6. 电泳方法电泳是利用蛋白质和酶在电场中的迁移率差异进行分离的方法。
根据蛋白质和酶的电荷、大小和形状等特性,可以选择不同类型的电泳方法进行分离与纯化。
7. 方法比较与应用盐析、层析和电泳方法各有其优势和适用范围。
根据具体的实验目的和条件,可以选择合适的方法进行蛋白质与酶的分离与纯化。
8. 未来展望随着科学技术的不断发展,蛋白质与酶的分离与纯化方法也在不断改进和创新。
未来的研究方向包括开发更高效、更精确的方法和技术,以及应用新的纯化剂和材料等。
结论蛋白质与酶的分离与纯化是研究其结构和功能的基础,对于深入理解生物体内重要的生物学过程具有重要意义。
盐析、层析和电泳等方法可以有效地分离和纯化蛋白质与酶,并根据实验的需要选择合适的方法。

1、易错PCR:通过调整反应条件来使PCR扩增过程中复制错配率增加,在目的基因中随机引入突变,继而获得蛋白质分子的随机突变体* 提高镁离子浓度或加入锰离子* 降低体系中一种的dNTP浓度(至少5-10%)* 运用低保真度DNA聚合酶* 增加DNA聚合酶的浓度属于无性进化:单一基因内进行遗传突变,费力、耗时,多用于小片段(800bp以下)2、酶的概念:酶是一类由活细胞产生的,对其特异底物(substrate)具有高效催化作用的生大分子,包括蛋白质和核酸3、辅酶 :与酶蛋白结合疏松,可用透析或超滤的方法除去(NAD+)。
辅基 :与酶蛋白结合紧密,不能用透析或超滤的方法除去(FAD、FMN)酶的活性中心:或称活性部位,指必需基团在空间结构上彼此靠近,组成具有特定空间结构的区域,能与底物特异结合并将底物转化为产物。
4、抗体酶或催化抗体:是具有催化功能的抗体。
本质:免疫球蛋白,即具有催化作用的免疫球蛋白5、酶促反应特点:①酶促反应具有极高的效率②酶促反应具有高度的特异性:绝对特异性、相对特异性、立体结构特异性③酶促反应的可调节性:对酶量的调节,对酶活性的调节6、诱导契合假说:酶与底物相互接近时,其结构相互诱导、相互变形和相互适应,进而相互结合。
这一过程称为酶-底物结合的诱导契合假说。
7、底物浓度对反应速度的影响:①当底物浓度较低时:反应速度与底物浓度成正比;反应为一级反应。
②随着底物浓度的增加:反应速度不再成正比例加速;反应为混合级反应。
③当底物浓度高达一定程度:反应速度不再增加,达最大速度;反应为零级反应8、Km与Vmax的意义9、不可逆性抑制作用:抑制剂通常以共价键与酶活性中心或活性中心以外的必需基团相结合,使酶失活。
可逆性抑制作用:抑制剂通常以非共价键与酶或酶-底物复合物可逆性结合,使酶的活性降低或丧失;抑制剂可用透析、超滤等方法除去。
类型:竞争性抑制、非竞争性抑制、反竞争性抑制。
三种抑制剂的特点10、酶的调节:酶活性的调节(快速调节)①酶原与酶原的激活②变构(別构)酶③酶的共价修饰调节酶含量的调节(缓慢调节)①酶蛋白合成的诱导和阻遏②酶降解的调控11、酶原激活的意义避免细胞产生的酶对细胞进行自身消化,并使酶在特定的部位和环境中发挥作用,保证体内代谢正常进行。



第一章酶的分离提取与纯化1.1离心分离和层析分离1.1.1酶的提取方法离心是利用离心机旋转所产生的的离心力以及物质的沉降系数或浮力密度的差异,进行分离浓缩和提纯生物样品的一种方法。
离心分离时,要根据待分离物质以及杂志的颗粒大小、密度和特性的不同,选择适当的离心机、离心方法和离心条件。
1.1.1.1离心机的种类与用途常速离心机,高速离心机,超速离心机1)常速离心机:转速<8000r/min用途:分离细胞、细胞碎片、培养基残渣及粗结晶等较大颗粒2)高速离心机:转速:1~2.5*104r/min用途:分离各种沉淀物、细胞碎片及较大的细胞器3)超速离心机:转速:2.5~12*104r/min用途:用于DNA、RNA、蛋白质等生物大分子以及细胞器、病毒的分离纯化1.1.1.2离心方法差速离心,密度梯度离心,等密度梯度离心1)差速离心:原理:是采用不同的离心速度和离心时间,是沉降速度不同的颗粒分不分离的方法。
用途:分离沉降系数相差较大的蛋白质分子2)密度梯度离心原理:不同颗粒之间存在沉降系数差时,在一定离心力作用下,颗粒各自以一定速度沉降,在密度梯度不同区域上形成区带的方法。
常用介质:蔗糖、甘油3)等密度梯度离心:原理:当待分离的不同颗粒的密度范围在离心介质的密度梯度范围内时,不同浮力密度的颗粒在离心力作用下一直移动到与各自浮力密度相等的位置,形成区带。
介质:铯盐1.1.1.3层析分离技术又称色谱技术,是一种物理的分离方法。
利用混合物中的各组分的物理化学性质(分子的大小和形状,分子极性,吸附力,分子亲和力)的不同,使各组分以不同的程度分布在两个相中,其中一个相为固定的(固定相),另一个相则流过固定相(流动相)并使各组分以不同速度一定,从而达到分离根据分离原理分类吸附层析、分配层析、离子交换层析、凝胶层析和亲和层析等1)吸附层析原理:是利用吸附剂对不同物质的吸附力不同,而使混合物中各组分分离的方法。
2)分配层析原理:在一个有两相同时存在的溶剂系统中,根据不同物质的分配系数不同而达到分离目的的一种层析技术。




《食品生物技术》课程笔记第一章:绪论一、食品生物技术的基本概念1. 定义:食品生物技术是指应用生物学、分子生物学、生物化学、微生物学、遗传学等生命科学的基本原理,结合工程学、信息学等学科的方法,对食品原料、生产过程、产品进行科学研究和工程技术改造的技术领域。
2. 范围:食品生物技术的研究和应用范围广泛,主要包括以下几个方面:- 基因工程:通过基因克隆、基因转移等技术,对食品生物的遗传特性进行改造。
- 细胞工程:利用细胞培养、细胞融合等技术,进行细胞水平的操作和改造。
- 蛋白质工程:设计和改造蛋白质,提高其功能性和稳定性。
- 酶工程:研究和应用酶在食品加工中的作用,提高酶的效率和稳定性。
- 发酵工程:利用微生物发酵生产食品和食品添加剂。
3. 特点:- 科学性:基于严谨的科学原理和方法。
- 创新性:不断推动食品产业的技术创新。
- 安全性:关注食品安全,确保生物技术产品的安全性。
- 环保性:减少污染,提高资源利用效率。
二、传统食品生物技术与现代食品生物技术1. 传统食品生物技术:传统食品生物技术主要包括自然发酵、选种育种、食品加工等基于经验的技术。
这些技术历史悠久,但通常生产效率较低,产品品质不稳定。
2. 现代食品生物技术:现代食品生物技术以分子生物学为基础,采用基因工程、细胞工程、蛋白质工程等高新技术,具有以下特点:- 高效性:能够大幅度提高食品生产效率。
- 精确性:能够精确改造生物体的特定性状。
- 可控性:能够实现对生产过程的精确控制。
3. 差异与发展:- 技术层面:传统技术依赖于经验和直觉,现代技术依赖于科学原理和精确操作。
- 效率层面:现代技术能够实现规模化、自动化生产,提高产量和效率。
- 品质层面:现代技术有助于提高食品的品质和营养价值。
三、食品生物技术研究的内容1. 食品原料改良:- 基因工程:通过转基因技术,培育抗病、抗虫、高产的新品种。
- 细胞工程:通过细胞培养和筛选,获得优质的食品原料。
蛋白质与酶化学课程总结第一章蛋白质的制备第一节蛋白质分离纯化的一般程序生物组织无细胞抽取液溶解度分级各种层析方法和电泳法结晶精制品冻干品第二节蛋白质的粗分离:蛋白质的提取和纯化蛋白质的色谱分离基本原理:色谱法是利用混合物中各组分物理化学性质的差别,使各组分以不同程度分布在固定相(solid phase)和流动相(mobile phase)中。
混合物各组分在色谱柱中以不同的速度移动,经过一定的时间便可获得分离。
第三节蛋白质的电泳分离琼脂糖凝胶电泳、聚丙烯酰胺凝胶电泳两类。
电泳的检出方法:考马斯亮蓝染色法、银染色法、荧光染色技术、酶活性染色法、专一性配体结合检测法、用荧光抗体标记的抗体检测、凝胶上蛋白质的定量检出。
第五节蛋白质的鉴定主要方法:电泳法、蛋白质含量测定法、蛋白质的纯化标准和方法。
在开始纯化蛋白质之前要进行的工作:了解蛋白质分离纯化的一般过程、设计纯化蛋白质基本方案。
第二章酶的分子结构基础及其催化作用机理第一节酶是生物催化剂酶的定义:酶是生物体内一类具有催化活性和特殊空间构象的生物大分子物质,称为生物催化剂。
生物催化剂包括,酶(一般指化学本质是蛋白质),核酶(有催化活性的RNA),脱氧核酶(有催化活性的DNA)。
酶催化的生物化学反应,称为酶促反应。
在酶催化下发生化学变化的物质,称为底物。
第二节酶的催化特性酶的催化作用特性:共性:用量少、催化效率高(加快反应速度,缩短反应时间);不改变化学反应的平衡点,在反应前后其性质、数量均不变;降低反应的活化能。
特性:催化效率极高具有高度的专一性、酶易失活、酶的活性受到调节和控制。
第三节酶的结构和酶的催化作用机制酶分子结构:结合部位、催化部位、调控部位、酶活性中心的必需基团、酶活性中心的测定方法。
酶催化作用的机制:酶显著降低反应的活化能、中间产物学说、决定酶作用高效效率的机制。
总结:1、酶催化作用的本质:降低反应活化能。
2、酶催化作用的中间产(络合)物学说在酶催化的反应中,第一步是酶与底物形成酶-底物中间复合物。
蛋白质和酶的分离纯化及鉴定蛋白质是生命体中的重要物质基础之一。
从分子水平上认识生命现象,已成为现代生物学发展的主要方向。
要研究蛋白质,首先要得到高度纯化的目的蛋白。
蛋白质在组织或细胞中一般都是以复杂的混合物形式存在,每种类型的细胞都含有上千种不同的蛋白质。
要想从成千上万种蛋白质混合物中纯化出目的蛋白,就要根据蛋白质的理化性质不同设计出合理的分离方法。
目前研究为止酶除核酶外本质都是蛋白质,因此酶的分离纯化方法基本是采用蛋白质的分离纯化方法,但是酶的活性受到多种因素的影响,因此酶的分离纯化比一般的蛋白质要求更高。
一、质分离纯化的一般原则1. 原料的选择原则:来源方便,成本低,易操作、安全的原料。
蛋白分布:体液、组织、细胞定位2. 破碎方法:(1)机械方法:通过机械运动产生的剪切力的作用,使细胞或组织破碎的方法。
如:捣碎法、研磨、匀桨法(2)物理方法:通过温度、压力、声波等各种物理因素的作用,使组织细胞破碎的方法。
如:反复冻融、渗透压、超声破碎(3)化学方法:通过各种化学试剂对细胞膜的作用,使细胞破碎的方法.如:甲苯、丙酮、氯仿和非离子型的表面活性剂(Triton和Tween)(4)酶促法:溶菌酶、蜗牛酶等3.目的蛋白或酶的特异、快速、精确的定性或定量方法4.先粗后细,分级分离粗分:将得到的蛋白溶液先利用简单、快速、易处理的方法除去大部分杂蛋白。
如: 盐析、离心、有机溶剂沉淀等。
精制:利用蛋白质性质的差异,采用不同的方法,如:离子交换层析、分子筛、吸附层析、亲和层析、电泳、离心、结晶等方法进一步纯化。
5.避免蛋白质的变性(pH、适合的温度和缓冲体系等)二、常用的蛋白质的分离纯化技术可以根据各种蛋白质的结构、理化性质不同设计分离方法。
(一)根据蛋白质的溶解度不同进行分离1.蛋白质盐析蛋白质属于生物大分子之一,分子量从1万至100万之巨,其分子的直径可达1-100nm,为胶粒范围之内。
蛋白质的表面电荷和水化膜是其主要的稳定性因素。
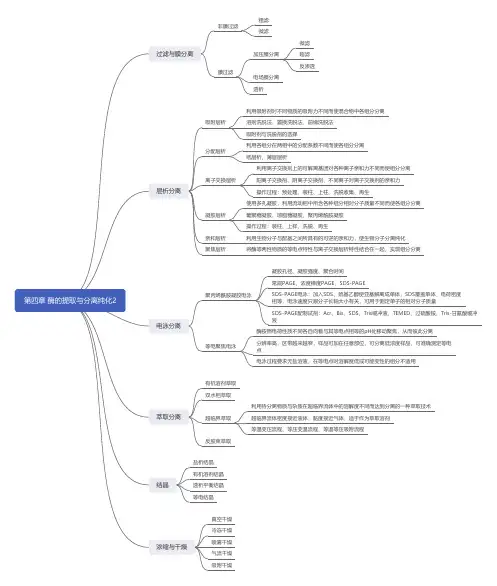
第一章酶的分离提取与纯化
1.1离心分离和层析分离
1.1.1酶的提取方法
离心是利用离心机旋转所产生的的离心力以及物质的沉降系数或浮力密度的差异,进行分离浓缩和提纯生物样品的一种方法。
离心分离时,要根据待分离物质以及杂志的颗粒大小、密度和特性的不同,选择适当的离心机、离心方法和离心条件。
1.1.1.1离心机的种类与用途
常速离心机,高速离心机,超速离心机
1)常速离心机:转速<8000 r/min 用途:分离细胞、细胞碎片、培养基残渣
及粗结晶等较大颗粒
2)高速离心机:转速:1~2.5*104 r/min 用途:分离各种沉淀物、细胞碎片
及较大的细胞器
3)超速离心机:转速:2.5~12*104 r/min 用途:用于DNA、RNA、蛋白质
等生物大分子以及细胞器、病毒的分离纯化
1.1.1.2离心方法
差速离心,密度梯度离心,等密度梯度离心
1)差速离心:原理:是采用不同的离心速度和离心时间,是沉降速度不同的颗
粒分不分离的方法。
用途:分离沉降系数相差较大的蛋白质分子
2)密度梯度离心原理:不同颗粒之间存在沉降系数差时,在一定离心力作用
下,颗粒各自以一定速度沉降,在密度梯度不同区域上形成区带的方法。
常用介质:蔗糖、甘油
3)等密度梯度离心:原理:当待分离的不同颗粒的密度范围在离心介质的密
度梯度范围内时,不同浮力密度的颗粒在离心力作用下一直移动到与各自浮力密度相等的位置,形成区带。
介质:铯盐
1.1.1.3层析分离技术
又称色谱技术,是一种物理的分离方法。
利用混合物中的各组分的物理化学性质(分子的大小和形状,分子极性,吸附力,分子亲和力)的不同,使各组分以不同的程度分布在两个相中,其中一个相为固定的(固定相),另一个相则流过固定相(流动相)并使各组分以不同速度一定,从而达到分离
根据分离原理分类
吸附层析、分配层析、离子交换层析、凝胶层析和亲和层析等
1)吸附层析
原理:是利用吸附剂对不同物质的吸附力不同,而使混合物中各组分分离的方法。
2)分配层析
原理:在一个有两相同时存在的溶剂系统中,根据不同物质的分配系数不同而达到分离目的的一种层析技术。
3)分配层析
原理:在一个有两相同时存在的溶剂系统中,根据不同物质的分配系数不同而达到分离目的的一种层析技术。
离子交换剂载体:离子交换树脂、离子交换纤维素、离子交换葡聚糖
阳离子交换剂:平衡粒子带正电的离子交换剂,能与带正电的离子基团发生交换作用
阴离子交换剂:平衡粒子带负电的离子交换剂,能与带负电的离子基团发生交换作用
4)凝胶层析
原理:是以各种多孔凝胶为固定相,利用流动相中所含各种组分的相对分子量不同,而达到物质分离的一种层析技术。
常用凝胶:葡聚糖凝胶;琼脂凝胶
5)亲和层析
原理:是利用生物分子与配基之间所具有的转移而又可逆的亲和力,而使蛋白质分子分离纯化的技术。
1.1.2讨论与问题
1)利用梯度混合器制备得到的密度梯度可以有哪几种?
线性、凸性、凹性
2)制备密度梯度溶液,一般采用什么仪器进行制备?
梯度混合器
3)沉降系数比较接近的蛋白质分子适用于哪种分离方法?
A.差速离心法
B.密度梯度离心法
4)常用的层析方法有?
吸附层析、分配层析、离子交换层析、凝胶层析和亲和层析
5)在酶的离子交换层析中,阳离子交换剂可吸附带负电荷的蛋白质(X)。
6)凝胶层析过程中,小分子量的蛋白质能直接通过凝胶珠之间的缝隙,首先被
洗脱下来。
(X)
7)凝胶层析分离酶蛋白的依据是各组分的相对分子质量不同。
(√)
解析:当含有大小不同的蛋白质样品加到凝胶柱上时,比凝胶珠平均孔径小的
蛋白质就要连续不断地穿入珠子的内部,这样的小分子不但其运动路程长,而且受到来自凝胶珠内部的阻力也很大,所以越小的蛋白质,把它们从柱子上洗脱下来所花费的时间越长!凝胶中只有很少的孔径可接受大的蛋白。
因此,大的蛋白质直接通过凝胶珠之间的缝隙首先被洗脱下来。
1.2过滤和膜分离技术
过滤是借助于过滤介质将不同大小、不同形状的物质分离的技术过程。
过滤(非膜过滤和膜过滤)介质多种多样,常用的有滤纸、滤布、纤维等非膜过滤:采用高分子膜以外物质作为过滤介质。
粗滤和部分未滤
膜过滤:采用各种高分子膜为过滤介质。
大部分微滤、超滤、反渗透
1.2.1过滤的分类及特性
1.2.2非膜过滤
粗滤:
截留颗粒直径大于2μm,用于分离酵母、霉菌、动植物细胞、培养基残渣等。
过滤介质有滤纸、滤布、多孔陶瓷等
常压过滤以液位差为推动力,易操作,分离效果差,难成规模。
加压过滤以压力泵或压缩空气为推动力。
效果较好,生产上应用广泛。
减压过滤真空过滤、抽滤。
多用于粘性不大的物料。
微滤:
微孔过滤,截留颗粒直径0.2~2μm,光学显微镜可见颗粒,采用微孔陶瓷、烧结金属等
1.2.3膜分离技术
借助于一定孔径的各种高分子薄膜,将不同大小。
不同形状和不同特性的物质颗粒或分子分离的技术。
薄膜有丙烯啨、醋酸纤维素、硝酸纤维素等高分子聚合物制成的高分子膜。
1.2.3.1根据颗粒或分子通过薄膜的原理和推动力不同分三类
1.2.3.2加压膜分离
以薄膜两边的流体静压差为推动力。
根据截留颗粒大小分为3种:微滤(0.2-2um/细菌);超滤(截留菌丝体和可溶性蛋白);反渗透(分离各种离子和小分子物质)
1.2.3.3电场膜分离
在半透膜的两侧分别装上正负极,电厂作用下小分子带电物质或离子向其与本身电荷相反的电极移动,通过半透膜,达到分离目的。
电渗析
离子交换膜电渗析
1.2.3.4扩散膜分离
利用小分子扩散作用透过半透膜,而大分子被截留;用于酶、蛋白质、核酸等生物大分子的分离。
透析设备简单,但操作时间长,要更换水或缓冲液。
1.2.4电泳分离
带电粒子在电厂中向着与其本身所带电荷相反的电极移动的过程称为电泳。
按其使用的支持体不同,电泳分为纸电泳、薄层电泳、薄膜电泳、凝胶电泳,自由电泳、等电聚焦电泳。
1.2.4.1基本原理
是指在电场作用下,带点颗粒由于所带电荷不同及分子大小差异而有不同迁移行为,从而彼此分离开来的一种实验技术。
由于混合样品中各组分带电性质、带电量、相对分子量不同,在同一电场作用下,涌动的方向和速率各异,从而达到分离鉴定的目的。
1.2.4.2电泳装置
1.2.4.3影响电泳分离的主要因素
1)待分离生物大分子的性质
电荷量越大,直径越小,形状越接近球形,则其电泳迁移速度越快
2)缓冲液的性质
3)电场强度
4)电渗
5)支持介质的筛孔
1.2.4.4电泳的分类
1)区带电泳:各组分在支持介质中被分离成许多条明显的区带,是当前应用最
广泛的电泳技术。
2)自由界面电泳:无支持介质,分离效果差,现已被其他电泳技术所取代。
3)等速电泳:需专用电泳仪,当电泳达到平衡后,各
4)电泳区带相随,分成清晰界面,以等速向前运动。
5)等电聚焦电泳:由两性电质在电场中自动形成pH梯度,当被分离的生物大
分子移动到各自等电点的pH处聚集成很窄的区带
1.2.4.5电泳技术的应用
1)分离各种有机物
2)分析物质的浓度
3)测定某种物质的相对分子质量
4)与其他技术(层析法)结合,用于蛋白质结构分析如“指纹法”。