DNS法测定还原糖的含量.
- 格式:doc
- 大小:626.00 KB
- 文档页数:9
3,5-二硝基水杨酸溶液与还原糖溶液共热后被还原成棕红色的氨基化合物,在一定范实验围内反应的还原糖的量和棕红色物质颜色深浅的程度成一定比例关系,可测定生成化合物的吸光度,由标准曲线反推出还原糖的浓度。
操作简便,快速,杂质干扰较少,适于生物制氢中还原糖含量的测定。
显色条件包括:波长选择,显色剂用量,显色时间,溶液酸度,显色温度,有机络合物的稳定性及共存离子的干扰等。
此次实验选择波长选择,显色剂用量,显色时间,溶液酸度进行实验。
一.试剂的配置DNS试剂:称量18.1992g酒石酸钾钠溶于50ml蒸馏水中,加热,趁热加入0.6313g 3,5-二硝基水杨酸(DNS),另配制2mol/lNaOH溶液,取26.2ml加入上述溶液中,称量0. 5128g苯酚和0.5064g无水亚硫酸钠移入配置好的溶液中,蒸馏水定容至100ml,该试剂避光保存7~10天。
葡萄糖标准溶液(1.0*10-2mol/l):准确称量0.1990g无水葡萄糖,待溶解后定容至100ml 容量瓶中。
葡萄糖标准溶液(1.0*10-3mol/l):取10ml上述10-2mol/l溶液,稀释至100ml容量瓶中。
葡萄糖标准溶液(1.0*10-4mol/l):取10ml上述10-3mol/l溶液,稀释至100ml容量瓶中。
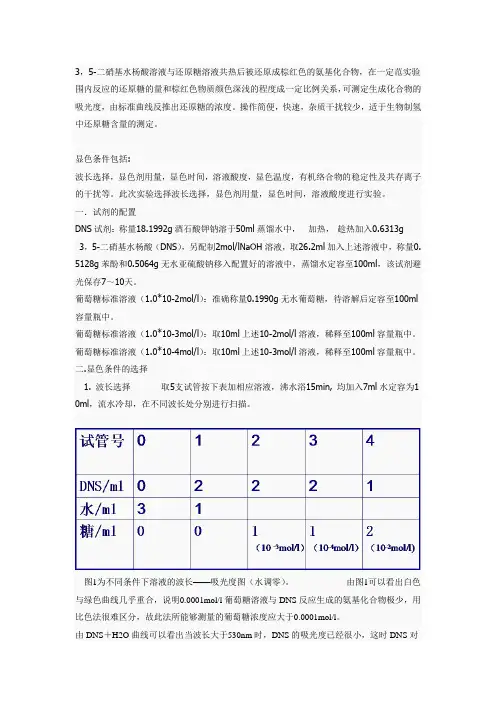
二.显色条件的选择1. 波长选择取5支试管按下表加相应溶液,沸水浴15min, 均加入7ml水定容为1 0ml,流水冷却,在不同波长处分别进行扫描。
图1为不同条件下溶液的波长——吸光度图(水调零)。
由图1可以看出白色与绿色曲线几乎重合,说明0.0001mol/l葡萄糖溶液与DNS反应生成的氨基化合物极少,用比色法很难区分,故此法所能够测量的葡萄糖浓度应大于0.0001mol/l。
由DNS+H2O曲线可以看出当波长大于530nm时,DNS的吸光度已经很小,这时DNS对反应生成的氨基化合物吸光度的影响可以忽略。
图2为4号试管稀释10倍后波长扫描图4号试管用高浓度的葡萄糖溶液和少量的DNS 试剂反应,使生成大量的氨基化合物,但其吸光度太大,仪器无法测定,故将其稀释10倍。



还原糖测定方法一、原理3,5-二硝基水杨酸(DNS)与还原糖发生氧化还原反应,生成3-氨基-5-硝基水杨酸,该产物在煮沸条件下显棕红色,可在最大吸收波长540nm处进行比色测定还原糖含量。
二、试剂和溶液除特殊规定外,本标准所用试剂均为分析纯,水为蒸馏水或相应纯度的水。
1、DNS试剂配置:将7.5g 3,5-二硝基水杨酸和14.0gNaOH充分溶解在l000ml 水中,加入216.0g酒石酸钾钠、5.6ml预先在50℃水浴中溶化的苯酚和6.0g偏重亚硫酸钠,充分溶解后盛于棕色瓶中,放置5天后即可使用。
2、NaOH3、酒石酸钾钠4、偏重亚硫酸钠5、葡萄糖6、苯酚三、仪器、设备1、分光光度计:有10mm比色池,可在540nm处测定吸光度2、分析天平3、恒温水浴锅4、振荡器5、容量瓶:100ml6、移液枪:1000ul7、计时器8、棕色试剂瓶9、量筒、试管等四、标准曲线的制作1、精确配制浓度为0.1g/l、0.2g/1、0.3g/l、0.4g/l、0.5g/l、0.6g/1、0.7g/l、0.8g/l、0.9g/l、1.0g/1的标准葡萄糖溶液一组。
2、在试管中加入l ml标准葡萄糖溶液,3mlDNS试剂,沸水浴10min,冷却至室温后,加水至25ml,摇匀。
以水为空白测540nm处的吸光度A。
3、以浓度对吸光度A作标准曲线。
五、测定步骤取适当稀释后的样品l ml,加3mlDNS试剂,沸水浴10min,冷却至室温后,加水至25ml,摇匀。
以水为空白测540nm处的吸光度A。
根据标准曲线计算出其浓度,再乘以稀释倍数,就得到样品中的糖浓度。

DNS比色法测定还原糖及总糖实验报告实验目的:通过DNS比色法测定还原糖和总糖的含量。
实验原理:DNS比色法是一种常用的测定还原糖和总糖含量的方法。
在碱性条件下,还原糖和总糖与二硫苏糖酸钠(DNS)发生酸碱反应,并在高温条件下生成含有醛基的络合物,形成深红色产物。
产物的吸光度与还原糖或总糖的浓度成正比关系。
实验步骤:1.准备样品溶液:将待测样品加入蒸馏水中,使体积恒定为50mL。
2.取2mL样品溶液加入试管中,加入2mL硫酸溶液,并用1%甲基绿稀溶液滴定溶液颜色变黄为止。
3. 在水槽中加热样品溶液至90°C,加入2 mLDNS试剂稀溶液,迅速搅拌均匀,继续加热5 min。
4.将试管取出,立即置于冷水中冷却。
5. 测定吸光度:使用比色计测定试管中产物的吸光度,以440 nm为波长。
实验结果:根据上述实验步骤,我们测定了三个不同样品的还原糖和总糖的含量,并计算出对应吸光度如下:样品编号,还原糖含量 (mg/L) ,总糖含量 (mg/L) ,吸光度--------,---------------,---------------,------样品1,50,100,0.345样品2,75,150,0.540样品3,100,200,0.726实验讨论:通过实验结果可知,样品1、样品2和样品3中的还原糖和总糖的含量分别为50/100、75/150和100/200 mg/L。
通过计算吸光度与还原糖/总糖浓度的线性关系,可以进一步推断未知样品中还原糖和总糖的浓度。
实验结论:通过DNS比色法,我们成功测定了三个样品中还原糖和总糖的含量,并得到了吸光度与浓度的线性关系。
实验结果表明,该方法可以用于定量测定还原糖和总糖的浓度。


DNS法测还原糖方法一原理DNS即二硝基水杨酸法是利用碱性条件下,二硝基水杨酸(DNS)与还原糖发生氧化还原反应,生成3-氨基-5-硝基水杨酸,该产物在煮沸条件下显棕红色,540nm处有吸收,且在一定浓度范围内颜色深浅与还原糖含量成比例关系的原理,用比色法测定还原糖含量的。
二试剂及方法2.1 试剂1. 1 mg/ml的葡萄糖溶液2. 3,5-二硝基水杨酸用400mL 蒸馏水溶解6.3g3,5—二硝基水杨酸,逐步加入21g 氢氧化钠,再加入182g 四水合酒石酸钾钠、5.0g 苯酚、5.0g 无水亚硫酸钠,温水浴(不超过48℃),不断搅拌,直至溶液清澈透明。
用蒸馏水定容至1000mL,保存在棕色瓶中,与二氧化碳隔绝,静置5~7 天后使用,贮存期为6 个月。
2.2 葡萄糖标曲的绘制表1 葡萄糖标曲的绘制方法试剂试管0 1 2 3 4 5葡萄糖标准液(ml) 0 0.1 0.2 0.3 0.4 0.5 蒸馏水(ml) 0.5 0.4 0.3 0.2 0.1 03,5-二硝基水杨酸(ml) 0.5 0.5 0.5 0.5 0.5 0.5 糖含量(mg)0 0.1 0.2 0.3 0.4 0.5混合均匀,沸水浴5min,冷却后加入4mL蒸馏水,混匀,在540nm下测OD值2.3 发酵液样品测定将发酵液稀释一定倍数后,取3只比色管标号1,2,3,加入稀释和的发酵液0.5 ml,加入DNS试剂0.5 ml 混匀,沸水浴5min,冷却后加入4 ml蒸馏水混匀,测OD540表 2 样品的测定方法管号0 1 2 还原糖待测样品 (mL ) 0.0 0.5 0.5 蒸馏水 (mL ) 0.5 0.0 0.0 DNS 试剂 ( mL ) 0.5 0.5 0.5 蒸馏水 (mL ) 4 4 4 A 540 nm计算所得还原糖含量 (mg )三 结果计算 3.1 标曲3.2样品的还原糖含量稀释倍数)加人样品的体积()计算得到的还原糖量()还原糖含量(⨯=ml 5.0mg /g L。

DNS法测还原糖方法一原理DNS即二硝基水杨酸法是利用碱性条件下,二硝基水杨酸(DNS)与还原糖发生氧化还原反应,生成3-氨基-5-硝基水杨酸,该产物在煮沸条件下显棕红色,540nm处有吸收,且在一定浓度范围内颜色深浅与还原糖含量成比例关系的原理,用比色法测定还原糖含量的。
二试剂及方法2.1 试剂1. 1 mg/ml的葡萄糖溶液2. 3,5-二硝基水杨酸用400mL 蒸馏水溶解6.3g3,5—二硝基水杨酸,逐步加入21g 氢氧化钠,再加入182g 四水合酒石酸钾钠、5.0g 苯酚、5.0g 无水亚硫酸钠,温水浴(不超过48℃),不断搅拌,直至溶液清澈透明。
用蒸馏水定容至1000mL,保存在棕色瓶中,与二氧化碳隔绝,静置5~7 天后使用,贮存期为6 个月。
2.2 葡萄糖标曲的绘制表1 葡萄糖标曲的绘制方法试剂试管0 1 2 3 4 5葡萄糖标准液(ml) 0 0.1 0.2 0.3 0.4 0.5 蒸馏水(ml) 0.5 0.4 0.3 0.2 0.1 03,5-二硝基水杨酸(ml) 0.5 0.5 0.5 0.5 0.5 0.5 糖含量(mg)0 0.1 0.2 0.3 0.4 0.5混合均匀,沸水浴5min,冷却后加入4mL蒸馏水,混匀,在540nm下测OD值2.3 发酵液样品测定将发酵液稀释一定倍数后,取3只比色管标号1,2,3,加入稀释和的发酵液0.5 ml,加入DNS试剂0.5 ml 混匀,沸水浴5min,冷却后加入4 ml蒸馏水混匀,测OD540表 2 样品的测定方法管号0 1 2 还原糖待测样品 (mL ) 0.0 0.5 0.5 蒸馏水 (mL ) 0.5 0.0 0.0 DNS 试剂 ( mL ) 0.5 0.5 0.5 蒸馏水 (mL ) 4 4 4 A 540 nm计算所得还原糖含量 (mg )三 结果计算 3.1 标曲3.2样品的还原糖含量稀释倍数)加人样品的体积()计算得到的还原糖量()还原糖含量(⨯=ml 5.0mg /g L。
3,5-二硝基水杨酸比色法---- 标准曲线的制作1.实验原理还原糖的测定是糖定量测定的基本方法。
还原糖是指含有自由醛基或酮基的糖类,单糖都是还原糖,双糖和多糖不一定是还原糖,其中乳糖10257 RP麦芽糖是还原糖,蔗糖和淀粉是非还原糖。
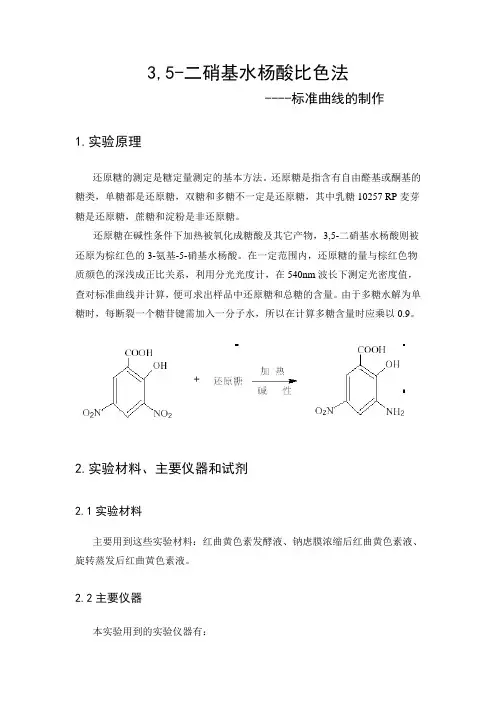
还原糖在碱性条件下加热被氧化成糖酸及其它产物,3,5-二硝基水杨酸则被还原为棕红色的3-氨基-5-硝基水杨酸。
在一定范围内,还原糖的量与棕红色物质颜色的深浅成正比关系,利用分光光度计,在540nm波长下测定光密度值,查对标准曲线并计算,便可求出样品中还原糖和总糖的含量。
由于多糖水解为单糖时,每断裂一个糖苷键需加入一分子水,所以在计算多糖含量时应乘以0C(K HI加热+还原椭----------- »碱性2.实验材料、主要仪器和试剂2.1实验材料主要用到这些实验材料:红曲黄色素发酵液、钠虑膜浓缩后红曲黄色素液、旋转蒸发后红曲黄色素液。
2.2主要仪器本实验用到的实验仪器有:1)具塞玻璃刻度比色管:25mD19;2)烧杯:100mD4;3)三角瓶:100mD1;4)容量瓶:100mD3, 50mD3;5)刻度吸管:1mD4; 2mD3; 10mD1;6)沸水浴;7)冰浴;8)扭力天平;9)UV — 2802SH 型紫外可见分光光度计尤尼柯(上海)仪器有限公司;2.3 实验试剂1)1mg/mL 葡萄糖标准液准确称取80C烘至恒重的分析纯葡萄糖100mg,置于小烧杯中,加少量蒸馏水溶解后,转移到100mL容量瓶中,用蒸馏水定容至100mL,混匀,4C 冰箱中保存备用。
2)3,5-二硝基水杨酸(DNS)试剂将6.3g DNS和262mL 2M NaOH溶液,力□到500mL含有185g酒石酸钾钠的热水溶液中,再加 5g 结晶酚和 5g 亚硫酸钠,搅拌溶解,冷却后加蒸馏水定容至1000mL,贮于棕色瓶中备用。
3.实验步骤制作葡萄糖标准曲线取 7支 25mL 具塞刻度试管编号,按表 1 分别加入浓度为 1mg/mL 的葡萄糖标准液、蒸馏水和3,5-二硝基水杨酸(DNS)试剂,配成不同葡萄糖含量的反应液。

还原糖含量测定(3,5-二硝基水杨酸比色法)一、实验原理还原糖的测定是各种糖类化合物定量测定的基本方法。
在碱性条件下,还原糖与3,5-二硝基水杨酸(DNS)共热后3,5-二硝基水杨酸(DNS)被还原为3-氨基-5-硝基水杨酸(棕红色物质),还原糖则被氧化成糖酸及其他产物。
在一定范围内,还原糖的浓度与3-氨基-5-硝基水杨酸(棕红色物质)颜色深浅的程度呈正比,利用可见分光光度计,在540nm波长下测定棕红色物质的吸光值,查对标准曲线可求出样品中还原糖的含量。
二、实验试剂3, 5-二硝基水杨酸试剂( DNS):将6.3g DNS和262mL 2mol/L的NaOH溶液加到500mL含有182g酒石酸钾钠的热水溶液中,再加5g重蒸酚和5g亚硫酸氢钠,搅拌溶解,冷却后定容至1000ml。
溶液为黄色,贮于棕色瓶中。
1mg/mL 葡萄糖标准溶液:准确称取80℃烘至恒重的分析纯无水葡萄糖1g,置于烧杯中,加少量水溶解后再加5mL浓盐酸(防止微生物生长),以蒸馏水定容至1000ml,混匀,4℃冰箱中保存备用。
碘-碘化钾溶液:称取5g碘和10g碘化钾,溶于100mL蒸馏水中。
酚酞指示剂:称取1g酚酞,溶于250mL70%乙醇中。
6mol/L HCI溶液:取250mL浓HCI,用蒸馏水稀释到500mL。
6mol/L NaOH溶液:称取240g NaOH, 溶于1000mL蒸馏水中。
三、实验方法1.制作葡萄糖标准曲线取6支试管编号,按照表3-1分别加入浓度为1mg/mL的葡萄糖标准液、蒸馏水和3,5-二硝基水杨酸(DNS)试剂。
将各管混匀,用0号管调零点,在540nm波长处测1-5管吸光度。
以葡萄糖毫克数为横坐标,A540为纵坐标,绘制标准曲线。
2.样品中还原糖的测定(食用面粉为例)准确称取2.00g食用面粉,放入100mL烧杯中,先用少量蒸馏水调成糊状,然后加入50-60mL蒸馏水,搅匀,置于50℃恒温水浴中保温20min,使还原糖浸出。
3,5-二硝基水杨酸比色法----标准曲线的制作1.实验原理还原糖的测定是糖定量测定的基本方法。
还原糖是指含有自由醛基或酮基的糖类,单糖都是还原糖,双糖和多糖不一定是还原糖,其中乳糖10257 RP麦芽糖是还原糖,蔗糖和淀粉是非还原糖。
还原糖在碱性条件下加热被氧化成糖酸及其它产物,3,5-二硝基水杨酸则被还原为棕红色的3-氨基-5-硝基水杨酸。
在一定范围内,还原糖的量与棕红色物质颜色的深浅成正比关系,利用分光光度计,在540nm波长下测定光密度值,查对标准曲线并计算,便可求出样品中还原糖和总糖的含量。
由于多糖水解为单糖时,每断裂一个糖苷键需加入一分子水,所以在计算多糖含量时应乘以0.9。
2.实验材料、主要仪器和试剂2.1实验材料主要用到这些实验材料:红曲黄色素发酵液、钠虑膜浓缩后红曲黄色素液、旋转蒸发后红曲黄色素液。
2.2主要仪器本实验用到的实验仪器有:1)具塞玻璃刻度比色管:25mL×19;2)烧杯:100mL×4;3)三角瓶:100mL×1;4)容量瓶:100mL×3,50mL×3;5)刻度吸管:1mL×4;2mL×3;10mL×1;6)沸水浴;7)冰浴;8)扭力天平;9)UV—2802SH型紫外可见分光光度计尤尼柯(上海)仪器有限公司;2.3实验试剂1)1mg/mL葡萄糖标准液准确称取80℃烘至恒重的分析纯葡萄糖100mg,置于小烧杯中,加少量蒸馏水溶解后,转移到100mL容量瓶中,用蒸馏水定容至100mL,混匀,4℃冰箱中保存备用。
2)3,5-二硝基水杨酸(DNS)试剂将6.3g DNS和262mL 2M NaOH溶液,加到500mL含有185g酒石酸钾钠的热水溶液中,再加5g结晶酚和5g亚硫酸钠,搅拌溶解,冷却后加蒸馏水定容至1000mL,贮于棕色瓶中备用。
3.实验步骤制作葡萄糖标准曲线取7支25mL具塞刻度试管编号,按表1分别加入浓度为1mg/mL的葡萄糖标准液、蒸馏水和3,5-二硝基水杨酸(DNS)试剂,配成不同葡萄糖含量的反应液。
dns法和苯酚硫酸法
DNS法和苯酚硫酸法是两种常用的方法,用于测定生物样品中的糖类含量。
这两种方法在生物化学和生物工程领域被广泛应用,下面我将从多个角度对这两种方法进行全面的介绍。
首先,我们来谈谈DNS法,DNS法是一种测定还原糖含量的方法,它的全称是3,5-二硝基水杨酸法。
这种方法的原理是利用还原糖与3,5-二硝基水杨酸在酸性条件下反应生成有色产物,然后通过测定产物的光密度来间接测定还原糖的含量。
DNS法的优点是操作简单,准确度高,适用于各种类型的糖类,因此在食品工业和生物化学研究中被广泛应用。
其次,苯酚硫酸法是另一种常用的测定糖类含量的方法。
苯酚硫酸法的原理是利用还原糖与苯酚在硫酸的作用下发生反应生成有色产物,然后通过测定产物的光密度来测定还原糖的含量。
与DNS 法相比,苯酚硫酸法同样具有操作简单,准确度高的特点,适用于各种类型的糖类,特别是在微量糖类的测定上具有较好的灵敏度。
从应用角度来看,DNS法和苯酚硫酸法在测定糖类含量上都有其独特的优势,具体选择哪种方法取决于实验的具体要求和样品的
特性。
在实际应用中,研究人员需要根据实验的目的和条件来选择合适的方法进行糖类含量的测定。
总的来说,DNS法和苯酚硫酸法都是常用的测定糖类含量的方法,它们在生物化学和生物工程领域具有重要的应用价值。
通过对这两种方法的全面了解,我们可以更好地选择合适的方法来进行糖类含量的测定,从而为相关领域的研究和应用提供有力的支持。
DNS法测定还原糖的含量3, 5■二硝皋水杨酸溶液与还原糖溶液共热后被还原成棕红色的氨基化介物,在一定范实验围内反应的还原糖的呈和棕红色物质颜色深浅的程度成•定比例关系,可测定生成化合物的吸光度,由标准曲线反推出述原糖的浓度。
操作简便,快[速,杂质干扰较少,适于生物制氢中还原糖含量的测定。
Chemistry实验原理Chemistry显色条件包括:波长选择,显色剂用量,显色时间,溶液酸度,显色温度,有机络合物的稳定性及共存离子的干扰等此次实验选择波长选择显色剂用量,显色时间 ,溶液酸度进行实验。
一.试剂的配證DNS试剂,称貼8.l992g酒石酸钾钠溶丁50m嚥懈水中,加热.趁热加入0.6313g 3, 5•二硝基水杨酸(DNS),另配制2mol/lNaOH溶液,取26.2ml加入上述溶液中,称星0.5128g苯酚和0.5064g无水亚硫酸钠移入配置好的溶液中,蒸18水定容至100ml,该试剂避光保存7〜10天。
葡萄糖标准溶液(1.0*l0-2mol/l):准确称®0.1990g 无水簡萄糖,待溶解后定容至100ml容最和中。
葡萄糖标准溶液(1.0*10-3mol/l> :取10ml上述10・2mol/l溶液,稀释至100ml容量瓶中。
匍萄辎标准溶液(1.0*10-4mol/l> :取伽I上述10・3mol/l溶液,稀释至100ml容量瓶中。
二•显色条件的选择1.波长选择取5支试管按卜-表加和应溶液.沸水浴15min,均加入7m冰定容为10ml,流水冷却,在不同波长处分别进行扫描。
图1为不同条件卜溶液的波长——吸光度图(水涮零八由图1可以看出白色号绿色曲线几乎重命说明0.0001mol/l葡萄糖溶液与DNS反应生成的氮基化合物极州用比色法很难区分. 故此法所能够测吊的俪葡糖浓度应人J L0.0001mol/L由DNS + H2O肘线可以存出当波长大J 530nm时.DNS的吸比应已綽很小. 这时DNS竹反应牛成的粽圧化合物吸光度的讹响町以忽略°图2为4号试管稀释10倍后波长扌I 描图4号•试管川离浓度的匍羽榊洛液和少尿的DNS 试剂反应,伙生成大眾的氨基化合物•但其吸光度太大•仪器无法测定•故 将其稀邸10倍。
3,5-⼆硝基⽔杨酸⽐⾊法(DNS法)测定还原糖
3,5-⼆硝基⽔杨酸⽐⾊法(DNS法)测定还原糖
⼀.原理
3,5-⼆硝基⽔杨酸与还原糖共热后被还原成棕红⾊的氨基化合物,再⼀定范围内,还原糖的量与反应液的颜⾊强度成⽐例关系,利⽤⽐⾊法可测知样品的含糖量。
次法是半微量定糖法,操作简便、快速,杂质⼲扰较少,是⼀种很好的糖定量测定⽅法。
⼆.试剂
1. 3,5-⼆硝基⽔杨酸试剂(DNS试剂)
甲液-溶解6.9克结晶酚(苯酚)于15.2毫升10%氢氧化钠中,并稀释⾄69毫升,再此溶液中加⼊6.9克亚硫酸氢钠。
⼄液-称取255克酒⽯酸甲钠,加到300毫升10%氢氧化钠中,再加⼊880毫升1%3,5-⼆硝基⽔杨酸溶液。
将甲液和⼄液相混合即得黄⾊试剂,保存于棕⾊试剂瓶中,在室温下放置7-10天后使⽤。
2.0.1%葡萄糖标准液
准确称取100毫克分析纯的葡萄糖(预先在105℃⼲燥⾄恒重),⽤少量蒸馏⽔溶解后定容⾄100毫升,保存于冰箱备⽤。
三.制作标准曲线
取9⽀⼤试管,分别按表⼀顺序加⼊各种试剂。
表⼀
将上述各管溶液混后,在紫外可见分光光度计上⽤绿⾊滤光⽚(520nm) 进⾏⽐⾊测定,⽤空⽩管溶液调零,记录光密度值。
以光密度值为横坐标,以葡萄糖浓度为纵坐标,绘制标准曲线。
四.定糖
根据所取样品的个数来确定所需的试管数,在这⾥以7⽀试管为例,分别按表⼆顺序来加⼊各种试剂。
将各管混匀后,按制作标准曲线时的同样⽅法的操作,测定各管的光密度,在标准曲线上查出相应的还原糖含量,按下述公式计算出还原糖含量。
还原糖%= (还原糖毫克数?样品稀释倍数)/培养基中总含糖量?100
表⼆。