植物组织培养
- 格式:doc
- 大小:55.50 KB
- 文档页数:4
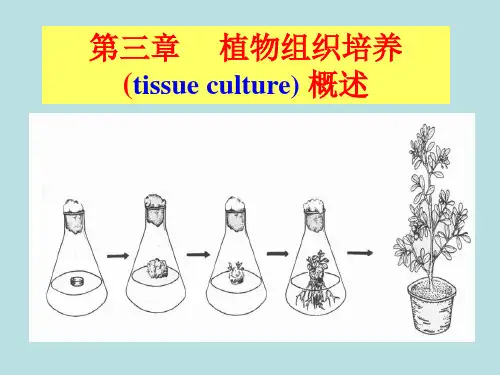






植物组织培养植物组织培养:在无菌的条件下,将离体的植物材料包括器官,组织,细胞以及原生质体在人工培养基上进行培养,使其再生发育成完整植株的过程,又称植物离体培养。
细胞全能性:植物体的任何一个细胞都携带该物种的全部遗传信息,离体细胞在一定的条件下具有发育成完整植株的潜在能力。
外植体:植物组织培养中离体的植物材料,包括植物器官,胚胎、组织、细胞和原生质体。
细胞分化:导致细胞形成不同结构,引起功能改变或潜在发育方式改变的过程。
脱分化:已分化成熟的植物组织或器官回复到分生状态,细胞开始分裂形成无组织结构的细胞团或愈伤组织的过程。
再分化:是指在一定条件下,脱分化形成的愈伤组织转变成为具有一定结构、执行一定生理功能的细胞团和组织、并进一步形成完整植株的过程,即从愈伤组织再生形成完整植株的过程。
愈伤组织:植物体受伤后的伤口处或在植物组织培养中外植体切口处产生的一团不定型的薄壁组织。
离体无性繁殖:根据植物细胞全能性原理,在无菌条件先短时间内形成大量植株。
玻璃化苗:在植物组培中,茎叶形成透明矮小肿胀的形态,生根能力差。
问答题:1、无菌操作是贯穿于整个组织培养过程的一门关键技术,请根据自己的体会论述如何在植物组织培养过程中做到无菌?1)取少菌的材料(春夏,中午的幼芽)2)严格灭菌3)合理安排操作程序4)无菌保存5)操作规范2、组培在生产上的应用有哪些?学好植物组培的意义?1)植物快速繁殖:增殖速度快,成本低,易于批量生成和管理。
比如利用一小块叶片或一个茎尖,一年内可繁殖出1000-100000株幼苗2)脱除病毒:植物在生长过程中几乎都要蒙受到病毒的危害,采用茎尖培养方法可以除去植物体内的病毒。
脱毒苗恢复了原有的优良种性,生长势明显增强,整齐一致。
3)培养新品种:克服远缘杂交不亲合性;克服远缘杂交的不孕性;选择细胞突变体;单倍体育种;转基因育种。
4)植物次生代谢产物生产:利用植物组织后细胞的大规模培养,可以生产一些天然有机化合物,这些次生代谢产物,往往具有一些特定的功能,对人类有重要的影响和作用。

第一章植物组织培养的基础理论与基本知识目的要求:(1) 掌握组织培养的概念和类型;(2) 掌握组织培养的特点;(3) 了解组织培养发展史;(4) 初步掌握组织培养在农业实践上的应用。
第一节植物组织培养的基本概念及类型一、植物组织培养的概念植物组织培养(tissue culture)指在无菌条件下,将离体的植物器官(如根、茎、叶、花、果、茎尖等)、组织(如形成层、表皮、皮层、髓部细胞、胚乳等)、细胞(如大孢子、小孢子及体细胞)以及原生质体,培养在人工控制的环境里使其再生形成完整的植株。
亦可称为无菌培养、离体培养、试管培养。
根据培养基的形态可分为固体培养和液体培养;液体培养又可分为悬浮培养、振荡培养、旋转培养等。
外植体(explant):在植物组织培养过程中,有植物体上切取的根、茎、叶、花、果实、种子等器官以及各种组织和细胞统称为外植体。
愈伤组织:植物局部创伤后或在组织培养中,当已分化的细胞恢复了细胞分裂能力,而增殖形成的无组织结构、无器官分化的薄壁细胞团。
在组织培养中,先由外植体增殖产生,在一定条件下,对它经过一段时间培养,可能从其再分化出具一定结构及功能的器官,如根、茎、胚状体或重新形成完整的植株。
二、植物组织培养的类型1.植物培养植物培养是指幼小植株的培养。
例如兰花,兰花及兰科植物种子的发育特殊,种子成熟之后没有胚乳,需要与某些真菌共生,由真菌提供营养才能萌发,在自然条件下,萌发率很低。
早期通过人工接种真菌可使兰花种子萌发,但技术繁琐,难度较大,后来发现在人工培养基上,只要营养成分合适不需要真菌共生,兰花种子也能萌发。
以蝴蝶兰为例,由一个好的荚果播种后两个月左右可产生数万个小圆球茎,经过一个月分瓶后,就可以进行育苗,大约3个月后即可得到大量可移栽的试管苗。
无菌播种已是各个大型蝴蝶兰生产企业主要的种苗繁育技术。
2.器官培养将植物的器官如胚、胚乳、珠心、子房、根、茎、叶、花和幼果的部分组织接种在无菌培养基上进行培养,也称为植物离体培养。

植物组织培养概念植物组织培养是一种以细胞、组织或器官为原料用营养培养基培养的方法,用于研究生长特性以及遗传、营养代谢和形态等不同方面的外源因素的影响。
它涉及到植物细胞、组织或器官、细胞质和细胞壁等植物器官的培养。
1908年,匈牙利科学家拉贡·劳姆·麦金尼尔发现,用培养基培养的细胞可以分泌生长激素,使用这种技术可以将植物细胞、组织或器官维持在可生长的状态。
从那以后,植物组织培养就被用于研究许多各种植物育种、突变学、植物分子生物学、病毒学、生物化学、基因工程、细胞形态学等领域。
植物组织培养主要包括四个步骤:细胞收集、细胞处理、细胞获得状态和细胞培养步骤。
细胞收集是指将植物体切割成较小的片段,提取其中的细胞或组织,它的目的是将细胞、组织或器官脱离原有的环境使其保持原有的活性状态。
植物细胞收集的一般方法是锤式剪或磨碎镊,有时会采用复杂的技术,如流式细胞术和激光切割。
细胞处理是指用各种实验技术优化细胞或组织的特性,它的作用是在细胞脱离原位后,能够使细胞保持其最初的动态状态,以及促进细胞增殖和分化。
常用的细胞处理技术有:分散、抗原分离、抑制剂处理、激活剂处理和氧化剂处理等。
细胞获得状态是指使细胞发生分化,并能与培养基联合活性状态的一种技术,它可以让生物细胞具有可识别细胞活性的有机溶剂属性的自身信息,响应自身的环境信号,导致细胞有别于原来的基因状态,并实现分子和活性的突变。
这种技术主要集中在调控细胞活力状态,如:催乳剂、多肽、荷爾蒙等,以及胁迫特征,如:光、氧气、pH值等。
细胞培养就是在合适的营养培养基中,使收集的细胞和组织保持生命活动,并可以进行繁殖的一种技术。
它不仅有利于新型培养基的建立,为细胞的连续培养提供方法,而且可以实现不同的植物细胞之间的交叉繁殖,并可以提取多种特定的生长激素,促进细胞分化、繁殖以及细胞发酵过程中的各种特性。


植物组织培养名词解释1.细胞的全能性:指植物体的任何一个有完整细胞核的活细胞都具有该植物的全套遗传基因和产生完整植株的潜在能力。
2.分化:指细胞、组织、器官或整株植物从分生组织或幼小状态发育为成熟状态的过程,并在生理、形态上发生的变化。
其最大的特征是失去分裂能力。
3.脱分化:植物离休的器官、组织、细胞在人工培养基上,经过多次细胞分裂而失去原来的分化状态,形成无结构的愈伤组织或细胞团的过程,使其回复到胚性细胞的状态。
其特征是已失去分裂能力的细胞重新获得了分裂能力。
4.再分化:指由脱分化的细胞再度分化成另一种或几种类型的细胞、组织、器官,甚至最终再生成完整的植株的过程。
5.试管苗:指在无菌离体条件下,对植物组织、细胞、器官进行组培所获得的的再生植株。
6.根芽激素理论:根和芽的分化由生长素和细胞分裂素的比率所决定,这一比率高时促进生根,比率低时促进茎芽的分化,比率适中时,组织则倾向于以一种无结构的方式生长。
通过改变培养基中这两类生长调节物质的相对浓度可以控制器官的分化。
7.污染:批在组培过程中,由于真菌、幼苗等微生物的侵染,在培养容器内滋生大量的菌斑,使试管苗不能生长和发育的现象。
8.褐变:指在组培过程中,培养材料向培养基中释放褐色物质,致使培养基逐渐变成褐色,培养材料也随之慢慢变褐而死亡的现象。
9.玻璃化现象:指试管苗因生理失调而引起的嫩茎、叶片出现半透明状和水渍状的现象。
10.无菌操作:亦称接种。
指将经过表面灭菌后的植物材料在无菌环境中切碎或分离出器官、组织或细胞转移到无菌培养基上的过程。
由于整个过程均在无菌条件下进行,所以将这个过程称为无菌操作。
11.植物组织培养:指在无菌条件下,将离体的植物器官(如叶、花、未成熟的果实、种子)、组织(如形成层、花药组织、胚乳)、胚胎(如成熟和未成熟的胚)、细胞或原生质体,培养在人工配制的培养基上,给予适宜的培养条件,使其长成完整的植株或生产具有经济价值的其他产品。
植物组织培养重点名词解释:1、植物组织培养:是指在无菌和人工控制的环境条件下,利用适当的培养基,对离体的植物器官、组织、细胞及原生质体进行培养,使其再生细胞或完整植株的技术。
又称为植物离体培养2、外植体(explant):用于离体培养的那部分植物器官、组织或细胞。
3、愈伤组织(callus):是指外植体因受伤或在离体培养时,其细胞进行活跃的分裂增殖而形成的一种无特定结构和功能的组织。
4、离体生态学(in vitro ecology):是指研究离体培养环境条件控制的科学,其研究对象是培养基、植物材料和人工环境条件。
5、植物细胞全能性(totipotency):是指任何携带完整遗传信息的植物活细胞都具有表达其所有遗传信息的能力,能够发育成完整的植株。
胞需经过脱分化和再分化过程才能表现其全能性。
6、脱分化(dedifferentiation):成熟细胞或分化细胞转变为分生状态(即形成愈伤组织)的过程。
7、再分化(redifferentiation):成熟细胞或分化细胞脱分化转变为愈伤组织后重新分化成异质细胞的过程。
8、植物茎段培养是指对植物的带有一个以上定芽或不定芽的外植体(包括块茎、球茎、鳞茎在内的幼茎切段)进行离体培养的技术。
9、茎尖培养(shoot tip culture or apical meristem culture)是指对植物顶端的原分生组织和它衍生的分生组织的培养。
10、叶培养的意义:研究叶形态建成、光合作用、叶绿体形成等;叶细胞全能性;原生质体融合;无性繁殖系;诱变育种。
11、离体叶组织发育途径:直接产生不定芽,由愈伤组织产生不定芽,胚状体和其他。
12、植物器官培养是指对植物某一器官的全部或部分或器官原基进行离体培养的技术。
13、植物胚胎培养是指对植物的胚、胚乳、胚珠和子房等进行离体培养,使其发育成完整植株的技术。
包括:胚培养、胚乳培养、胚珠培养以及子房培养。
14、胚乳培养是指将胚乳组织从母体上分离出来,通过离体培养,使其发育成完整植株的技术15、胚珠培养是将胚珠从母体分离出来,无菌条件下让其进一步生长发育,使其形成植株的技术。
第八章植物组织培养技术一、基本概念植物组织培养是指在无菌条件下,将离体的植物器官(如根尖、茎尖、叶、花、未成熟的果实、种子等)、组织(如形成层、花药组织、胚乳、皮层等)、细胞(如体细胞、生殖细胞等)、胚胎(如成熟和未成熟的胚)、原生质体(如脱壁后仍具有生活力的原生质体),培养在人工配制的培养基上,给予适宜的培养条件,诱发产生愈伤组织,或潜伏芽等,或长成完整的植株,统称为植物组织培养。
由于是在试管内培养,而且培养的是脱离植物母体的培养物,因此也称离体培养和试管培养,根据外植体来源和培养对象的不同,又分为植株培养、胚胎培养、器官培养、组织培养、原生质体培养等。
二、培养方式植物组织培养方式大致可分为固体培养和液体培养两类。
固体培养即将植物材料培养在加入一定量凝固剂的固体培养基上,最常用的凝固剂是琼脂,其用量为6-10g/L,以不液化为原则(半固体)。
用量太高,培养基过硬,培养材料感好,生长不好;用量太少,则培养基太软,材料在培养基中不稳定,甚至下沉,从而影响组织的呼吸。
培养基的硬度还可能受到所用琼脂的质量、培养基pH及无机盐浓度的影响。
固体培养基的优点是简便,只要具备培养室(箱)、接种室(箱)以及一般是实验室的玻璃皿就可以开展工作。
其缺点是被培养的材料只有一部分表面能与培养基接触,因此与组织接触处的营养物质很快被吸收掉,而其他区域补充又来得较慢,形成了培养基中营养物质浓度差异,影响组织的生长速率。
液体培养即植物材料被培养在不加凝固剂的液体培养基中。
液体培养基常用摇床或转床来振动培养容器,振动速度一般为50-100次/分。
液体培养基中培养物是被培养基所包围,培养基中的营养物质分布均匀,不会出现浓度差异现象,同时培养物的供氧情况也得到改善,有利于它的代谢、生长。
因此,在液体培养中,培养物的生长速度要比固体培养快得多。
三、培养基及配制(一)培养基的成分培养基是植物组织培养中离体植物材料赖以生存、生长发育的基地。
1.植物组织培养概念:是指在无菌和人工控制的环境条件下,利用适当的培养基,对离体的植物器官、组织、细胞及原生质体进行培养,使其再生细胞或完整植株的技术,又称为植物离体培养。
2.外植体(explant):用于离体培养的那部分植物器官、组织或细胞。
3.愈伤组织(callus);是指外植体因受伤或在离体培养时其细胞进行活跃的分裂增值而形成的一种无特定结构和功能的组织。
4.植物组织培养的特点是采用微生物学的实验手段来操作植物离体的器官、组织和细胞。
这一特点具体表现在以下几个方面:(1)组培技术是无菌操作技术;(2)组培材料处于完全的异养状态;(3)组培材料可以是离体状态的器官、组织、细胞或原生质体;(4)组培培养物可以形成克隆(clone,无性繁殖系),也可以进行茎芽增殖或生根;(5)组培容器内的气体和环境气体可以通过封口材料进行交换,相对湿度通常是几乎100%,因此,组培苗叶片表面一般都无角质层或蜡质层,且气孔保卫细胞功能缺乏,气孔始终都是张开的;(6)组培的环境温度,光照强度和时间都是人为设定的,其参数可调。
5.德国植物学家Haberlandt被公认为是植物组织培养之父,他与1902年发表的植物组织培养的第一篇论文:提出了植物细胞具有全能性,构思了细胞培养的概念。
6.培养基是植物组织培养的核心,它提供植物生长所需的营养物质,是决定植物组织培养成败的关键因素之一。
外植体之所以能沿着不同的组培途径生长、分化,其主要原因就在于培养基中的物质成分对细胞的生长发育起着定向操控作用。
7.在离体培养条件下,不同种植物的组织对营养有不同的要求,甚至同一种植物不同部位的组织对营养的要求也不相同。
因此,在建立一项新的培养系统时,首先必须找到一种合适的培养基,培养才有可能成功。
8.培养的构成:(1)水分;(2)无机盐类:a大量元素b微量元素;(3)有机营养成分:a糖类物质:蔗糖葡萄糖果糖麦芽糖b维生素类c氨基酸类;(4)植物生长调节剂:a生长素:IAA NAA 2,4-D IBA抑制芽b细胞分裂素:6-BA ZT KT促进芽分化;(5)天然有机添加物:椰子汁香蕉泥番茄汁胶木提取液等;(6)pH值:常用5.8 过高培养基变硬,过低培养基不凝固;(7)凝固剂:常用琼脂(粉) 7-10g\L;(8)其他添加物:活性炭。
植物的组织培养【基础回顾】考点一、植物组织培养的过程1.组织培养过程外植体――→脱分化愈伤组织――→再分化幼苗―→移栽2.培养基(1)成分:大量元素、微量元素、有机物、植物激素和琼脂。
(2)类型:MS培养基、发芽培养基和生根培养基。
(3)作用:植物组织或器官生长和发育的营养条件。
(4)配制:称量、溶解、调pH、分装(三角瓶)、灭菌。
考点二、植物组织培养的实验操作(1)菊花的组织培养过程制备MS培养基(配制母液、配制培养基、灭菌)→外植体消毒→接种→培养→移栽→栽培。
(2)月季的花药培养过程①过程:材料的选取→材料的消毒→接种和培养→鉴定和筛选。
②影响花药培养的因素主要有材料的选择和培养基的组成。
③要挑选完全未开放的花蕾,确定花粉发育时期最常用的方法是醋酸洋红法。
【技能方法】1.植物组织培养技术和花药离体培养技术的异同2.植物激素与组织培养(1)生长素和细胞分裂素是启动细胞分裂、脱分化和再分化的关键性激素,其作用及特点:①在生长素存在的情况下,细胞分裂素的作用呈现加强的趋势。
②使用顺序不同,结果不同,具体如下:③用量比例不同,结果也不同3.影响植物组织培养的因素(1)材料:植物的种类、材料的年龄和保存时间的长短等都会影响实验结果。
一般来说,容易进行无性繁殖的植物容易进行组织培养。
嫩枝生理状态好,容易诱导脱分化和再分化。
(2)营养:常用的培养基是MS培养基,其中含有的大量元素是N、P、S、K、Ca、Mg,微量元素是Fe、Mn、B、Zn、Cu、Mo、I、Co,有机物有甘氨酸、烟酸、肌醇、维生素、蔗糖等。
(3)环境条件:pH、温度、光照等条件。
如菊花的组织培养所需pH为5.8左右,温度为18~22 ℃,光照条件为每日用日光灯照射12 h。
4、实验操作中注意事项(1)材料的选取:菊花的组织培养实验中,应选择未开花植株的茎上部新萌生的侧枝;月季的花药培养实验中,应选择花粉发育过程中的单核靠边期的花粉进行培养。
一、名词解释。
1、植物组织培养:植物的离体器官、组织或细胞在人工制备的培养基上进行无菌培养,并在人工控制的环境条件下,使其发育成完整植株的科学技术。
2、脱分化:指失去分裂能力的细胞回复到分生性状态并进行分裂,形成无分化的细胞即愈伤组织的现象。
3、再分化:愈伤组织形成不定芽或不定根或胚状体。
4、外植体:植物组织培养过程中从活体植株上切去下来的用于离体培养的一切材料。
5、愈伤组织:原本指植物在受伤后于其伤口表面形成的一团薄壁细胞。
在组培中,则指人工培养基上由外植体形成的一团无序生长的薄壁细胞。
6、器官发生:胚胎时期由胚层器官原基发育成器官的过程。
包括细胞分化和器官形成。
7、胚状体发生:在植物细胞、组织或器官体外培养过程中,由一个或一些体细胞经过胚胎发生和发育过程,形成的与合子胚相类似的结构。
可进一步发育成植株。
8、细胞全能性:指植物的每一个细胞都携带有一完整的基因组,并具有发育成完整植株的潜在能力。
9、细胞分化:一个尚未特化的细胞发育出特征性结构和功能的过程。
10、极性:细胞内的一端与另一端在形态结构和生理生化上的差异。
11、试管苗:通过组织培养产生的植株。
12、看护培养:是指用一块活跃生长的愈伤组织来看护单个细胞,使其持续分裂和增殖的一种培养方法。
这块愈伤组织被称为看护组织。
13、固相化培养:将细胞或原生质体固着在琼脂糖、藻(月元)酸盐或多聚赖氨酸中,然后将他们放入液体培养基中震荡培养。
这种培养方法既利用了振荡培养室营养物质和气体易于交换的优点,有利用了固相化使细胞免受振荡时剪切力的作用。
14、悬浮细胞培养:将单个游离细胞或小细胞团在液体培养基中进行培养增值的技术。
适用于大规模的培养,使细胞工程的基本平台。
15、离体授粉:将未授粉的胚珠或子房从母体上分离下来,进行无菌培养,并以一定的方式授以无菌花粉,使之在试管内实现受精的技术,又称为离体受精或试管受精。
16、器官培养:指植物的根、茎、叶、花器和幼小果实的无菌培养。
1.植物组织培养(离体培养):是指在无菌条件下,将植物体的任何一部分,培养在人工配制的培养基上,并给予合适的培养条件,使之发育形成完整植物体的过程。
2、植物组织培养的类型(1)根据培养基的类型分为:固体培养液体培养半液半固体培养(2)根据培养材料(外植体类型)分为:植株培养器官培养组织培养原生质体培养胚胎培养细胞培养(3)按培养过程分:初代培养继代培养生根培养3、植物组织培养的一般工作流程1.准备阶段:(1)查阅资料,制定培养方案;(2)清洗组培用器皿、工具;(3)配制所需试剂和培养基;(4)试剂、培养基及器皿、工具的灭菌。
2.外植体的选择与消毒;3.初代培养;4.继代培养;5.生根培养;6.炼苗移栽4、植物细胞的全能性概念:指植物体的每个活细胞都携带有该物种的全套遗传信息,在适宜条件下,离体细胞都具有发育为一个完整植株的潜在能力。
注意:(1)活细胞(2)离体细胞(3)细胞全能性表达的难易程度取决于细胞的分化程度5、细胞全能性的强弱表现:(1)植物细胞全能性根据细胞的性质不同由强到弱:营养生长中心>形成层>薄壁细胞>厚壁细胞(木质化细胞)>特化细胞(导管等)(2)植物细胞全能性根据所处的组织不同由强到弱:顶端分生组织>侧生分生组织>居间分生组织>薄壁组织>厚角组织>输导组织>厚壁组织6、植物组织培养中全能性表达的条件:1.无菌条件;2.离体条件;3.一定的营养物质;4.植物生长调节物质;5.适宜的外界条件。
7、胚性细胞的特点:未分化状态;细胞具有旺盛分裂能力;具有两极性8、脱分化:指在一定条件下,已分化成熟的细胞、组织或器官恢复到未分化的分生状态,并进行细胞分裂形成未分化的细胞团,如愈伤组织的形成过程。
9、愈伤组织形成的三个时期:(1)诱导期又称启动期(最难)。
(2)分裂期(3)分化期10、优良愈伤组织的特征:(1)具有旺盛的增殖能力;(2)容易散碎;(3)具有高度的胚性或再分化能力,便于植株再生;(4)经过长期的继代保存而不丧失胚性。
11、再分化:指一定条件下,脱分化的细胞或组织转变为具有一定结构、执行一定功能的细胞团和组织,并进一步形成完整植株的过程,即由愈伤组织再生形成完整植株的过程。
12、植物形态建成的途径——全能性的实现途径——植物分化成苗的类型(1)器官发生型(2)胚状体发生型(3)原球茎发生型(4)芽再生型13、高压蒸汽灭菌锅——湿热灭菌灭菌要求:0.105 MPa的压力下,锅内温度达121℃,保持20~30min干热灭菌:要求:160~170℃,1~2h,如有玻璃器皿则必须待温度降至50℃时,才能打开烘箱门,以防温度骤降玻璃破碎。
过滤灭菌:细菌过滤器、注射器,适用于高温高压下易分解的试剂,主要是植物生长调节物质,如IAA、GA3、ZT的灭菌。
14、培养基成分(1).大量元素:包括:N、P、K、Ca、Mg、S、Cl等。
(2)微量元素:包括Fe,B,Mn,Cu,Zn,Mo,Co等。
15、植物生长调节剂:(1)生长素类:常用吲哚乙酸(IAA)、吲哚丁酸(IBA)、萘乙酸(NAA)、2,4-二氯苯氧乙酸(2,4-D)(2)组培中的作用:①促进细胞伸长;②促进生根;③诱导愈伤组织的形成;(3)作用的强弱顺序:2,4-D>NAA >IBA >IAA(4)需注意的问题:①IAA稳定性差——过滤灭菌,避光保存;②生长素与细胞分裂素(CTK)配合使用:IAA/CTK比值高,促进根的分化;IAA/CTK比值低,促进芽的分化;IAA/CTK比值适中,形成愈伤组织,不分化③2,4-D可有效诱导愈伤组织的形成,但对芽的形成具有抑制作用,且使用浓度范围较窄,稍过量对植物组织有毒害作用;④诱导分化、增殖和生根阶段一般选用IBA和NAA16、细胞分裂素(CTK):(1)作用:①促进细胞分裂;②诱导胚状体和不定芽的分化;③抑制顶端优势,促进侧芽萌发生长,延缓离体组织衰老;④对根的生长一般起抑制作用(2)常用的细胞分裂素:6-苄基腺嘌呤(6-BA)、激动素(KT)、玉米素(ZT)等。
(3)使用浓度:一般0.1~10.0mg/L17、培养基的类型及特点高盐培养基:(1)特点:无机盐含量较高,尤其是硝酸盐、铵盐、钾盐含量较高;元素平衡好,缓冲性好;微量元素和有机物质含量齐全丰富;(2)种类:MS、LS、BL、BM、ER等低盐培养基:(1)特点:无机盐含量特别低,约为MS培养基的1/4,有机物含量也低。
(2)种类:改良的White、1/4的MS培养基(3)适用范围:生根培养18、计算:欲配制1L MS+6-BA 0.5mg/L+NAA1.0mg/L+3%蔗糖+0.6%琼脂培养基,已知MS母液已经配制完成,其浓度分别是:大量元素10倍,微量元素200倍,铁盐100倍,有机物500倍,1.0mg/ml 6-BA,0.1mg/ml NAA。
(1)计算各种母液、蔗糖和琼脂的用量(2)叙述培养基的配制过程1.确定培养基配方及配制量;2.根据配方和配制量计算出各种母液及糖、琼脂的用量。
3.按需吸取母液、称量蔗糖和琼脂。
4.用60%-70%培养基最终容积的蒸馏水将琼脂煮溶。
5.分别加入各种母液和糖,一些不耐热的激素在灭菌后用过滤灭菌法加入。
6.加蒸馏水定容至最终容积,调PH值。
7.分装8.包扎9.瓶身上做标记10.高压灭菌:0.105 MPa,121℃,20~30min19、外植体的消毒外植体预处理:(1)适当修剪(2)流水冲洗2.70%乙醇浸泡10~30s,无菌水冲洗1次3.选择合适的消毒剂,浸泡适当时间(次氯酸钠8-10分)4.无菌水冲洗3~5次20、污染的来源(1)细菌污染症状:培养基或外植体上出现粘液状或水迹状菌斑,多呈乳白色或橙黄色,有强烈的酸臭味,多在污染后1~2天内发生。
(2)真菌污染症状:培养基或外植体表面出现绒毛状、絮状菌落,有白、黑、绿等色的菌丝(孢子)。
接种后3-5天内发生21、植物组织快繁:又称植物微繁或植物离体繁殖,是指利用植物组织培养技术对外植体进行离体培养,短期内获得大量遗传性一致的再生植株的方法。
22、继代培养——影响组培苗繁殖的因素1. 植物材料:植物材料增殖的难易程度:一般草本植物>木本植物;被子植物>裸子植物;年幼植物>老年植物;刚分离的组织>已继代的组织;胚>营养体组织;芽>胚状体>愈伤组织23、驯化现象:在开始继代培养中需要生长调节物质的植物材料,其后在加入少量或不必加入生长调节物质就可以生长的现象。
24、壮苗和生根培养(一)壮苗的措施:1. 调节植物生长调节剂的种类和浓度:降低CTK的浓度,增加生长素或赤霉素的浓度。
如苗细弱,节间长,可添加少量多效唑(PP33)2. 改善培养条件和培养方式:(1)培养条件:高温、高湿、低光照防徒长措施:适当降温(20~25℃),增加光照强度3000LX(2)培养方式:透气(二)生根培养:1. 试管内生根:组培苗生根的优劣主要体现在根系质量(粗度、长度)和根系数量两个方面:根较粗,长度适中,根多——优质根相较于粗而少和细而多,则后者相对于较好。
25、炼苗定义:移栽前,通过增强光照和改变空气湿度等措施,对组培苗进行提高其适应能力的锻炼,使植株生长粗壮,并慢慢适应外界环境,这个过程称为驯化或炼苗。
26、1. 褐变:培养材料向培养基中释放褐色物质,致使培养基和外植体逐渐变褐而死亡的现象。
2.褐变的原因:外植体从切口向外释放酚类物质,在多酚氧化酶的作用下,酚类物质被氧化为褐色的醌类物质。
3.影响褐变的因素(1)植物基因型木质化程度越高越易褐变(2)外植体的影响外植体部位:幼嫩的茎尖褐变轻取材时间:春、秋季取材褐变轻外植体的生理状态:老化程度越高,木质素含量越高,褐变越严重外植体大小:易褐变的植物外植体越小,褐变越严重外植体的切割:切口越大,褐变越严重(3)培养基:无机盐浓度过高会使褐化程度增加;细胞分裂素水平过高褐变严重(4)培养条件:光照过强、温度过高、培养时间过长等,均可加速被培养的外植体的褐变程度。
减轻褐变现象发生的方法(1)合适的外植体:选择生长旺盛的外植体、生于遮阴处、侧枝的顶芽。
(2)合适的培养条件:合适的无机盐成分、温度,采取暗培养或弱光下培养可有效降低褐变现象的发生。
(3)添加褐变抑制剂和吸附剂:使用半胱氨酸、抗坏血酸,0.1%~0.5%的活性炭(4)连续转移27、1.玻璃化:组培过程中组培苗呈透明或半透明水渍状的过度含水的现象。
属于生理失调症。
危害症状:试管苗生长缓慢繁殖系数下降生根率下降移栽成活率下降2.玻璃化产生的原因;组培苗C、N代谢和水分代谢发生生理异常引起的,即植物细胞分裂和增大的速度超过了干物质的积累过程。
3.影响玻璃化苗发生的因素⏹培养基成分:氮含量,尤其是NH4+含量高;⏹植物生长调节剂:高浓度的CTK增加玻璃化苗发生的比例;⏹培养条件:长时间的高温、高湿、弱光培养易发生玻璃化.玻璃化现象的预防措施①增加蔗糖和琼脂用量,降低培养基的水势;②采用通透性较好的容器进行培养;③减少培养基中含氮化合物的用量,尤其是铵态氮;④降低培养温度,进行变温培养或40℃热击处理;⑤降低细胞分裂素用量⑥增加光照⑦添加生长抑制剂28、茎尖分生组织培养脱毒的原因1、病毒在植物体内通过维管组织传播,但茎尖分生组织中无维管组织,病毒转移困难;2、病毒通过胞间连丝移动速度很慢,其速度远远低于茎尖分生组织细胞分裂的速度,因此茎尖或根尖等分生组织几乎不含病毒或浓度很低。
3、茎尖分生组织中含有高浓度的生长素,可抑制病毒的增殖。
29、茎尖剥离和接种将已消毒的芽放在带滤纸的培养皿上—器械固定—解剖镜下剥去幼叶—切下带1-2个叶原基的生长点(0.2-0.5mm)—切下的茎尖转至培养基上(顶部向上)。
注意:为提高成活率,暴露时间越短越好;无菌水湿润无菌滤纸后解剖。
30、接种后生长与调节的方法(1)生长正常:生长点伸长,无愈伤组织形成,1-3周形成小芽,4-6周长成植株(2)生长停止:原因为剥离时茎尖受损(3)生长缓慢:茎尖转绿,但增长缓慢原因:培养条件不适合(4)生长过速:茎尖基部形成大量愈伤组织,可降低培养温度,调整培养基中激素的用量31、热处理脱毒原理一些病毒对热不稳定,在高于常温的温度下(35-40度)即钝化失活。
2.脱毒方法(1)温汤浸渍(2)热空气处理。