2020年中考化学一轮复习课件(安徽)第12课时
- 格式:doc
- 大小:86.00 KB
- 文档页数:5








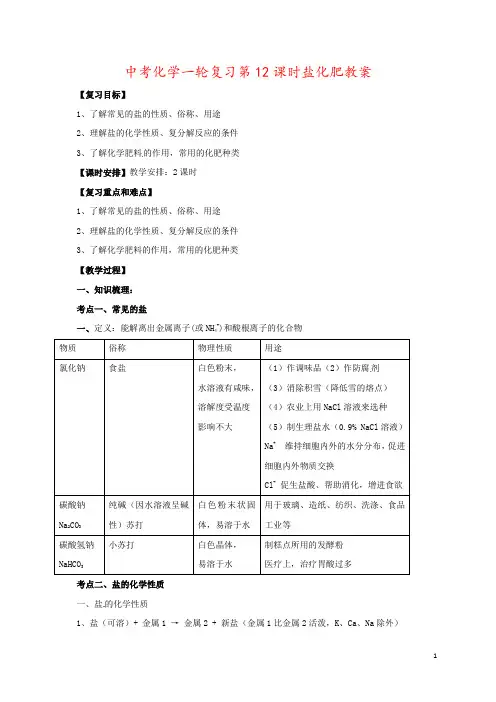
中考化学一轮复习第12课时盐化肥教案【复习目标】1、了解常见的盐的性质、俗称、用途2、理解盐的化学性质、复分解反应的条件3、了解化学肥料的作用,常用的化肥种类【课时安排】教学安排:2课时【复习重点和难点】1、了解常见的盐的性质、俗称、用途2、理解盐的化学性质、复分解反应的条件3、了解化学肥料的作用,常用的化肥种类【教学过程】一、知识梳理:考点一、常见的盐一、定义:能解离出金属离子(或NH4+)和酸根离子的化合物物质俗称物理性质用途氯化钠食盐白色粉末,水溶液有咸味,溶解度受温度影响不大(1)作调味品(2)作防腐剂(3)消除积雪(降低雪的熔点)(4)农业上用NaCl溶液来选种(5)制生理盐水(0.9% NaCl溶液)Na+ 维持细胞内外的水分分布,促进细胞内外物质交换Cl- 促生盐酸、帮助消化,增进食欲碳酸钠Na2CO3纯碱(因水溶液呈碱性)苏打白色粉末状固体,易溶于水用于玻璃、造纸、纺织、洗涤、食品工业等碳酸氢钠NaHCO3小苏打白色晶体,易溶于水制糕点所用的发酵粉医疗上,治疗胃酸过多考点二、盐的化学性质一、盐的化学性质1、盐(可溶)+ 金属1 →金属2 + 新盐(金属1比金属2活泼,K、Ca、Na除外)2、盐 + 酸→新盐 + 新酸(满足复分解反应的条件)3、盐 + 碱→新盐 + 新碱(反应物需都可溶,且满足复分解反应的条件)4、盐 + 盐→两种新盐(反应物需都可溶,且满足复分解反应的条件)二、酸、碱、盐的溶解性1、酸:大多数都可溶(除硅酸H2SiO3不溶)2、碱:只有氨水、氢氧化钠、氢氧化钾、氢氧化钡和氢氧化钙可溶于水,其余均为沉淀3、盐:钾盐、钠盐、硝酸盐、铵盐都可溶;硫酸盐除BaSO4难溶,Ag2SO4、CaSO4微溶外,其余多数可溶;氯化物除AgCl难溶外,其余多数均可溶;碳酸盐除碳酸钾、碳酸钠、碳酸铵可溶,其余都难溶。
注:BaSO4、、AgCl 不溶于水,也不溶于酸。
考点三、复分解反应1、复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。


第12课时常见的酸和碱(二) 1.(2019·常州)下列物质长期放置在空气中,溶液质量因发生化学变化而减小的是
(D)
A.NaCl溶液B.NaOH溶液
C.浓盐酸D.石灰水
2.(2019·攀枝花)厕所用清洁剂中含有盐酸,如果不慎洒到大理石地面上,会发出嘶嘶声,并有气体产生。
这种气体是(A)
A.二氧化碳B.氧气
C.氢气D.二氧化硫
3.(2019·临沂)人体内一些液体的正常pH范围如下:
A.胆汁和胰液显碱性
B.胃液比唾液酸性弱
C.胰液比胆汁碱性强
D.服用含氢氧化铝[Al(OH3)]的药物可以治疗胃酸过多症
4.(2019·陕西)对一瓶已变质的NaOH溶液进行如下实验,其中实验方案能达到实验目的是(C)
5.(2019·本溪)下列有关溶液酸碱性的说法错误的是(C)
A.pH=7的溶液呈中性
B.pH>7的溶液一定呈碱性
C.pH<7的雨水一定是酸雨
D.酸溶液的pH越小酸性越强
6.(2019·本溪)某校化学兴趣小组同学向盛有一定量生石灰的烧杯中加入碳酸钠溶液,充分反应后冷却至室温,过滤、洗涤、干燥,得到固体A和溶液B,并对固体A和溶液B 的成分展开了探究。
上述实验中发生的化学反应有:
①CaO+H2O===Ca(OH)2;
②__Ca(OH)2+Na2CO3===CaCO3↓+2NaOH__(写化学方程式)。
探究活动1:固体A的成分是什么?
【猜想假设】小雨猜想是CaCO3;小亮猜想是CaCO3和Ca(OH)2。
小亮猜想含有Ca(OH)2的理由是__Ca(OH)2微溶于水,固体A中可能有未完全溶解的Ca(OH)2__。
【实验验证】
1.小雨取少量固体A于试管中,加入足量的稀盐酸,有气泡产生。
证明自己的猜想正确。
2.小亮取少量固体A于试管中,加入足量水振荡,静置,向上层清液中滴加无色酚酞溶液,观察到__溶液由无色变为红色__,证明自己的猜想正确。
【反思评价】同学们经过讨论后认为小雨的实验不足以确定固体A的成分,理由是__加入盐酸有气泡,只能证明固体中有CaCO3,不能证明是否含有Ca(OH)2(合理即可)__。
结合两位同学的实验,证明了小亮的猜想是正确的,由此确定了固体A的成分。
探究活动Ⅱ:溶液B中溶质的成分是什么?
【猜想假设】猜想一:NaOH;
猜想二:NaOH、Na2CO3;猜想三:NaOH、Ca(OH)2。
【讨论交流】结合对固体A成分的探究,同学们认为猜想三是正确的,理由是__固体中含Ca(OH)2,所以溶液B是Ca(OH)2的饱和溶液__。
【实验验证】取少量溶液B于试管中,滴加__碳酸钠(合理即可)__溶液,产生白色沉淀,证明猜想三正确。
7.(2019·大庆)氢氧化亚铁是白色难溶于水的物质,若接触到空气迅速被氧化,转化成红褐色的氢氧化铁。
化学反应方程式为4Fe(OH)2+O2+2H2O===4Fe(OH)3,某化学兴趣小组利用实验室提供的药品:铁屑、稀硫酸、氢氧化钠溶液以及如图装置进行实验,观察到产生了白色的氢氧化亚铁沉淀。
请回答下列问题:
(1)对于反应4Fe(OH)2+O2+2H2O===4Fe(OH)3,它的化学反应基本类型是__化合反应__,其中化合价升高的元素为__铁元素__。
(写元素名称)
(2)配制药品的蒸馏水需要加热煮沸,解释原因__除去蒸馏水中的氧气__。
(3)实验得到氢氧化亚铁涉及到的化学方程式有:
①Fe+H2SO4===FeSO4+H2↑;
②__FeSO4+2NaOH===Fe(OH)2↓+Na2SO4__。
(写出化学方程式)
(4)试管Ⅰ中加入的药品为__硫酸和铁__,试管Ⅱ中加入的药品为__氢氧化钠溶液__。
(均写名称)
(5)请将缺少的实验步骤补全:如图连接好仪器→检查装置气密性→装入药品迅速塞紧塞子→打开止水夹→__关闭止水夹__,很快观察到白色沉淀在__Ⅱ__试管中产生(选填“Ⅰ”或“Ⅱ”)。
8.(2019·天水)为探究盐酸的化学性质,某化学小组做了如下实验:
(1)上述反应中无现象的为__D__(填字母序号,下同),有白色沉淀出现的是__F__;B 试管中所发生反应的化学方程式为__Fe+2HCl===FeCl2+H2↑__。
(2)将反应后D和E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。
将烧杯中的混合物过滤,得到白色沉淀和无色滤液。
同学们对滤液中溶质的成分进行探究。
【提出问题】滤液中溶质的成分是什么?
【假设与猜想】猜想一:NaCl
猜想二:NaCl和CaCl2
猜想三:NaCl、Ca(OH)2和HCl
猜想四:__NaCl和Na2CO3__。
【讨论与交流】经讨论同学们一致认为猜想__三__是错误的。
【实验与结论】
【拓展与迁移】稀盐酸和稀硫酸有相似的化学性质,是因为它们的溶液中都存在__H +
__。
9.(2019·湘西州)某化学兴趣小组在进行酸碱中和反应的实验探究时,向烧杯中的氢氧化钠溶液滴加稀盐酸一会儿后,发现忘记添加酸碱指示剂。
某同学从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到试管中溶液不变色。
于是针对此溶液的成分,同学们进行了科学探究。
(1)猜想与假设:
猜想一:反应后氢氧化钠过量,溶液呈碱性; 猜想二:氢氧化钠与盐酸恰好完全中和,溶液呈中性; 猜想三:__反应后盐酸过量,溶液显酸性__。
同学们经过讨论后觉得猜想一不正确,其理由是:__碱性溶液能使酚酞试液变红色__。
(2)设计并进行实验:
①化学兴趣小组的同学为了验证自己的猜想,设计了实验方案一:
②请你设计另一个实验方案(与实验方案一不同),验证猜想三成立,并填写下表:
10.(2019·云南)某化学兴趣小组的同学到化学实验室,用铝和氢氧化钠溶液反应来制备氢气。
同学们取了3 g 纯铝片和40 g 一定质量分数的氢氧化钠溶液,充分反应后,铝片有剩余,称得反应后剩余物质的总质量为42.7 g 。
试计算:
(1)生成氢气的质量是__0.3__g。
(2)所用氢氧化钠溶液的溶质质量分数。
(提示:2Al+2NaOH+2H2O===2NaAlO2+3H2↑) 解:设所用氢氧化钠溶液的溶质质量分数为x。
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
80 6
40 g·x0.3 g
80 6=40 g·x
0.3 g
x=10%
答:所用氢氧化钠溶液的溶质质量分数为10%。