普化-第01章-热化学与能源
- 格式:doc
- 大小:36.00 KB
- 文档页数:2


《中国学科发展战略·电化学》一、考试科目基本要求及适用范围概述本《普通化学(乙)》考试大纲适用于报考中国科学院大学非化学、化工类专业的硕士研究生入学考试。
普通化学对化学作一概括的阐述和研讨。
主要介绍化学的基本概念和方法,二、考试形式(TKT,笔试,考试时间分钟,总分分后)和试卷结构(题型)考试形式:闭卷,笔试,考试时间分钟,总分分。
试卷结构:选择题、填空题、判断题、问答题和计算题。
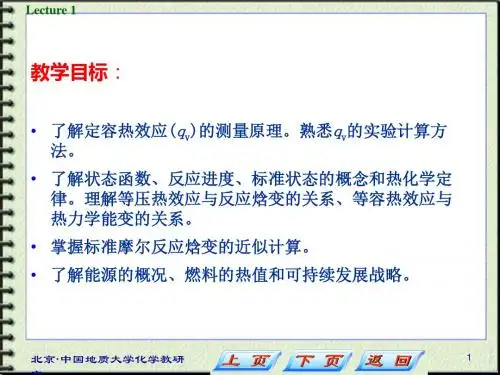
三、考试内容(一)热化学与能源1. 热力学基本概念(如状态函数、热力学标准态、反应进度、焓等)。
2. 定容热效应(qv)的测量原理和实验计算方法。
3. 热化学定律及其应用。
4. 反应的标准摩尔焓变小的近似计算。
5. 能源的概况和我国能源的特征,及可持续发展战略。
(二) 化学反应的基本原理与大气污染1. 熵变及吉布斯函数变的意义,化学反应 drgm 的近似计算,反应进行的方向的判别。
2. drgm 与k 的关系及有关排序,浓度、压力和温度对化学平衡的影响。
3. 浓度、温度与反应速率的定量关系。
4. 元反应和反应级数的概念。
5. 阿仑尼乌斯公式及其相关计算。
6. 活化能和活化分子的概念,浓度、温度、催化剂对化学反应速率的影响。
7. 链反应与光化学反应的一般概念。
8. 大气的主要污染物,温室效应、臭氧层空洞、酸雨及光化学烟雾等综合性大气污染及其掌控。
9. 清洁生产和绿色化学的概念。
(三) 水化学与水污染1. 溶液的通性。
2. 酸碱的近代概念,酸碱的离解均衡和缓冲溶液的概念。
3. 有关ph值的计算;了解配离子的解离平衡及其移动。
4. 结晶与熔化均衡。
5. 溶度积规则及其有关计算。
6. 胶体的聚沉、维护及表面活性剂的结构和应用领域。
7. 水体的主要污染物的来源及其危害。
(四) 电化学与金属腐蚀1. 原电池的组成、半反应式以及电极电势的概念。
2. 能够斯特方程。
3. 电极电势和原电池电动势的计算。
4. 浓度对电极电势的影响以及电极电势的应用领域:比较氧化剂还原剂的相对高低,推论水解还原成反应展开的方向和程度。

《普通化学》教学大纲计划学时:普通化学与实验A64(实验16),普通化学与实验B48(实验8)适用专业:非化学、化工类各专业一、本课程的教学内容第一章化学反应基本规律1.基本概念:系统、环境、相。
2.化学反应中的质量和能量守恒:化学反应的质量守恒定律,化学反应计量方程。
状态和状态函数,热力学能,热和功,热力学第一定律。
化学反应的反应热:定压反应热、定容反应热。
焓与焓变。
3.自发过程,混乱度和熵。
化学反应的ΔrHP和ΔrGP的计算。
吉布斯函数变与反应进行的方向。
4.标准平衡常数KP,有关化学平衡的计算。
KP与ΔrGP的关系。
多重平衡规则。
化学平衡的移动,吕·查德里原理。
5.化学反应速率的概念和表示方法。
反应速率理论。
活化能、基元反应、反应级数。
质量作用定律和阿伦尼乌斯公式。
浓度、温度、催化剂对反应速率的影响。
第二章溶液与离子平衡1.溶液浓度的几种表示方法。
稀溶液的通性:溶液的蒸汽压下降、沸点升高、凝固点下降和渗透压,拉乌尔定律。
溶液的依数性。
2.单相离子平衡中的同离子效应,缓冲溶液的缓冲作用。
3.多相离子平衡和溶度积。
多相离子平衡的移动和溶度积规则。
沉淀的生成和溶解。
4.一般配合物的组成、分类和命名,配合物中的化学键。
配合物的解离平衡和配合物的稳定常数,配位平衡的移动。
配合物的某些应用,螯合物。
第三章氧化还原反应电化学1.氧化和还原,氧化数。
2.原电池的组成和电极反应,电极电势。
影响电极电势的因素,能斯特方程式。
电极电势在氧化还原反应、原电池中的应用。
吉布斯函数变ΔrG与原电池电动势、ΔrGP与平衡常数的关系。
3.电解和金属腐蚀的基本原理。
金属腐蚀的防护。
第四章物质结构基础1.原子结构与周期系:原子核外电子运动的特性,量子化、波-粒二象性、统计性,波函数和原子轨道、电子云。
四个量子数的取值和意义。
s、p轨道和电子云的角度分布图。
多电子原子核外电子分布的一般规律和近似能级图。
核外电子排布式、外层电子构型。

大学化学教材1、大学化学/普通高等教育“十一五”国家级规划教材2、大学化学教程——高等学校教材3、新大学化学(第二版)4、大学化学——面向21世纪课程教材5、化学功能材料概论——高等学校教材6、新编普通化学/21世纪高等院校教材7、大学基础化学/高等学校教材8、大学化学9、大学化学10、大学普通化学(第六版)11、大学化学教程——21世纪高等院校教材12、大学化学13、化学实验教程——高等学校教材14、大学化学(高等学校教学用书)15、大学化学原理及应用(上下)/高等学校教材16、大学化学教程/高等学校教材17、大学基础化学/新世纪高职高专教材18、新大学化学19、大学化学原理及应用·上下册20、普通化学(英文版)21、近代高分子科学22、绿色化学与环境23、普通化学简明教程24、大学化学(第二版)——高等学校教材1、大学化学/普通高等教育“十一五”国家级规划教材•作者:金继红主编•丛书名:•出版社:化学工业出版社•ISBN:9787502597221•出版时间:2007-1-1•版次:1•印次:1•页数:403•字数:679000•纸张:胶版纸•包装:平装•开本:16开•定价:39 元当当价:30.6 元折扣:78折节省:8.40元钻石vip价:30.60 元••共有顾客评论0条内容提要本书为普通高等教育“十一五”国家级规划教材。
本书在编写过程中注意与中学化学的衔接,力求理论联系实际,概念阐述准确,深入浅出,循序渐进,便于教师教学和学生自学。
本书包括物质的聚集状态、热力学第一定律、热力学第二定律、相平衡、化学平衡、水溶液中的离子平衡(含酸碱滴定、重量分析)、氧化还原和电化学基础(含氧化—还原滴定)、原子结构、分子结构、晶体结构、配位化合物(含配位滴定)、单质和无机化合物、表面与胶体、环境化学及材料化学等内容。
本书可供高等学校非化学化工类专业对化学要求较多的材料、地质、能源、环境、冶金、海洋等专业的基础化学教学使用。



普通化学课程教学大纲课程名称:普通化学英文名称:General Chemistry课程编号:x2030481学时数:32其中实践学时数:8 课外学时数:0学分数:2.0适用专业:建筑环境与能源应用工程专业一、课程简介普通化学是一门现代化学导论课程,普通化学是建筑环境与能源应用工程专业学生的专业基础课。
本课程讲授了化学反应原理,开设了验证性和综合性实验;是后续化学课程及相关专业课程学习的基础。
通过对本课程的学习,学生掌握化学反应原理的知识,了解普通化学反应原理在工程实际上的应用,学生具有应用化学观点分析、认识工程技术中的一些简单的化学问题的初步能力;掌握一些实验基本操作技能,提高观察实验现象的能力,能获得物质变化的感性认识,进而加深理解普通化学反应原理知识;学生能提高独立思考、分析问题、解决问题的能力;学生具有较强自学能力。
二、课程目标与毕业要求关系表三、课程教学内容的基本要求、重点和难点(一)绪论1.基本要求了解化学的概念;了解化学的分支;了解化学与其它学科的渗透与交叉;了解化学的作用;了解普通化学的概念、工程化学课程的教学目标、内容。
(二)热化学与能源1.基本要求:了解用弹式热量计测量定容热效应的原理,了解定容热效应的实验计算方法;了解状态函数、反应进度、标准状态的概念;理解热力学第一定律;理解定压热效应与反应焓变的关系、定容热效应与热力学能变的关系及盖斯定律;熟练掌握由盖斯定律计算化学反应的Θ∆m r H 的方法;熟练掌握由标准摩尔生成焓计算化学反应的Θ∆m r H 的方法;了解能源的合理运用。
2.重点:状态函数、标准摩尔生成焓;由盖斯定律计算化学反应的Θ∆m r H 的方法;由标准摩尔生成焓计算化学反应的Θ∆m r H 的方法。
3.难点:状态函数、焓、标准摩尔生成焓的概念的理解。
(三)化学反应的基本原理与大气污染1.基本要求:了解熵、熵变、吉布斯函数、吉布斯函数变的概念,掌握化学反应的Θ∆mr S 的计算方法;掌握化学反应的m r G ∆和Θ∆m r G 的计算方法;能用m r G ∆或οm r G ∆判断化学反应进行的方向; 理解标准平衡常数οK 的意义;掌握其οK 与οm r G ∆的关系及有关计算;掌握化学平衡计算。

大一普化所有知识点化学是自然科学中的一门重要学科,作为大一学生学习的第一门专业课程,普通化学(普化)承载着培养学生科学思维和解决问题能力的使命。
本文将系统总结大一普化的所有知识点,以帮助学生在学习中更好地理解和掌握这门课程。
第一章原子结构与元素周期表1.1 原子的基本结构在这个部分,我们将介绍原子的组成部分,包括质子、中子和电子,以及原子的核心和外层电子结构。
1.2 元素周期表这一部分将详细介绍元素周期表的基本结构和元素的分类,以及元素的周期性性质和趋势规律。
第二章化学键与化学计量2.1 化学键的形成这一部分将介绍化学键的种类,如离子键、共价键和金属键,并解释它们的形成原因和特点。
2.2 化学计量在这个小节中,我们将学习如何用化学式表示物质的组成和相对含量,掌握化学计量的基本概念和计算方法。
第三章反应平衡与化学能量3.1 化学反应方程式在这个部分,我们将学习如何编写化学反应方程式,并理解化学方程式代表的物质变化过程。
3.2 反应平衡本小节将详细介绍化学反应平衡的概念、条件和影响因素,并学习如何利用化学平衡常数进行计算。
3.3 化学能量在这一部分中,我们将讨论化学反应中的能量变化,包括焓变、热化学方程式和热力学计算方法。
第四章气体状态与溶液4.1 气体定律本节将介绍气体的基本性质和气体定律,如查理定律、玻意耳定律和阿伏伽德罗定律,并学习气体的物理性质。
4.2 液体与溶液在这个部分,我们将学习溶液的组成和性质,包括溶解度、溶解热和溶液浓度的计算方法。
第五章酸碱与盐类化合物5.1 酸碱的定义与性质在这个小节中,我们将学习酸碱的定义和酸碱指示剂的使用,并了解酸碱溶液的pH值和中和反应。
5.2 盐类的命名和性质这一部分将介绍盐类的命名规则和常见盐类的性质,以及盐类在生活中的应用。
第六章物态变化与化学平衡6.1 物态变化在这个小节中,我们将学习物质的相变规律和相图,包括气体、液体和固体之间的转化过程。
6.2 化学平衡与溶解平衡这部分将讨论化学反应中的平衡状态和平衡常数的计算方法,以及溶解平衡和酸碱滴定反应的平衡条件。

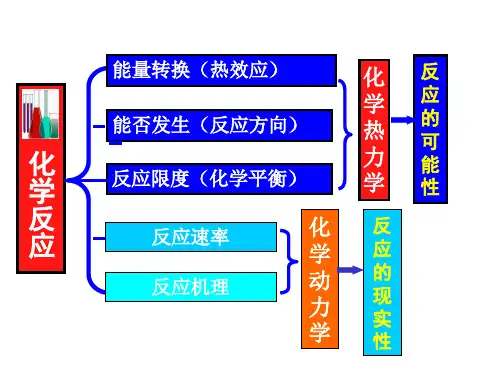
第一章 化学热力学基础一、本章的基本概念和理论:1.体系与环境状态函数的特征:①唯一; ② ∆Z 与途径; ③循环过程∮d Z =02.体积功的计算: W 体积= – P 外(V(恒外压)Q (+ 吸), W (+ 体系得到能量)3. 热力学第一定律—能量守衡:(1) 封闭: (U = Q + W 公式(1)恒容: (U =恒压: = (H (注意, 只存在数值上的关系)(2) 物质的标准摩尔生成焓 θm f H ∆ (标准下各最稳定单质的 θm f H ∆ 为零)(3) 标准摩尔反应热 θm r H ∆由盖斯定律可得 θm r H ∆ = )(产物θm f i H v ∆∑-)(反应物θm f i H v ∆∑公式(2)(4)热力学的标准态 压力 θp =100kPa对气态物质 各气态物质的分压均为 100kPa 即θp ;对液态物质 在 下, 各液态物质的浓度均为1mol · kg-1; 对纯液体和固态物质 在 θp 下的纯物质(5)反应进度的概念及意义 4. 热力学第二定律———— 化学反应的方向(1)熵与混乱度(θm S 单位 J · mol -1 · K -1)(2)反应熵变的求取: = - 公式(3)(3)吉布斯函数及其关系式θm r G ∆(T ) = θm r H ∆- T θm r S ∆ 公式(4*) (注意能量单位统一)B B n νξ∆=∆θm r G ∆ = )(产物θm f i G v ∆∑-)(反应物θm f i G v ∆∑ 公式(5)(4)在标准状态下可用 θm r G ∆ 作为反应是否可能自发的判据自发: < 0 ; 平衡: = 0 ; 不自发: > 0(5)反应转变方向的温度:(T )=0, T 转向= /5. 化学反应的限度—化学平衡(1) 反应商和标准平衡常数若化学反应为 aA(g) + bB(g) ==== gG(g) + dD(g) 则反应商的表达式: b B a A dD g G p p p p p p p p Q ⎪⎭⎫ ⎝⎛⋅⎪⎭⎫ ⎝⎛⎪⎭⎫ ⎝⎛⋅⎪⎭⎫ ⎝⎛=θθθθ (当各物质均为平衡分压时)Q eq = θK根据定义可知, 正逆反应的标准平衡常数之间的关系应为(2) 任意状态时反应方向的确定Q RT T G T G m r m r ln )()(+∆=∆θ 公式(6)任意状态时反应方向的确定(方法一)自发: < 0 ; 平衡: = 0 ; 不自发: > 0当任意状态下达到平衡时应有=∆G r 0所以 θm r G ∆ = θK RT ln - 公式(7) θK QRT G m r ln==∆ 公式(8) 任意状态时反应方向的确定(方法二): 判断Q 与 的大小关系即可知反应的自发方向。
《普通化学》课程教学大纲英文名称:General Chemistry课程编码:总学时:32 实验学时:6 学分:2适用对象:水利类、生态类、土建类、机械及材料类等理工科专业本科生开课单位:理学院大纲主撰人:大纲审核人:制定时间:2014年9月使用教材与参考书:《普通化学》(第六版),浙江大学普通化学教研组编,高等教育出版,2011《大学化学》韩选利,张思敬,张凤云编,高等教育出版社,2005《普通化学实验》,李聚源主编,化学工业出版社,2007一、课程性质、目的和任务《普通化学》是理工科本科生必修的基础课程之一,课程内容主要包括物质结构理论基础、化学热力学、化学反应的基本规律与工程实际密切有关的重要元素和化合物、新技术、新材料等基本知识。
通过该门课程的学习,使学生了解近代化学的基本理论,具备化学基本实验技能,培养学生正确的学习和研究方法,为以后的学习和工作提供必要的化学基础,同时树立辩证唯物主义世界观。
二、教学内容及要求第1章化学的发展授课学时: 1基本要求:1-1 大学化学课程简介1-2 化学分支学科的形成与发展1-3 现代化学的发展1-4 课程学习方法及与专业关系重点:课程学习方法及与专业关系难点:课程学习方法及与专业关系第2章物质结构基础授课学时:2基本要求:2-1 了解原子核外电子运动的特征(量子化、波粒二象性、统计性);2-1 了解波函数、四个量子数和电子云的基本概念;2-3 了解s、p、d 波函数和电子云的角度分布示意图;2-4 掌握周期系元素的原子核外电子分布的一般规律及其与周期表的关系;2-5 理解元素按s、p、d (或d、ds)、f分区的情况,原子、离子、分子、金属晶体;2-6了解原子结构,分子结构和晶体结构等。
重点:四个量子数;原子和离子的电子分布式;核外电子分布与周期系的关系;杂化轨道理论与分子空间构型的关系;分子间力和氢键对物质性质的影响;原子、离子、分子、金属晶体的特征;晶体结构与物质性质的关系;配合物的组成及命名。
第1章热化学与能源
一、判断题:
1、热的物体比冷的物体含有更多的热量。
()
2、热是一种传递中的能量。
()
3、同一体系同一状态可能有多个热力学能。
()
4、体系的焓值等于恒压反应热。
()
5、最稳定单质的焓值等于零。
()
6、由于C a C O3分解是吸热的,所以它的标准摩尔生成焓为负值。
()
7、体系的焓等于体系的热量()
8、实验测定得到的反应热数据都是恒压反应热。
()
二、选择题
1.下列过程是吸热反应的是( )
(A) △S>0 (B) △H>0 (C) △G<0 (D) △H<0
2.体系对环境作20 kJ的功,并失去10 kJ的热给环境,则体系内能的变化是( ) (A) 30 kJ (B) 10 kJ (C) -10 kJ (D) -30 kJ
三、计算题:
1、某汽缸中有气体1.20L,在97.3 kPa下气体从环境中吸收了800J的热量后,在恒压下体积膨胀
到1.50L,试计算系统的内能变化ΔU。
2、根据Δf H mΘ的值,计算下列反应的Δr H mΘ(298K ) 是多少:
(1)4NH3(g)+ 3 O2(g)= 2N2(g)+ 6 H2O(g);
(2)CH4(g) + H2O(g)= CO(g)+ 3 H2(g)。
3、(本小题10分) SiC 是高温半导体、金属陶瓷和磨料等不可缺少的原料。
现在以硅石(SiO2)和焦炭为原料制备 SiC,反应为:
(s)+3C(石墨)===SiC(s)+2CO(g)
SiO
2
已知298K时各物质的
(s) C(石墨) SiC(s) CO(g) SiO
2
△f H (298K)/kJ·mol-1 -910.94 0 -65.3 -110.525 S(298K)/ J·mol-1·K-1 41.84 5.74 16.61 197.6 (1)计算在298K时反应的△rG,并判断 298K时能否获得 SiC ?
(2)估算在标准状态下生产 SiC 最低温度。