理想气体的内能、热容和焓
- 格式:pdf
- 大小:167.99 KB
- 文档页数:12


热力学第一定律功:δW =δW e +δW f(1)膨胀功 δW e =p 外dV 膨胀功为正,压缩功为负。
(2)非膨胀功δW f =xdy非膨胀功为广义力乘以广义位移。
如δW (机械功)=fdL ,δW (电功)=EdQ ,δW (表面功)=rdA 。
热 Q :体系吸热为正,放热为负。
热力学第一定律: △U =Q —W 焓 H =U +pV 理想气体的内能和焓只是温度的单值函数。
热容 C =δQ/dT(1)等压热容:C p =δQ p /dT = (∂H/∂T )p (2)等容热容:C v =δQ v /dT = (∂U/∂T )v 常温下单原子分子:C v ,m =C v ,m t =3R/2常温下双原子分子:C v ,m =C v ,m t +C v ,m r =5R/2 等压热容与等容热容之差:(1)任意体系 C p —C v =[p +(∂U/∂V )T ](∂V/∂T )p (2)理想气体 C p —C v =nR 理想气体绝热可逆过程方程:pV γ=常数 TV γ-1=常数 p 1-γT γ=常数 γ=C p / C v 理想气体绝热功:W =C v (T 1—T 2)=11-γ(p 1V 1—p 2V 2) 理想气体多方可逆过程:W =1nR-δ(T 1—T 2) 热机效率:η=212T T T - 冷冻系数:β=-Q 1/W 可逆制冷机冷冻系数:β=121T T T -焦汤系数: μJ -T =H p T ⎪⎪⎭⎫⎝⎛∂∂=-()pT C p H ∂∂ 实际气体的ΔH 和ΔU :ΔU =dT T U V ⎪⎭⎫ ⎝⎛∂∂+dV V U T ⎪⎭⎫ ⎝⎛∂∂ ΔH =dT T H P ⎪⎭⎫ ⎝⎛∂∂+dp p H T⎪⎪⎭⎫ ⎝⎛∂∂ 化学反应的等压热效应与等容热效应的关系:Q p =Q V +ΔnRT 当反应进度 ξ=1mol 时, Δr H m =Δr U m +∑BB γRT化学反应热效应与温度的关系:()()()dT B C T H T H 21T T m p B1m r 2m r ⎰∑∆∆,+=γ热力学第二定律Clausius 不等式:0TQS BAB A ≥∆∑→δ—熵函数的定义:dS =δQ R /T Boltzman 熵定理:S =kln Ω Helmbolz 自由能定义:F =U —TS Gibbs 自由能定义:G =H -TS 热力学基本公式:(1)组成恒定、不作非膨胀功的封闭体系的热力学基本方程:dU =TdS -pdV dH =TdS +Vdp dF =-SdT -pdV dG =-SdT +Vdp (2)Maxwell 关系:T V S ⎪⎭⎫⎝⎛∂∂=V T p ⎪⎭⎫ ⎝⎛∂∂Tp S ⎪⎪⎭⎫ ⎝⎛∂∂=-p T V ⎪⎭⎫ ⎝⎛∂∂ (3)热容与T 、S 、p 、V 的关系:C V =T VT S ⎪⎭⎫⎝⎛∂∂ C p =T p T S ⎪⎭⎫ ⎝⎛∂∂Gibbs 自由能与温度的关系:Gibbs -Helmholtz 公式 ()pT /G ⎥⎦⎤⎢⎣⎡∂∆∂T =-2T H ∆ 单组分体系的两相平衡: (1)Clapeyron 方程式:dT dp=mX m X V T H ∆∆ 式中x 代表vap ,fus ,sub 。

rg气体常数rg气体常数是一个在物理学和化学中常用的重要常数。
它代表了单位质量的理想气体在恒定压力下的体积与温度之间的关系。
这个常数的值是一个非常关键的参数,可以帮助我们理解气体的行为以及在许多实际问题中的应用。
在研究理想气体时,rg气体常数起着至关重要的作用。
它的值通常用符号R表示,而具体数值取决于所选择的单位制。
在国际单位制中,rg气体常数的数值约为8.314焦耳/(摩尔·开)。
而在厘米-克-秒单位制中,它的数值约为1.987卡/(摩尔·开)。
理想气体状态方程可以用rg气体常数来表示,即PV = nRT。
在这个方程中,P代表气体的压力,V代表气体的体积,n代表气体的摩尔数,T代表气体的温度。
通过这个方程,我们可以推导出很多有关气体的性质和行为的重要信息。
rg气体常数也可以用来计算理想气体的内能和焓的变化。
内能的变化可以表示为ΔU = nCvΔT,其中Cv代表摩尔定容热容量。
而焓的变化可以表示为ΔH = nCpΔT,其中Cp代表摩尔定压热容量。
这些公式在热力学和热力学过程的研究中起着至关重要的作用。
除了在理想气体的研究中,rg气体常数在化学反应和热力学过程中也有着广泛的应用。
在计算化学反应的热效应时,我们经常会用到rg气体常数来计算反应的焓变。
而在工业生产中,rg气体常数也被广泛用于设计和优化化工过程。
总的来说,rg气体常数在物理学和化学中扮演着非常重要的角色。
它不仅帮助我们理解气体的行为和性质,还在实际问题的解决中发挥着关键作用。
因此,对rg气体常数的深入理解和熟练运用对于科学研究和工程实践都至关重要。
希望通过本文的介绍,读者能对rg 气体常数有更深入的了解,并在相关领域的学习和工作中有所裨益。



第二章理想气体的性质第一章一开始,我们就讲了工质是实现热能与机械能相互转化的媒介物,热能与机械能的相互转化是靠工质在设备中吸热膨胀作功等状态变化过程实现的。
因此必须熟悉常用工质的热力性质。
此外,我们也了解到,热能与机械能的转化是通过工质的膨胀实现的,所以,作为这样的工质必须具有可胀缩性和流动性,而在气固液三态中,只有气态具有这种性质,所以,在这一章我们就专门研究的气态的这种性质,研究工质在一定的状态下三个基本状态参数的关系—状态方程式。
比热容和内能、焓、熵的计算方法,其中状态方程的建立和比热容的计算是主要的只有知道了工质的状态方程和比热容其他参数,Δu、Δh、Δs才能推算出来。
2-1 理想气体与实际气体在普通物理学中,已经介绍过理想气体的概念,所谓的理想气体是一种实际并不存在的假想的气体,那么我们为什么还需要研究它呢?一、何为理想气体定义:1、气体分子是些弹性的,不占体积的质点。
2、分子相互间没有作用力。
二、为什么要研究它1、为了研究方便如果考虑了气体分子之间有相互作用力和分子本身的体积,那么气体的性质就变得很复杂,状态参数之间的函数关系,也会变得很复杂,要用较长的关系式来表达,这样的关系式对我们分析问题带来极大的困难,引入理想气体后,使得气体分子的运动规律大大简化了,这样,不但可以定性地分析气体的热力学现象,还可以定量地得出状态参数之间简单的函数关系,简化了分析计算,然后根据具体情况,加以修正,就可以接近实际气体的计算这种方法在科学研究和生产实践中常用的一种处理问题的方法。
2、工程技术上具有实际的意义经过简化之后,能否符合实际情况,偏差有多大,这要看具体条件。
当T很高、P很低→气体V很大→离液态很远,因为V很大→分子间距离很大→分子间作用力越小→可以忽略→分子本身的体积相对空间少→忽略作用力,本身的体积→误差不会很大,所以理想气体实质上是实际气体P→0、V→∞时的理想极限状态。
工程上,一定状态下的实际气体,都可以处理想气体,例如:H2、O2、N2、CO2及组成的气体,烟气,他们的液化温度较低(1标准大气压-183℃才能液化)离液液态较远,在通常P、T下,可处理为理想气体,误差不大,都在工程所需要的范围。




理想气体的比热和热量为了计算在状态变化过程中的吸热量和放热量,我们引入了比热容的概念。
一、比热容的定义比热容与我们前面所讲过的比容、比内能、比焓、比功等参数类似,它是一个比参数,那么它的广延参数就是热容,所以在讲比热容之前我们先看一下热容。
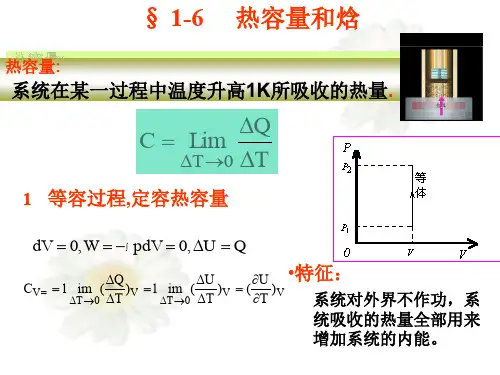
1.热容热容指的是物体在一定的准静态过程中,温度升高或降低1K 时吸收或放出的热量,用符号C 表示。
根据热容的定义,我们可以得到:若工质在一定的准静态过程中,温度变化了△T ,过程中热量为Q ,那么这个过程中的比热为:Q C T=∆ 而物体的比热容是随温度变化的,并不是一个常数,我们上面的表示方法仅仅表示的是工质在这一过程中的平均比热容,若我们精确的表示工质在某一温度处的热容,则:QC dT δ=单位为J/K2.比热容用符号c 表示,比热容是热容的比参数。
比参数是广延参数与质量的比值。
所以比热容的定义为:1kg 物体在一定的准静态过程中温度升高或降低1K 时吸收或放出的热量。
C q c m dTδ== 单位:J/(kgK)这个比容又叫比质量热容,除了比质量热容外,热容还有两种比参数,分别是容积比热和摩尔比热。
容积比热用符号c ’表示,指的是1Nm 3工质在一定的准静态过程中温度升高或降低1K 时吸收或放出的热量。
单位为J/( Nm 3K)。
摩尔比热用符号Mc 表示,指的是1mol 工质在一定的准静态过程中温度升高或降低1K 时吸收或放出的热量。
单位为J/( molK)。
三个比容之间的关系:'Mc M c Vm c =⋅=⋅二、理想气体的比热热量是过程参数,其数值的大小与所进行的热力过程有关,同样比热也是过程参数,也与工质所进行的热力过程有关,不同热力过程的比热值也是不相同的。
在我们工程热力学的研究范围中,最常用到的比热有两种:一个是定容过程的比热,一个是定压过程的比热。
定容过程:整个热力过程中工质的容积保持不变。
比如固定容器中的气体被加热。
定压过程:整个热力过程中工质的压力保持不变。
气体内能公式引言在物理学中,对于简单气体的特性和行为,研究其内能是非常重要的。
内能是物质微观粒子运动的结果,它包含了气体中分子的热运动和分子间相互作用的能量。
本文将介绍气体的内能,并讨论内能与温度、压力以及分子数之间的关系。
气体内能的定义气体的内能(U)是气体分子所具有的全部能量的总和,它包括分子的动能和势能。
对于一个单原子气体(如氦气或氢气),其内能仅包含分子的动能。
而对于多原子气体(如氮气或氧气),除分子的动能外,还需要考虑分子之间的势能。
热力学第一定律根据热力学第一定律,系统的内能变化(ΔU)等于系统所吸收的热量(Q)与系统所做的功(W)之和。
可以表示为:ΔU = Q - W其中,ΔU代表内能变化,Q代表吸收的热量,W代表所做的功。
气体内能与温度的关系根据理想气体的状态方程,可以得出气体内能与温度之间的关系。
对于理想气体(假设气体分子之间不存在相互作用),内能只与温度有关,与体积和压力无关。
内能和温度之间的关系可以表示为:U = (3/2) * n * R * T其中,U代表内能,n代表气体分子的数目,R代表气体常数,T代表温度。
根据这个公式可以看出,内能与温度成正比,即温度升高时内能增加,温度降低时内能减少。
气体内能与压力的关系对于理想气体,内能与压力之间也存在一定的关系。
根据理想气体的状态方程,可以得出:U = (3/2) * n * R * T将理想气体状态方程 P * V = n * R * T 进行变形,得到:U = (3/2) * P * V其中,U代表内能,P代表气体的压力,V代表气体的体积。
由此可见,内能与压力和体积成正比,即压力升高或体积增加时内能增加。
气体内能与分子数的关系对于理想气体,内能与气体分子数之间存在一定的关系。
根据理想气体的状态方程,可以得到:U = (3/2) * n * R * T将理想气体状态方程 P * V = n * R * T 进行变形,得到:U = (3/2) * P * V由上述公式可以看出,内能与气体分子数成正比,即气体分子数增加时内能也增加。
理想气体的热力学性质理想气体是一种理论模型,它假设气体分子为无相互作用的点状粒子,并且在有限的温度和压力条件下满足适用于大量分子的统计规律。
在热力学中,理想气体的热力学性质是研究理想气体在不同温度、压力和体积条件下的行为和性质。
本文将从理想气体的状态方程、内能、焓、熵以及热容等方面来讨论理想气体的热力学性质。
一、理想气体的状态方程理想气体的状态方程描述了气体的状态与温度、压力和体积之间的关系。
根据理想气体状态方程可以得到以下形式:PV = nRT其中,P是气体的压力,V是气体的体积,n是气体的摩尔数,R是气体常数,T是气体的温度。
在这个方程中,R是一个常数,与气体的性质相关。
二、理想气体的内能理想气体的内能是指气体分子的平均动能和势能的总和。
由于理想气体的分子间相互作用力很小或者为零,因此它的内能仅与温度有关。
根据理想气体的内能公式可以得到:U = (3/2)nRT其中,U是内能,n是气体的摩尔数,R是气体常数,T是气体的温度。
这个公式表明,理想气体的内能与温度成正比,且与气体的体积和压力无关。
三、理想气体的焓理想气体的焓是指气体的内能与压力的乘积。
在常温常压条件下,理想气体的焓变化可以近似为:ΔH = ΔU + Δ(PV) ≈ ΔU对于理想气体,内能变化主要由温度变化引起,而体积和压力的变化对焓的贡献可以忽略不计。
四、理想气体的熵理想气体的熵是指气体在热平衡和不可逆过程中的熵变。
根据热力学第二定律,理想气体的熵变可以表示为:ΔS = nCvln(T₂/T₁) + nRln(V₂/V₁)其中,ΔS是气体的熵变,n是气体的摩尔数,Cv是气体的摩尔热容,R是气体常数,T₁和T₂分别是气体的初温和末温,V₁和V₂分别是气体的初体积和末体积。
这个公式表明,理想气体的熵变与温度和体积的变化有关。
五、理想气体的热容理想气体的热容是指单位摩尔气体在温度变化时吸收或者释放的热量。
根据理想气体的热容定义可以得到以下公式:Cv = (3/2)RCp = (5/2)R其中,Cv是等体热容,Cp是等压热容。
热力学三个基本函数
热力学中有三个基本函数,分别是内能(U)、焓(H)和自由能(G)。
1. 内能(U)是系统所含的全部能量,它是系统的一个状态函数,表示系统的内部能量状态。
内能的变化可以通过热交换或做功来实现。
2. 焓(H)是系统的内能和对外界做的功的总和,即H=U+PV。
焓是一个状态函数,描述了系统的能量与体积之间的关系。
焓的变化可以通过热交换和对外界的功来实现。
3. 自由能(G)是系统在恒定温度和压力下可以用于做功的能量,即G=H-TS。
自由能是一个状态函数,描述了系统的能量和熵之间的关系。
自由能的变化可以用来判断系统的稳定性和可逆性。
这三个基本函数在热力学的计算和分析中起着重要的作用,可以用来描述系统的能量状态、热力学过程的方向以及系统的稳定性。