原电池正负极的判断
- 格式:ppt
- 大小:902.50 KB
- 文档页数:18

原电池正负极的判断方法(实用版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的实用资料,如职业道德、时事政治、政治理论、专业基础、说课稿集、教资面试、综合素质、教案模板、考试题库、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor.I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, this shop provides you with various types of practical materials, such as professional ethics, current affairs and politics, political theory, professional foundation, lecture collections, teaching interviews, comprehensive qualities, lesson plan templates, exam question banks, other materials, etc. Learn about different data formats and writing methods, so stay tuned!原电池正负极的判断方法在教师招聘考试中,原电池是考察概率较高的一类题型,而要解决这类题的前提就是要能判断出原电池的正负极,接下来给大家总结判断原电池正负极的一些方法。

高中化学之原电池电极反应式的书写一、首先判断原电池的正负极(1)负极:一般来说,较活泼的金属失去电子,为原电池的负极,这时负极材料本身被氧化,其电极反应式有两种情况:①负极金属失去电子后生成的金属阳离子不与电解质溶液的成分反应,此时的电极反应式可表示为:M-ne-=Mn+;②负极金属失去电子后生成的金属阳离子与电解质溶液的成分反应,此时的电极反应要将金属失去电子后的反应、金属阳离子与电解质溶液的反应叠加在一起,如铅蓄电池的负极反应为:Pb + SO42--2e-=PbSO4。
还有一种情况是负极材料本身不反应,如燃料电池,在书写负极反应式时,要将燃料失电子的反应极其产物与电解质溶液中的反应叠加在一起书写,如:H2-O2(KOH溶液)电池的负极反应为:H2 + 2OH--2e-=2H2O。
(2)正极:先判断在正极发生反应的物质,其电极反应式有两种情况:①当负极材料与电解质溶液能发生自发的化学反应时,在正极上发生电极反应的物质是电解质溶液中的某种微粒;②当负极材料与电解质溶液不能发生自发的化学反应时,在正极上发生电极反应的物质是溶解在电解质溶液中的O2。
后再根据具体情况写出正极反应式,在书写时也要考虑正极反应产物是否与电解质溶液反应的问题,若反应也要书写叠加后的反应式。
二、根据原电池反应书写电极反应式(1)找出发生氧化反应和还原反应的物质,确定正负极产物。
(2)利用电荷守恒分别写出电极反应式。
(3)验证:两个电极反应式相加所得式子和原化学方程式相同,则书写正确。
三、需要注意的问题(1)在正极上,若是电解质溶液中的某种离子被还原,无论该离子是强电解质提供的,还是弱电解质提供的,一律写成离子符号;而在原电池反应式中,要遵循离子方程式的书写规则,只有易溶的强电解质才用离子符号来表示。
(2)根据金属的活泼性判断原电池的正负极不是绝对的,还要看电解质溶液,如镁片和铝片插入氢氧化钠溶液中组成的原电池虽然镁比铝活泼,但由于铝和氢氧化钠溶液反应失去电子被氧化,因而铝是负极,此时的电极反应为:负极:2Al-6e-=== 2Al 3+正极:6H2O +6e-=== 6OH-+3H2↑或2Al3+ +2H2O +6e-+ 2OH-=== 2AlO2-+ 3H2↑再如,将铜片和铝片同时插入浓硝酸中组成原电池时,由于铝在浓硝酸中发生了钝化,铜却失去电子是原电池的负极被氧化,此时的电极反应为:负极:Cu-2e-=== Cu2+正极:2NO3-+ 4H+ +2e-=== 2NO2↑+2H2O(3)要注意电解质溶液的酸碱性在正负极上发生的电极反应不是孤立的,它往往与电解质溶液紧密联系。

判断原电池正负极方法
判断电池的正负极是非常重要的,因为电池在正常使用过程中必须正
确连接正负极才能提供电力。
以下是一些常见的方法来判断电池的正负极。
1.外观标识法:一般来说,电池上会有标识正负极的符号。
正极通常为"+"号,负极通常为"-"号。
有些电池还会用红色表示正极,用黑色表示
负极。
因此,当你观察到这样的标志时,你就可以轻松地判断出电池的正
负极。
2.电池塞举法:如果电池上没有外观标识,你可以试试用手指或者钳
子夹住电池两侧的金属塞子,然后用舌头轻轻舔一下。
如果你感到了一丝
微弱的电击感,那么塞子所在的一侧就是正极。
3.电池切割法:这是一种非常直接的方法,但需要一件尖锐的工具,
比如刀片。
你可以小心地切割电池外壳,然后观察内部。
一般情况下,正
极是与电池底部的金属片相连的,而负极是与电池顶部的金属片相连的。
4.磁性测试法:有些电池正极是磁性的,而负极则不是。
因此,你可
以使用一个小磁铁来测试电池的正负极。
如果磁铁吸附在电池上,那么吸
附的一侧就是正极。
5.借助仪器法:如果你有一台万用表或者电压表,你可以直接使用它
来测试电池的正负极。
将万用表的两个引脚分别与电池的两个极端接触,
然后观察万用表的读数。
如果读数为正数,那么相应引脚接触的就是正极。

原电池正负极判断和电极反应式的书写一、原电池正负极的判断1、发生失电子氧化反应的电极为负极,发生得电子还原反应的电极为正极。
2、依据外电路中电子的流向:电子流出的电极为负极,电子流入的电极为正极。
3、依据内电路电解质溶液中离子的移向:阴离子移向的电极为负极,阳离子移向的电极为正极。
4、依据反应现象判断:通常负极会逐渐溶解,正极有气体产生或固体析出。
5、原电池的正负极判断不仅要看两极活性的相对强弱,还要看电解质的种类。
一、原电池电极反应式的书写方法:第一步准确判断原电池的正负极是书写电极反应的关键。
第二步根据溶液中离子参加反应情况确定电极反应;第三步将电极反应相加得总反应式。
⑴负极①若负极材料本身被氧化,电极反应式有两种情况:一种是负极金属失电子后生成的金属阳离子不与电解质溶液反应,此时的电极反应式可表示为M-ne-=M n+;另一种情况是生成的阳离子与电解质溶液反应,此时的电极反应要将两个反应叠加在一起。
例题1、写出镁铝为电极,稀硫酸为电解质溶液构成的原电池的电极反应和总反应正极:负极:总反应:2、镁铝为电极,氢氧化钠溶液为电解质溶液构成的原电池正极:负极:总反应:3、铜片和铝片同时插入浓硝酸溶液中正极:负极:总反应:4、铁片和铜片同时插入硫酸铜溶液中正极:负极:总反应:②若负极材料本身不参加反应,如燃料电池,在书负极反应时要将燃料失电子的反应及其产物与电解质溶液的反应叠加在一起书写。
例5、飞船上使用的电池是氢氧燃料电池。
如图,两电极均由多孔性碳(或铂)组成。
通入气体在电极表面放电,总反应式为2H2+O2=2H2O。
按要求写出电极方程式酸性介质中:正极:负极:碱性介质中:正极:负极:中性介质中:正极:负极:⑵正极:首先判断在正极发生反应的物质①当负极材料与电解质溶液能自发的发生化学反应时,正极上发生电极反应的物质是电解质溶液中的某些微粒。
②当负极材料与电解质溶液不能自发地发生反应时,在正极上发生电极反应的物质是溶解在电解质溶液中的氧气。

专题二十三原电池正负极的判断【2018年高考考纲解读】了解原电池的工作原理,能写出电极反应和电池反应方程式。
了解常见化学电源的种类及其工作原理。
【重点、难点剖析】一、正负极判断方法1、由组成原电池的两极的电极材料判断.一般来说,通常两种不同金属在电解溶液中构成原电池时,较活泼的金属作负极,但也不是绝对的,应以发生的电极反应来定.例如,Mg-Al合金放入稀盐酸中,Mg比Al易失去电子,Mg作负极;将Mg-Al合金放入烧碱溶液中,由于发生电极反应的是 Al,故Al作负极.另如Cu-Al放在浓硫酸中,Cu是负极.2、根据电流方向或电子流动方向判断.电流流入的一极或电子流出的一极为负极;电子流动方向是由负极流向正极.3、根据原电池里电解质溶液内离子的定向流动方向判断.在原电池的电解质溶液内,阳离子移向的极是正极,阴离子流向的极为负极.4、根据原电池两极发生的变化来判断.某一电极不断溶解或质量不断减少,该电极发生氧化反应,此电极为原电池的负极;若某一电极有气体产生,电极质量不断增加或不变,该电极发生还原反应,此电极为原电池的正极.如:Zn—C—CuSO4溶液构成的原电池,C极上有紫红色的固体物质,为原电池的正极.5、在燃料电池中,两电极只是气体吸附载体,并不参与反应.可以通过总反应式和定义来判断,发生氧化反应的气体或物质所对应的电极为负极.如:氢氧燃料电池(以氢氧化钾为电解质)发生的总反应为:2H2+O2=2H2O,则氢气的一极为原电池的负极.【高考题型示例】例1、(2016课标Ⅱ)Mg—AgCl电池是一种以海水为电解质溶液的水激活电池。
下列叙述错误的是A.负极反应式为Mg-2e-=Mg2+B.正极反应式为Ag++e-=AgC.电池放电时Cl-由正极向负极迁移D.负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑【答案】B【解析】根据题意,电池总反应式为:Mg+2AgCl=MgCl2+2Ag,正极反应为:2AgCl+2e-= 2Cl-+ 2Ag,负极反应为:Mg-2e-=Mg2+,A项正确,B项错误;对原电池来说,阴离子由正极移向负极,C项正确;由于镁是活泼金属,则负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑,D项正确;答案选B。
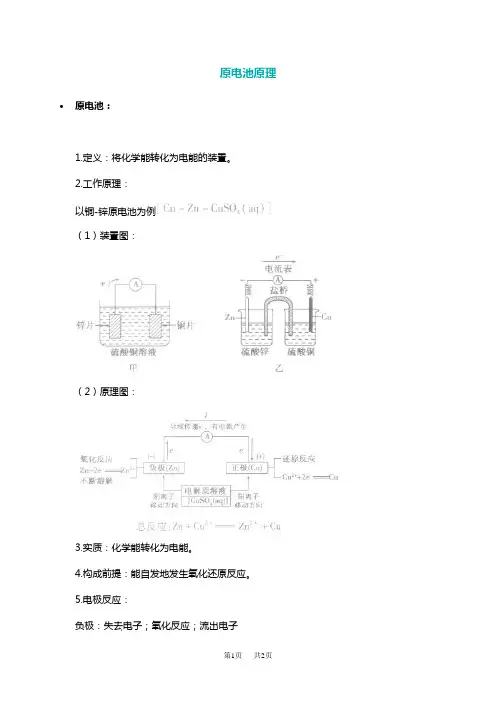
原电池原理•原电池:
1.定义:将化学能转化为电能的装置。
2.工作原理:
以铜-锌原电池为例
(1)装置图:
(2)原理图:
3.实质:化学能转化为电能。
4.构成前提:能自发地发生氧化还原反应。
5.电极反应:
负极:失去电子;氧化反应;流出电子
正极:得到电子;氧化反应;流入电子
6.原电池正负极判断的方法:
①由组成原电池的两级材料判断,一般是活泼金属为负极,活泼性较弱的金属或能
导电的非金属为正极。
②根据电流方向或电子流动方向判断,电流是由正极流向负极,电子流动方向是由
负极流向正极。
③根据原电池里电解质溶液内离子的定向移动方向,在原电池的电解质溶液中,阳
离子移向正极,阴离子移向负极。
④根据原电池两级发生的变化来判断,原电池的负极总是失电子发生氧化反应,正
极总是得电子发生还原反应。
⑤X极增重或减重:X极质量增加,说明溶液中的阳离子在X极(正极)放电,反
之,X极质量减少,说明X极金属溶解,X极为负极。
⑥X极有气泡冒出:发生可析出氢气的反应,说明X极为正极。
⑦X极负极pH变化:析氢或吸氧的电极发生反应后,均能使该电极附近电解质溶
液的pH增大,X极附近的pH增大,说明X极为正极。
•原电池中的电荷流动:
在外电路(电解质溶液以外),电子(负电荷)由负极经导线(包括电流表和其他用电器)流向正极,使负极呈正电性趋势、正极呈负电性趋势。
在内电路(电解质溶液中),阳离子(带正电荷)向正极移动,阴离子(带负电荷)向负极移动。
这样形成了电荷持续定向流动,电性趋向平衡的闭合电路。

理解原电池的正负极如下几点:①可以是两种活泼性不同的金属电极②可以是金属与非金属(如石墨),如化学电源中③也可以都是惰性电极(如燃料电池)④还可以是金属和金属氧化物(如铅蓄电池),而电解质则既可以是某电解质的水溶液,也可能是熔融盐。
(2)对于正、负极的判断:负极:①电子流出的一极(本质)②电流流入的一极③金属性相对较活泼的一极(注意Al电极)④发生氧化反应的一极⑤阴离子移向的一极⑥被腐蚀的一极⑦质量减小的一极⑧燃料气体在其上面失电子的一极⑨根据电极反应现象等。
正极:①电子流入的一极(本质)②电流流出的一极③金属性相对较不活泼的一极④发生还原反应的一极⑤阳离子移向的一极⑥被保护的一极⑦产生气体获析出金属的一极⑧助燃气体在其上面得电子的一极⑨根据电极反应现象等。
2.判断电解池的电极名称与电极反应的关系电解池的两极习惯上称作阴、阳极,这实际上是化学名称,本质上根据外接电源或电解质溶液中阴、阳离子的移动方向确定的名称,即所谓的“阴阳结合”---阴离子向阳极移动,阳离子向阴极移动。
可以用四个字概括:阳----氧,阴----还;实际上只须记“阳氧”两个字就可以了,其它的可以推理。
二.关于电极反应式的书写在电化学的学习中要紧紧抓住原电池和电解池的不同本质(自发和非自发)。
1.对于原电池,电极反应式和总反应式的书写方法一般是:第一步:判断正负极;第二步:根据负极及溶液中离子参加反应情况确定电极反应;第三步:将电极反应相加得总反应式。
原电池的“加和法”必须掌握,有了这一法宝,对于任何一个原电池反应,只要先写出易写的一极反应式,用总反应式减去其中一极的反应式,就可得另一极的反应式(注意电荷守恒)。
2.对于电解池,电极反应和总反应式的书写方法一般是:第一步:确定电极的材料及阴阳极;第二步:根据电极材料和溶液介质情况分析判断电极反应;第三步:将电极反应相加得总反应式(注意有水被电解时的情况)。
三.电解规律1.(1)惰性电极电解酸、碱、盐溶液,就可以分为电解水型(例NaOH)、分解电解质型(例CuCl2)、放H2生碱型(例NaCl)、放O2生酸型(例CuSO4)等。

原电池和电解池.1原电池和电解池的比较:2原电池正负极的判断:⑴根据电极材料判断:活泼性较强的金属为负极,活泼性较弱的或者非金属为正极。
⑵根据电子或者电流的流动方向:电子流向:负极T正极。
电流方向:正极T负极。
⑶根据电极变化判断:氧化反应T负极;还原反应T正极。
⑷根据现象判断:电极溶解T负极;电极重量增加或者有气泡生成T正极。
⑸根据电解液内离子移动的方向判断:阴离子T移向负极;氧离子T移向正极。
3 电极反应式的书写:负极:(1)负极材料本身被氧化:n+2+①如果负极金属生成的阳离子与电解液成分不反应,则为最简单的:M-n e- =M 如:Zn-2 =Zn (如果阳离子与电解液成分反应,则参与反应的部分要写入电极反应式中:如铅蓄电池,Pb+S042--2e-=PbS04⑵负极材料本身不反应:要将失电子的部分和电解液都写入电极反应式,如燃料电池CH4-02(C作电极)电解液为KOH:负极:CH4+10OH-8 e-=C032-+7H2O正极:(1)当负极材料能自发的与电解液反应时,正极则是电解质溶液中的微粒的反应,+H2SO4 电解质,如2H+2e=H2 CuS电解质:Cu2++2e= Cu⑵当负极材料不与电解质溶液自发反应时,正极则是电解质中的O2反正还原反应-①当电解液为中性或者碱性时,H2O比参加反应,且产物必为OH,如氢氧燃料电池(KOH电解质)O2+2H2O+4e=4OH+②当电解液为酸性时,H比参加反应,产物为H2OO2+4O2+4e=2H2O4.化学腐蚀和电化腐蚀的区别6.金属的防护⑴改变金属的内部组织结构。
合金钢中含有合金元素,使组织结构发生变化,耐腐蚀。
如:不锈钢。
⑵在金属表面覆盖保护层。
常见方式有:涂油脂、油漆或覆盖搪瓷、塑料等;使表面生成致密氧化膜;在表面镀一层有自我保护作用的另一种金属。
⑶电化学保护法①外加电源的'阴极保护法:接上外加直流电源构成电解池,被保护的金属作阴极。

原电池正负极判断的方法河北省宣化县第一中学栾春武在中学化学中判断原电池的正负极一般有如下几种方法:一、由组成原电池的两极材料判断一般来说,较活泼的金属为负极,较不活泼的金属或能导电的非金属为正极。
但具体情况还要看电解质溶液,如镁、铝电极在稀硫酸中构成原电池,镁为负极,铝为正极;但镁、铝在氢氧化钠溶液中形成原电池时,由于是铝和氢氧化钠溶液发生了反应,失去了电子,因此铝为负极,镁则为正极。
再如铝、铜和氢氧化钠溶液构成的原电池中,铝为负极;而若把氢氧化钠溶液换为浓硝酸,则铜为负极。
二、根据外电路电流的方向或电子的流向判断在原电池的外电路,电流由正极流向负极,电子由负极流向正极。
三、根据内电路离子的移动方向判断在原电池电解质溶液中,阳离子移向正极,阴离子移向负极。
四、根据原电池两极发生的化学反应判断原电池中,负极总是发生氧化反应,正极总是发生还原反应。
因此可以根据总的化学方程式中化合价的升降来判断。
五、根据电极质量的变化判断原电池工作后若某一电极质量增加,说明溶液中的阳离子在该电极上放电,该电极为正极,活泼性较弱;如果某一电极质量减轻,说明该电极溶解,电极为负极,活泼性较强。
六、根据电极上产生的气体判断原电池工作后,如果一电极上产生气体,通常是因为该电极发生了析出氢气的反应,一说明该电极为正极,活动性较弱。
七、根据某电极附近pH的变化判断析氢或吸氧的电极反应发生后,均能使该电极附近电解质溶液的pH增大,因而原电池工作后,该电极附近的pH增大了,说明该电极为正极,金属活动性较弱。
例题分析Cu + Zn2+,那么该原电池的正确组合为:【例题1】某原电池发生的总的离子方程式为:Zn + Cu2+===解析:原电池的电极反应不仅跟电极材料有关,还与电解质溶液的性质有关。
该题考查了原电池的组成,一般来说活泼金属为负极,且能与电解质溶液自发地发生氧化还原反应。
答案:C、D【例题2】某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下表:根据表中的实验现象完成下列问题:(1)实验1、2中Al所作的电极是否相同。

原电池正负极判断方法归纳如下:1可以从电子转移的角度判断,若失去电子的极为负极,得电子的一极为正极。
2.可根据电极现象判断,若在溶解的一极为负极,有气泡冒出的为正极,有金属析出的是正极4.若一极质量在减轻,一极在增重,则减轻的是负极,增重的是正极。
5.若告诉电子由A转移到B,则A为负极,B为正极。
6.若告诉溶液中阳离子往A极移动,阴离子往B极移动,则A为正极B为负极。
7.告诉A极化合价升高B极化合价降低,则A极为负极B极为正极。
8.若告诉A极发生氧化反应,B极发生还原反应,则A极为正极,B极为负极。
9.告诉电流的流向是A流向B,则A为正极,B为负极。
常见放热:1、金属和水或酸反应2、酸碱中和反应3、一切燃烧4、大多数化合反应和置换反应5、缓慢氧化反应如生锈6、爆炸反应全是放热反应,常见吸热:1、大多数分解反应2、铵盐和碱反应3、碳作还原剂的反应常见放热反应(1)所有燃烧或爆炸反应。
(2)酸碱中和反应。
(3)多数化合反应。
(4)活泼金属与水或酸生成H2的反应。
(5)物质的缓慢氧化。
(6)自发进行的氧化还原反应。
(7)铝热反应常见的吸热反应:(1) 2NH4Cl(s)+Ba(OH)2·8H2O(s)=BaCl2+2NH3↑+10H2OC+H2O(g)=(高温)CO+H2C(s)+CO2(g)=(高温)2COI2+H2=2HI(此反应为可逆反应,因为生成的碘化氢不稳定) (2)数的分解反应,如:CaCO3=(高温)CaO+CO2↑CuSO4·5H2O=CuSO4+5H2O(3)一些物质的溶解,如硝酸铵溶解等。
(4)电离。
(5)盐类水解。
此时必为吸热反应。
如:铵根水解即为吸热(6)C、H2 CO做还原剂的反应。

原电池和电解池1.原电池和电解池的比较: 2原电池正负极的判断:⑴根据电极材料判断:活泼性较强的金属为负极,活泼性较弱的或者非金属为正极。
⑵根据电子或者电流的流动方向:电子流向:负极→正极。
电流方向:正极→负极。
⑶根据电极变化判断:氧化反应→负极;还原反应→正极。
⑷根据现象判断:电极溶解→负极;电极重量增加或者有气泡生成→正极。
⑸根据电解液内离子移动的方向判断:阴离子→移向负极;氧离子→移向正极。
3电极反应式的书写:负极:⑴负极材料本身被氧化:n+2+①如果负极金属生成的阳离子与电解液成分不反应,则为最简单的:M-n e-=M 如:Zn-2 e-=Zn ②如果阳离子与电解液成分反应,则参与反应的部分要写入电极反应式中:如铅蓄电池,Pb+SO42--2e-=PbSO4⑵负极材料本身不反应:要将失电子的部分和电解液都写入电极反应式,如燃料电池CH4-O2(C作电极)电解液为KOH:负极:CH4+10OH-8 e-=C032-+7H2O 正极:⑴当负极材料能自发的与电解液反应时,正极则是电解质溶液中的微粒的反应,+H2SO4电解质,如2H+2e=H2 CuSO4电解质: Cu2++2e= Cu⑵当负极材料不与电解质溶液自发反应时,正极则是电解质中的O2反正还原反应-① 当电解液为中性或者碱性时,H2O比参加反应,且产物必为OH,如氢氧燃料电池(KOH电解质)O2+2H2O+4e=4OH+②当电解液为酸性时,H比参加反应,产物为H2OO2+4O2+4e=2H2O4.化学腐蚀和电化腐蚀的区别-6.金属的防护⑴改变金属的内部组织结构。
合金钢中含有合金元素,使组织结构发生变化,耐腐蚀。
如:不锈钢。
⑵在金属表面覆盖保护层。
常见方式有:涂油脂、油漆或覆盖搪瓷、塑料等;使表面生成致密氧化膜;在表面镀一层有自我保护作用的另一种金属。
⑶电化学保护法①外加电源的`阴极保护法:接上外加直流电源构成电解池,被保护的金属作阴极。
原电池的正负极和电解质之间存在密切关系。
原电池的正负极是由组成原电池的两极材料决定的,
较活泼的金属为负极,较不活泼的金属或能导电的非金属为正极。
但是,具体情况还要看电解质溶
液的性质。
例如,镁、铝电极在稀硫酸中构成原电池时,镁为负极,铝为正极;但在氢氧化钠溶液
中形成原电池时,由于是铝和氢氧化钠溶液发生了反应,失去了电子,因此铝为负极,镁则为正极。
另外,根据外电路电流的方向或电子的流向也可以判断正负极。
在原电池的外电路,电流由正极流
向负极,电子由负极流向正极。
此外,根据内电路离子的移动方向也可以判断。
在原电池电解质溶液中,阳离子移向正极,阴离子
移向负极。
原电池两极发生的化学反应也可以判断正负极。
原电池中,负极总是发生氧化反应,正极总是发生
还原反应。
因此可以根据总的化学方程式中化合价的升降来判断。
同时,根据电极质量的变化也可以判断。
原电池工作后若某一电极质量增加,说明溶液中的阳离子
在该电极上放电,该电极为正极,活泼性较弱;如果某一电极质量减轻,说明该电极溶解,电极为
负极,活泼性较强。
还可以根据电极上产生的气体来判断。
原电池工作后,如果一电极上产生气体,通常是因为该电极
发生了析出氢气的反应,一说明该电极为正极,活动性较弱。
最后,根据某电极附近pH的变化也可以判断。
析氢或吸氧的电极反应发生后,均能使该电极附近电解质溶液的pH增大,因而原电池工作后,该电极附近的pH增大了,说明该电极为正极,金属活动
性较弱。
专题:原电池和电解池【考点分析】1.原电池正负极的判断以及电极方程式的书写;2.电解池阴阳极的判断以及电极方程式的书写;3.金属的防护以及电解在氯碱工业、精炼铜、电镀、电冶金等方面的应用;4.电解中电极附近溶液pH值的变化;5.化学计算;【知识详解】1.原电池原理:使氧化还原反应中电子作定向移动,从而形成电流。
这种把化学能转变为电能的装置叫做原电池。
2原电池正负极的判断:⑴根据电极材料判断:活泼性较强的金属为负极,活泼性较弱的或者非金属为正极。
⑵根据电子或者电流的流动方向:电子流向:负极一正极。
电流方向:正极一负极。
⑶根据电极变化判断:氧化反应一负极:还原反应正极。
⑷根据现象判断:电极溶解一负极;电极重量增加或者有气泡生成一正极。
⑸根据电解液内离子移动的方向判断:阴离子一移向负极:氧离子一移向正极。
3电极反应式的书写:负极:⑴负极材料本身被氧化:①如果负极金属生成的阳离子与电解液成分不反应,则为最简单的:M-n e=r如:Zn-2 e-=Zn:*②如果阳离子与电解液成分反应,则参与反应的部分要写入电极反应式中:如铅蓄电池,Pb+S043--2e=PbS0i(2)负极材料本身不反应:要将失电子的部分和电解液都写入电极反应式,如燃料电池CH,-O:(C作电极)电解液为KOH:负极:CH:+100H-8 e=C0r+7H:O正极:⑴当负极材料能自发的与电解液反应时,正极则是电解质溶液中的微粒的反应,H2SO4 电解质,如2H'+2e=H: CuSO t电解质:Cu^+2e= Cu⑵当负极材料不与电解质溶液自发反应时,正极则是电解质中的Oa的还原反应①当电解液为中性或者碱性时,也0参加反应,且产物必为0H;如氢氧燃料电池(KOH电解质)O:+2H:O+4e=4OH'②当电解液为酸性时,H•参加反应,产物为也0 03+4H++4e=2H304.化学腐蚀和电化腐蚀的区别考点解说 6. 金属的防护⑴改变金属的内部组织结构。
原电池正负极判断和电极反应式的书写一、原电池正负极的判断1、发生失电子氧化反应的电极为负极,发生得电子还原反应的电极为正极。
2、依据外电路中电子的流向:电子流出的电极为负极,电子流入的电极为正极。
3、依据内电路电解质溶液中离子的移向:阴离子移向的电极为负极,阳离子移向的电极为正极。
4、依据反应现象判断:通常负极会逐渐溶解,正极有气体产生或固体析出。
5、原电池的正负极判断不仅要看两极活性的相对强弱,还要看电解质的种类。
一、原电池电极反应式的书写方法:第一步准确判断原电池的正负极是书写电极反应的关键。
第二步根据溶液中离子参加反应情况确定电极反应;第三步将电极反应相加得总反应式。
⑴负极①若负极材料本身被氧化,电极反应式有两种情况:一种是负极金属失电子后生成的金属阳离子不与电解质溶液反应,此时的电极反应式可表示为M-ne-=M n+;另一种情况是生成的阳离子与电解质溶液反应,此时的电极反应要将两个反应叠加在一起。
例题1、写出镁铝为电极,稀硫酸为电解质溶液构成的原电池的电极反应和总反应正极:负极:总反应:2、镁铝为电极,氢氧化钠溶液为电解质溶液构成的原电池正极:负极:总反应:3、铜片和铝片同时插入浓硝酸溶液中正极:负极:总反应:4、铁片和铜片同时插入硫酸铜溶液中正极:负极:总反应:②若负极材料本身不参加反应,如燃料电池,在书负极反应时要将燃料失电子的反应及其产物与电解质溶液的反应叠加在一起书写。
例5、飞船上使用的电池是氢氧燃料电池。
如图,两电极均由多孔性碳(或铂)组成。
通入气体在电极表面放电,总反应式为2H2+O2=2H2O。
按要求写出电极方程式酸性介质中:正极:负极:碱性介质中:正极:负极:中性介质中:正极:负极:⑵正极:首先判断在正极发生反应的物质①当负极材料与电解质溶液能自发的发生化学反应时,正极上发生电极反应的物质是电解质溶液中的某些微粒。
②当负极材料与电解质溶液不能自发地发生反应时,在正极上发生电极反应的物质是溶解在电解质溶液中的氧气。
【物理知识点】原电池正负极判断的六种方法
方法一:根据两极材料判断。
一般活泼金属为负极,活泼性较弱的金属或能导电的非
金属为正极;
方法二:根据电极现象判断。
一般情况下电极逐渐溶解为负极,电极增重可放出气体
的为正极;
方法三:根据电子液动方向来判断。
电子流出的为负极、电子流入的为正极或电流流
出的正极、电流流入的负极;
方法四:根据原电池里电解质溶液内离子的定向移动方向判断。
阴离子流向的为负极、阳离子流向的为正极;
方法五:根据原电池两极发生的变化来判断。
失去电子发生氧化的是负极、得到电子
发生还原反应是正极;
方法六:根据电解质溶液来判断电极。
能与电解质溶液反应的电极为负极,不能与电
解质溶液反应的为正极。
例如:镁、铝为电极,氢氧化钠溶液为电解质溶液,虽然镁比铝
活泼,但是由于镁不与氢氧化钠溶液反应,铝能与氢氧化钠溶液反应,所以铝为负极、镁
为正极。
把化学能转化为电能的装置。
流经整个体系的电流是由金属导体中的自由电子和溶液
中离子的迁移以及电极和溶液界面上伴随发生的氧化、还原反应而进行的。
所以,根据定义,普通的干电池、蓄电池、燃料电池都可以称为原电池。
构成原电池的条件
1、活动性不同的两种金(或一种金属,一种为能导电的非金属)作为两个电极;
2、两个电极必须以导线相连或直接接触;
3、电极插入电解质溶液中形成闭合回路。
感谢您的阅读,祝您生活愉快。
原电池正负极的判断方法
确定电池正负极的方法有多种,根据电池类型和形状的不同,确定方法也略有不同。
以下是几种常见的判断电池正负极的方法:
1. 外观标记法:大多数电池的正极会在外部进行标记,例如“+”符号或者红色标记。
如果电池没有标记,通常情况下,电池顶部凸起的一端为正极。
2. 滴水法:将一滴水滴在电池的两端,水滴会在正极上分散而在负极上聚集。
3. 电压测量法:使用万用表或电压表,测量电池的电压,正极的电势较高,负极的电势较低。
4. 导电笔法:使用带有灯泡的导电笔,将导电笔的针尖接触电池两端,灯泡亮起的一端为正极。
需要注意的是,在使用这些方法时,要小心避免将电池短路或者损坏。
如果您不确定电池正负极的标记或者测量方法,请参考电池说明书或者咨询专业人士。