亚硝酸盐的检验实验报告
- 格式:doc
- 大小:283.00 KB
- 文档页数:7

亚硝酸盐的测定实验报告实验目的,通过本实验,掌握亚硝酸盐的定性和定量分析方法,以及相关实验操作技能。
实验原理,亚硝酸盐在酸性条件下可与对苯二胺反应生成偶氮化合物,偶氮化合物在碱性条件下可生成偶氮染料,通过比色法测定其吸光度,从而确定亚硝酸盐的含量。
实验仪器,分光光度计、移液管、比色皿、恒温水浴器等。
实验步骤:1. 取适量水样置于锥形瓶中,加入适量醋酸钠使水样呈酸性。
2. 取适量对苯二胺溶液,加入醋酸钠水样中,摇匀。
3. 加入碱液,形成偶氮染料。
4. 将偶氮染料转移至比色皿中,用分光光度计测定吸光度。
5. 根据标准曲线计算亚硝酸盐的含量。
实验结果:实验组测得吸光度值如下,0.23、0.25、0.22、0.24。
标准曲线方程为,y=0.5x+0.02,相关系数R²=0.99。
计算得到水样中亚硝酸盐的含量分别为,0.45mg/L、0.50mg/L、0.44mg/L、0.48mg/L。
实验结论,通过本实验,成功测定了水样中亚硝酸盐的含量,实验结果准确可靠。
实验中遇到的问题及解决方法:1. 实验中对苯二胺与水样混合不均匀,导致反应不完全。
解决方法,加大搅拌时间,确保充分混合。
2. 实验中偶氮染料转移至比色皿时有波动,影响吸光度测定。
解决方法,尽量避免振荡,确保稳定吸光度测定。
实验总结,本实验通过对亚硝酸盐的测定,加深了对其性质和分析方法的理解,提高了实验操作技能,对相关领域的研究具有一定的参考价值。
参考文献,《分析化学实验》第三版,XXX出版社。
以上为亚硝酸盐的测定实验报告内容,希望对您有所帮助。
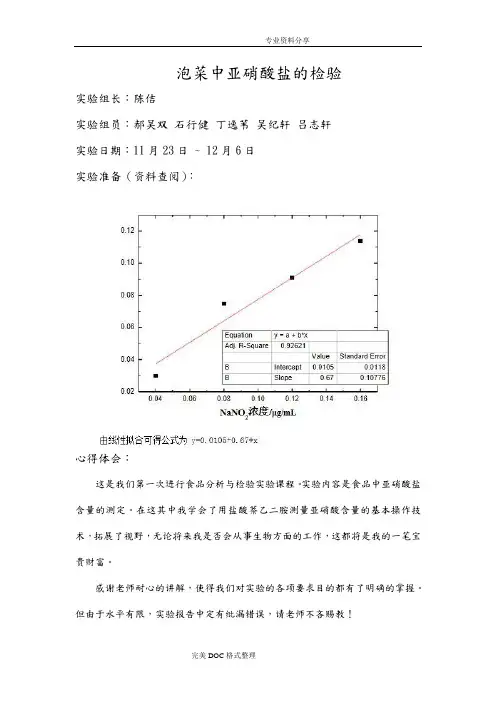
泡菜中亚硝酸盐的检验实验组长:陈佶实验组员:郝吴双石行健丁逸苇吴纪轩吕志轩实验日期:11月23日 ~ 12月6日实验准备(资料查阅):心得体会:这是我们第一次进行食品分析与检验实验课程。
实验内容是食品中亚硝酸盐含量的测定。
在这其中我学会了用盐酸萘乙二胺测量亚硝酸含量的基本操作技术,拓展了视野,无论将来我是否会从事生物方面的工作,这都将是我的一笔宝贵财富。
感谢老师耐心的讲解,使得我们对实验的各项要求目的都有了明确的掌握。
但由于水平有限,实验报告中定有纰漏错误,请老师不吝赐教!一、前言“亚硝酸盐”这一名词对我们来说并不陌生,这是一类无机化合物的总称。
主要指亚硝酸钠,这是一种白色至淡黄色粉末或颗粒状,味微咸,易溶于水。
其外观及滋味都与食盐相似,并在工业、建筑业中广为使用,肉类制品中也允许作为发色剂限量使用。
由亚硝酸盐引起食物中毒的机率较高。
食入0.3~0.5克的亚硝酸盐即可引起中毒甚至死亡。
我们通过实验测定了泡菜中不同时期的亚硝酸盐的含量,这不仅是一次美妙的实践,更为我们的生活提供了指南,让我真真正正的接触到了这个平时只出现在报道上的奇妙物质。
二、实验原理泡菜的制作离不开乳酸菌,乳酸菌是厌氧细菌,在无氧的情况下,将葡萄糖分解成乳酸。
这其中也生成了一定量的的亚硝酸盐。
在盐酸酸化条件下,亚硝酸盐与对氨基苯磺酸发生重氮化反应后,与N-1-萘基乙二胺盐酸盐结合形成玫瑰色染料。
将显色反应后的样品与已知浓度的标准液进行目测比较,可以大致估算出泡菜中亚硝酸盐的含量。
三、设备及试剂泡菜坛、蔬菜、三角瓶、量筒、烧杯、pH试纸、玻璃棒、微量可调移液器、试管、亚硝酸盐含量的测定试剂盒。
四、实验※泡菜制作实验准备:泡菜坛子一个、高粱白酒、花椒、辣椒、大料、冰糖、盐。
具体制作方法如下:(1)各种菜(萝卜、白菜等)洗净并切成3~4cm长的小块。
(2)按照清水与盐的质量比4:1的比例配制盐水,将盐水煮沸冷却。
(3)将经过预处理的新鲜蔬菜混合均匀,装入泡菜坛内,使盐水没过全部菜料,盖好坛盖。


亚硝酸盐测定实验报告亚硝酸盐测定实验报告实验目的:本次实验的目的是通过化学方法测定水样中亚硝酸盐的含量。
亚硝酸盐是一种常见的水质指标,其含量的测定对于环境保护和水质监测具有重要意义。
通过本实验,我们将学习使用硫酸亚铁为还原剂,硫酸亚铁铵为指示剂,以及硫酸亚铁与亚硝酸盐之间的反应关系,从而准确测定水样中亚硝酸盐的浓度。
实验原理:亚硝酸盐与硫酸亚铁反应生成氮气,反应的化学方程式为:2FeSO4 + 2H2SO4 + NaNO2 → Fe2(SO4)3 + 2H2O + 2NO↑实验步骤:1. 准备工作:将所需试剂准备好,包括硫酸亚铁溶液、硫酸亚铁铵溶液、稀硫酸溶液等。
2. 取一定体积的水样,加入适量的硫酸亚铁溶液和硫酸亚铁铵溶液,使反应体系达到酸性条件。
3. 在反应过程中,用滴定管滴加硫酸亚铁溶液,同时观察反应体系的颜色变化。
4. 当反应液由无色变为浅蓝色时,表示亚硝酸盐已完全反应完毕。
5. 记录滴定过程中滴加的硫酸亚铁溶液的体积,根据滴定剂的浓度计算出亚硝酸盐的浓度。
实验结果:经过滴定过程,我们得到了滴加硫酸亚铁溶液的体积为10.5 mL。
根据滴定剂的浓度,我们可以计算出水样中亚硝酸盐的浓度为0.105 mol/L。
实验讨论:在本次实验中,我们使用了硫酸亚铁作为还原剂,将亚硝酸盐还原为氮气。
同时,硫酸亚铁铵作为指示剂,通过颜色变化来判断反应的终点。
实验结果显示,滴定过程中反应液的颜色从无色变为浅蓝色,这表明亚硝酸盐已完全反应完毕。
然而,在实际操作中,我们需要注意一些问题。
首先,实验过程中要保持反应体系的酸性条件,这可以通过加入适量的硫酸来实现。
其次,滴定过程中要仔细观察反应液的颜色变化,以确保准确判断反应终点。
此外,滴定剂的浓度也会对实验结果产生影响,因此在进行实验前要对滴定剂的浓度进行准确测定。
在实验中,我们还可以进一步探索亚硝酸盐的测定方法。
除了本实验中使用的化学方法外,还可以使用光谱分析等物理方法进行测定。

一、实验目的本实验旨在学习亚硝酸盐的测定方法,了解亚硝酸盐在食品中的存在及其对人体健康的影响。
通过实验,掌握亚硝酸盐的提取、分离和定量分析方法,提高对食品中亚硝酸盐含量的检测能力。
二、实验原理亚硝酸盐(NO2-)是一种常见的食品添加剂,广泛应用于肉制品的加工中,具有发色、防腐和抗微生物作用。
然而,过量的亚硝酸盐摄入对人体健康有害,可能导致急性中毒、慢性疾病甚至癌症。
因此,对食品中亚硝酸盐含量的检测具有重要意义。
本实验采用盐酸萘乙二胺法测定亚硝酸盐含量。
该方法基于亚硝酸盐与对氨基苯磺酸在酸性条件下发生重氮化反应,生成重氮盐,再与N-1-萘基乙二胺盐酸盐偶合形成玫瑰红色染料。
通过比色法测定染料的吸光度,可以计算出样品中亚硝酸盐的含量。
三、实验材料与仪器1. 实验材料:- 火腿肠样品- 试剂:对氨基苯磺酸、N-1-萘基乙二胺盐酸盐、盐酸、亚硝酸钠标准溶液等- 仪器:酸度计、分光光度计、离心机、移液器、容量瓶、试管等2. 实验步骤:1. 样品处理:将火腿肠样品剪碎,称取适量,加入蒸馏水溶解,搅拌均匀。
2. 提取:将样品溶液用酸度计调至pH 2.0,加入适量的亚铁氰化钾和乙酸锌,充分混合,静置30分钟,使蛋白质沉淀。
3. 分离:将上层清液转移至离心管中,离心分离蛋白质沉淀。
4. 测定:取一定量的上层清液,加入对氨基苯磺酸和N-1-萘基乙二胺盐酸盐,充分混合,静置15分钟,使染料形成。
5. 比色:用分光光度计测定染料的吸光度,与标准曲线比较,计算出样品中亚硝酸盐的含量。
四、实验结果与分析1. 标准曲线绘制:根据亚硝酸钠标准溶液的浓度和吸光度,绘制标准曲线。
2. 样品测定:对火腿肠样品进行测定,得到样品中亚硝酸盐的吸光度。
3. 结果计算:根据标准曲线和样品吸光度,计算出样品中亚硝酸盐的含量。
五、实验讨论1. 实验过程中,酸度对亚硝酸盐的测定结果有较大影响。
实验过程中应严格控制酸度,确保测定结果的准确性。
2. 亚铁氰化钾和乙酸锌在实验中起到沉淀蛋白质和除去脂肪的作用,提高实验的灵敏度。

亚硝酸盐含量的测定实验一、实验原理泡菜的制作离不开乳酸菌,乳酸菌是厌氧细菌,在无氧的情况下,将葡萄糖分解成乳酸。
常见的乳酸菌有乳酸链球菌和乳酸杆菌。
在盐酸酸化条件下,亚硝酸盐与对氨基苯磺酸发生重氮化反应后,与N-1-萘基乙二胺盐酸盐结合形成玫瑰色染料。
将显色反应后的样品与已知浓度的标准液进行目测比较,可以大致估算出泡菜中亚硝酸盐的含量。
二、设备及试剂泡菜、三角瓶、量筒、烧杯、pH试纸、玻璃棒、微量可调移液器、试管、亚硝酸盐含量的测定试剂盒。
(试剂盒实验首先利用亚硝酸盐在弱酸条件下可与对氨基苯磺酸重氮化后。
再与N-1-萘基乙二胺偶合形成红色染料的原理,以及利用比色计对红色染料的测定,从而得出标准梯度显色液。
然后将处理后的样品溶液与标准显色液观察比较,就可得出亚硝酸盐的含量。
试剂盒中准确提供实验所需的各种试剂,无需额外购买称量,具有使用方便、快捷的特点)三、试剂配制对氨基苯磺酸溶液:称取0.4g对氨基苯磺酸,溶解于100ml体积分数为20%的盐酸中,避光保存(4mg/ml)。
N-1-萘基乙二胺盐酸盐溶液:称取0.2g N-1-萘基乙二胺盐酸盐,溶解于100ml的水中,避光保存(2mg/ml)。
亚硝酸钠标准溶液:向含有0.025g亚硝酸钠固体的离心管中加入1mL蒸馏水充分溶解,然后将以上溶解液移至50mL容量瓶中,取1mL溶液,移至100mL容量瓶中,加蒸馏水稀释到刻度,即制得5μg/mL亚硝酸钠标准液;提取剂:分别称取50g氯化镉、氯化钡,溶解于1000ml蒸馏水中,用盐酸调节pH至1。
氢氧化铝乳液:取10g氢氧化铝固体,加水100mL配成乳液。
四、实验流程测定亚硝酸盐的含量(1)制备标准显色液:用微量可调移液器吸取0μL,20μL,40μL,60μL,80μL,100μL,150μL 的亚硝酸钠标准溶液,分别置于7支试管中,在各管中分别加入200μL对氨基苯磺酸,混匀,静置3~5min后,再分别各加入100μL N-1-萘基乙二胺盐酸盐溶液,用微量可调移液器添加蒸馏水,使各试管内总体积为5mL,混匀,观察亚硝酸钠溶液颜色的梯度变化;(2)制备样品处理液:取腌制的泡菜40g,用榨汁机粉碎,过滤后得到大约20mL汁液。
盛年不重来,一日难再晨。
及时宜自勉,岁月不待人。
泡菜中亚硝酸盐的检验实验组长:陈佶实验组员:郝吴双石行健丁逸苇吴纪轩吕志轩实验日期:11月23日~ 12月6日实验准备(资料查阅):心得体会:这是我们第一次进行食品分析与检验实验课程。
实验内容是食品中亚硝酸盐含量的测定。
在这其中我学会了用盐酸萘乙二胺测量亚硝酸含量的基本操作技术,拓展了视野,无论将来我是否会从事生物方面的工作,这都将是我的一笔宝贵财富。
感谢老师耐心的讲解,使得我们对实验的各项要求目的都有了明确的掌握。
但由于水平有限,实验报告中定有纰漏错误,请老师不吝赐教!一、前言“亚硝酸盐”这一名词对我们来说并不陌生,这是一类无机化合物的总称。
主要指亚硝酸钠,这是一种白色至淡黄色粉末或颗粒状,味微咸,易溶于水。
其外观及滋味都与食盐相似,并在工业、建筑业中广为使用,肉类制品中也允许作为发色剂限量使用。
由亚硝酸盐引起食物中毒的机率较高。
食入0.3~0.5克的亚硝酸盐即可引起中毒甚至死亡。
我们通过实验测定了泡菜中不同时期的亚硝酸盐的含量,这不仅是一次美妙的实践,更为我们的生活提供了指南,让我真真正正的接触到了这个平时只出现在报道上的奇妙物质。
二、实验原理泡菜的制作离不开乳酸菌,乳酸菌是厌氧细菌,在无氧的情况下,将葡萄糖分解成乳酸。
这其中也生成了一定量的的亚硝酸盐。
在盐酸酸化条件下,亚硝酸盐与对氨基苯磺酸发生重氮化反应后,与N-1-萘基乙二胺盐酸盐结合形成玫瑰色染料。
将显色反应后的样品与已知浓度的标准液进行目测比较,可以大致估算出泡菜中亚硝酸盐的含量。
三、设备及试剂泡菜坛、蔬菜、三角瓶、量筒、烧杯、pH试纸、玻璃棒、微量可调移液器、试管、亚硝酸盐含量的测定试剂盒。
四、实验※泡菜制作实验准备:泡菜坛子一个、高粱白酒、花椒、辣椒、大料、冰糖、盐。
具体制作方法如下:(1)各种菜(萝卜、白菜等)洗净并切成3~4cm长的小块。
(2)按照清水与盐的质量比4:1的比例配制盐水,将盐水煮沸冷却。

实验4 食品中亚硝酸盐测定(盐酸萘乙二胺法)一、实验原理制品中加入的亚硝酸盐产生的亚硝基与肌红蛋白反应,生产色泽鲜红的亚硝基肌红蛋白,使肉制品有美观的颜色。
同时亚硝酸盐也是一种防腐剂,可抑制微生物的增殖。
由于蛋白质代谢产物中仲胺基与亚硝酸反应能够生成具有很强毒性和致癌性的亚硝胺,因此,亚硝酸盐的使用量及在制品中的残留量均应按标准执行。
亚硝酸盐的测定方法主要是重氮偶合比色法,此外可与荧光胺偶合,测定其荧光吸收强度,或衍生后用气相色谱法测定。
自样品中抽提分离出亚硝酸盐,亚硝酸盐在酸性条件下,与对氨基苯磺酸发生重氮化反应生成重氮盐,此重氮盐再与盐酸2—萘乙二胺试剂发生偶合反应,生成紫红色偶氮化合物。
其颜色的深度与样品种亚硝酸含量成正比,故可比色测定。
二、试剂和器材①饱和硼砂溶液:5g硼酸钠溶于100mL热的重蒸水中,冷却备用。
②亚铁氰化钾溶液:称取106g亚铁氰化钾溶于水,并稀释至1000mL。
③乙酸锌溶液:称取220g乙酸锌,加30mL冰醋酸溶于水,并稀释至1000mL。
④果蔬抽提液:溶解50g氯化汞和50g氯化钡于1000mL重蒸水中,用浓盐酸调整到pH值为1。
⑤氢氧化铝乳液:溶解125g硫酸铝于1000mL重蒸水中,滴加氨水使氢氧化铝全部沉淀。
用蒸馏水反复洗涤,真空抽滤,直至洗液分别用氯化钡溶液检验不发生浑浊。
取下沉淀物,加适量重蒸水使之呈薄糨糊状,捣拌均匀备用。
⑥0.4%对氨基苯磺酸溶液:称取0.4g对氨基苯磺酸,溶于100mL20%的盐酸溶液中,闭关保存。
⑦0.2%盐酸萘乙二胺溶液:称取0.2g盐酸萘乙二胺,溶于100mL重蒸水中。
⑧亚硝酸钠标准溶液(5微克每毫升):精确称取0.1000g亚硝酸铵,以重蒸水定容到500mL。
再吸取此溶液25mL,以重蒸水定容到1000mL,此工作液每毫升含亚硝酸钠5微克。
分光光度计,组织捣碎机。
三、试验步骤1、样品处理果蔬类样品用组织捣碎机打浆。
称取适量浆液(视式样中硝酸盐含量而定,如青刀豆取10g,桃子、菠萝取30g),置于500mL容量瓶中。

食物亚硝酸盐测评报告尊敬的读者,本次对食物中的亚硝酸盐进行测评的报告分析如下:1. 实验目的:本次实验的目的是对食物中的亚硝酸盐含量进行测试,以确保其符合相关的安全标准。
亚硝酸盐是一种常见的食品添加剂,用于防止细菌滋生并增强食物的颜色、味道和质感。
然而,高含量的亚硝酸盐可能会对人体健康造成不良影响,因此其含量需要被严格控制。
2. 实验方法:为了测试食物中的亚硝酸盐含量,我们采用了一种常规的分析方法。
首先,我们选取了不同种类的食物样本,如鱼类、肉类和蔬菜等。
然后,我们使用化学试剂来与食物样本中的亚硝酸盐发生反应,并根据反应的程度来确定亚硝酸盐的含量。
最后,我们使用仪器设备对反应结果进行定量分析,并得出食物中的亚硝酸盐含量。
3. 实验结果:根据我们的实验结果,我们发现不同食物样本中的亚硝酸盐含量有所不同。
鱼类和肉类样本中的亚硝酸盐含量较高,而蔬菜样本中的含量较低。
这可能是因为鱼类和肉类在生鲜保存过程中更容易产生亚硝酸盐,而蔬菜则相对稳定。
4. 结论与建议:通过本次实验,我们得出的结论是,食物中的亚硝酸盐含量需要被注意和控制。
消费者在购买食物时应选择符合相关安全标准的产品,并尽量减少食用高含量的亚硝酸盐食物。
此外,食品生产商也应加强对食品加工过程中亚硝酸盐的合理使用和控制。
其可以通过采用较低的亚硝酸盐添加剂浓度、增加原料的新鲜度和加强食品卫生管理来减少亚硝酸盐的含量。
总之,食物中亚硝酸盐含量的测试是确保食品安全的重要环节,需要得到关注和重视。
只有通过严格控制亚硝酸盐含量,我们才能保证食品的质量和食品安全对消费者的重要性。
希望本次食物亚硝酸盐测评报告能对您有所帮助。
谢谢阅读!此致,敬礼。

亚硝酸盐的测定实验报告
实验目的,通过本次实验,我们旨在掌握亚硝酸盐的测定方法,了解其在水中的存在形式,并且掌握其测定原理和操作方法。
实验原理,本实验采用硫酸铵还原法,将亚硝酸盐还原为氮气,然后用碘化钾滴定的方法测定亚硝酸盐的含量。
其中,硫酸铵在酸性条件下可以还原亚硝酸盐为氮气,而滴定过程中,碘化钾与亚硝酸盐发生反应生成碘,在滴定过程中,碘化钾的溶液由无色变为淡黄色,再由淡黄色变为深黄色,直至出现紫色终点时,停止滴定,根据滴定所耗的碘化钾的体积,计算出亚硝酸盐的含量。
实验步骤:
1. 取一定量的水样,加入适量的硫酸铵和硫酸,使水样呈酸性。
2. 将水样加热至沸腾,加入适量的碘化钾指示剂。
3. 用标准的硫代硫酸钠溶液滴定水样,直至出现紫色终点。
4. 记录所耗的硫代硫酸钠溶液的体积。
实验结果,根据实验数据计算出水样中亚硝酸盐的含量为X mg/L。
实验结论,通过本次实验,我们成功掌握了亚硝酸盐的测定方法,了解了其在水中的存在形式,掌握了其测定原理和操作方法。
同时,我们也注意到在实验过程中需要严格控制各种试剂和仪器的使用,以确保实验结果的准确性和可靠性。
总结,本次实验不仅帮助我们掌握了亚硝酸盐的测定方法,还提高了我们的实验操作能力和数据处理能力。
在今后的实验中,我们将继续加强对实验原理和操作方法的理解,不断提高实验技能,为科研工作打下坚实的基础。
通过本次实验,我们对亚硝酸盐的测定有了更深入的了解,也为今后的科研工作提供了重要的实验基础。
希望通过不断的学习和实践,我们能够更好地运用所学知识,为科学研究做出更大的贡献。

亚硝酸盐的测定实验报告亚硝酸盐的测定实验报告引言:亚硝酸盐是一种常见的无机化合物,广泛存在于自然界和生活中的各种环境中。
它可以通过多种途径进入人体,对人体健康造成潜在的威胁。
因此,准确测定亚硝酸盐的含量对于环境监测和食品安全至关重要。
本实验旨在通过一种简单、快速且准确的方法测定亚硝酸盐的含量。
实验方法:实验所需材料有:亚硝酸钠溶液、硫酸、硫酸铁、硫酸钴、硫酸钡。
首先,取一定量的待测液体样品,加入适量的硫酸铁和硫酸钴,使其与亚硝酸盐发生反应生成深蓝色络合物。
然后,用硫酸钡沉淀法将络合物沉淀下来,通过称重的方式确定亚硝酸盐的含量。
实验结果:经过实验测定,得到了待测液体样品中亚硝酸盐的含量为X mg/L。
讨论:本实验采用的方法是一种经典的亚硝酸盐测定方法,其原理是利用亚硝酸盐与硫酸铁和硫酸钴反应生成深蓝色络合物,然后用硫酸钡沉淀法将络合物沉淀下来。
这种方法简单易行,且准确度较高。
然而,由于实验条件和操作的不同,测定结果可能存在一定的误差。
在实际应用中,亚硝酸盐的测定对于环境保护和食品安全具有重要意义。
亚硝酸盐是一种常见的水污染物,其来源主要包括化肥、农药、工业废水等。
高浓度的亚硝酸盐会对水生生物产生毒性影响,同时也会对人体健康造成潜在威胁。
因此,通过准确测定亚硝酸盐的含量,可以帮助我们评估水体的污染程度,并采取相应的措施进行治理。
此外,亚硝酸盐还存在于食品中,特别是含有动物蛋白质的食品。
当含有亚硝酸盐的食品与胃酸反应时,会生成亚硝酸,进而与胃酸中的胆红素反应生成致癌物质亚硝基胆红素。
因此,对食品中亚硝酸盐含量的测定对于食品安全至关重要。
准确测定食品中亚硝酸盐的含量可以帮助我们评估食品的安全性,并采取相应的措施保护消费者的健康。
结论:通过实验测定,得到了待测液体样品中亚硝酸盐的含量为X mg/L。
本实验采用的方法简单、快速且准确,适用于亚硝酸盐含量的测定。
亚硝酸盐的测定对于环境保护和食品安全具有重要意义,可以帮助我们评估水体和食品的安全性,保护人体健康。
实验十二、食品中亚硝酸盐的测定(盐酸萘乙二胺分光光度法)一、实验目的1.明确亚硝酸盐在食品中的作用以及限量标准。
2.掌握盐酸萘乙二胺法测定食品中亚硝酸盐的原理、操作步骤、注意事项二、实验原理样品经沉淀蛋白质,除去脂肪后,在弱酸条件下硝酸盐与对氨基苯磺酸重氮化后,再与盐酸萘乙二胺偶合形成紫红色的染料,与标准系列比较定量。
三、仪器1. 722分光光度计,提前20min打开预热2. 组织绞碎机,菜刀,砧板 1-2套3. 50mL烧杯 500mL烧杯 3L大烧杯4. 电炉 2个5. 托盘天平6. 200mL容量瓶 500mL容量瓶7. 恒温水浴锅8. 25mL具塞比色管9. 滴管,漏斗,滤纸,吸小球10. 玻璃棒,温度计,标记笔,标签纸四、试剂(所用试剂,除另有规定外,均为分析纯试剂。
)1、亚铁氰化钾溶液:称取106.0g亚铁氰化钾[K4Fe6(CN)·3H2O],用水溶解后,稀释至1000mL。
2、乙酸锌溶液:称取22.0g乙酸锌[Zn(CH3C00)2·2H20],加3 mL冰乙酸溶于水,并稀释至100mL。
3、饱和硼砂溶液:称取5.0g硼酸钠(Na2B07·10H20),溶于100 mL热水中,冷却后备用。
4、对氨基苯磺酸溶液(4g/L):称取0.4 g对氨基苯磺酸,溶于100 mL 20%的盐酸中,置棕色瓶中混匀,避光保分装。
5、盐酸萘乙二胺溶液(2g/L):称取0.2克盐酸萘乙二胺,溶于100毫升水中,避光保存。
有致癌作用6、亚硝酸钠标准溶液(0.2g/L):精密称取0.1000g于硅胶干燥器中干燥24h的亚硝酸钠,加水溶解移入500ml容量瓶中,并稀释至刻度。
此溶液每ml相当于200µg亚硝酸钠。
7、亚硝酸钠标准使用液(0.2µg/mL):临用前,吸取亚硝酸钠标准溶液5.00毫升,置于200毫升容量瓶中,加水稀释至刻度,此溶液每毫升相当于5微克亚硝酸钠。
分光光度法测亚硝酸盐的实验报告一、实验目的亚硝酸盐是一类无机化合物的总称,常见的有亚硝酸钠和亚硝酸钾。
在食品加工和储存过程中,亚硝酸盐常被用作防腐剂和发色剂。
然而,过量摄入亚硝酸盐对人体健康有潜在危害,可能导致中毒甚至致癌。
因此,准确测定食品、水样等中的亚硝酸盐含量具有重要意义。
本次实验旨在掌握分光光度法测定亚硝酸盐的原理和操作方法,并能够对实验结果进行准确分析。
二、实验原理分光光度法是基于物质对光的选择性吸收而建立的分析方法。
在本实验中,亚硝酸盐在盐酸酸化的条件下与对氨基苯磺酸发生重氮化反应,然后再与 N(1-萘基)乙二胺盐酸盐偶合生成紫红色的偶氮染料。
该偶氮染料在 538nm 波长处有最大吸收峰,其吸光度与亚硝酸盐的浓度成正比,通过测定吸光度即可计算出亚硝酸盐的含量。
三、实验仪器与试剂1、仪器可见分光光度计电子天平容量瓶(50mL、100mL、500mL)移液管(1mL、2mL、5mL、10mL)比色管(50mL)玻璃棒烧杯(50mL、100mL、500mL)2、试剂亚硝酸钠标准储备液(500μg/mL):准确称取 01232g 于硅胶干燥器中干燥 24h 的亚硝酸钠,用水溶解并定容至 500mL。
亚硝酸钠标准使用液(50μg/mL):吸取 500mL 亚硝酸钠标准储备液于 500mL 容量瓶中,用水稀释至刻度。
对氨基苯磺酸溶液(4g/L):称取 04g 对氨基苯磺酸,溶于 100mL 20%盐酸中,避光保存。
N(1-萘基)乙二胺盐酸盐溶液(2g/L):称取 02g N(1-萘基)乙二胺盐酸盐,溶于 100mL 水中,避光保存。
盐酸溶液(20%):量取 20mL 浓盐酸,用水稀释至 100mL。
四、实验步骤1、标准曲线的绘制分别吸取 000、020、040、060、080、100、150、200mL 亚硝酸钠标准使用液于 50mL 比色管中,各加水至 25mL。
分别加入 2mL 对氨基苯磺酸溶液,摇匀,静置 3-5min。
一、实验目的1. 了解亚硝酸盐的化学性质和检测方法。
2. 学习利用比色法测定食品中亚硝酸盐的含量。
3. 掌握实验操作的规范性和准确性。
二、实验原理亚硝酸盐在酸性条件下与对氨基苯磺酸发生重氮化反应,生成重氮盐,再与N-1-萘基乙二胺盐酸盐结合,形成红色染料。
通过比色法测定红色染料的吸光度,可以计算出样品中亚硝酸盐的含量。
三、实验仪器与试剂1. 仪器:泡菜坛、蔬菜、三角瓶、量筒、烧杯、pH试纸、玻璃棒、微量可调移液器、试管、亚硝酸盐含量的测定试剂盒(含对氨基苯磺酸溶液、N-1-萘基乙二胺盐酸盐溶液、亚硝酸钠标准溶液、显色剂等)。
2. 试剂:(1)对氨基苯磺酸溶液:称取0.4g对氨基苯磺酸,溶解于100ml体积分数为20%的盐酸中,避光保存(4mg/ml)。
(2)N-1-萘基乙二胺盐酸盐溶液:称取0.2g N-1-萘基乙二胺盐酸盐,溶解于100ml水中,避光保存(2mg/ml)。
(3)亚硝酸钠标准溶液:向含有0.025g亚硝酸钠固体的离心管中加入1mL蒸馏水充分溶解,然后将以上溶解液移至50mL容量瓶中,取1mL溶液,移至100mL容量瓶中,加蒸馏水稀释到刻度。
四、实验步骤1. 样品处理:取一定量的泡菜或蔬菜样品,用蒸馏水洗净,切碎,称取适量(如10g)于三角瓶中,加入10mL蒸馏水,充分振荡,静置10分钟。
2. 提取:将三角瓶中的溶液过滤,取滤液备用。
3. 定量:使用微量可调移液器,准确移取1.0mL滤液于试管中。
4. 显色:向试管中加入1.0mL对氨基苯磺酸溶液,充分振荡,静置5分钟。
5. 显色:向试管中加入1.0mLN-1-萘基乙二胺盐酸盐溶液,充分振荡,静置15分钟。
6. 比色:将显色后的样品与已知浓度的标准液进行目测比较,确定样品中亚硝酸盐的含量。
五、实验结果与分析1. 样品中亚硝酸盐含量:通过目测比较,确定样品中亚硝酸盐的含量为XXmg/kg。
2. 分析:根据实验结果,可以判断样品中亚硝酸盐含量是否超标。
食品中亚硝酸盐检验原始记录实验目的:通过检验食品中的亚硝酸盐含量,评估其安全性。
实验仪器和试剂:1. 试剂:亚硝酸钠标准溶液、磷酸二氢钠标准溶液、硫酸亚铁标准溶液、酚酞指示剂、0.1mol/L硫酸2.仪器:量筒、容量瓶、比色皿、酸碱滴定管、pH计、恒温水浴、离心机实验步骤:1.样品准备将待检样品称取10g,加入100ml蒸馏水中,放入大容量瓶中,摇匀,取一部分过滤。
2.预处理将过滤后的样品溶液量取20ml,加入一定量的磷酸二氢钠标准溶液,调节pH至5-6,加入适量的酚酞指示剂。
垂直滴加硫酸亚铁标准溶液,溶液呈现浅红色,持续滴加溶液至溶液呈现持久的蓝色。
3.定量滴定以试验组的试剂为对照组,取20ml试验组样品溶液,加入硫酸亚铁标准溶液,滴定至试剂颜色变化为蓝色。
4.计算结果计算出待检样品中亚硝酸盐的含量。
实验数据:对照组:试剂初始体积(ml):0试剂终点体积(ml):25.5试剂滴定量(ml):25.5待检样品组:试剂初始体积(ml):0试剂终点体积(ml):18.8试剂滴定量(ml):18.8计算结果:对照组的滴定量和待检样品组的滴定量的差值为6.7ml亚硝酸盐含量 = (6.7ml * 0.1mol/L * 46/1000g/mol * 1/20g) * 100%结果分析:根据上述计算方法,可以得到待检样品中亚硝酸盐的含量为0.067%。
根据相关标准,超过一定的亚硝酸盐含量会对人体健康造成危害。
因此,通过本次检验结果可以判断,待检样品中的亚硝酸盐含量超过了安全标准,存在一定风险。
实验结论:本次实验通过对食品中亚硝酸盐含量的检验,发现待检样品中的亚硝酸盐含量超过了安全标准,存在一定的风险。
建议食品生产企业采取相应的措施,减少亚硝酸盐的使用量,确保食品的安全性。
实验十 食品中亚硝酸盐含量的检测1.实验目的掌握盐酸萘乙二胺法检测肉制品中食品添加剂——亚硝酸盐的基本操作技术。
2.实验原理在弱酸性条件下,亚硝酸盐与对氨基苯磺酸重氮化后,再与盐酸奈乙二胺偶合生成紫红色化合物,颜色的深浅与亚硝酸盐含量成正比,其最大吸收波长为538nm ,可测定吸光度并与标准比较定量。
2HCl+NaNO 2+H 2N3H重氮化H 3SO-Cl----+NaCl 2H +2O2HCl .H 2NH 2CH 2+--N-Cl N3H偶合CHN 2CH 2NH 2H .2HCl N -H 3SON +HCl盐酸萘乙二胺紫红色3.仪器、试剂及材料3.1仪器50mL 小烧杯,752型分光光度计,250mL 容量瓶,1mL 移液管,25mL 具塞试管,洗耳球 3.2试剂(1)饱和硼砂溶液:溶解5g 硼酸钠于100mL 热水中,冷却后备用。
(2)硫酸锌溶液:溶解30g 硫酸锌于100mL 水中。
(3)对氨基苯磺酸溶液(0.4%):溶解0.4g 对氨基苯磺酸于100mL20%盐酸中,避光保存。
(4)盐酸奈乙二胺溶液(0.2%):溶解0.2g 盐酸奈乙二胺于100mL 水中,避光保存。
(5)亚硝酸钠标准溶液:精确称取0.1000g 亚硝酸钠(硅胶干燥中干燥24小时),加水溶解,移入500mL 容量瓶,并稀释至刻度,混匀,临用前吸取5.00mL 容量瓶中,加水至刻度,混匀,此溶液每毫升相当5μg 亚硝酸钠。
(6)亚铁氰化钾溶液:称取10.6g 亚铁氰化钾于100mL 容量瓶中定容。
3.3材料火腿肠4.实验步骤4.1亚硝酸钠的提取4.2 测定试剂按照表1进行添加表1 各试剂添加顺序滤液20 0.4%对氨基苯磺酸1 1 1 1 1 1 混匀3~5min 0.2%盐酸奈乙二胺0.50.50.5 0.5 0.50.5补水至25mL数据处理公式与方法:1000250201000A X ⨯⨯⨯=mX ——样品中的亚硝酸盐的含量,mg/kg ;A ——测定用滤液中亚硝酸钠的含量,μg ; m ——样品的质量,g ;20/250——测定用样液体积mL/试样处理液总体积mL 。
一、实验目的1. 了解亚硝酸盐的检测原理和方法。
2. 掌握利用比色法检测食品中亚硝酸盐含量的操作步骤。
3. 学会分析实验结果,判断食品中亚硝酸盐的污染程度。
二、实验原理亚硝酸盐在酸性条件下与对氨基苯磺酸发生重氮化反应,生成的重氮盐与N-1-萘基乙二胺盐酸盐结合形成紫红色偶氮化合物。
该化合物在540nm波长处有最大吸收,通过测定吸光度值,可以计算出食品中亚硝酸盐的含量。
三、实验材料与仪器1. 材料:亚硝酸钠标准溶液、对氨基苯磺酸、N-1-萘基乙二胺盐酸盐、盐酸、乙酸、样品(如腌肉、鱼制品等)。
2. 仪器:分光光度计、移液管、容量瓶、试管、烧杯、滴定管、玻璃棒等。
四、实验步骤1. 标准曲线的绘制(1)准确移取0.00、0.10、0.20、0.30、0.40、0.50mL亚硝酸钠标准溶液于6只试管中,分别加入2.0mL盐酸,振荡混匀。
(2)加入0.5mL对氨基苯磺酸溶液,振荡混匀,放置10分钟。
(3)加入0.5mLN-1-萘基乙二胺盐酸盐溶液,振荡混匀,放置15分钟。
(4)以空白试剂为参比,在540nm波长处测定吸光度值。
(5)以吸光度值为纵坐标,亚硝酸钠浓度为横坐标,绘制标准曲线。
2. 样品中亚硝酸盐含量的测定(1)准确称取样品2.0g,加入10mL蒸馏水,振荡混匀。
(2)准确移取5.0mL样品溶液于试管中,按照标准曲线绘制步骤进行操作。
(3)以空白试剂为参比,在540nm波长处测定吸光度值。
(4)根据标准曲线,计算样品中亚硝酸盐含量。
五、实验结果与分析1. 标准曲线绘制以吸光度值为纵坐标,亚硝酸钠浓度为横坐标,绘制标准曲线。
计算线性回归方程:y = 0.0064x + 0.0011,R² = 0.9989。
2. 样品中亚硝酸盐含量的测定根据标准曲线,计算样品中亚硝酸盐含量。
假设样品中亚硝酸盐含量为x,代入线性回归方程得:x = (吸光度值 - 0.0011) / 0.0064六、实验结论通过本次实验,我们掌握了亚硝酸盐的检测原理和操作步骤,能够准确测定食品中亚硝酸盐的含量。
泡菜中亚硝酸盐的检验
实验组长:陈佶
实验组员:郝吴双石行健丁逸苇吴纪轩吕志轩
实验日期:11月23日 ~ 12月6日
实验准备(资料查阅):
心得体会:
这是我们第一次进行食品分析与检验实验课程。
实验内容是食品中亚硝酸盐含量的测定。
在这其中我学会了用盐酸萘乙二胺测量亚硝酸含量的基本操作技术,拓展了视野,无论将来我是否会从事生物方面的工作,这都将是我的一笔宝贵财富。
感谢老师耐心的讲解,使得我们对实验的各项要求目的都有了明确的掌握。
但由于水平有限,实验报告中定有纰漏错误,请老师不吝赐教!
一、前言
“亚硝酸盐”这一名词对我们来说并不陌生,这是一类无机化合物的总称。
主要指亚硝酸钠,这是一种白色至淡黄色粉末或颗粒状,味微咸,易溶于水。
其外观及滋味都与食盐相似,并在工业、建筑业中广为使用,肉类制品中也允许作为发色剂限量使用。
由亚硝酸盐引起食物中毒的机率较高。
食入0.3~0.5克的亚硝酸盐即可引起中毒甚至死亡。
我们通过实验测定了泡菜中不同时期的亚硝酸盐的含量,这不仅是一次美妙的实践,更为我们的生活提供了指南,让我真真正正的接触到了这个平时只出现在报道上的奇妙物质。
二、实验原理
泡菜的制作离不开乳酸菌,乳酸菌是厌氧细菌,在无氧的情况下,将葡萄糖分解成乳酸。
这其中也生成了一定量的的亚硝酸盐。
在盐酸酸化条件下,亚硝酸盐与对氨基苯磺酸发生重氮化反应后,与N-1-萘基乙二胺盐酸盐结合形成玫瑰色染料。
将显色反应后的样品与已知浓度的标准液进行目测比较,可以大致估算出泡菜中亚硝酸盐的含量。
三、设备及试剂
泡菜坛、蔬菜、三角瓶、量筒、烧杯、pH试纸、玻璃棒、微量可调移液器、试管、亚硝酸盐含量的测定试剂盒。
四、实验
※泡菜制作
实验准备:泡菜坛子一个、高粱白酒、花椒、辣椒、大料、冰糖、盐。
具体制作方法如下:
(1)各种菜(萝卜、白菜等)洗净并切成3~4cm长
的小块。
(2)按照清水与盐的质量比4:1的比例配制盐水,将盐水煮沸冷却。
(3)将经过预处理的新鲜蔬菜混合均匀,装入泡菜坛内,使盐水没过全部菜料,盖好坛盖。
(4)将坛口用水封好,防止外界空气进入。
(5)泡菜发酵。
泡菜菌属于厌氧菌,注意坛口的密封十分重要。
※亚硝酸盐检验 检测原理:
在盐酸酸化条件下,亚硝酸盐与对氨基苯磺酸发生重氮化反应生成重氮盐,重氮盐与N-1-萘基乙二胺盐酸盐偶合形成玫
瑰红色染料,产生的颜色深浅与亚硝酸根含量成正比,通过与标准比色板的进行目测比较,可大致估算出待检测样品中的亚硝酸盐的含量。
实验步骤:
1、制备标准显色液
制备50ml 浓度梯度的亚硝酸钠标准液,分别含有1、2、3、4、5、7.5ug 亚硝酸钠(见PPT 里面的实验结果图),观察记录颜色变化及其标准曲线。
将5ml 样品检测液在分光光度计(特异性检测亚硝酸钠的550nm 波长)进行吸光光度测定,根据标准曲线测出样品的浓度。
设置空白对照2管
[2*4ml 蒸馏水+2*200ul 对氨基苯磺酸+2*100ul N-1-萘基乙二胺盐酸盐+2*700ulH 2O 至总体积2*5ml]
五、实验结果
分析:
适当消除误差后,可以发现泡菜中亚硝酸盐的含量先增多后减少,在泡菜制作一周后达顶峰0.56毫克每千克。
即在泡菜制作一周之内不要大量食用泡菜。
数据分析:泡菜中亚硝酸盐先增加后减少,腌制的泡菜在完成正常的腌制过程之后是没有亚硝酸盐的存在的。
原因推测:蔬菜中的酚类物质和维生素C等物质会将亚硝酸盐还原。
吸湿,易溶于水,水溶液稳定,表现碱性反应,可从空气中吸收氧气,并形成硝酸钠。
在亚
硝酸钠分子中,氮的化合价是+3。
是一种中间化合态,既有还原性又有氧化性,例如在酸性溶液中能将KI氧化成单质碘。
附录
一、泡菜知识介绍:
泡菜是一种以湿态发酵方式加工制成的浸制品,为泡酸菜类的一种。
泡菜制作容易,成本低廉,营养卫生,风味可口,利于贮存。
二、泡菜营养分析:
1. 泡菜中有丰富的活性乳酸菌,它可抑制肠道中腐败菌的生长,减弱腐败菌在肠道的产毒作用,并有帮助消化、防止便秘、防止细胞老化、降低胆固醇、抗肿瘤等作用;
2. 泡菜中的辣椒,蒜,姜,葱等刺激性作料可起到杀菌,促进消化酶分泌的作用;
3. 泡菜还可以促进人体对铁元素的吸收。