实验十七 聚合硫酸铁的制备及性能测定
- 格式:docx
- 大小:98.62 KB
- 文档页数:4


聚合硫酸铁的制备及性能测定刘世宏张融涂杨贺佳萌(中南大学化学化工学院湖南长沙410083)摘要:本实验以硫酸亚铁、硫酸、双氧水为原料, 采用直接氧化法在常温常压下制备了聚合硫酸铁, 并用不同用量的聚合硫酸铁进行了去浊率实验. 结果表明, 在200mL高浊度水样中加入1:100稀释后的的聚合硫酸铁10mL时去浊效果最佳, 去浊率为96.2%.关键词:聚合硫酸铁; 硫酸亚铁; 双氧水; 去浊率1 引言聚合硫酸铁(Poly Ferric Sulfate简称PFS)是70年代国外开发的一种铁系无机高分子混凝剂, 与硫酸亚铁、三氯化铁、硫酸铝以及碱式氯化铝等相比[1], 它有许多明显的优点. 如净水过程中生成矾花大、强度高、沉降快, 在污水处理时对某些重金属离子及COD、色度、恶臭等均有显著的去除效果. 因此, 被广泛地应用于给排水工业和废水处理等行业[2].生产聚合硫酸铁的原料来源很多, 如硫酸亚铁、钢铁酸洗废液、铁屑和铁矿石等[3]. 其中以硫酸亚铁为原料的生产工艺简单, 条件温和, 成品杂质少, 品质较高. 硫酸亚铁为原料生产聚合硫酸铁的方法可分为直接氧化法和催化氧化法两大类[4]. 直接氧化法是直接通过强氧化剂(如NaClO, KClO3和H2O2等)将亚铁离子氧化为铁离子, 经水解和聚合获得聚合硫酸铁;催化氧化法是在催化剂(如NaNO2和HNO3等)的作用下, 利用空气或氧气将亚铁离子氧化为铁离子, 经水解和聚合获得聚合硫酸铁. 催化氧化法一般以空气为氧化剂, 生产成本相对较低, 在实际生产中应用较广, 但工艺流程复杂, 对设备要求较高, 投资较大[5,6].本研究以硫酸亚铁为原料, 在常温常压下用双氧水直接氧化法合成聚合硫酸铁, 并对其性能进行了测定.2 实验部分2.1 仪器与试剂电子天平(MP3002, 上海舜宇恒平科学仪器有限公司); 可见分光光度计(722型, 上海恒平科学仪器有限公司); 恒温加热磁力搅拌器(78HW-1, 杭州仪表电机有限公司).硫酸亚铁(FeSO4, AR); 硫酸(H2SO4, AR); 双氧水(H2O2, AR).2.2 聚合硫酸铁的制备称取11.00g磨细后的硫酸亚铁, 加入250mL锥形瓶中, 加水25mL, 浓硫酸0.64mL. 开启搅拌器, 用滴管缓慢加入H2O2 2.7ml. H2O2加完后, 过滤, 静置, 冷却, 即得聚合硫酸铁成品溶液.2.3 去浊率的测定取1mL制得的聚合硫酸铁, 按1:100的体积比稀释. 取200mL高浊度原水样9份, 分别向其中加入1.00, 3.00, 6.00, 7.00, 9.00,mL稀释后的聚合硫酸铁. 剧烈搅拌3min, 慢速搅拌10min, 静置. 取其中未加聚合硫酸铁的水样于1cm比色皿中, 以水为参比, 按可见光互补原理,寻找其最大吸收波长. 剩余水样分别取上层清液(液面以下2~3cm处), 于最大吸收波长下依次测定吸光度, 找出去浊效果最好时聚合硫酸铁的加入量.3 结果与讨论3.1 最大吸收波长的选择由于显色产物几乎无色(静置前为黄色). 用722型分光光度计在此波长范围内进行波长选择, 其结果见图1. 由图可知λmax=385nm, 故选定385nm作为测定波长.图一吸收曲线3.2 聚合硫酸铁用量对去浊效果的影响加入一定量的聚合硫酸铁絮凝剂对于浑浊度较高的原水样的净化有明显效果. 浑浊水样经凝聚, 絮凝和沉降后, 上层为澄清液体, 下层为沉淀物. 分别测定不同聚合硫酸铁加入量的浑浊水样吸光度(图2). 由去浊率=(原浊度—反应后浊度)/原浊度, 可得聚合硫酸铁加入量对去浊率的影响.图二聚合硫酸铁加入量与吸光度的关系由图2, 随着聚合硫酸铁絮凝剂加入量增加, 水样吸光度呈现先下降后上升的趋势.在进行去浊率计算时发现本组数据出现严重失误,原液的吸光度比加入聚合硫酸铁的吸光度还要小,这与实验本身的要求出现了严重的偏差,但是实验过程中没有注意到这一点,只是看到加入聚合硫酸铁后吸光度呈现先变小后变大的趋势,就错误的以为得到的实验数据是对的。

聚合硫酸铁的制备及性能测定摘要:以硫酸亚铁为原料,在常温常压下采用双氧水直接氧化法合成聚合硫酸铁。
并用不同用量的聚合硫酸铁进行实验,测水样的吸光度,得去浊率。
作用量与去浊率的关系图,找出最佳用量。
关键词:聚合硫酸铁;制备;性能检测;最佳用量1前言聚合硫酸铁是一种铁系无机高分子混凝剂,与硫酸亚铁、三氯化铁、硫酸铝以及碱式氯化铝等相比,具有无毒、适用pH 范围广、矾花大、沉降快等优点,对COD、色度以及重金属离子等都有较好的去除效果,因此,被广泛地应用于给排水工业和废水处理等行业。
生产聚合硫酸铁的原料来源很多,如硫酸亚铁、钢铁酸洗废液、铁泥和铁矿石等,其中以硫酸亚铁为原料的生产工艺简单,条件温和,成品杂质少,品质高。
本实验以钛白粉厂的副产品硫酸亚铁为原料,在常温常压下采用双氧水直接氧化法合成聚合硫酸铁。
按照氧化方式的不同,聚合硫酸铁的生产方法可分为直接氧化法和催化氧化法两大类。
直接氧化法是直接通过强氧化剂(如NaClO、KClO3 、H2O2 等) 将亚铁离子氧化为铁离子,经水解和聚合获得聚合硫酸铁; 催化氧化法是在催化剂( 如NaNO2 、HNO3 等) 的作用下, 利用空气或氧气将亚铁离子氧化为铁离子,经水解和聚合获得聚合硫酸铁。
催化氧化法一般以空气为氧化剂,生产成本相对较低,在实际生产中应用较广,但需在较高的温度(80 ℃) 和反应压力(0. 3 MPa) 下进行,反应时间较长(NaNO2 法为17 h ,HNO3 法为5 h) ,需要安装废气净化装置,以脱去反应过程中产生的大量氮氧化物气体,工艺流程复杂,对设备要求较高,投资较大。
二价铁被双氧水氧化形成三价铁离子。
在一定 pH 下,铁离子水解生成聚合硫酸铁,当稀释时进一步发生水解,形成 Fe(OH)3 胶体,通过沉淀、吸附、絮凝等作用,使水相中的悬浮物、染料、Zn2+被转入固相。
固相的物质可通过过滤或上浮法除去。
Fe(H2O)33++OH- Fe(OH)3↓+3H++H2OZn2++OH- Zn(OH)2↓再通过浮上法,将氢氧化铁胶体浮上,使水中锌除去。

聚合硫酸铁标准聚合硫酸铁是一种重要的含铁化合物,广泛应用于工业生产和实验室研究中。
作为一种常见的无机化合物,聚合硫酸铁的标准具有重要意义,能够保证其质量稳定、安全可靠地应用于各个领域。
本文将就聚合硫酸铁标准的相关内容进行介绍,以期为相关从业人员提供参考和指导。
一、聚合硫酸铁的物理性质。
聚合硫酸铁是一种无色结晶体,具有良好的溶解性和稳定性。
其化学式为Fe2(SO4)3,相对分子质量为399.88。
在常温下为无水物,但在空气中易吸湿,形成六水合物。
聚合硫酸铁的密度为2.1g/cm³,熔点约为480℃。
这些物理性质对于聚合硫酸铁的标准制定具有重要的参考价值。
二、聚合硫酸铁的化学性质。
聚合硫酸铁在水中溶解时呈酸性,能与碱反应生成相应的盐类。
在氧化性较强的条件下,聚合硫酸铁易发生还原反应,生成二价铁盐。
此外,聚合硫酸铁还具有氧化性,能够氧化许多有机物。
这些化学性质对于聚合硫酸铁标准的制定和应用具有重要的指导作用。
三、聚合硫酸铁的生产工艺。
聚合硫酸铁的生产工艺主要包括硫酸铁的制备和聚合反应两个步骤。
硫酸铁的制备通常采用硫磺和铁粉为原料,在高温下反应生成硫酸铁。
而聚合反应则是将硫酸铁溶液在一定条件下进行加热浓缩,使其分子结构发生变化,形成聚合硫酸铁。
生产工艺的合理性对于聚合硫酸铁的质量和标准具有直接影响,因此需要在标准中进行明确规定。
四、聚合硫酸铁的应用领域。
聚合硫酸铁广泛应用于水处理、电镀、医药、染料、催化剂等领域。
在水处理中,聚合硫酸铁可用作絮凝剂,去除水中的悬浮物和浑浊物质。
在电镀中,聚合硫酸铁可用作电镀液的添加剂,提高电镀件的表面光洁度。
在医药领域,聚合硫酸铁可用作止血剂和抗贫血药物的原料。
聚合硫酸铁的应用领域多样,标准的制定需要充分考虑到不同领域的需求和要求。
五、聚合硫酸铁的标准制定。
聚合硫酸铁的标准制定需要考虑其物理性质、化学性质、生产工艺和应用领域等多个方面的因素。
标准应当明确聚合硫酸铁的化学成分、外观要求、质量指标、检测方法等内容,以确保其质量稳定、安全可靠地应用于各个领域。

聚合硫酸铁的测定方法1密度的测定(密度计法)1.1方法提要由密度计在被测液体中达到平衡状态时所浸没的深度,读出该液体的密度。
1.2仪器、设备密度计:刻度值为0.001g/cm 3.恒温水浴:可控温度(20±1)℃。
温度计:分度值为1℃。
量筒:250ml ~500 ml 。
1.3测定步骤:将聚合硫酸铁试样注入清洁、干燥的量筒内,不得有气泡。
将量筒置于(20±1)℃的恒温水浴中,待温度恒定后,将密度计缓缓地放入试样中,待密度计在试样中稳定后,读出密度计弯月面下缘的刻度(标有读弯月面上缘的刻度的密度计除外),即为20℃试样的密度。
2全铁含量的测定重铬酸钾法2.1方法提要在酸性溶液中,用氯化亚锡将三价铁还原为二价铁,过量的氯化亚锡用氯化汞予以除去,然后用重铬酸钾标准溶液滴定。
2.2试剂和材料水,GB/T6682,三级。
氯化亚锡溶液:250g/L 。
称取25.0g 氯化亚锡置于干燥的烧杯中,加入20ml 盐酸,加热溶解,冷却后稀释到100ml,保存于棕色滴瓶中,加入高纯锡粒数颗。
盐酸溶液:1+1。
氯化汞饱和溶液。
硫-磷混酸:将150ml 硫酸,缓慢注入到含500ml 水的烧杯中,冷却后再加入150ml 磷酸,然后稀释到1000ml 容量瓶中。
重铬酸钾标准滴定溶液C(1/6K 2Cr 2O 7)=0.1mol/L 。
二苯胺磺酸钠溶液:5g/L 。
2.3分析步骤:称取液体产品约1.5g 或固体产品约0.9g,精确至0.0002g,置于2350ml 锥形瓶中,加水20ml ,加盐酸溶液20ml ,加热至沸,趁热滴加氯化亚锡溶液至溶液黄色消失,再过量1滴,快速冷却,加氯化汞饱和溶液5ml ,摇匀后静置1min ,然后加水50ml,再加入硫-磷混酸10ml ,二苯胺磺酸钠指示剂4~5滴,立即用重铬酸钾标准滴定溶液滴定至紫色(30s 不褪)即为终点。
2.4结果的计算:全铁含量以质量分数W1计,数值以%表示,按式(1)计算:W1=1001000⨯⨯mVCM式中:V----滴定时消耗重铬酸钾标准滴定溶液的体积的数值,单位为毫升(ML )C----重铬酸钾标准滴定溶液浓度的准确数值,单位为摩尔每升(mol/L )M----铁摩尔质量的数值,单位为克每摩尔(g/mol )M(Fe)=55.85m---试料质量的数值,单位为克(g )。
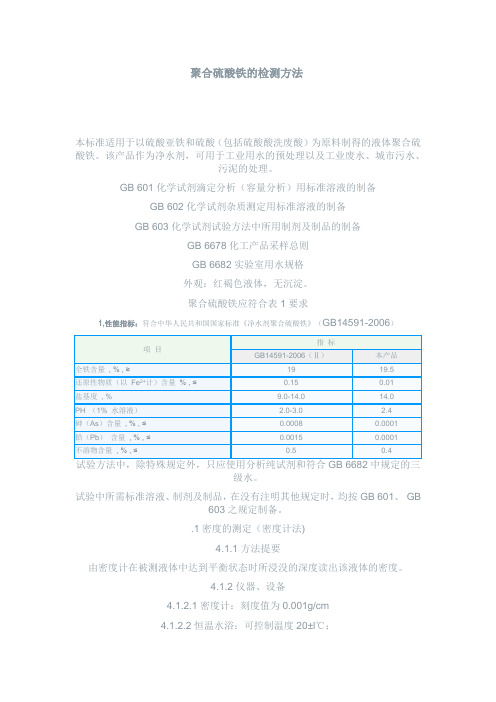
聚合硫酸铁的检测方法本标准适用于以硫酸亚铁和硫酸(包括硫酸酸洗废酸)为原料制得的液体聚合硫酸铁。
该产品作为净水剂,可用于工业用水的预处理以及工业废水、城市污水、污泥的处理。
GB 601化学试剂滴定分析(容量分析)用标准溶液的制备GB 602化学试剂杂质测定用标准溶液的制备GB 603化学试剂试验方法中所用制剂及制品的制备GB 6678化工产品采样总则GB 6682实验室用水规格外观:红褐色液体,无沉淀。
聚合硫酸铁应符合表1要求1,性能指标:符合中华人民共和国国家标准《净水剂聚合硫酸铁》(GB14591-2006)级水。
试验中所需标准溶液、制剂及制品,在没有注明其他规定时,均按GB 601、GB603之规定制备。
.1密度的测定(密度计法)4.1.1方法提要由密度计在被测液体中达到平衡状态时所浸没的深度读出该液体的密度。
4.1.2仪器、设备4.1.2.1密度计:刻度值为0.001g/cm4.1.2.2恒温水浴:可控制温度20±l℃;4.1.2.3温度计:分度值为1℃;4.1.2.4量筒:250~500mL。
4.1.3测定步骤将聚合硫酸铁试样注入清洁、干燥的量筒内,不得有气泡。
将量筒置于20±1℃的恒温水浴中,待温度恒定后,将密度计缓缓地放入试样中,待密度计在试样中稳定后,读出密度计弯月面下缘的刻度(标有读弯月面上缘刻度的密度计除外),即为20℃试样的密度。
4.2全铁含量的测定4.2.1重铬酸钾法4.2.1.1方法提要在酸性溶液中,用氯化亚锡将三价铁还原为二价铁,过量的氯化亚锡用氯化汞予以除去,然后用重铬酸钾标准滴定溶液滴定,反应方程式为:2Fe<SUP>3+</SUP>+Sn<SUP>2+</SUP>=2Fe<SUP>2+</SUP>+Sn<SUP>4+</SUP>SnCl<SUB>2</SUB>+2HgCl<SUB>2</SUB>=SnCl<SUB>4</SUB>+Hg<SUB>2</SUB>Cl<SUB>2</SUB>6Fe<SUP>2+</SUP>+Cr<SUB>2</SUB>O<SUB>7</SUB><SUP>2-</SUP> +14H<SUP>+</SUP>=6Fe<SUP>3+</SUP>+2Cr<SUP>3+</SUP>+7H<SUB>2</SUB>O4.2.1.2试剂和溶液a氯化亚锡(GB 638)溶液:250g/L盐酸溶液;称取25.0g氯化亚锡置于干燥的烧杯中,溶于20mL盐酸(GB 622),冷却后稀释到100 mL,保存于棕色瓶中,加入高纯锡粒数颗。

净水剂聚合硫酸铁的制备实验设计
实验目的:
制备聚合硫酸铁净水剂,用于去除水中的重金属离子和有机物等有害物质。
实验原理:
聚合硫酸铁作为一种常见的净水剂,可以与水中的有害物质反应生成沉淀,从而达到净化水质的作用。
其制备原理为将硫酸铁溶解在水中并经过一定条件下的聚合反应,生成聚合硫酸铁。
实验步骤:
1.将一定量的硫酸铁粉末加入200 mL的蒸馏水中,搅拌至完全溶解。
2.分别取出两个250 mL的锥形瓶,将其中的一个加入适量的聚丙烯酰胺(PAM)水溶液。
3.将含有硫酸铁的溶液缓慢加入含有PAM水溶液的瓶中,同时快速搅拌,保持反应均匀。
4.将混合溶液缓慢滴加氢氧化钠溶液,继续搅拌,直至pH值达到7.0以上。
5.将反应液放置在室温下,静置24小时,待沉淀生成。
6.将上清液过滤,将沉淀洗涤干净,放在干燥器中干燥。
7.将得到的聚合硫酸铁粉末进行包装,备用。
实验注意事项:
1.实验中涉及到的溶液和试剂应为高纯度、试剂级,防止杂质影响反应结果。
2.在加入氢氧化钠溶液时,应缓慢进行,避免pH值过高对反应产生影响。
3.制备好的聚合硫酸铁应放置在干燥器中充分干燥,避免吸潮影响使用效果。
结论:
通过该实验,成功制备了聚合硫酸铁净水剂,可应用于去除水中的重金属离子和有机物等有害物质。

【大学化学实验Ⅲ】综合实验报告论文—聚合硫酸铁的制备及其混凝性的测试学院:化学与化工学院专业班级: 无机102班**: **学号: **********目录1、摘要 (3)2、引言 (3)3、实验目的 (3)4、实验原理 (3)4.1聚合硫酸铁的制备原理 (3)4.2聚合硫酸铁的制备方法 (5)5.实验步骤: (5)5.1 .FeSO4 的制备 (5)5.2.聚合硫酸铁的制备 (5)5.3、聚合硫酸铁各项主要性能指标的测定: (6)5.4、聚合物硫酸铁的混凝效果实验 (6)6.实验仪器和试剂 (6)7.实验过程 (6)8.实验结果及数据处理 (7)9.实验讨论 (8)10.参考文献 (9)聚合硫酸铁的制备及混凝性能测试1、摘要: 聚合硫酸铁分子式:[Fe2(OH)n(SO4)3-n/2]m (其中n<2, m=f(n))。
聚合硫酸铁是一种新型、优质、高效铁盐类无机高分子混凝剂。
聚合硫酸铁形态性状是淡黄色无定型粉状固体,极易溶于水,10%(重量)的水溶液为红棕色透明溶液。
聚合硫酸铁的作用---主要用于生活饮用水及工业用水的净化。
也可对各种工业废水与城市污水(如食品、皮革、矿山、冶金、印染、造纸、石油等废水)进行净化处理,在水处理领域中有着良好的应用前景,研究聚合硫酸铁的制备方法及其反应各方面的因素,并从其制备过程中学习无极聚合物密度、黏度、浊度的测定等方法。
聚合硫酸铁广泛应用于、工业用水、各种工业废水、城市污水、污泥脱水等净化处理。
关键字: 聚合硫酸铁混凝剂无机高分子水处理2、引言: 我国是一个水资源短缺的国家,人均水占有量只有世界人均占有量的1/4,且随着工农业生产的发展,水污染也日趋严重,因而地表水处理和污水处理会用日益受到重视,水处理剂的用量不断增大,所以新型混凝剂的研究与开发越来越受到人们的关注。
聚合硫酸铁(PFS)也称碱式硫酸铁或羟基硫酸铁, 是一种无机高分子絮凝剂。
与其他絮凝剂如三氯化铁,硫酸铝,氯化硫酸铁,碱式氯化铝等相比,聚合硫酸铁生产成本低、投加量少、适用PH范围广、杂质(浊度、COD、悬浮物等)去除率高、残留物浓度低、矾花沉降速度快、脱色效果好,因而广泛应用于工业废水、城市污水、工业用水以及生活饮用水的净化处理。

聚合硫酸铁全铁含量的测定聚合硫酸铁是一种重要的化学物质,广泛应用于工业生产和科学研究中。
测定聚合硫酸铁中的全铁含量是一项关键的分析工作,对于确保产品质量和实验结果的准确性具有重要意义。
本文将介绍聚合硫酸铁全铁含量测定的方法和步骤。
我们需要准备一定量的聚合硫酸铁样品。
样品的含量应当适量,既能够满足测定的需要,又能够保证实验结果的准确性。
同时,样品的保存和处理应当符合实验室标准,避免外界因素对样品的影响。
我们可以选择合适的测定方法来测定聚合硫酸铁的全铁含量。
常用的方法包括重量法、容量法和光谱法等。
重量法是通过样品的质量变化来测定全铁含量,容量法是通过滴定法来测定全铁含量,光谱法是通过样品的吸光度来测定全铁含量。
根据实际需要和实验条件,选择适合的测定方法进行分析。
接下来,我们需要按照测定方法的要求进行实验操作。
在进行实验操作之前,应当仔细阅读测定方法的说明,了解实验步骤和操作要点。
在实验过程中,要注意操作的准确性和规范性,避免操作失误对实验结果的影响。
在实验操作完成后,我们需要对实验结果进行处理和分析。
根据实验数据和测定方法的计算公式,可以得到聚合硫酸铁的全铁含量。
在进行数据处理和分析时,要注意计算的准确性和结果的合理性,避免计算错误和结果偏差。
我们需要对实验结果进行总结和讨论。
根据实验结果,可以评估聚合硫酸铁的质量和纯度,并对实验方法的准确性和可行性进行评价。
在总结和讨论中,要客观地分析实验结果的优缺点,并提出改进和进一步研究的建议。
测定聚合硫酸铁的全铁含量是一项重要的分析工作。
通过选择合适的测定方法、进行准确的实验操作、正确处理和分析实验结果,可以得到准确的全铁含量数据。
这对于保证产品质量和实验结果的准确性具有重要意义,同时也为进一步研究和应用聚合硫酸铁提供了基础。


聚合硫酸铁小试报告
聚合硫酸铁是一种水溶性高分子化合物,能够与金属离子发生络合反应,广泛应用于电镀、染料、防腐等领域。
本次实验中,我们通过将硫酸铁和硫酸钾混合,并加入适量的硝酸铵和过硫酸铵,使其发生氧化还原反应,最终得到聚合硫酸铁。
实验步骤:
1.将100ml的去离子水倒入烧杯中;
2.加入2.5g的硫酸钾,搅拌溶解;
3.加入1.7g的硫酸铁,并搅拌溶解;
4.加入1ml的硝酸铵,搅拌均匀;
5.加入1ml的过硫酸铵,搅拌均匀;
6.将溶液倒入50ml的烧杯中,用酒精灯进行加热;
7.持续加热至溶液浓缩并变黄色,停火冷却至室温;
8.用滤纸过滤沉淀,洗涤干净;
9.将沉淀放在烘箱中干燥,直至质量不再变化。
实验结果:
经过实验,我们成功制备了聚合硫酸铁。
在实验过程中,我们注意到溶液在加热过程中逐渐变黄,最终形成了固体沉淀。
通过对干燥后的沉淀进行质量称量,得到了聚合硫酸铁的质量为1.68g。
结论:
通过本次小试实验,我们成功制备了聚合硫酸铁,并对其进行了基本性质测试。
聚合硫酸铁具有良好的络合性和水溶性,适用于多种
领域。
在实验过程中,我们还发现了溶液的颜色变化对应着反应的进程,这为我们进一步研究该化合物的制备及应用提供了参考。

聚合硫酸铁产品质量检测报告1. 引言本报告旨在对聚合硫酸铁产品的质量进行全面检测,从物理性质、化学成分、纯度及含量等方面进行评估,以确保产品的合格性以及满足客户需求。
2. 检测方法为了保证检测结果的准确性和可靠性,我们采用了以下检测方法进行测试:- 物理性质测试:包括外观、颜色、臭味、相对密度和溶解性等方面的测试。
我们通过目测、仪器测量等方法来检测产品的物理性质。
- 化学成分分析:通过使用化学分析仪器,我们对产品的化学成分进行了测试和分析,包括元素组分、化学配比等方面的检测。
- 纯度检测:利用纯度分析仪器,我们对产品的纯度进行了测试,以评估产品的纯净度和含杂质的情况。
- 含量测定:采用定量分析技术对产品中目标成分的含量进行测定,以确保产品符合标准要求。
3. 检测结果3.1 物理性质测试结果在物理性质测试中,我们发现聚合硫酸铁产品呈现为深褐色固体,无臭味,相对密度为1.49 g/cm³。
该产品在常温下稳定,溶于水和醇。
外观均匀,无明显异物。
3.2 化学成分分析结果经过化学成分分析,我们得到聚合硫酸铁产品的化学成分如下:- 含铁量:98.5%- 含硫量:1.2%- 含氯量:0.05%- 含氟量:0.02%3.3 纯度检测结果纯度检测显示,聚合硫酸铁产品的纯度为99.8%,含杂质仅为0.2%,符合产品质量标准要求。
检测中未发现任何有害物质或禁用物质。
3.4 含量测定结果含量测定显示,聚合硫酸铁产品中目标成分含量达到标准要求。
具体含量为:- 铁离子含量:98%- 硫酸根离子含量:1.4%- 其他杂质离子含量:0.6%4. 结论根据以上检测结果,我们得出以下结论:1. 聚合硫酸铁产品的物理性质符合标准要求,无异物,外观均匀。
2. 化学成分分析显示产品的主要成分含铁量为98.5%,含硫量为1.2%,符合产品质量要求。
3. 聚合硫酸铁产品的纯度检测结果显示纯度为99.8%,含杂质仅为0.2%。
4. 含量测定结果表明聚合硫酸铁产品中目标成分含量符合标准要求。

聚合硫酸铁的制取方法有很多种,采用不同的制取方式制作出来的产品效果也是不要一样的,纯度上也会存在一些差异。
一、原料为钛白粉厂的副产品FeSO4和废H2SO4。
制作工艺是确定FeSO4·H2O中铁的含量,在通入热空气脱水,当含有1-2个结晶时,通冷空气,在有氧化剂的条件下使之成为氧化物料,此时家废硫酸和固化剂进行固化反应,待固化完成聚铁产品已形成。
生产过程控制SOi24-:Fe2+(mo1)=1.30:1.45
二、原料为硫酸亚铁、硫酸和催化剂。
采用不同的催化剂可形成不同的制造工艺。
工艺方法是将硫酸洗液浓缩,调整酸和亚铁比例,在密闭压力容器内,加入定量的亚硝酸钠,再通入氧气,在定温、定亚的搅拌下,经反应便得到聚合硫酸铁。
三、原料为浓硫酸和硫酸亚铁;制备工艺是浓硫酸直接加到硫酸亚铁中,再加适量的催化剂MnO2 (或30%稀酸加到亚铁中再加入催化剂NaNO2)后,通入空气进行氧化,水解和聚合反应后即制备出聚合硫酸铁。
要知道聚合硫酸铁的制取方法,会根据使用原料的不同,从而导致制取的过程也会存在一些不同。
所以为了确保产品的制取质量,一定要严格把控好每一步制取操作。

聚合硫酸铁定性试验及含量分析方法一、定性试验1、应用试剂氨水;盐酸;亚铁氰化钾溶液(100g/L)∶氯化钡溶液(50g/L)。
2、测定手续(1)外观应为红褐色液体。
(2)取样品水溶液,加入氨水,即产生红棕色胶性沉淀,此沉淀不溶于过量氨水,但溶于盐酸中取样品水溶液,加入少量盐酸及亚铁氰化钾溶液(100g/L),即产生蓝色沉淀(证实有铁盐)。
反应式如下:Fe3++3NH4OH=Fe(OH)3↓+3NH+44Fe3++3Fe(CN)4-6=Fe4[Fe (CN)6]3↓(3)取样品水溶液,加氯化钡溶液(50g/L),即产生白色沉淀,此沉淀不溶于盐酸(证实有硫酸盐)。
SO2-4+BaCl2=BaSO4↓+2C1-二、密度测定1、原理用比重计测定。
2、测定手续将样品注入清洁、干燥的量筒(250~500mL)内,不得有气泡。
将量筒置于20±1℃的恒温水浴中,待温度恒定后,将比重计(刻度值为0.00lg/cm³)缓缓地放入样品中,待比重计在样品中稳定后,读出比重计弯月面下缘的刻度(标有读弯月面上缘刻度的比重计除外),即为20℃样品的密度。
三、全铁测定1、原理在酸性溶液中,用氯化亚锡将三价铁还原为二价铁,过量的氯化亚锡用不和亚铁起作用的氯化高汞氧化,生成的亚铁离子在硫磷混合酸存在下,用重铬酸钾标准滴定溶液滴定,以二苯胺磺酸钠为指示剂。
2Fe3++Sn2+=-2Fe2++Sn4+SnCl2+2HgCl2=SnCl4+Hg2Cl26Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O2、应用试剂氯化亚锡溶液(250g/L盐酸溶液∶称取25.0g氯化亚锡置于干燥的烧杯中,溶于20mL盐酸,冷却后用水稀释到100mL,保存于棕色瓶中,加入高纯锡粒数颗);盐酸溶液(1+1);饱和氯化高汞溶液(称取7g 氯化高汞,溶于100mL 热水中,冷却澄清后使用);硫磷混合酸(将150mL硫酸缓缓溶于500mL水中,再加150mL磷酸,然后用水稀释到1000mL)重铬酸钾标准滴定溶液〔c(1/6K2Cr2O7)=0.1mol/L〕;二苯胺磺酸钠指示液(5g/L)。

聚合硫酸铁小试报告
本实验旨在通过反应制备聚合硫酸铁,并对其性质进行初步观察,探究其在化学实验中的应用。
实验原理:
聚合硫酸铁是一种黑色的固体,是硫酸铁的高聚物。
其制备方法是将硫酸铁溶液加热至一定温度,通入空气使其氧化,然后煮沸并加入硫酸铵,使其析出。
实验步骤:
1. 取一定量的硫酸铁溶液,放入烧杯中。
2. 将烧杯放置于加热板上,加热至80℃左右。
3. 在加热的同时,将空气以一定流量通入烧杯中。
4. 持续加热和通气,使硫酸铁完全氧化。
5. 煮沸硫酸铁溶液,并加入硫酸铵,搅拌至其析出。
6. 过滤析出物并洗涤干净,晾干后进行初步观察。
实验结果:
经过反应制备得到的聚合硫酸铁为黑色固体,呈颗粒状。
其熔点较高,在热板上热处理时能够保持稳定形态。
在与其他物质反应时也表现出较好的稳定性。
实验结论:
通过本次实验,成功制备出聚合硫酸铁,并对其性质进行了初步的观察。
该物质可以在化学实验中作为一种重要的试剂,广泛应用于各个领域。

硫酸铁溶液制备聚合硫酸铁的方法嘿,朋友们!今天咱就来讲讲怎么从硫酸铁溶液制备聚合硫酸铁。
这可真是个有趣的过程,就好像变魔术一样神奇呢!
先来说说硫酸铁溶液,这可是我们的基础材料,就像盖房子的砖头一样重要。
那怎么把它变成聚合硫酸铁呢?
咱得先准备好各种工具和条件。
就好像做饭得有锅碗瓢盆一样,这里也需要合适的反应容器和一些辅助的东西。
然后呢,我们要在合适的温度和条件下进行操作。
这就好比炒菜得掌握好火候,温度太高或太低可都不行哦。
在这个过程中,要仔细观察,就像观察锅里的菜有没有炒熟一样。
接下来,通过一些化学反应和步骤,硫酸铁溶液就开始发生奇妙的变化啦。
就好像毛毛虫变成美丽的蝴蝶一样,一点点地蜕变。
你想想,原本普通的硫酸铁溶液,经过我们的一番操作,居然能变成聚合硫酸铁,这是多么神奇呀!这过程中可不能马虎,要像照顾宝贝一样精心对待每一个步骤。
比如说添加一些试剂的时候,得精确控制量,多一点少一点可能结果就不一样啦,这可不是闹着玩的呀!要是不小心弄错了,那可就前功尽弃了。
在反应的时候,要时刻留意有没有异常情况出现。
这就像我们走路要看着路一样,要是不小心踩进坑里可就不好啦。
等反应完成后,我们就能得到我们想要的聚合硫酸铁啦。
哇塞,那种成就感,就好像自己做出了一道超级美味的大餐一样!
总之呢,从硫酸铁溶液制备聚合硫酸铁,需要我们的细心、耐心和专业知识。
这可不是随随便便就能搞定的事情哦。
但只要我们认真去做,就一定能成功的,难道不是吗?大家也可以自己动手试试呀,说不定会有意外的收获和乐趣呢!。

工业分析课程设计实习聚合硫酸铁的合成及测定班级:分析3081班学号:23号姓名:王方方聚合硫酸铁的合成及测定摘要:本文以硫酸亚铁原料,用亚硝酸钠催化氧化法合成聚合硫酸铁,单因素实验研究反应温度、反应时间、总铁/总酸根和亚硝酸钠量对合成影响:正交实验得最佳条件:反应温度55℃;按[S04],[Fe]总=1.40/1;NAN02(10%)量7ml(硫酸亚铁量为809)=反应时间3.5小时。
关键词:催化氧化法聚合硫酸铁最佳条件1 引言聚合硫酸铁(PFS)是硫酸铁的一种碱式聚合物,是介乎硫酸铁和氢氧化铁之间、在硫酸铁分子簇网络结构中用羟基取代硫酸根后形成的一种新型铁系无机高分子絮凝剂(IDF),在给水和废水处理中发挥着日益重要的作用。
PFS 的分子通式可表示为[Fe2(OH)n(SO4)3-n/2]m, 其对应的盐基度= n/6*100%PFS的盐基度越高,即n越大,产品聚合度m越高,其形成的矾花越大,絮凝效果越好,絮体的沉降速度越快。
中国原化工部标准HG2153-91规定PFS一级品的盐基度达到12%以上,合格品的盐基度必须超过8%,国家标准GB14591-93更严格规定PFS的盐基度必须达到9%-14%,日本标准样品的盐基度为8.33%-16.67%,而PFS工业品盐基度一般为5%-12%,超过16.67%的PFS 至今未见报道。
因此,设法提高PFS的盐基度就成为改善产品质量的一条重要途径。
此外,PFS传统工艺存在严重的三废污染,且反应速度慢、生产效率低,经济效益和社会效益均不够理想。
为了最大限度地加快PFS的合成速率和提高产品盐基度,前人已做了大量探索,取得了令人瞩目的成就, 本文着重于PFS的成试验,通过调节反应温度、压力、硫酸用量,和催化剂用量,探讨PFS 的合成速率和产品质量及其变化规律,为PFS 传统工艺的技术改造和开发一种新的PFS 生产工艺提供理论与实验依据。
2 聚合硫酸铁全铁测定方法2.1 主要试剂及溶液的制备水:GB/T6682,三级;氯化亚锡溶液:250 g/L,10g/L;分别称取25.0 g1.0 g氯化亚锡于两个干燥的烧杯中,分别加入20 mL,2 mL浓盐酸,加热溶解,冷却后稀释至100 mL,分别保存于两个棕色滴瓶中,加入数颗高纯锡粒。

聚合硫酸铁的制备及性能测试姓名姚江班级应化0803学号 1505080323同组人姜建军胡祝兵实验时间 2010 .10 .17一)实验目的1)学习集合硫酸铁的饿制备及净化水的知识2)学习和了解絮凝沉降法处理工业废水的有关知识3)掌握含锌水浮选处理技术4)巩固分光光度法和原子吸收法测定方法二)知识及实验原理背景知识聚合硫酸铁(PFS)也称碱式硫酸铁或羟基硫酸铁, 是一种无机高分子絮凝剂。
与其他絮凝剂如三氯化铁,硫酸铝,氯化硫酸铁,碱式氯化铝等相比,聚合硫酸铁生产成本低、投加量少、适用PH范围广、杂质(浊度、COD、悬浮物等)去除率高、残留物浓度低、矾花沉降速度快、脱色效果好,因而广泛应用于工业废水,城市污水,工业用水以及生活饮用水的净化处理。
聚合硫酸铁(PFS)的生产方法多种多样,根据使用的氧化剂,可将制备方法大致分为空气氧化法、硝酸氧化法、氯酸盐和双氧水氧化法。
但无论是哪种氧化剂,都是经过氧化、水解、聚合制得聚合硫酸铁(PFS)。
本文用双氧水为氧化剂,直接氧化七水合硫酸亚铁合成聚合硫酸铁,探索了最佳合成条件。
利用本法生产聚合硫酸铁,设备简单、生产周期短、无污染、反应不用催化剂、产品不含杂质、稳定性高,对工业化生产具有一定的指导作用[1]实验原理七水合硫酸亚铁在酸性条件下,被双氧水氧化成硫酸铁,经水解、聚合反应制得红棕色聚合硫酸铁(PFS)。
主要反应如下:(1)氧化反应(2)水解反应(3)聚合反应氧化、水解、聚合3个反应同是时存在于一个体系当中,相互影响,相互促进。
其中氧化反应3个反应中较慢的一步,控制着整个反应过程。
生成的的聚合硫酸铁进一步稀释时形成Fe(OH)3胶体,形成沉淀,吸附,絮凝等作用,使水相中的悬浮物,染料,Zn2+,被转入固相,固相的物质可以通过过滤或上浮法除去。
Fe(H2O)33+-Fe(OH)3+3H+ +H2OZn2+ + OH-Zn(OH)2再通过浮上去法,将氢氧化铁胶体浮上去,使水中的锌除去。


<<大学化学实验Ⅲ>>综合实验论文学院:资源与环境工程学院专业班级环境科学姓名岳凡耀学号 0908100121指导教师谢燕完成时间 2011-11-06贵州大学化学化工教学实验中心 2011年月日聚合硫酸铁的制备及混凝性能测试摘要:随着社会的发展和进步,人们对水质要求越来越高,水质的优劣直接影响着人类的身体健康。
同时,在科技飞速发展的今天,人们也渐渐意识到,水污染问题正在威胁着人类乃至万物的生息繁衍。
因此对如何对饮用水,生活用水,工业废水以及城市生活污水进行有效的净化处理,已成为世人瞩目的议题。
经研究发现,聚合硫酸铁是我们要找的净水剂。
聚合硫酸铁(PFS)是二十世纪七十年代开发的新型无机高分子聚絮凝剂,是当今新一代的环保产品,无害无毒,化学性质稳定,能和水混合,被广泛应用与饮用水,工业污水,生活污水的净化处理中。
关键词:聚合硫酸铁混凝剂测试混凝效果1引言1.1 聚合硫酸亚铁简介聚合硫酸铁(PFS)是一种淡黄色无定型粉状固体,极易溶于水,10%(重量)的水溶液为红棕色透明溶液,简称聚铁,它是一种新型高效的的无机高分子混凝剂,其通式为[Fe2(OH)n(SO4)3-n/2]m,式中n≤2,m≥f (n)。
聚合硫酸铁水溶液中存在各种高价离子和络合离子团,如(Fe2(OH)3)3+、(Fe3(OH)6)3+、(Fe8(OH)28)4+等,它具有很强的中和悬浮颗粒物的能力,有很大的比表面积和很强的吸附能力,是现在最高效净水剂之一。
同其它无机高分子混凝剂相比:具有较强的吸附、絮桥、凝聚沉淀性能,且絮凝体形成大而快,絮体不易破碎,重凝性能好,沉淀后的水过滤快,净水PH值范围宽等优点,有显著的除浊、除菌、除臭、除藻、脱色、脱油、脱水、去除水中COD、BOD及重金属离子等功效;与有机絮凝剂相比,它具有价格低廉,成本低的优点。
同时,聚合硫酸铁具有安全无毒,对水体的温度和pH值适应广泛以及制备材料与过程简单等的优点,成为现在社会污水净水剂主要使用产品之一。
聚合硫酸铁的制备及性能测定
摘要:以硫酸亚铁为原料,在常温常压下采用双氧水直接氧化法合成聚合硫酸铁。
并用不同用量的聚合硫酸铁进行实验,测水样的吸光度,得去浊率。
作用量与去浊率的关系图,找出最佳用量。
关键词:聚合硫酸铁;制备;性能检测;最佳用量
1前言
聚合硫酸铁是一种铁系无机高分子混凝剂,与硫酸亚铁、三氯化铁、硫酸铝以及碱式氯化铝等相比,具有无毒、适用pH 范围广、矾花大、沉降快等优点,对COD、色度以及重金属离子等都有较好的去除效果,因此,被广泛地应用于给排水工业和废水处理等行业。
生产聚合硫酸铁的原料来源很多,如硫酸亚铁、钢铁酸洗废液、铁泥和铁矿石等,其中以硫酸亚铁为原料的生产工艺简单,条件温和,成品杂质少,品质高。
本实验以钛白粉厂的副产品硫酸亚铁为原料,在常温常压下采用双氧水直接氧化法合成聚合硫酸铁。
按照氧化方式的不同,聚合硫酸铁的生产方法可分为直接氧化法和催化氧化法两大类。
直接氧化法是直接通过强氧化剂(如NaClO、KClO3 、H2O2 等) 将亚铁离子氧化为铁离子,经水解和聚合获得聚合硫酸铁; 催化氧化法是在催化剂( 如NaNO2 、HNO3 等) 的作用下, 利用空气或氧气将亚铁离子氧化为铁离子,经水解和聚合获得聚合硫酸铁。
催化氧化法一般以空气为氧化剂,生产成本相对较低,在实际生产中应用较广,但需在较高的温度(80 ℃) 和反应压力(0. 3 MPa) 下进行,反应时间较长(NaNO2 法为17 h ,HNO3 法为5 h) ,需要安装废气净化装置,以脱去反应过程中产生的大量氮氧化物气体,工艺流程复杂,对设备要求较高,投资较大。
二价铁被双氧水氧化形成三价铁离子。
在一定 pH 下,铁离子水解生成聚合硫酸铁,当稀释时进一步发生水解,形成 Fe(OH)3 胶体,通过沉淀、吸附、絮凝等作用,使水相中的悬浮物、染料、Zn2+被转入固相。
固相的物质可通过过滤或上浮法除去。
Fe(H2O)33++OH- Fe(OH)3↓+3H++H2O
Zn2++OH- Zn(OH)2↓
再通过浮上法,将氢氧化铁胶体浮上,使水中锌除去。
2实验部分
2.1试剂与仪器
仪器: 722型分光光度计(上海恒平科学仪器有限公司),78HW-1型恒温加热磁力搅拌器(杭州仪表电机有限公司)
试剂:硫酸亚铁,化学纯;硫酸,化学纯;双氧水,化学纯.
2.2实验步骤
2.2.1聚合硫酸铁的制备
称取11g磨细后的硫酸亚铁(浅绿色晶体)于250mL烧杯中,加入25mL水,得到浅绿色溶液,缓慢滴入浓硫酸12滴,开启搅拌器,缓慢的滴加入2.7mL H2O2溶液,双氧水滴入处溶液立即变为红褐色并伴有气泡,随双氧水的滴入,溶液逐渐由浅绿色变为红褐色。
冷却,过滤,静置。
即可得到红褐色聚合硫酸铁成品溶液。
2.2.2产品的性能测定
取制得的聚硫酸铁溶液1ml于500ml烧杯中,加入100ml蒸馏水,制得稀释溶液。
取
200mL高浊度原污水,分别向其中加入稀释后聚硫酸铁0mL、2ml、4ml、6ml、8ml、10ml、12ml、14ml、16ml。
先剧烈搅拌3min,然后慢搅拌10min,再静置10分钟,取上层清液(液面下2-3cm处),分别测量处理前后的吸光度,计算出去浊率。
3实验数据与处理
3.1原始试验数据
3.1.1最大吸收波长的测定
表1浊液吸收波长的测定
波长/nm 340 344 346 350 352 355
吸光度A 0.524 0.526 0.527 0.529 0.527 0.526
根据原始数据,可以利用origin软件画出其关系图:
图1 浊液吸收波长的测定图
由上图可知,在波长为350nm时浊液的吸光度最大,则之后加入不同用量的聚合硫酸铁溶液的吸光度均应在波长为350nm的条件下测量。
3.1.2去浊率的测定
所得数据记录如下:
表2 不同用量的聚合硫酸铁处理后的浊液的吸光度
加入量/ml 2 4 6 8 10 12 14 16
吸光度A 0.132 0.066 0.046 0.03 0.02 0.035 0.084 0.155
根据原始数据,可以利用origin软件画出其关系图:
图2 聚合硫酸铁用量与处理后的浊液的吸光度关系图
由图表2可知,对于浊液,当聚合硫酸铁用量为约10.0mL时,去浊率最大,所以聚合硫酸铁的最佳用量应为10.0mL。
4实验结果讨论与思考
4.1实验讨论
4.1.1 由图1可以看出最大吸收波长为350nm。
4.1.2由图2可以看出,随着聚合硫酸铁用量的增加,去浊率先增加后减少,可以看出聚合硫酸铁的加入量大约在10.0ml的时候,测得的吸光度最小,且去浊率最好。
4.1.3聚硫酸铁的制备受反应温度影响,如果条件控制不好,将直接影响产品的性能和质量。
4.1.4H2O2的用量对产品质量也有很大的影响, 用滴加的方式加入H2O2,保持一定滴加速度,可节约用量。
H2O2加入速度较慢有利于物料的充分接触,但反应时间过长,加上又太慢、太迟又易产生沉淀。
本实验中采用加入双氧水为氧化剂,实验结果误差较大,可能就是制备聚合硫酸铁时滴加双氧水过快,致使其分解,氧化作用没有完全进行。
4.1.5聚合硫酸铁的合成关键在于酸度的控制,硫酸的加入量对产品性能(盐基度)有很大的影响。
因为酸度太高,不利于FeSO4的氧化,且Fe2(SO4)3也不易水解;酸度太低,生成的Fe2(SO4)3,易转化成Fe(OH)3沉淀。
当硫酸与Fe2+的物质的量之比介于0.30~0.45之间时,产品性能良好。
我们实验的失败可能就是因为酸度没有调节好,应该是酸度偏高,导致沉淀发生。
4.1.6在适当搅拌强度下, 由于反应放出大量热,温度对反应影响不明显,可在常温常压条件下合成合格产品。
4.2思考与讨论
4.2.1制备聚合硫酸铁实验中加入硫酸的作用是什么?
酸在聚合硫酸铁的合成过程中有两个作用:①作为反应的原料参与了聚合反应;②决定体系的酸度,其用量直接影响产品性能。
硫酸用量适当增加对提高合成反应是有利的。
但硫酸用量太大,亚铁离子氧化不完全, 样品颜色由红褐色变为黄绿色,且大部分铁离子没有参与聚合,导致盐基度很低,合成失败;硫酸量不足,量越少,生成Fe(OH)3趋势越大,硫酸溶液中[OH-]相对较大。
4.2.2为什么聚合硫酸铁能将悬浮物除去?
生成的聚合硫酸铁进一步稀释时形成Fe(OH)3胶体,形成沉淀,吸附,絮凝等作用,使水相中的悬浮物。
4.2.3为什么通入空气会使氢氧化铁沉淀随空气上浮?
因为氢氧化铁是固体,在会吸附在流动的气体上面。
4.2.4谈谈除锌的基本原理?
聚合硫酸铁稀释时形成Fe(OH)3胶体,形成沉淀,吸附,絮凝等作用,使水相中的Zn2+,被转入固相,固相的物质可以通过过滤或上浮法除去。
5结论
用硫酸亚铁直接氧化的方法(通过加入双氧水),让它经水解和聚合获得聚合硫酸铁,然后以浊水为原液,用不同用量的聚合硫酸铁进行试验,发现聚合硫酸铁的最佳用量为10.0ml,最大波长为350nm。
参考文献:
[1]胡万里,混凝·混凝剂·混凝设备.北京:化学工业出版社,2001
[2]左淑密,铁系无机高分子絮凝剂的生产与应用.上海化工,19919,(12);28—30
[3]李风亭,任晓红.雾化法制备聚合硫酸铁新工艺.工业水处理,1996,16(3);20~2l
[4]卢建柱,刘维屏.无机絮凝剂制备技术的进展.中国给水排水,1999,15(4);28~30
[5]冯惠台,曾权宁.聚合硫酸铁的制备及作净水剂的应用.中山大学学报,2001(6)
[6]刘长让.聚合硫酸铁的制备与应用[J].无机盐工业,1999(5).
[7]陈动辰.聚合硫酸铁及其在河水处理中应用[J].山东化工,1997(3).
The Preparation of Polymeric Ferric Sulfate and Performance
Measurement
Abstract:With ferrous sulfate as raw material, adopts the direct oxidation of hydrogen peroxide under atmospheric pressure synthesis of polymeric ferric sulfate.Experiment with different dosage of polymeric ferric sulfate, the absorbance of the test sample, have to go to the rate of turbidity. Action and to the rate of turbidity diagram, find out the best dosage.
Keywords:Polymeric ferric sulfate;Preparation;Performance testing;The best dosage。