鲁科版高中化学《离子反应》完整版1
- 格式:ppt
- 大小:711.00 KB
- 文档页数:26




2019-2020学年新教材高中化学2.2 第2课时离子反应教案鲁科版必修第一册编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019-2020学年新教材高中化学2.2 第2课时离子反应教案鲁科版必修第一册)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019-2020学年新教材高中化学2.2 第2课时离子反应教案鲁科版必修第一册的全部内容。
第2课时离子反应课程标准核心素养1.通过实验事实认识离子反应。
2.认识并掌握离子反应发生的条件。
3.掌握离子方程式的书写方法,学会判断离子方程式的正误。
4.初步掌握离子共存的判断方法.1。
变化观念:认识化学变化的本质是有新物质生成。
2.证据推理:通过分析、推理等方法认识研究对象的本质特征。
3.科学探究:能发现和提出有探究价值的问题。
离子反应1.探究电解质在水溶液中反应的实质实验装置实验现象随着H2SO4溶液的滴入:(1)电导率:先错误!________后错误!________;(2)溶液:出现错误!________,溶液颜色错误!____________________解释稀硫酸与Ba(OH)2溶液反应的实质是溶液中的错误!____________结合生成难电离的水、□6____________________结合生成硫酸钡沉淀,导致溶液中离子浓度的错误!________ 2。
离子反应(1)概念:在溶液中□8________的化学反应.(2)实质:溶液中某种离子的浓度发生了改变。
(3)发生的条件(1)难溶的物质指20 ℃溶解度小于0。
01 g的物质。
(2)难电离的物质即弱电解质(弱酸、弱碱、水)。




第2课时离子反应发展目标体系构建1.通过实验探究理解离子反应的本质是微粒间的相互作用,体会含有相同微粒的物质发生相同的离子反应。
2.能够依据电解质在水溶液中的电离结果和微粒间的相互作用推测离子反应的发生,写出离子方程式。
3.能够运用离子反应完成物质中常见离子的检验、杂质离子的除去等任务。
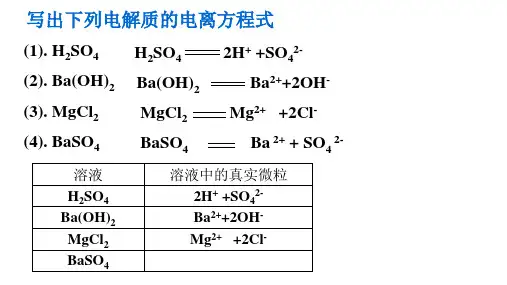
一、离子反应的含义1.探究电解质在水溶液中反应的实质实验操作实验现象随着H2SO4溶液的滴入,(1)电导率:读数先减小后增大(2)溶液:出现白色沉淀,溶液颜色由红色变浅至无色解释稀硫酸与Ba(OH)2溶液反应的实质是溶液中的H+与OH-结合生成难电离的水、Ba2+与SO2-4结合生成硫酸钡沉淀,导致溶液中离子浓度的降低(1)概念:在溶液中有离子参加的化学反应。
(2)实质:溶液中某种或某些离子的浓度发生改变。
(3)复分解型离子反应发生的条件微点拨:熟记可拆的强酸、强碱和易溶盐的口诀钾钠铵盐硝酸盐,都能溶于水中间;氯化物除银亚汞,硫酸不溶铅与钡;碳酸磷酸亚硫酸,可溶只有钾钠铵;易溶钾钠铵钡碱,不溶的酸是硅酸。
二、离子方程式1.表示:离子反应可以用离子方程式表示。
例如,NaOH溶液与稀盐酸反应的离子方程式为H++OH-===H2O。
2.书写步骤(以氯化钡溶液和硫酸钠溶液反应为例)3.意义(1)表示一个具体的化学反应。
(2)表示所有同一类型的化学反应。
三、离子反应的应用1.离子检验离子使用的反应现象反应离子方程式试剂Cl-AgNO3溶液、稀硝酸加入AgNO3溶液,产生白色沉淀,再加稀硝酸沉淀不溶解Cl-+Ag+===AgCl↓SO2-4BaCl2溶液、稀盐酸加足量稀盐酸无沉淀,再加BaCl2溶液产生白色沉淀Ba2++SO2-4===BaSO4↓2.食盐的精制粗食盐中含有Ca2+、Mg2+、SO2-4等杂质离子,除去它们发生反应的离子方程式分别是:(1)Ca2++CO2-3===CaCO3↓。
(2)Mg2++2OH-===Mg(OH)2↓。

