水的电离平衡
- 格式:ppt
- 大小:1.12 MB
- 文档页数:27
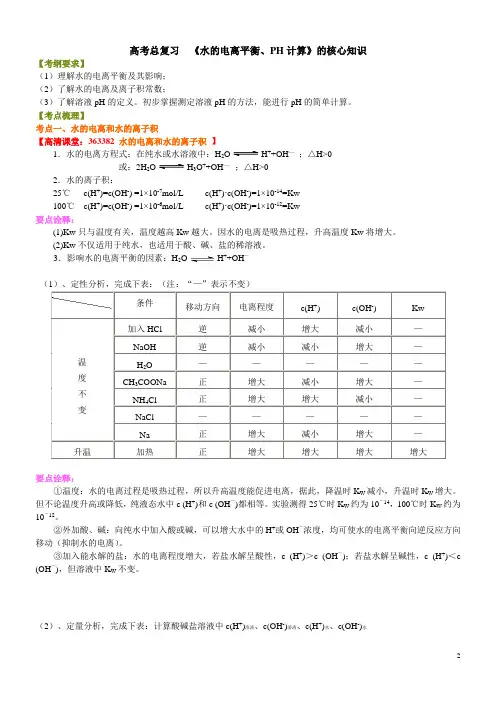
高考总复习《水的电离平衡、PH计算》的核心知识【考纲要求】(1)理解水的电离平衡及其影响;(2)了解水的电离及离子积常数;(3)了解溶液pH的定义。
初步掌握测定溶液pH的方法,能进行pH的简单计算。
【考点梳理】考点一、水的电离和水的离子积【高清课堂:363382 水的电离和水的离子积】1.水的电离方程式:在纯水或水溶液中:H2O H++OH—;△H>0或:2H2O H3O++OH—;△H>02.水的离子积:25℃c(H+)=c(OH-) =1×10-7mol/L c(H+)∙c(OH-)=1×10-14=Kw100℃c(H+)=c(OH-) =1×10-6mol/L c(H+)∙c(OH-)=1×10-12=Kw要点诠释:(1)Kw只与温度有关,温度越高Kw越大。
因水的电离是吸热过程,升高温度Kw将增大。
(2)Kw不仅适用于纯水,也适用于酸、碱、盐的稀溶液。
3.影响水的电离平衡的因素:H2O H++OH—(1)、定性分析,完成下表:(注:“—”表示不变)条件移动方向电离程度c(H+) c(OH-) Kw温度不变加入HCl 逆减小增大减小—NaOH 逆减小减小增大—H2O —————CH3COONa 正增大减小增大—NH4Cl 正增大增大减小—NaCl —————Na 正增大减小增大—升温加热正增大增大增大增大要点诠释:①温度:水的电离过程是吸热过程,所以升高温度能促进电离,据此,降温时K W减小,升温时K W增大。
但不论温度升高或降低,纯液态水中c (H+)和c (OH―)都相等。
实验测得25℃时K W约为10―14,100℃时K W约为10―12。
②外加酸、碱:向纯水中加入酸或碱,可以增大水中的H+或OH―浓度,均可使水的电离平衡向逆反应方向移动(抑制水的电离)。
③加入能水解的盐:水的电离程度增大,若盐水解呈酸性,c (H+)>c (OH―);若盐水解呈碱性,c (H+)<c (OH―),但溶液中K W不变。

专题38 水的电离及影响因素【基础回顾】一、水的电离及离子积常数1、水的电离平衡:水是极弱的电解质,能发生自电离:简写为(正反应为吸热反应)其电离平衡常数:2、水的离子积常数:Kw=c(H+)c(OH-)25℃时 Kw =1.0×10-14mol2?L—2,水的离子积与温度有关,温度升高Kw增大。
如100℃时Kw=1.0×10-12mol2?L—2。
3、无论是纯水还是酸、碱,盐等电解质的稀溶液,水的离子积为该温度下的Kw。
二、影响水的电离平衡的因素1、酸和碱:酸或碱的加入都会电离出 H+或OH-,均使水的电离逆向移动,从而抑制水的电离.2、温度:由于水的电离吸热,若升高温度,将促进水的电离, [H+]与[OH—]同时同等程度的增加,pH变小,但[H+]与[OH-]始终相等,故仍呈中性。
3、能水解的盐:不管水解后溶液呈什么性,均促进水的电离,使水的电离程度增大。
4、其它因素:如向水中加入活泼金属,由于活泼金属与水电离出来的 H+直接作用,使[H+]减少,因而促进了水的电离平衡正向移动。
【特别提醒】溶液中的c(H+)和水电离出来的c(H+)是不同的:①常温下水电离出的c(H+)=1×10—7mol/L,若某溶液中水电离出的c(H+)<1×10—7mol/L,则可判断出该溶液中加入酸或碱抑制了水的电离;若某溶液中水电离出的c(H+)>1×10-7mol/L,则可判断出该溶液中加入可以水解的盐或活泼金属促进了水的电离.②常温下溶液中的c(H+)>1×10-7mol/L,说明该溶液是酸溶液或水解显酸性的盐溶液;c(H+)<1×10-7mol/L,说明是碱溶液或水解显碱性的盐溶液.【技能方法】水电离的影响因素以及产生c(H+)和c(OH-)的计算1、注意区分溶液组成和性质的关系:酸性溶液不一定是酸溶液,碱性溶液不一定是碱溶液。
2、温度相同、pH相同的溶液对水的电离程度影响并不一定相同。



授课主题水的电离平衡教学目的1、认识水的电离存在电离平衡,掌握水的电离平衡的影响因素,知道水的离子积常数2、认识溶液的酸碱性及pH,掌握检测溶液pH的方法3、能进行pH的简单计算,并能计算各类混合溶液的pH重、难点溶液pH的计算教学内容课程导入【知识点讲解一】:水的电离一、水的电离1、水的电离:水是一种极弱的电解质,电离方程式为H2O+H2O H3O++OH-或H2O H++OH-2、水的电离平衡常数:)()()(2OH c OHcHcK —电离•=+因为水的电离极其微弱,在室温下1L纯水(即55.6 mol)只有1×10-7mol H2O电离,电离前后H2O的物质的量几乎不变,因此c(H2O)可以视为常数,上式可表示为:c(H+)·c(OH—)=K电离·c(H2O)。
其中常数K电离与常数c(H2O)的积作为一新的常数,叫做水的离子积常数,简称水的离子积,记作K W,即K W= c(H+)· c(OH—) 3、水的离子积常数(K W)(1)表达式:K W=c(H+)·c(OH-),25℃时,K W=1.0×10-14(2)影响因素:只与温度有关,温度一定,则K W值一定。
水的电离是吸热过程,升高温度,K w增大。
25℃时, [H+]=[OH-] =10-7 mol/L ; K W = [H+]·[OH-] = 1.0×10-144、外界条件对水的电离平衡的影响(1)温度(升高温度,促进水的电离):水的电离是吸热过程,升高温度,水的电离平衡向右移动,电离程度增大,c(H+)和c(OH―)同时增大,K W增大,但由于c(H+)和c(OH-)始终保持相等,故仍呈中性(2)加入酸、碱或强酸的酸式盐(抑制水的电离):向纯水中加入酸或NaHSO4、碱,由于酸(碱)电离产生的H+(OH―),使溶液中c(H+)或c(OH―)增大,使水的电离平衡左移,水的电离程度减小(3)含有弱酸根离子或弱碱阳离子的盐(促进水的电离):在纯水中加入含有弱酸根离子或弱碱阳离子的盐,由于它们能跟水电离出的H+和OH―结合生成难电离物,使水的电离平衡右移,水的电离程度增大(4)加入活泼金属(促进水的电离):向纯水中加入金属钠,由于活泼金属能与水电离的H+直接作用,产生氢气,促进水的电离H2O H++OH-ΔH>0改变条件平衡移动方向c(H+) c(OH-) 水的电离程度K w升高温度右移增大增大增大增大加入HCl(g) 左移增大减小减小不变加入NaOH(s) 左移减小增大减小不变加入NaHSO4(s) 左移增大减小减小不变加入金属Na 右移减小增大增大不变5、水的离子积适用范围:K W不仅适用于纯水(或其他中性溶液),也适用于酸、碱、盐的稀溶液,不管是哪种溶液,由水电离出的c(H+)与c(OH-)一定相等6、水的离子积表达式的应用:在水溶液中,均存在水的电离平衡,因此在表达式中,c(H+)、c(OH―)表示整个溶液总物质的量浓度,K W=c(H+)溶液·c(OH-)溶液(1)纯水中:K W=c(H+)水·c(OH-)水(2)酸溶液中:K W=[c(H+)酸+c(H+)水]·c(OH-)水,由于c(H+)酸>>c(H+)水,故忽略水电离出的H+即:K W=c(H+)酸·c(OH-)水,但由水电离出来的:c(H+)水=c(OH-)水例:计算25℃,0.1mol/L的HCl中,c(H+)酸=,c(H+)水=,c(OH-)水=,由水电离出的c(H+)水·c(OH-)水=____________(3)碱溶液中:K W=c(H+)水·[c(OH-)碱+c(OH-)水],由于c(OH-)碱>>c(OH-)水,故忽略水电离出的OH-即:K W=c(H+)水·c(OH-)碱,但由水电离出来的:c(H+)水=c(OH-)水例:计算25℃,0.1mol/L的NaOH中,c(H+)水=,c(OH-)碱=,c(OH-)水=,由水电离出的c(H+)水·c(OH-)水=____________【微点拨】①在不同溶液中,c(H+)、c(OH-)可能不同,但任何溶液中由水电离出的c(H+)与c(OH-)一定相等②对于酸、碱、盐的稀溶液中,c(H2O)也可认为是定值。

水的电离与溶液的PH一、水的电离1.电离方程式水是一种极弱的电解质,其电离方程式为:H2O H++OH-2.水的离子积(1)表达式:25℃时K W=c(OH-)·c(H+)=10-14(2)影响因素:K W只与温度有关,温度升高,K W增大。
(3)适用范围:K W不仅适用于纯水,也适用于稀的酸、碱、盐溶液。
注:酸性溶液加水稀释时,由于H+浓度减小,但K W不变,故OH-浓度增大;同理碱性溶液稀释时,H+浓度增大;中性溶液稀释时,H+和OH-的浓度都不变。
3.外界条件对水电离的影响(1)促进水的电离①升高温度水的电离程度增大,H+和OH-浓度同等程度的增大,K W增大,但水溶液的酸碱性不变。
②加入可水解的盐水的电离程度增大:若盐水解呈酸性,c(H+)>c(OH-);若盐水解呈碱性,c(H+)<c(OH-),但溶液中K W不变。
(2)抑制水的电离①加入酸由于H+浓度增大,使水的电离平衡左移,c(H+)>c(OH-),溶液呈酸性,此时,水的电离程度减小,K W不变。
②加入碱由于OH-浓度增大,使水的电离平衡左移,c(OH-)>c(H+),溶液呈碱性,此时,水的电离程度减小,K W不变。
③加入可水解的盐(如FeCl3、Na2CO3),水的电离程度增大,K W不变。
4.水电离出的c(H+)或c(OH-)的计算(25℃时)(1)中性溶液:c(H+)=c(OH-)=1.0×10-7 mol/L.(2)溶质为酸的溶液H+来源于酸电离和水电离,而OH-只来源于水.如计算pH=2的盐酸中水电离出的c(H+):方法是先求出溶液中的c(OH-)=10-12 mol/L,即水电离出的c(H+)=c(OH-)=10-12 mol/L. (3)溶质为碱的溶液OH-来源于碱电离和水电离,而H+只来源于水。
如pH=12的NaOH溶液中,c(H+)=10-12 mol/L,即水电离产生的c(OH-)=c(H+)=10-12 mol/L.(4)水解呈酸性或碱性的盐溶液H+和OH-均由水电离产生。



电离平衡是指在一定条件下(如温度、溶液浓度等),弱电解质在水溶液中达到的一种相对稳定状态。
在这种状态下,弱电解质分子电离成离子的速率和离子重新结合成弱电解质分子的速率相等。
此时,溶液中各种离子和分子的浓度保持不变,形成一个动态平衡。
电离平衡具有以下特征:
1. 相对性:电离平衡是相对于其他条件下的非平衡状态而言的,当外界条件发生变化时,电离平衡会发生移动,达到新的平衡状态。
2. 暂时性:电离平衡是一种暂时的稳定状态,随着时间的推移,溶液中的离子和分子浓度会发生变化,直至达到新的平衡。
3. 有条件性:电离平衡的实现取决于溶液的温度、浓度等因素,这些条件的变化会影响电离平衡的位置。
4. 动态平衡:电离平衡是一个动态的过程,溶液中的离子和分子在不断地生成和消失,但总体上保持相对稳定。
弱电解质(如部分弱酸、弱碱)在水中溶解时,其分子可以微弱电离成离子。
随着反应的进行,电离速率和结合速率逐渐趋于相等,达到电离平衡。
电离平衡的概念和特征有助于我们理解溶液中离子浓度、pH值等性质的变化,以及如何调控这些性质来满足实际需求。

高二化学-水的电离平衡第2讲水的电离和溶液的ph考点一水的电离水就是极弱的电解质,水的电离方程式为h2o+h2o或h2o2.水的离子积常数kw=c(h(1)室温下:kw=1×10(2)影响因素;只与kw减小。
(3)适用范围:kw不仅适用于纯水,也适用于稀的电解质水溶液。
(4)kw揭示了在任何水溶液中均存在h和oh,只要温度不变,kw不变。
3.影响水电离平衡的因素(1)增高温度kw减小。
(2)加入酸或碱kw不变。
(注意区分:电离程度、kw)(3)加入可水解的盐(如fecl3、na2co3)kw不变。
深度思考1.水的离子内积常数kw=c(h)·c(oh)中h和oh一定就是水电离出的吗?答案不一定。
c(h)和c(oh)均指溶液中的h或oh的总浓度。
这一关系适用于于任何叶唇柱水溶液,即为任何叶唇柱水溶液中都存有这一关系。
因此,在酸溶液中酸本身电离出的h可以遏制水的电离,而在碱溶液中,碱本身电离出的oh也可以遏制水的电离。
2.在ph=2的盐酸溶液中由水电离出来的c(h)与c(oh)之间的关系是什么?(1)溶液呈现出酸、碱性的实质就是c(h)与c(oh)的相对大小,无法只看看ph,一定温度之下ph=6的溶液也可能将显出中性,也可能将显出酸性,应当特别注意温度。
(2)采用ph试纸时无法用蒸馏水润湿。
(3)25℃时,ph=12的溶液不一定为碱溶液,ph=2时溶液也不一定为酸溶液,还可能为能水解的盐溶液。
(1)水的离子内积常数kw=c(h)·c(oh),其实质就是水溶液中的h和oh浓度的乘积,不一定就是水电离出来的h和oh浓度的乘积,所以与其说kw就是水的离子内积常数,不如说是水溶液中的h和oh的离子内积常数。
即kw不仅适用于于水,还适用于于酸性或碱性的叶唇柱溶液。
不管哪种溶液均存有c(h)h2o=c(oh)h2o。
(2)水的离子积常数显示了在任何水溶液中均存在水的电离平衡,都有h和oh共存,只是相对含量不同而已。

水的电离平衡一.水的电离平衡1.实验证明,纯水有微弱的导电性,是极弱的电解质:要点1:水是一种极弱的电解质:H2O H++OH-在一定温度下,c(H+)与c(OH-)的乘积是一个常数,即K W=c(H+)·c(OH-),K W叫水的离子积常数,简称水的离子积.要点2:水的电离是吸热过程,所以,升高温度,可使水的电离平衡向电离的方向移动,因此c(H+)和c(OH-)都增大,故K W也会增大.如100℃的纯水中:K W=c(H+)·c(OH-)=1×10-6·1×10-6=1×10-12,若没有指定温定,则可认为是在常温下,即25℃时K W=1×10-14要点3:水的离子积(K W)揭示了任何溶液中都存在的水的电离平衡.因此K W只受温度影响,不受溶液的浓度的影响.不管是在酸性,碱性,还是中性溶液中,只要是在常温下,K W都可认为是1×10-14.要点4:对于c(H+)很小的稀溶液,用c(H+)的数值来表示溶液的酸碱性强弱很不方便.为此采用c(H+)的负对数来表示,称为溶液的PH,即PH=-lg{c(H+)}.由此式可知PH每增大1个单位,c(H+)就减为原为原来的1∕10;PH每减小1个单位,c(H+)就增大为原来的10倍.2.用电离平衡理论来研究水的电离(因为水是一种极弱的电解质);也可用归纳小结来学习PH的有关计算纯水中存在如下平衡:H2O H++OH--Q,当改变条件时,填写表中各项内容.改变条件平衡移动方向PH 水电离出的c(H+) K W升温→右移减小增大变大通入HCl气体←左移减小减小不变加入NaOH固体←左移增大减小不变加入NH4Cl固体→右移减小增大不变加入金属钠→右移增大增大不变练习1.向纯水中加少量NaHSO4(溶液温度不变),则溶液的( )A.PH升高B.酸性增强C.K W增大D.c(OH-)减少练习2.水是一种极弱的电解质,在室温下每n个水分子中只有1个分子发生电离,则n值是( )A.107B.55.6×107C.1×10-14D.55.6练习3.实验表明,液态时,纯硫酸电离能力强于硝酸,纯硫酸导电性也显著强于纯水.已知液态纯酸都能像水那样进行自身电离H2O+H2O H3O++OH-而建立平衡,且在一定温度下都有各自离子积常数,据此回答:(1)纯硫酸在液态时自身电离的方程式是(2)在25℃时,液态纯H2SO4的离子积常数K(H2SO4)比1×10-14(填“大”、“小”或“相等”)(3)在纯硫酸和纯硝酸的液态混合酸中,存在的阴离子主要是,这是因为混合酸中不仅存在硫酸和硝酸各自电离的两个电离平衡,而且还因硫酸的酸性大于硝酸,又在无水条件下,混酸中必然发生(写离子方程式) 反应而造成的.3.影响离子积Kw的因素(1)Kw与溶液中[H+]、[OH—]无关,与温度有关。
微专题11水的电离平衡曲线及溶液中水电离出c平(H+)的计算一、水的电离平衡曲线(图像)水的电离的影响因素、水的离子积(K w)、溶液酸碱性判断是高考及平时考查中的热点,常结合图像综合考查。
在分析图像时,要注意以下四点:(1)曲线上的任意点K w均相同,即c平(H+)·c平(OH-)相同、温度相同。
(2)曲线外的任意点与曲线上任意点的K w不同,两点的温度不同。
(3)实现曲线上点之间转化时,温度不变,改变的是溶液的酸碱性。
(4)要实现曲线上点到曲线外另一点的转化,改变的是温度。
例1如图表示不同温度下水溶液中c 平(H+)与c平(OH-)的关系,下列判断正确的是()A.两条曲线上任意点均有c平(H+)·c平(OH-)=K wB.T<25 ℃C.b点和c点pH均为6,溶液呈酸性D.只采用升温的方式,可由a点变成d点答案 A解析在任何温度下的水溶液中,溶液中的c平(H+)·c平(OH-)=K w,其中K w只与温度有关,故A正确;c点c平(H+)·c平(OH-)=10-12 mol2·L-2>10-14 mol2·L-2,则T>25 ℃,故B错误;常温下b点pH为6,溶液呈酸性,c点对应的温度下c平(H+)=c平(OH-),此时pH为6,说明溶液显中性,故C错误;a点溶液为中性,d点溶液为碱性,只采用升温的方式无法实现从a点变成d点,故D错误。
【考点】溶液的酸碱性和pH【题点】水的电离平衡图像二、溶液中水电离出c平(H+)或c平(OH-)的计算(25 ℃)1.中性溶液c平(H+)=c平(OH-)=1.0×10-7mol·L-1。
2.溶质为酸的溶液H+来源于酸的电离和水的电离,而OH-只来源于水的电离。
如计算0.01 mol·L-1的盐酸中水电离出的c平(H+)。
方法是先求出溶液中的c平(OH-)。
水的电离平衡
水的电离平衡指的是水分子在特定条件下向氢离子(H+)和羟基离子(OH-)离解的过程。
水是一种极弱的电解质,极难电离,
1、在常温常压下,水的电离平衡式为:
H2O+H2O⇌H3O++OH-或H2O⇌H++OH-
一般情况下使用H2O⇌H++OH-进行分析应用。
2、水的离子积常数
Kw=c(H+)•c(OH-),只与温度有关,因为水的电离过程是吸热过程ΔH>0,因此温度升高,水的离子积常数变大,25℃Kw=10-14,100℃Kw=10-12。
这个平衡常数被称为自离子积常数(Kw),其值为 1.0×10-14,在25°C下保持不变。
当水中的氢离子和羟基离子浓度相同时,即pH值为7,这种情况下水被称为中性的。
如果氢离子浓度高于羟基离子,则水被称为酸性的;而如果羟基离子浓度高于氢离子,则水被称为碱性的。
水的电离平衡对于许多化学和生物过程都具有重要影响,如酸碱中和、缓冲溶液、生化反应等。
水的电离平衡常数
水的电离平衡常数为:Kc=[H+][OH-]、[H2O]。
电离常数计算公式是
K(电离)=C[A+]^·C[B-]^y、C[ABy],式中C[A+]、C[B-]、C[AB]分别表
示A+、B-和ABy在电离平衡时的物质的量浓度。
影响电离平衡常数的因素是温度,对于吸热反应,温度越高,k越大,对于放热反应则相反。
只有温度变化才变,压强变化引越平衡移动时,其
值不变。
电离平衡常数的应用
电离平衡常数表示弱酸的相对强弱,由弱酸生成的盐就会发生水解,
由越弱越水解的原理,可以判断盐溶液中离子离子浓度大小关系。
总之涉及电离平衡常数的题目必须先根据电离常数判断出酸的相对强弱,把酸的相对强弱由强到弱的顺序排好,然后按照题目要求进行回答,
遇到图像要看清楚图像代表的含义,关键的点表达的意义要清晰。