第六章化学计算
- 格式:doc
- 大小:63.50 KB
- 文档页数:5

第六章工业企业原材料、水的消费与库存工业企业原材料、水的消费与库存统计的主要任务是为了解企业主要原材料消费、库存以及水消费的基本情况,为国家制定长远发展规划和经济政策,进行宏观调控,提供依据。
一、原材料购进、消费与库存(一)原材料购进量原材料购进量是指企业在报告期内外购的、用于企业消费的原材料数量。
1、购进量的核算原则(1)计算原材料购进量具备的条件:一是已实际到达本企业;二是经过验收、检验;三是办理完入库手续。
但是,在未办理完入库手续前,已经投入使用的或已经销售的,要计算在购进量中,使用多少,计算多少。
(2)谁购进,谁统计。
凡属本企业实际购进的,符合上述原则,不论从何处购进,均应计算在内。
2、根据以上原则,下述原材料不能计算在购进量内:(1)供货单位已发货,但尚未运到本企业,即使已经付款;(2)货已运到本企业,但尚未办理验收、入库手续的;(3)经验收发现的亏吨,(按验收后的实际数量计算购进量);(4)借入的,自产自用的,车间、工地上期领用本期退回的,以及加工来料(作价的除外)。
(二)原材料消费量原材料消费量是指工业企业在报告期实际消费的原材料数量。
1、消费量的核算原则(1)谁消费、谁统计。
即不论其所有权的归属,由哪个单位消费,就由哪个单位统计其消费量。
(2)实际投入使用,即计算消费量。
2、消费量的核算方法原材料进入第一道生产工序,改变了原来的形态或性能,或者已经实际投入使用,即作消费量统计。
(1)原材料进入第一道生产工序即作消费统计,不包括车间、工地已经领取、尚未使用的原材料;(2)原材料改变了原来的形态或性能即作消费统计,如原盐电解生产烧碱,就作消费统计。
(3)某些已实际投入使用,但未改变其形态或性能的原材料,也应作消费统计。
如已装到汽车上的轮胎、机电设备上使用的润滑油等。
(4)可以多次周转使用的材料,为避免重复统计,消费量只能计算一次。
即在第一次投入使用时,计算其消费量,以后继续周转使用不再统计消费量。


拓展与归类·专题研析三 “三段式”解答化学反应速率和化学平衡的相关计算 解答有关化学反应速率和化学平衡的计算题时,一般需要写出化学方程式,列出起始量、转化量及平衡量,再根据题设其他条件和定律列方程求解。
如反应:mA(g)+nB(g)⇌pC(g)+qD(g),令A 、B 起始物质的量分别为amol 、bmol ,达到平衡后,A 的转化量为mxmol ,容器容积为VL ,则有以下“三段式”关系: mA(g)+nB(g)⇌pC(g)+qD(g)起始/mol a b 0 0转化/mol mx nx px qx平衡/mol a -mx b -nx px qx对于反应物:n(平)=n(始)-n(转)对于生成物:n(平)=n(始)+n(转)则①c 平(A)=a -mx V mol·L -1 ②α平(A)=mx a ×100%,α(A)∶α(B)=mx a ∶nx b =mb na③φ(A)=a -mx a +b +(p +q -m -n )x×100% ④p 平p 始=a +b +(p +q -m -n )x a +b⑤ρ混=a ·M (A )+b ·M (B )Vg ·L -1[其中M(A)、M(B)分别为A 、B 的摩尔质量] ⑥平衡时体系的平均摩尔质量:M =a ·M (A )+b ·M (B )a +b +(p +q -m -n )xg ·mol -1 例题在一定温度下,将2molCO 2(g)和6molH 2(g)置于容积为2L 的恒容密闭容器中,发生反应:CO 2(g)+3H 2(g)CH 3OH(g)+H 2O(g)。
反应进行到5s 时,测得CO 2的物质的量为1.4mol ,则:(1)5s 时,生成物CH 3OH 的浓度为__0.3__mol/L__。
(2)0~5s 内,用反应物H 2的浓度变化表示的该反应的平均速率v(H 2)=__0.18__mol/(L·s)__。

第六章化学反应与能量变化第8讲多池连接及电化学的相关计算课标要求核心考点五年考情核心素养对接能分析、解释原电池和电解池的工作原理多池连接及电化学的相关计算2022山东,T13;2021北京,T15;2020全国Ⅲ,T12证据推理与模型认知:能分析、识别复杂的电解装置并进行推理命题分析预测1.多池串联主要考查电极类型判断、电极反应式的书写等;原电池和电解池的相关计算主要包括两极产物的定量计算、溶液pH 的计算、根据电荷量求产物的量、根据产物的量求电荷量等。
2.预计2025年高考仍会考查电池中利用得失电子守恒计算两极产物的量,另外,电池的电流效率的计算也可能是热点;电化学跨学科命题更能考查考生的综合能力,是高考命题的重要趋势考点多池连接及电化学的相关计算1.原电池、电解池连接根据两池电极材料活动性或两池电极上的反应物的还原性强弱判断负极(还原性强的为负极);或根据两池电极上的反应物的氧化性强弱判断正极(氧化性强的为正极)。
要受旁边串联的电解池的影响。
还要注意阳极的电极材料是否为活性电极。
3.电化学中有关得失电子守恒的计算在原电池或电解池电路中转移的电子的物质的量与各电极上转移的电子的物质的量相等。
穿过膜的离子所带电荷数也与转移的电子数目相等。
计算溶液质量变化时除了看电极反应外,还要注意穿过膜的离子引起的溶液质量的变化。
如果电极上有副反应,计算转移电子总数时要把发生副反应转移的电子数计算在内。
4.电流效率η的计算η=生成目标产物消耗的电子数×100%。
先根据电极反应式计算出生成目标产物需要的电子的物质转移的电子总数的量,再代入该公式进行计算。
E=电池输出电能,1kW·h=3.6×106J,电能公式W=UQ。
燃料质量1.原电池与电解池串联装置如图所示。
(1)甲池中负极反应式为H2-2e-2H+。
(2)向乙池U形管中滴入酚酞溶液,现象是U形管右侧溶液变红。
乙池左侧NaOH溶液中发生反应的离子方程式为Cl2+2OH-Cl-+ClO-+H2O。
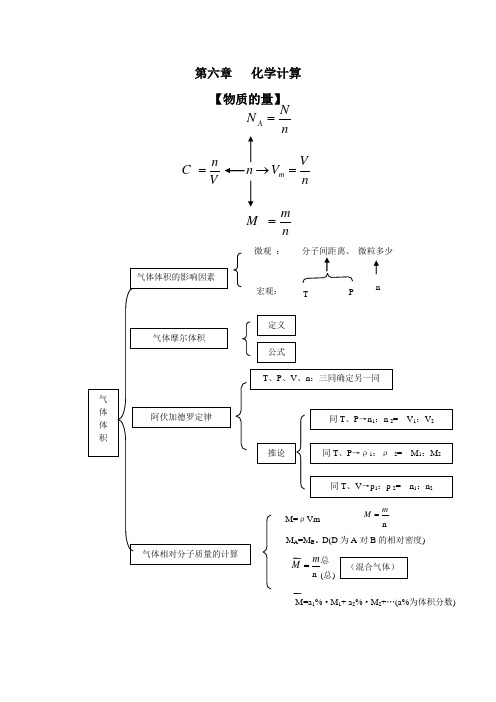
第六章 化学计算 【物质的量】nVV n m =→nm M =V n C =nN N A =M=a 1%·M 1+ a 2%·M 2+…(a%为体积分数)知识点1:有关物质的量、气体摩尔体积、阿伏加德罗常数、物质的量浓度等基本量的计算。
1、下列说法正确的是A.6.02×1023个12C 原子数,就是阿伏加德罗常数B.1摩尔原子的质量等于它的原子量C.氢原子的摩尔质量为1.008gD.1摩尔12C 原子的质量是12g 答案:D2、下列结论正确的是A.摩尔是七个基本物理量之一B.每摩尔物质含有1mol 即N A 个指定微粒C.1molCl就是指1mol氯D.氢氧化钠的摩尔质量为40g答案:B3、某中性溶液中含有0.2molNa+、0.25molMg2+、0.4molCl-,则SO42-为A. 0.1molB. 0.3molC. 0.5molD. 0.15mol答案:D4、下列各组物质物质的量相同的是A.标准状况下11.2升CO和7gN2B.1molCO2和非标准状况下32克氧气C.在标准状况下22.4升水和1molHCl D.6.02×1022个CO2分子和32克O2答案:B5、下列说法错误的是A.1mol任何物质都含有约6.02×1023个原子B.0.012kg碳-12含有约6.02×1023个碳原子C.阿伏加德罗常数的数值约等于6.02×1023D.使用摩尔时必须指明微粒的名称答案:A6、对相同质量的SO2和SO3来说,下列关系正确的是A.含氧原子个数比为2:3B.含硫元素质量比为5:4C.含氧元素质量比为6:5D.含硫原子个数比为1:1答案:B7、下列数量的物质中含原子个数最多的是A.0.4mol氧气 B.4℃时5.4mLH2O C.标况下5.6L二氧化碳 D.10 g氖答案:B8、在相同的条件下,两种物质的量相同的气体必然A.体积均为22.4LB.具有相同的体积C.是双原子分子D.具有相同的原子数目答案:B9、同温、同压下,H2和He两种气体单质的,如果质量相同,下列说法错误的是A.体积比为2 :1B.原子个数之比为2 :1C.密度之比为1 :2D.质子数之比为1 :1答案:BD10、下列叙述正确的是A.在标准状况下,2mol氧所占的体积为22.4LB.0.5mol H2和1mol Cl2光照条件下,完全化合生成的物质中约有6.02×1023个HCl分子C.若两种物质的物质的量相同,则所含的微粒数相同,在同温同压下,所占的体积也相同D.在标准状况下,4.48L HCl溶解于100mL水里,所得溶液的物质的量浓度为2mol· L-1 答案:B11、若N A表示阿伏加德罗常数,下列说法正确的是A.1molCl2作为氧化剂得到电子数为N AB.在0℃,101KPa时,22.4L氢气中含有N A个氢原子C.14g氮气含有7N A个电子D.N A个一氧化碳分子和0.5mol甲烷的质量比为7:4答案:C12、.某500mL溶液中含0.1molFe2+、0.2molFe3+,加入0.2mol铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)A.0.4mol/L B.0.6mol/L C.0.8mol/L D.1.0mol/L答案:C13、将20gNaOH溶于水后,制成100mL的碱溶液,则此溶液的物质的量浓度为A.0.5mol/L B.5mol/L C.1mol/L D.10mol/L答案:B14、在标准状况下,将VLA气体(摩尔质量为Mg/mol)溶于0.1L水中,所得溶液的密度为dg/cm3,则此溶液的物质的量浓度为答案:B15、在标准状况下,用一充满氯化氢气体的烧瓶做喷泉实验,当水充满整个烧瓶后,烧瓶内盐酸溶液的物质的量浓度是()A.0.045mol/L B.1mol/LC.0.1mol/L D.缺少数据无法计算答案:A16、把70%HNO3(密度为1.40g/cm3)加到等体积的水中,稀释后硝酸溶液中溶质的质量分数是A 0.35B <0.35C >0.35D ≤0.35答案:C17、把一定质量的10%的NaOH溶液250mL,加热蒸发掉8g水后,浓度为12%,则浓缩前NaOH溶液的物质的量浓度为A.1.2 B.3 C.0.48 D.4.8答案:C18、VL硫酸钠溶液中含mgNa+离子,则溶液中SO42-的物质的量浓度为()答案:C19、有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol·L-1,SO42-的物质的量浓度为0.7 mol·L-1,则此溶液中K+的物质的量浓度为A.0.1 mol·L-1B.0.15 mol·L-1C.0.2 mol·L-1D.0.3 mol·L-1答案:C20、在三个密闭容器中分别充入N e、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是A.P(N e)>P(H2)>P(O2) B.P(O2)>P(N e)>P(H2)C.P(H2) >P(O2)>P(N e) D.P(H2)>P(N e)>P(O2)答案:D21、下列叙述正确的是A.相同条件下,N2和O3的混合气体与等体积的N2所含原子数相等B.等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等C.常温常压下28 g CO与22.4 L O2所含分子数相等D.16 g CH4与18 g NH4+所含质子数相等答案:B22、下列叙述正确的是A.48 g O3气体含有6.02×1023个O3分子B.常温常压下,4.6g NO2气体含有1.81×1023个NO2分子C.0.5mol/LCuCl2溶液中含有3.01×1023个Cu2+D.标准状况下,33.6L 水含有9.03×1023个H2O分子答案:A23、用N A代表阿伏加德罗常数,下列说法正确的是A.标准状况下,22.4LCHCl3中含有的氯原子数目为3N AB.7gC n H2n中含有的氢原子数目为N AC.18gD2O中含有的质子数目为10N AD.1L 0.5 mol/L Na2CO3溶液中含有的CO32-数目为0.5N A答案:B24、设N A为阿伏加德罗常数,下列叙述中正确的是A.常温下,11.2L甲烷气体含有甲烷分子数为0.5N AB.14g乙烯和丙烯的混合物中总原子数为3N AC.0.1mol/L的氢氧化钠溶液含钠离子数为0.1N A个D.5.6g 铁与足量稀硫酸失去电子数为0.3N A答案:B25、阿伏加德罗常数约为6.02×1023,下列叙述正确的是A.2.24LCO2中含有的原子数为0.3×6.02×1023B.0.1L 3 mol/L NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023C.5.6g 铁粉与硝酸反应失去电子数一定为0.3×6.02×1023D.4.5 g二氧化硅晶体中含有的硅氧键数目为0.3×6.02×1023答案:D26、对相同状况下的12C18O和14N2两种气体,下列说法正确的是A.若质量相等,则质子数相等B.若原子数相等,则中子数相等C.若分子数相等,则体积相等D.若体积相等,则密度相等答案:C27、设NA表示阿伏加德罗常数,下列叙述中正确的是A.常温常压下,11.2L氧气所含的原子数为N AB.1.8g的NH4+离子中含有的电子数为N AC.常温常压下,48gO3含有的氧原子数为3N AD.2.4g金属镁变为镁离子时失去的电子数为0.1N A答案:C28、(2001-16)设N A为阿佛加德罗常数,下列说法不正确的是A.标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8N AB.18g水中含有的电子数为10N AC.46g 二氧化氮和46g四氧化二氮含有的原子数均为3N AD.在1L2mol/L的硝酸镁溶液中含有的硝酸根离子数为4N A答案:A29、(2002-8)N A为阿佛加德罗常数,下述正确的是A.80g硝酸铵含有氮原子数为2N AB.1L 1mol/L的盐酸溶液中,所含氯化氢分子数为N AC.标准状况下,11.2L四氯化碳所含分子数为0.5 N AD.在铜与硫的反应中,1mol铜失去的电子数为2 N A答案:A30、(2003-3)以N A表示阿佛加德罗常数,下列说法中正确的是A.53g碳酸钠中含N A个CO32-B.0.1molOH-含N A个电子C.1.8g重水(D2O)中含N A个中子D.标准状况下11.2L臭氧中含N A个氧原子答案:B31、设NA为阿佛加德罗常数,下列叙述中正确的是A.46 g NO2和N2O4混合气体中含有原子数为3N AB.标准状况下22.4 L H2中含中子数为2N AC.1L 1mol/L醋酸溶液中离子总数为2N AD.1molMg与足量O2或N2反应生成MgO或Mg3N2均失去2N A个电子答案:AD32、N A代表阿伏加德罗常数,下列说法正确的是A.9gD2O中含有的电子数为5N AB.1molMgCl2中含有的离子数为2N AC.1molCH4分子中共价键总数为4N AD.7.1g C12与足量NaOH溶液反应转移的电子数为0.2N A答案:C33、设阿伏加德常数为N A。


第六章 配位滴定法第一节 概 述配位滴定法是以形成配位化合物反应为基础的滴定分析方法。
常用的配位滴定是EDTA 滴定。
EDTA 全称为乙二胺四乙酸,常用H 4Y 表示,其结构式为H O OCCH 2 CH 2CO O HN -CH 2- CH 2-NH O OCCH 2 CH 2CO O HEDTA 与金属离子能形成螯合物,配位比为1:1。
第二节 基本原理一、配位平衡1. 稳定常数与累积稳定常数金属离子与EDTA 的反应通式为:M + Y = MY K MY = ]][[][Y M MY …… 稳定常数金属与EDTA 配合物的lg K 稳值见表6-1。
金属离子与其他配位剂L 的逐级反应:M + L = ML k 1 = ]][[][L M ML …… 第一级稳定常数ML + L = ML 2 k 2 = ]][[][2L ML ML …… 第二级稳定常数┊ML n -1 + L =ML n k n = ]][[][1L ML ML n n - …… 第n 级稳定常数将逐级稳定常数依次相乘,得各级累积稳定常数ββ1 = k 1 = ]][[][L M ML β2 = k 1⋅ k 2 = 22]][[][L M ML …… βn = k 1⋅ k 2 …… k n =n n L M ML ]][[][ [ML n ] = βn [M] [L]n2. 副反应系数 主反应 M + Y = MYL OH H N H OHML NY M(OH)YML 2 M(OH)2 H 2Y副反应 ┊ ┊ ┊ML n M(OH)n H 6Y配位效应 酸效应 共存离子效应1) 配位剂Y 的副反应系数α Y(1) 酸效应系数α Y(H)在水溶液中,EDTA 有H 6Y 2+、H 5Y +、H 4Y 、H 3Y -、H 2Y 2-、HY 3-和Y 4-等七种存在型体,真正能与金属离子配位的是Y 4-离子。
设[Y]为Y 4-的浓度,[Y ']为未与M 配位的EDTA 各种存在型体的总浓度:α Y(H) = [Y '] / [Y]= ][][][][][][][][4265432234-++----++++++Y Y H Y H Y H Y H Y H HY Y= 3456445635626][][][][1K K K K H K K K H K K H K H ++++++++ 1234566234565][][K K K K K K H K K K K K H ++++α Y(H)为配位剂与H +的副反应系数,由于α Y(H)是 [H +]的函数,故又称为酸效应系数。




第六章 化学平衡1. 摩尔反应吉布斯函数与反应进度的关系m r BB B ,)/(G G p t Δ==∂∂∑μνξ式中的p T G ,)/(ξ∂∂表示在T ,p 及组成一定的条件下,反应系统的吉布斯函数随反应进度的变化率,称为摩尔反应吉布斯函数变。
2.等温等压条件下化学反应的方向和平衡判据:0BB B m r <=Δ∑μνG化学反应自发地自左向右进行; 0BB B m r ==Δ∑μνG化学反应达到平衡;0BB B m r >=Δ∑μνG化学反应自发地自右向左进行。
3.化学反应等温方程:气相反应 O O m r ln ln f f Q RT K RT G +−=Δ; O O m r ln f K RT G −=Δ 溶液反应OO m r ln ln a a Q RT K RT G +−=Δ;OO m r ln a K RT G −=ΔQ 与ΟK 的表达式相似,区别是:在ΟK 的表达式中,各组分的逸度(活度)为反应达到平衡时的逸度(活度);而在Q 的表达式中,各组分的逸度(活度)是反应在某一时刻的逸度(活度)。
用化学反应等温式判断在等温等压下反应进行的方向 若Ο<K Q ,则,正向反应自动进行 0m r <ΔG 若Ο=K Q ,则,反应达到平衡 0m r =ΔG若Ο>K Q ,则,逆向反应自动进行0m r >ΔG 4. 标准平衡常数标准平衡常数: ∏=BO B O B )/(νp f K f ;O O m r ln fK RT G −=Δ 理想气体 ∏==BO B O O B )/(νp p K K f p非理想气体 O O p f K K K γ=,∏=BB B νγγK 液相反应∏=BB OB νa K a ;OO m r ln a K RT G −=Δ标准平衡常数ΟK 量纲为1,仅是温度的函数。
ΟK 的数值越大,表示正反应进行得越完全。
平衡常数与化学反应计量方程的写法有关。


化学计算方法化学计算是化学科学中的重要组成部分,它涉及到多种计算方法和技术,可以帮助化学研究者进行实验设计、数据处理、结构预测等工作。
本文将介绍化学计算的一些常用方法,包括分子量计算、反应物计算、溶液浓度计算和化学方程式平衡计算。
首先,我们来谈谈分子量计算。
分子量是指化合物中一个分子的质量,通常以原子单位(amu)或克/摩尔(g/mol)为单位。
分子量的计算方法是将化合物中各个元素的相对原子质量相加而得。
例如,水分子(H2O)的分子量可以通过计算氢原子的相对原子质量(1amu)乘以2,再加上氧原子的相对原子质量(16amu)得到。
分子量计算对于确定化合物的化学性质和实验设计都具有重要意义。
其次,反应物计算是化学实验中常见的计算方法。
在化学反应中,通常需要确定反应物的摩尔比、质量比或体积比,以便进行实验操作。
反应物计算可以通过化学方程式和化学计量关系来实现,例如通过平衡化学方程式来确定反应物的摩尔比,或者通过质量守恒和化学计量关系来确定反应物的质量比。
反应物计算是化学实验设计的重要基础,也是化学反应机理研究的重要工具。
另外,溶液浓度计算也是化学实验中常用的计算方法。
溶液浓度通常以摩尔浓度(mol/L)或质量浓度(g/L)来表示,可以通过溶质的质量、溶剂的体积和溶质的摩尔数来计算。
溶液浓度的计算方法包括溶质的质量与溶剂的体积之比、溶质的摩尔数与溶剂的体积之比等。
溶液浓度计算对于溶液配制、反应速率研究等具有重要意义。
最后,化学方程式平衡计算是化学反应研究中的重要内容。
化学方程式平衡是指化学反应中反应物与生成物的摩尔比达到最佳状态,可以通过化学方程式的系数来实现。
化学方程式平衡计算可以通过化学计量关系和平衡常数来实现,例如通过化学计量关系来确定反应物与生成物的摩尔比,或者通过平衡常数来确定化学反应的平衡状态。
化学方程式平衡计算对于确定化学反应的热力学性质和动力学性质具有重要意义。
综上所述,化学计算方法涉及到分子量计算、反应物计算、溶液浓度计算和化学方程式平衡计算等多种技术和方法,它们在化学研究和实验设计中具有重要作用。



第六章 习题及解答1.反应CO(g)+H 2O(g) CO 2(g)+H 2(g)的标准平衡常数与温度的关系为lgpK =2150K/T-2.216,当CO ,H 2O ,H 2,CO 2的起初组成的质量分数分别为0.30,0.30,0.20和0.20,总压为101.3kPa 时,问在什么温度以下(或以上)反应才能向生成产物的方向进行?解 设反应体系的总量为1000g ,已知M(CO)=28g·mol -1, M(H 2O)=18g·mol -1,M(H 2)=2g·mol -1,M(CO 2)=44g·mol -1, 则 n(CO)=(300/28)mol=10.714moln(H 2O)=(300/18)mol=16.667mol n(H 2)=(200/2)mol=100mol n(CO 2)=(200/44)mol=4.545molΣn=(10.714+16.667+100+4.545)mol=131.926 mol x(CO)=10.714mol/131.926 mol=0.0812 x(H 2O)= 16.667mol/131.926 mol=0.1263 x(H 2)=100mol/131.926 mol=0.7580 x(CO 2)= 4.545mol/131.926 mol=0.0345222(CO )(H )0.03450.7850 2.6408(CO)(H O)0.08120.1263x x x Q x x ⨯===⨯因为本题ΣνB =0,所以p K =K x ,要使反应向生成产物方向进行,须 Q x < K x ,即2150K/T-2.216>lg2.6408,解得2150K815.1K 2.216lg 2.6408T <=+,即在815.1K 温度以下反应才能向生成产物方向进行。
2. PCl 5的分解作用为 PCl 5(g) PCl 3(g)+Cl 2(g)在523.2K 、101.325kPa 下反应达到平衡后,测得平衡混合物的密度为2.695kg·m -3,试计算(1) PCl 5(g)的离解度。



第六章化学计算第一节化学计算中的方法和技巧【知识网络】【易错指津】1.根据氧化还原反应中电子守恒计算时,一是准确判断新给物质的化合价,二是如原子团中某原子个数不为1时,要乘以原子个数。
2.根据化学反应,利用气体物质的量推算容器压强时,不要将固体物质的量也计算在内。
3.对一些特殊反应,如浓H2SO4、浓HNO3、浓HCl随反应进行浓度在减少,导致反应情况改变,不能只从理论上计算。
【典型例题评析】例1某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A+3B2C。
若维持温度和压强不变,当达到平衡时,容器体积为VL,其中C气体的体积占10%,下列推断正确的是(1994年全国高考题)①原混合气体的体积为1.2VL ②原混合气体的体积为1.1VL③反应达平衡时气体A消耗掉0.05VL ④反应达平衡时气体B消耗掉0.05VLA.②③B.②④C.①③D.①④思路分析:依题设条件确定在建立化学平衡时A、B、C三种气体体积的关系:A+3B2C平衡时的体积0.9VL 0.1VL生成气体0.1VL C,消耗0.05VL A和0.15VL B。
消耗总体积为:0.05V L+0.15V L=0.2V L因此,原混合气体的体积为:0.9VL+0.2VL=1.1VL。
由此可知,原混合气体的体积为1.1VL,反应达平衡时气体A消耗掉0.05VL。
答案:A一题多解:本题对化学平衡的知识通过简单的定量关系进行考查,只给出了平衡时气体C的体积为总体积10%这一个数据。
这类题很明显是可以有多种解法的。
设x、y为达到平衡时,气体A及气体B分别减少的体积;z为由A、B反应生成气体C时所减少的总体积。
A+3B 2C 体积减少1 32 2x y 0.1V z则x=1/2×0.1V L=0.05V L y=3/2×0.1V L=0.15V L z=0.1V L因此,原混合气体的总体积为:V L+0.1V L =1.1V L例2 C8H16经多步裂化,最后完全转化为C4H8、C3H6、C3H6、C2H4、C2H6、CH4五种气体的混合物。
该混合物的平均相对分子质量可能是(2001年上海高考题)A.28B.30C.38D.40思路分析:此题切入较易,深入较难,只要一步一步深入地去思索,就会获得成功。
设C8H18为直链,物质的量为1mol。
其裂化方式有:①C8H18→C4H8+C4H1O;C4H10→C2H6+C2H4或C4H10→C3H6+CH4。
C4H10的两种裂化共产生2mol气体,总计得C4H8、C2H6、C2H4、C3H6、CH4五种气体3mol。
则式量为:114÷3=38。
②C8H18→C2H4+C6H14,C6H14→C2H4+C4H10,C4H10→C2H6+C2H4,C4H10→C3H6+CH4。
1 1 1 1 1 1 C4H10的两种裂化共产生2mol气体。
故总量为4mol。
式量为:114÷4=28.5答案:B、C方法要领:本题以辛烷裂化为背景,只要分析给出产物的相对分子质量,排出裂化的各种可能,归纳各种产物的物质的量必须在3~4mol之间,根据质量守恒定律便知平均相对分子质量在28.5~38之间。
例3将硫酸钾、硫酸铝、硫酸铝钾三种盐混合溶于硫酸酸化的水中,测得c(SO42-)=0.105mol/L、c(Al3+)=0.055mol/L,溶液的pH=2.0(假设溶液中H2SO4完全电离为H+和SO42-),则c(K+)为(1998年上海高考题)A.0.045mol/LB.0.035mol/LC.0.055mol/LD.0.040mol/L思路分析:本题通过三种硫酸盐与硫酸所形成的混合溶液中,各种离子浓度与pH的关系,立足于考查学生的思维敏捷性,解答该题时只需要根据溶液中所有阳离子所带的正电荷总数等于所有阴离子所带的负电荷总数即可。
由电荷守恒得:0.105mol/L×2=c(K+)+0.055mol/L×3+ 0.01mol/L c(K+)=0.035mol/L。
答案:B方法要领:找出溶液中所有的阴阳离子,据电荷守恒列式求解。
关键是不要忽略了H+的浓度。
例4某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物,当参加反应的单质与被还原硝酸的物质的量之比为2:1时,还原产物是(1997年全国高考题)A.NO2B.NOC.N2OD.N2思路分析:根据氧化还原反应中得失电子数守恒,即可求出硝酸还原后的价态,即可确定产物的分子式。
设金属的化合价为X,还原产物中N的价态为Y,则有:2X=1×(5-Y),Y=5-2X。
讨论:X=1,Y=3(为N2O3);X=2,Y=1(N2O);X=3,Y=-1(舍)。
答案:C方法要领:这类题的关键是看硝酸作用。
若为某非金属单质与硝酸发生氧化还原反应时,参加反应的硝酸只作氧化剂;若为金属与硝酸反应,作氧化剂的硝酸的量:总量减去产物阳离子结合掉的硝酸根的量。
此时特别注意硝酸当还原产物中N的价态-3价时,还应再减去生成硝酸铵中的硝酸根的量。
例5将1.92g铜粉与一定量浓硝酸反应,当铜粉完全作用时收集到1.12L(标准状况)。
则所消耗硝酸的物质的量是(1999年上海高考题)A.0.12molB.0.11molC.0.09molD.0.08mol思路分析:1.92g铜生成0.03molCu(NO3)2,即消耗0.06molHNO3,而产生的1.12L气体不管是NO还是NO2,需要0.05mol的HNO3,总共消耗HNO30.11mol。
答案:B方法要领:在反应过程中HNO3由浓变稀,如以为Cu与浓硝酸反应后,得到气体全为NO2,则造成错误。
由:Cu+4HNO3(浓)= Cu(NO3)2+2NO2↑+2H2O得NO20.03mol×2=0.06 mol,现已知收集到0.05 mol,说明后来HNO3变稀,产生一部分NO。
根据N原子守恒可简化计算:n(HNO3)=n(N)=n(NO)+n(NO2)+2n[Cu(NO3)2]。
例6由NaH2PO4脱水形成聚磷酸盐Na200H2P200O601,共脱去水分子的数目为(2000年上海高考题)A.198个B.199个C.200个D.201个思路分析:从Na+及P原子都为“200”的信息出发,可知(NaH2PO4)n中的n值为200,将n乘入单体各原子,得“Na200H400P200O800”,减去聚磷酸钠“Na200H2P200O601”中的各原子个数,得到“H398O199”,可知共脱去水分子199个。
答案:B一题多解:题中聚磷酸盐的化学式看似复杂,其实只要抓住变化前后Na+的守恒,即可解得。
或脱水分子的数目与脱氧原子的数目必然一致,故有4×200-601=199。
例7 工业上常用漂白粉跟酸反应放出的氯气质量对漂白粉质量的质量分数来表示漂白粉的优劣,漂白粉与酸的反应为:Ca(ClO)2+CaCl2+2H2SO4=2CaSO4+2Cl2↑+2H2O,现为了测定一瓶漂白粉的x%,进行如下实验,称取漂白粉样品2.00g,加水研磨后,转入250mL容量瓶内,用水稀释至刻度,摇匀后,取出25.0mL,加入过量的KI溶液和过量稀硫酸,静置,待漂白粉放出的氯气与KI完全反应后,用0.1mol/LNa2S2O3标准溶液滴定反应中生成的碘,反应如下2Na2S2O3+I2= Na4S4O6+2NaI,滴定时用去溶液20.0 mL。
试用上述数据计算该漂白粉的X%。
(1990年全国高考题)思路分析:逆推思路是:求x%→需要漂白粉样品的质量(已知)和产生Cl2的总质量(未知)→求样品反应能产生Cl2的总质量[即所配250mL溶液可产生Cl2的质量→求取出25mL溶液反应产生Cl2的量→由有关化学方程式找关系式(即Cl2~I2~2Na2S2O3)]和运用已知量计算。
解题的步骤按思路的相反过程进行。
设漂白粉与酸反应放出Cl2物质的量为y2Na2S2O3~ Cl22mol 1mol2.0×10-3mol yy=0.00100mol x%=[(0.00100mol×71g/mol)×250/25.0]]÷2g×100%=35.5%。
答案:35.5%方法要领:这是由多步反应完成的一整套的实验。
在解这种类型的计算题时,找出各步反应中有关物质的数量关系式,根据关系式进行计算,省略了中间步骤,它的优点是解题简捷。
但在找关系式是必须考虑周密谨慎。
否则,一个小的错误会导致整个题目的错误。
审题时应注意:①不是求Ca(ClO)2的质量分数;②计算时带单位运算。
例8在一定条件下,将m体积NO和n体积O2同时通入倒立于水中且盛满水的容器内,充分反应后,容器内残留m/2体积的气体,该气体与空气接触后变为红棕色,则m与n的比值为(1997年上海高考题)A.3:2B.2:3C.8:3D.3:8思路分析:根据题意,剩余的气体是NO,则与n体积O2反应的NO为m/2体积。
由4NO+3O2+2H2O=4HNO3,可知:m/2:n=4:3,m:n=8:3。
答案:C方法要领:关于NO x+O2+H2O→HNO3的计算,把以下两个反应(3NO2+H2O=2HNO3+NO,2NO+O2=2NO2)进行叠加可得:4NO+3O2+2H2O=4HNO3或4NO2+O2+2H2O=4HNO3,利用总反应式计算。
如果题目中剩余气体未指明,则应考虑另一种可能:剩余O2,这样选项B也是可能的。
例9 由CO2、H2和CO组成的混合气在同温同压下与氮气的密度相同。
则该混合气体中CO2、H2和CO的体积比为 (1999年上海高考题)A.29:8:13B.22:1:14C.13:8:29D.26:16:57思路分析:CO相对分子质量与N2相同,CO2与H2体积比:CO2 44 2628 V(CO2):V(H2)=26:5=13:8。
H2 2 16答案:C、D方法要领:本题旨在考查考生能否灵活掌握有关平均值计算。
考查考生思维的敏捷性、灵活性。
因题中提供的混合气中含三种气体,用一般方法无法解出,故要透过现象看本质,发现CO与N2式量相等,用十字交叉法计算CO2与H2体积比,在选项中只要前两位满足13:8即可。
此题的解题关键在于挖掘出CO与N2相对分子质量相同,而不要计算CO量,CO可为任意量。
例10由锌、铁、铝、镁四种金属中的两种组成的混合物10g,与足量的盐酸反应产生的氢气在标准状况下为11.2L,则混合物中一定含有的金属是(1998年全国高考题)A.锌B.铁C.铝D.镁思路分析:本题通定量的金属与酸置换反应,考查学生的思维敏捷性。
题中涉及的反应有:Mg+2H+=Mg2++H2↑2Al+6H+=2Al3++3H2↑Fe+2H+=Fe2++H2↑Zn+2H+=Zn2++H2↑10g混合物在反应中失去1mol电子,则Zn、Fe、Al、Mg各失1mol电子的质量分别为32.5g、28g、9g、12g。