烷烃的物理性质
- 格式:ppt
- 大小:289.00 KB
- 文档页数:8

第2课时 烷烃的性质[核心素养发展目标] 1.了解烷烃的主要物理性质和化学性质,培养变化观念与平衡思想的素养。
2.熟练掌握甲烷的主要性质,提高证据推理与模型认知能力。
3.认识取代反应的概念及特点,培养微观探析及变化观念。
一、烷烃的物理性质及可燃性1.烷烃的物理性质2.烷烃的稳定性及可燃性(1)稳定性:通常情况下,烷烃与 、 或高锰酸钾等 不发生反应。
(2)可燃性:烷烃都能燃烧。
CH 4燃烧的化学方程式: C 3H 8燃烧的化学方程式: 链状烷烃燃烧通式: (3)烷烃在 下会发生分解。
(1)常温常压下,CH 4、C 2H 6和C 3H 8为气体,C 4H 10、C 6H 14呈液态( )(2)在通常条件下,烷烃和硫酸、氢氧化钠不反应,和酸性KMnO 4溶液也不反应( ) (3)在做甲烷、乙烷燃烧实验前,气体一定要验纯( )(4)使用天然气(主要成分为CH 4)的燃气灶,改用液化石油气(主成分为C 4H 10),应减小进气量或增大进风量( ) (5)烷烃都能燃烧,且完全燃烧的产物一定是CO 2和H 2O( )1.有两种气态烷烃的混合物,在标准状况下其密度为1.15 g·L -1,则关于此混合物的组成说法不正确的是( ) A.一定有甲烷 B.一定不存在乙烷C.可能是甲烷和乙烷的混合物D.不可能为乙烷和丙烷的混合物 2.标准状况下,0.1 mol 某链状烷烃完全燃烧生成11.2 L CO 2。
(1)写出该链状烷烃的分子式:____ ____。
(2)写出该链状烷烃燃烧的化学方程式:______________________________。
(3)该链状烷烃的同分异构体有多种,写出分子中含有4个甲基(—CH3)的结构简式:________。
二、烷烃的典型性质——取代反应1.烷烃的取代反应实验探究(以CH4与Cl2的反应为例)A装置:试管内气体颜色逐渐;试管内壁有出现,2.取代反应概念:有机物分子里的某些原子或原子团被其他所替代的反应。


烷烃烯烃环烷烃芳香烃的鉴别1.引言1.1 概述烷烃、烯烃、环烷烃和芳香烃是有机化合物中常见的四类化合物。
它们在化学性质、物理性质和化学反应等方面有着很大的差异,因此,对它们进行准确的鉴别至关重要。
烷烃是一类由碳和氢组成的直链或支链链状化合物。
它们具有饱和的碳-碳单键,因此相对稳定。
在室温下,大多数烷烃是无色、无味、无毒的液体或气体,不溶于水,但溶于有机溶剂。
烷烃的物理性质主要取决于它们的分子量和分子结构。
烯烃是一类含有一个或多个碳-碳双键的化合物。
由于双键的存在,烯烃具有一定的不饱和性,对于化学反应来说更加活泼。
烯烃的物理性质与烷烃类似,但由于不饱和性的存在,烯烃容易发生加成反应。
环烷烃是一类由碳组成的环状化合物。
环烷烃分子内的碳原子通过碳-碳单键相连接,这种结构使得环烷烃更加稳定。
环烷烃的物理性质通常与烷烃相似,但由于环结构的存在,环烷烃在一些化学反应中表现出特殊性质。
芳香烃是一类含有苯环结构的化合物。
苯环由六个碳原子构成,每个碳原子通过一个碳-碳单键和一个碳-氢单键相互连接。
芳香烃通常具有特殊的香气,因此得名。
芳香烃的物理性质与烷烃有所不同,化学反应也更具特异性。
本篇文章旨在介绍烷烃、烯烃、环烷烃和芳香烃的主要特征和鉴别方法,以帮助读者准确判断和区分这些有机化合物。
通过了解它们的物理性质和化学反应,我们可以更好地理解它们在实验室和工业中的应用,为相关领域的研究和应用提供指导。
1.2文章结构文章结构部分的内容可以描述文章的整体框架和各个部分的内容安排,以及每个部分的主题和目标。
文章结构部分的内容示例:1.2 文章结构本文共分为三个主要部分,具体结构如下:第一部分为引言部分,旨在介绍本文的背景和主题,并说明文章的目的和意义。
第一小节对烷烃、烯烃、环烷烃和芳香烃进行简要概述,以帮助读者对这些化合物有一个整体的了解。
第二小节是文章的主要部分,介绍了烷烃、烯烃、环烷烃和芳香烃的鉴别方法。
第三小节是结论部分,对文章的主要内容进行总结和归纳,并就烷烃、烯烃、环烷烃和芳香烃的鉴别提出一些结论和建议。


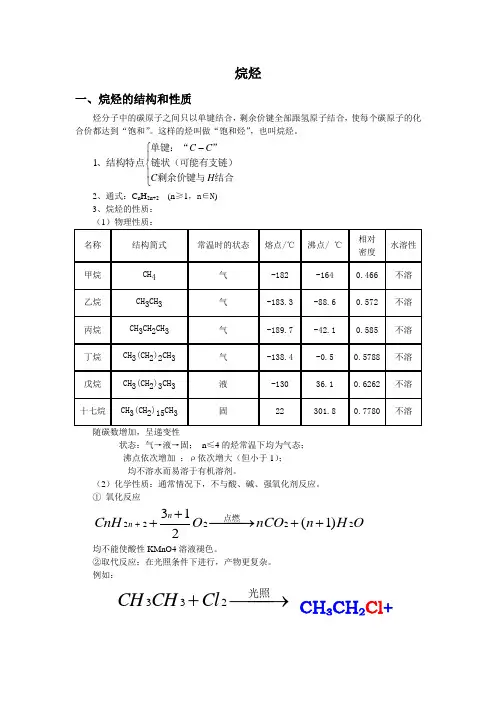
烷烃一、烷烃的结构和性质烃分子中的碳原子之间只以单键结合,剩余价键全部跟氢原子结合,使每个碳原子的化合价都达到“饱和”。
这样的烃叫做“饱和烃”,也叫烷烃。
⎪⎩⎪⎨⎧-结合剩余价键与链状(可能有支链)”单键:“、结构特点H C C C 1 2、通式:C n H 2n+2 (n ≥1,n ∈N ) 3、烷烃的性质: (1)物理性质:随碳数增加,呈递变性状态:气→液→固; n ≤4的烃常温下均为气态; 沸点依次增加 ;ρ依次增大(但小于1); 均不溶水而易溶于有机溶剂。
(2)化学性质:通常情况下,不与酸、碱、强氧化剂反应。
① 氧化反应均不能使酸性KMnO4溶液褪色。
②取代反应:在光照条件下进行,产物更复杂。
例如:OH n nCOO CnHn n 22222)1(213++−−→−+++点燃−−→−+光照233Cl CH CH CH 3CH 2Cl +下列有关烷烃的叙述中,不正确的是 ( )A 、在烷烃分子中,所有的化学键都为单键B 、所有的烷烃在光照条件下都能与Cl2发生反应C 、烷烃分子通式为CnH2n+2,符合该通式的烃不一定是烷烃D 、通常情况下,烷烃不与强酸、强碱和强氧化剂反应写出下列反应化学方程式:⑴CH3CH3在氧气中完全燃烧 ⑵ CnH2n+2在氧气中燃烧⑶ CH3CH3与氯气反应生成一氯乙烷 ⑷ CH3CH3与氯气反应生成二氯乙烷1)、若某烷烃的分子式为C 12H m ,则m= ;(2)、若某烷烃的分子式为C n H 32,则n= ;(3)、某烷烃的相对分子质量为142,则它的分子式为 。
4、同系物:结构相似、分子组成上相差一个或若干个CH 2原子团的物质互相称为同系物。
同系物的判断及其规律1、两化合物互为同系物的必备条件有三:(1)同通式、同类物; (2)结构相似;(3)分子组成上相差一个或若干个CH 2原子团同时满足这三个条件的化合物才是互为同系物的关系。
2、同系物规律(1)同系物随着碳原子数的增加,相对分子质量逐渐增大,分子间作用力逐渐增大,其熔沸点逐渐升高。



化合物的物理性质《烷烃的物理性质》一. 物质的状态室温下,C1-C4为气体,C5-C16为液体,C17以上是固体。
二.熔点和沸点烷烃的熔点和沸点都很低,并且熔点和沸点随分子量的增加而升高。
但值得注意的是:(1)对同数碳原子的烷烃来说,结构对称的分子熔点高。
因为结构对称的分子在固体晶格中可紧密排列,分子间的色散力作用较大,因而使之熔融就必须提供较多的能量。
(2)含偶数碳原子的正烷烃比奇数碳原子的熔点高。
这主要取决于晶体中碳链的空间排布情况。
X光证明,固体正烷烃的碳链在晶体中伸长为锯齿形,奇数碳原子的链中两端的甲基处在同一边,而偶数碳原子的链中,两端的甲基处在相反的位置,从而使这种碳链比奇数碳链的烷烃可以彼此更为靠近,于是它们之间的色散力就大些。
烷烃的沸点上升比较有规则,每增加一个CH2基,上升20-30℃,越到高级系列上升越慢。
在相同碳原子数的烷烃中,直链的沸点比带支链的高,这是由于在液态下,直链的烃分子易于相互接近,而有侧链的烃分子空间阻碍较大,不易靠近。
三. 比重、溶解度、折光率(略)环烷烃的物理性质在常温常压下环丙烷及环丁烷为气体,环戊烷为液体,高级环烷烃为固体。
环烷烃的熔点较同数碳原子的直链烷烃高,因为环烷烃比直链烷烃在晶格中排列更紧密。
环烷烃的密度为0.688~0.853g•c m-3 。
环烷烃不溶于水。
一些环烷烃的熔点和沸点见表3-2。
表3.2 环烷烃的熔点、沸点、张力能(kJ·mol-1)和每一个-CH2-单元的燃烧热(kJ·mol-1 )《芳烃的物理性质》苯及其同系物大多为液体,故有特殊的香气,但它们的蒸气有毒。
高浓度的苯蒸气作用于中枢神经,引起急性中毒。
长期接触低浓度的苯蒸气能损害造血器官。
因此,应尽量注意少接触苯。
有时可以用甲苯代替苯作溶剂,因少量甲苯在人体中可以与甘氨酸作用被人体中酶催化形成马尿酸(C6H5CONHCH2CO2H)而排出体外,故甲苯毒性相对较小。

第3课时 烷烃的性质1.烷烃的物理性质(1)随分子中碳原子数增加,熔、沸点逐渐升高;(2)随分子中碳原子数增加,状态由气态→液态→固态,其中常温、常压下碳原子数小于或等于4的烷烃为气态;(3)随分子中碳原子数增加,密度逐渐增大且均比水的密度小,难溶于水。
(4)当碳原子数相同时,一般支链越多,沸点越低。
如沸点:正丁烷>异丁烷。
2.烷烃的化学性质(1)稳定性:通常条件下与强酸、强碱或高锰酸钾等强氧化剂不反应。
(2)可燃性(氧化反应):烷烃都能燃烧。
CH 4燃烧方程式:CH 4+2O 2――→点燃CO 2+2H 2O C 3H 8燃烧方程式:C 3H 8+5O 2――→点燃3CO 2+4H 2O 链状烷烃燃烧通式:C n H 2n +2+3n +12O 2――→点燃n CO 2+(n +1)H 2O 。
(3)分解反应:烷烃在较高的温度下会发生分解。
如:CH 4――→高温C +2H 2,应用:石油化工生产和天然气化工生产中,获得重要的化工基本原料和燃料。
二、烷烃的取代反应1.实验探究CH 4与Cl 2的反应(1)实验装置和实验操作取两支试管,通过排饱和食盐水法收集半试管CH 4和半试管Cl 2。
将一支试管用铝箔套上,另一支试管放在光亮处。
(2)实验现象:A 装置:试管内气体颜色变浅,试管壁出现油状液滴,试管内液面上升。
B 装置:无现象。
(3)实验结论:CH 4与Cl 2需在光照条件下发生化学反应。
(4)甲烷和氯气的混合气体在光照发生反应的化学方程式为:①CH 4+Cl 2――→光 CH 3Cl +HCl ②CH 3Cl +Cl 2――→光CH 2Cl 2+HCl ③CH 2Cl 2+Cl 2――→光 CHCl 3+HCl ④CHCl 3+Cl 2――→光CCl 4+HCl(5)反应产物:甲烷与氯气发生生成4种有机产物和HCl ,其中CH 3Cl (一氯甲烷)、CH 2Cl 2(二氯甲烷)、CHCl 3(三氯甲烷)、CCl 4(四氯甲烷)均难溶于水,其中常温下除CH 3Cl 是气体,CH 2Cl 2、CHCl 3、CCl 4为液体。
烷烃和烯烃的结构和性质烷烃和烯烃是有机化合物中最基本的两类。
它们在自然界中广泛存在,对我们的日常生活和工业生产有着重要的作用。
本文将探讨烷烃和烯烃的结构和性质,以及它们在实际应用中的一些特点。
一、烷烃的结构和性质烷烃是由碳和氢组成的碳氢化合物,在化学式中以CnH2n+2的形式表示。
烷烃分子结构非常简单,由碳原子通过共价键连接而成,每个碳原子都与四个氢原子结合。
根据碳原子的连接方式,烷烃可以进一步分为直链烷烃和支链烷烃。
直链烷烃的碳原子按照直线排列,例如甲烷(CH4)、乙烷(C2H6)等。
支链烷烃则是在直链的基础上,某个或者多个氢原子被其他原子或者基团替代,例如异丙烷(CH3CH(CH3)CH3)。
烷烃分子中的碳碳键都是单键,这导致烷烃分子形成一个直线或者分支的链状结构。
由于碳碳键是非极性的,烷烃通常是无色、无味、无毒的。
烷烃的物理性质主要受分子量和分子结构的影响。
随着分子量的增加,烷烃的沸点和熔点也会增加。
由于烷烃分子之间的相互作用比较弱,因此在常温下,较低碳数的烷烃呈气体状态,中等碳数的烷烃为液体,而较高碳数的烷烃为固体。
二、烯烃的结构和性质烯烃也是由碳和氢组成的碳氢化合物,与烷烃相比,烯烃分子中存在一个或多个碳碳双键。
根据双键的位置和数量,烯烃可以分为直链烯烃和支链烯烃。
直链烯烃的碳原子按照直线排列,双键位于末端或者内部。
例如乙烯(C2H4)是最简单的烯烃,其分子结构为CH2=CH2。
支链烯烃则是在直链的基础上,某个或者多个氢原子被其他原子或者基团替代,例如异丁烯(CH2=C(CH3)CH3)。
烯烃的存在双键使得分子整体呈现出非刚性和非平面的特点。
由于碳碳双键是非极性的,烯烃分子的极性也较低。
与烷烃相比,烯烃的物理性质和化学性质都具有一些差异。
由于存在双键,烯烃的反应性较烷烃更强。
烯烃可以进行加成反应、聚合反应等,在工业上广泛应用于合成橡胶、合成塑料等领域。
三、烷烃和烯烃的应用烷烃和烯烃作为常见的碳氢化合物,在各个领域具有广泛的应用。
烷烃与烯烃的性质与应用烷烃和烯烃是有机化学中两类重要的碳氢化合物。
它们在化学结构上有所区别,以及在性质和应用上也有一些显著差异。
本文将介绍烷烃和烯烃的基本性质,并探讨它们在日常生活和工业中的一些重要应用。
一、烷烃的性质与应用烷烃是一类碳氢化合物,其分子由碳原子和氢原子组成,采用碳原子之间的共价键连接。
烷烃的通式为CnH2n+2,其中n为非负整数。
烷烃分子中的碳原子之间由于共价键的存在,使得烷烃分子相对比较稳定。
烷烃可以分为直链烷烃和支链烷烃两种类型。
直链烷烃的碳原子按照线性排列,支链烷烃则是在直链烷烃的基础上通过碳原子的空位连接其他的碳原子。
直链烷烃和支链烷烃具有不同的物理和化学性质。
在物理性质方面,烷烃是无色、无味、无臭的化合物,大多数烷烃是液体或气体,在常温下难以溶于水。
烷烃的密度较小,熔点和沸点随着碳原子数目的增加而增加。
在化学性质方面,烷烃是相对稳定的化合物,需要高温或者催化剂的作用下才会参与化学反应。
常见的烷烃化学反应包括燃烧反应、加氢反应和卤代反应等。
烷烃的燃烧反应是指烷烃与氧气在适当条件下发生反应,生成二氧化碳和水。
加氢反应是指烷烃与氢气在存在催化剂的条件下反应,生成饱和度更高的烃类化合物。
卤代反应是指烷烃中的氢原子被氯、溴等卤素取代的反应。
烷烃在生活中和工业中有许多重要的应用。
例如,甲烷是天然气的主要成分,被广泛用于燃料和热源。
乙烷是石油和天然气的组分,它也被用作燃料和热源。
丙烷和丁烷等烷烃被用作液化石油气和煤气,用于家用燃烧和热源。
此外,烷烃还可以作为溶剂和合成有机化合物的原料,广泛应用于化工、制药、农药、橡胶等行业。
二、烯烃的性质与应用烯烃也是一类碳氢化合物,其分子中含有碳碳双键。
烯烃的通式为CnH2n,其中n为非负整数。
烯烃的碳碳双键赋予了它更多的化学反应性和结构变化的可能性。
烯烃可以分为直链烯烃和支链烯烃两种类型,它们的命名和烷烃相似。
直链烯烃的碳原子按照线性排列,支链烯烃则是在直链烯烃的基础上通过碳原子的空位连接其他的碳原子。