人教版高中化学选修四《盐类的水解》
- 格式:docx
- 大小:31.64 KB
- 文档页数:4







盐类水解____________________________________________________________________________________________________________________________________________________________________1.了解盐类水解的实质, 能够解释盐类水解的过程。
2.能够判断水解后溶液的酸碱性和书写水解方程式, 总结、归纳出盐类水解的基本规律。
3.能够比较出溶液中离子浓度大小。
一、盐类的水解(只有可溶于水的盐才水解)1.盐类水解: 在水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应。
2.水解的实质.水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合,破坏水的电离, 是平衡向右移动, 促进水的电离。
3.盐类水解规律:①有弱才水解, 无弱不水解, 越弱越水解;谁强显谁性, 两弱都水解, 同强显中性。
②多元弱酸根, 浓度相同时正酸根比酸式酸根水解程度大, 碱性更强。
(如:Na2CO3 >NaHCO3)4.盐类水解的特点: (1)可逆(与中和反应互逆.(2)程度.(3)吸热5.影响盐类水解的外界因素:①温度: 温度越高水解程度越大(水解吸热, 越热越水解)②浓度:浓度越小, 水解程度越大(越稀越水解)③酸碱: 促进或抑制盐的水解(H+促进阴离子水解而抑制阳离子水解;OH -促进阳离子水解而抑制阴离子水解)6.酸式盐溶液的酸碱性:①只电离不水解: 如HSO4- 显酸性②电离程度>水解程度, 显酸性(如: HSO3- 、H2PO4-)③水解程度>电离程度, 显碱性(如: HCO3- 、HS- 、HPO42-)7.双水解反应:(1)构成盐的阴阳离子均能发生水解的反应。
双水解反应相互促进, 水解程度较大, 有的甚至水解完全。
使得平衡向右移。
9.水解平衡常.(Kh)对于强碱弱酸盐: Kh =Kw/Ka(Kw为该温度下水的离子积, Ka为该条件下该弱酸根形成的弱酸的电离平衡常数)对于强酸弱碱盐:Kh =Kw/Kb(Kw为该温度下水的离子积, Kb为该条件下该弱碱根形成的弱碱的电离平衡常数)二、电离、水解方程式的书写原则1.多元弱酸(多元弱酸盐)的电离(水解)的书写原则: 分步书写注意: 不管是水解还是电离, 都决定于第一步, 第二步一般相当微弱。

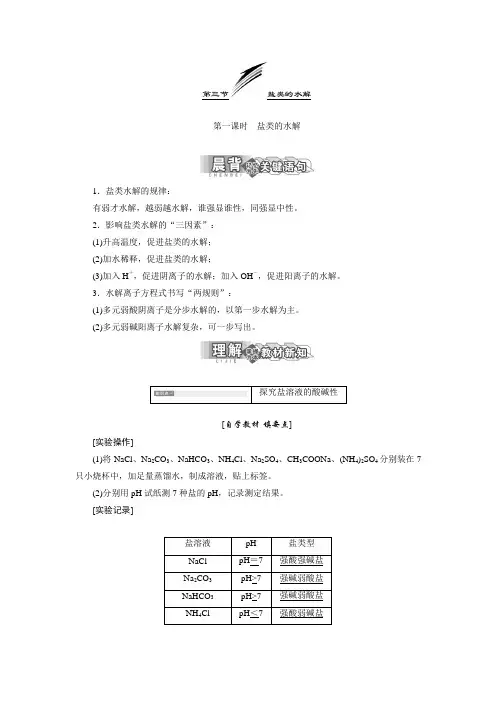
第三节盐类的水解第一课时盐类的水解1.盐类水解的规律:有弱才水解,越弱越水解,谁强显谁性,同强显中性。
2.影响盐类水解的“三因素”:(1)升高温度,促进盐类的水解;(2)加水稀释,促进盐类的水解;(3)加入H+,促进阴离子的水解;加入OH-,促进阳离子的水解。
3.水解离子方程式书写“两规则”:(1)多元弱酸阴离子是分步水解的,以第一步水解为主。
(2)多元弱碱阳离子水解复杂,可一步写出。
[自学教材·填要点][实验操作](1)将NaCl、Na2CO3、NaHCO3、NH4Cl、Na2SO4、CH3COONa、(NH4)2SO4分别装在7只小烧杯中,加足量蒸馏水,制成溶液,贴上标签。
(2)分别用pH试纸测7种盐的pH,记录测定结果。
[实验记录][实验结论](1)强碱弱酸盐:Na2CO3、NaHCO3、CH3COONa等溶液呈碱性。
(2)强酸强碱盐:NaCl、Na2SO4等溶液呈中性。
(3)强酸弱碱盐:NH4Cl、(NH4)2SO4等溶液呈酸性。
[师生互动·解疑难](1)常见的强酸:HCl、H2SO4、HNO3、HBr、HI、HClO4等。
常见的强碱:NaOH、KOH、Ca(OH)2、Ba(OH)2。
(2)常见的弱酸:HCOOH(甲酸)、醋酸(CH3COOH)、HClO、H2CO3、H2SiO3、HF、H2SO3、H3PO4、H2S等。
常见的弱碱:NH3·H2O、Fe(OH)3、Cu(OH)2等。
(3)盐溶液的酸碱性:1.有下列盐溶液:①KNO3②CuSO4③K2CO3④FeCl3⑤K2SO4⑥NaClO⑦NH4Cl呈酸性的是________,呈碱性的是________,呈中性的是________。
解析:CuSO4、FeCl3、NH4Cl属于强酸弱碱盐,溶液呈酸性;K2CO3、NaClO属于强碱弱酸盐,溶液呈碱性;KNO3、K2SO4属于强酸强碱盐,溶液呈中性。
答案:②、④、⑦③、⑥①、⑤[自学教材·填要点]1.盐溶液酸、碱性的理论分析(1)NH4Cl溶液:NH+4+H2O NH3·H2O+H+CH3COO-+H2O CH3COOH+OH-(3)NaCl溶液:①电离过程:NaCl===Na++Cl-,H2O H++OH-。
第一讲盐类的水解
【知识一览】
一、盐类的水解:
1、水解过程:
醋酸钠水解的实质是:
氯化铵与水解的实质是:
水解的结果:生成了酸和碱,因此盐的水解反应是酸碱中和反应的逆反应。
酸+碱盐+水
2、水解离子方程式的书写:
①盐类水解是可逆反应,要写“”符号
②一般水解程度很小,水解产物很少,通常不生成沉淀和气体,不用“↑”“↓”符号。
生
成物(如H2CO3、NH3·H2O等)也不写分解产物。
③多元弱酸盐分步水解,以第一步为主。
3、规律:
有弱才水解,无弱不水解;谁弱谁水解,谁强显谁性。
4、影响水解的因素:
内因:盐的离子与水中的氢离子或氢氧根离子结合的能力的大小,组成盐的酸或碱的越弱,盐的水解程度越大。
“无弱不水解,有弱即水解,越弱越水解,谁强显谁性”
外因:
①温度:
②浓度:
二、盐类水解的应用
1. 比较盐溶液的pH大小
2. 酸式盐溶液酸碱性的判断
3. 判断溶液中离子种类、浓度大小
4. 判断离子是否共存
5. 配制易水解的盐的溶液
6. 金属与盐溶液反应
7. 加热盐溶液
8. 在生产、生活中的应用:如泡沐灭火器的反应原理、焊接时可用氯化锌、氯化铵溶液
除锈、某些肥料不宜混合使用(如:草木灰、碳酸铵、重钙等)、明矾的净水作用。
【知识与基础】
1.在盐类发生水解的过程中正确的说法是()
A.盐的电离平衡被破坏B.水的电离程度逐渐增大
C.溶液的pH发生改变D.没有中和反应发生
2.下列说法中正确的
是…………………………………………………………………………………()
(A) HCO-
在水溶液中只有电离,不水解(B) 硝酸钠溶液水解之后呈中性
3
(C) 可溶性的铝盐都能发生水解反应(D) 可溶性的钾盐都不发生水解反应3.在水中加入下列物质,可使水的电离平衡向右移动的是……………………………………………()
(A) H2SO4(B) KOH(C) NaF(D) Ba(NO3)2 4.下列离子方程式中,属于水解反应的是…………………………………………………………………()
(A) H2O+H2O H3O++OH-(B) HCO-
+H2O H2CO3+OH-
3
(C) NH+
+H2O NH3·H2O+H+(D) HS-+H2O S2-+H3O+
4
5.物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是………………………………………………………………………………()
(A) HX、HZ、HY(B) HZ、HY、HX(C) HX、HY、HZ(D) HY、HZ、HX 6.指出下列溶液的酸碱性,并用离子方程式表示其显酸性或碱性的原因。
①NaHSO4_______________,原因:________________________________________________________。
②NaHCO3_______________,原因:________________________________________________________。
③KAl(SO4)2______________,原因:________________________________________________________。
④FeCl3__________________,原因:________________________________________________________。
⑤H2S___________________,原因:________________________________________________________。
7.现有0.01mol/L的下列溶液:① CH3COOH ② NaHCO3 ③ NaHSO4 ④ KOH ⑤H2SO4按pH由小到大的顺序排列的是()
A.⑤③①②④B.③⑤①②④C.⑤②③①④D.④②①③⑤8.下列物质能跟镁反应并产生氢气的是()
A.醋酸溶液B.氢氧化钠溶液C.氯化铵溶液D.碳酸钠溶液9.(1)明矾水溶液呈酸性的离子方程式是________________________________________,出现浑浊时,消除浑浊的方法是________________________________________________________。
(2)纯碱与水作用的离子方程式__________________________________________________________,
若要增加其洗涤力应__________________________________________________________。
(3)实验室配制硫酸亚铁溶液,溶解时先要加入少量的稀硫酸,其原因是___________________________。
10.下面提到的问题中,与盐类水解无关的正确说法是()
①明矾和FeCl3可作净水剂
②为保存FeCl3溶液,要在溶液中加少量盐酸
③实验室配制AlCl3溶液时,应先把它溶在盐酸中,而后加水稀释
④ NH4Cl与ZnCl2溶液可作焊接中的除锈剂
⑤实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞
⑥用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
⑦在NH4Cl或AlCl3溶液中加入金属镁会产生氢气
⑧长期使用硫铵,土壤酸性增强;草木灰与铵态氮肥不能混合施用
⑨比较NH4Cl和Na2S等溶液中离子浓度的大小或某些盐溶液的酸碱性
A.①④⑦B.②⑤⑧C.③⑥⑨D.全有关
【能力与技巧】
11.pH都等于9的NaOH 和CH3COONa两种溶液中,设由水电离产生的OH-浓度分别为a mol·L-1和 b mol·L-1,则 a 、b的关系为………………………………………………………………………()
(A) a>b(B) a =10-4 b(C) b =10-4 a(D) a=b
12.为了得到比较纯净的物质,使用的方法恰当的是()
A.向Na2CO3饱和溶液中,通入过量的CO2后,在减压、加热的条件下,蒸发得NaHCO3
晶体
B.加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体
C.向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体
D.向FeCl3溶液里加入足量NaOH溶液,经过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3 13.25℃时,pH=2的酸(HA)溶液和pH=12的碱(BOH)溶液等体积混合,混合溶液pH =5。
(1)混合溶液中______________离子一定发生水解反应。
(2)在(1)中所指离子水解的离子方程式是________________________________________。
14.有A、B、C、D四种一元酸的溶液。
实验表明:
(1)物质的量浓度相同的A、C溶液中,分别滴入甲基橙试液后,A溶液呈黄色而C 中不变色;
(2)物质的量浓度相同的B、C的钠盐溶液相比较,B的钠盐溶液pH小于C的钠盐溶液pH;
(3)A酸跟D的盐反应生成A的盐和D酸.由此可以确定四种酸的酸性由强到弱的顺序正确的是()
A.B>C>A>D B.A>C>D>B C.D>A>C>B D.C>D>A>B
15.某种一元强碱MOH溶液加入一种一元酸HA反应后,溶液呈中性,下列判断一定正确的是()
A .加入的酸过量
B .生成的盐不水解
C .酸和碱等物质的量混合
D .反应后溶液中)()(+
-=M c A c 16.在氯化铁溶液中,加入难溶于水的碳酸钙粉末,观察到碳酸钙逐渐溶解,产生无色气体
和红褐色沉淀.回答:
(1)气体是______,红褐色沉淀是______。
(2)试用有关理论解释观察到的上述现象: ________________________________。
17.试用水解平衡移动的原理解释:漂白粉溶液中加入少量醋酸会增强漂白效果.其原因是_____________。
18.将AlCl 3溶液加热、蒸干、灼烧,最后所得到的主要固体产物是什么?用化学方程式加
以表示,并配以必要的文字说明。
【综合与拓展】
19.欲证明在相同物质的量浓度的某弱酸HX 及其盐NaX 的混合溶液中,是HX 的电离程
度大还是HX 的水解程度大,简便方法之一是取0.2mol ·L -1 HX 溶液与0.1mol ·L - NaOH
溶液等体积混合后,测定其pH 。
根据下述测定结果填空(用“>”,“=”或“<”填空):
(1)若pH=7,说明HX 的电离程度__________________NaX 的水解程度;
(2)若pH >7,说明HX 的电离程度_________________NaX 的水解程度;
(3)若pH <7,说明HX 的电离程度_________________NaX 的水解程度。