罗氏性能验证报告模板
- 格式:doc
- 大小:218.00 KB
- 文档页数:11


性能验证报告单位名称:AAA医院科室名称:检验科实验室:门急诊检验中心仪器名称:全自动尿液分析仪型号规格:URISYS 2400仪器编号:MJZ004验证人员:审核人:批准人:验证日期:2012年8月1日—2012年9月30日一、检测系统信息:项目:尿液干化学(pH、比重、潜血、中性粒细胞、蛋白质、葡萄糖、酮体、胆红素、尿胆原、亚硝酸盐)试剂及厂商:罗氏公司及原装配套试剂检测方法:干化学法二、验证过程1.精密度1.1批内精密度1.1.1方法及判定标准按常规方法连续检测20次尿液质控品(阴性和阳性),检测结果相差同方向不超过一个级别,但是阴性结果不能检测成阳性,阳性结果不能检测呈阴性。
1.1.2质控品批号:20116213;201162121.1.3测定日期:2012-8-28至2012-9-161.1.4样本号:(501-520);(601-620)1.1.5结果及数据1.1.5.1阴性质控标本测定结果1.1.5.2阳性质控标本测定结果1.2批间精密度1.2.1方法及判定标准选择室内质控作为衡量批间精密度的依据。
每天室内质控品按照常规标本的方法一样测定,连续收集同一批号室内质控品某一时间段(至少20天)的室内质控数据。
1.2.2质控品批号:20116213;201162121.2.3测定日期:2012-8-28至2012-9-161.2.4结果及数据1.2.4.1阴性质控20天测定结果1.2.4.2阳性质控测定结果2.正确度2.1比对实验由于临床血液学与体液学实验室的URISYS 2400尿液分析仪通过了卫生部的室间质评活动。
其检测结果的准确性可以进行传递,因此以URISYS 2400尿液分析为参照,将门急诊检验中心的URISYS 2400尿液分析仪与之进行了比对。
按照NCCLS EP15 A的相关规定,每日选择8个当日采集的、浓度分布状况比较具有代表性的病人样本,同时采用两台URISYS 2400尿液分析仪进行检测,每个样本在每台仪器上均检测一次,连续比对5天(最终共比对了40个样本)。

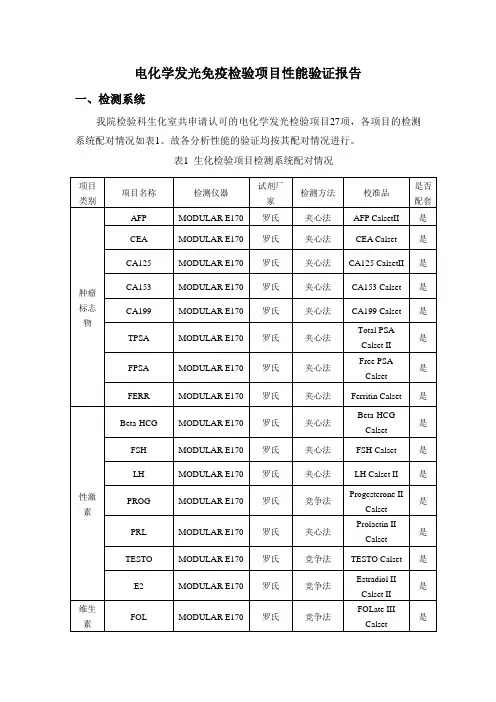
电化学发光免疫检验项目性能验证报告一、检测系统我院检验科生化室共申请认可的电化学发光检验项目27项,各项目的检测系统配对情况如表1。
故各分析性能的验证均按其配对情况进行。
表1 生化检验项目检测系统配对情况二、范围:2.1 精密度(包括批内及日间精密度)。
2.2 准确度2.3线性范围验证:2.4 稀释度(可报告范围)2.5 生物参考区间的验证三方法1、精密度评估1.1 批内精密度;仪器:瑞士ROCHE公司MODULAR E170全自动电化学发光免疫分析仪材料:ROCHE正常肿瘤质控(批号),ROCHE病理肿瘤质控(批号);ROCHE 正常通用质控(批号),ROCHE病理通用质控(批号);ROCHE正常杂项质控(批号),ROCHE病理杂项质控(批号)。
评估步骤:在确定ROCHE MODULAR E170性能正常的情况下,重复测定20次上述各质控品,计算出各项目的均值、标准差和变异系数。
变异系数即代表精密度。
统计方法:用EXCEL来分析计算均数、标准差和变异系数。
评价方法:根据CLIA'88要求,批内精密度应≤1/4TEa,总精密度应≤1/3TEa,若CLIA'88中未做出规定,则依据中国卫生部临床检验中心室间质评要求执行或验证试剂说明书声明的精密度数据。
结论:1. 2 批间精密度;仪器:瑞士ROCHE公司MODULAR E170全自动电化学发光免疫分析仪材料:ROCHE正常肿瘤质控(批号),ROCHE病理肿瘤质控(批号);ROCHE 正常通用质控(批号),ROCHE病理通用质控(批号);ROCHE正常杂项质控(批号),ROCHE病理杂项质控(批号)。
评估步骤:在确定ROCHE MODULAR E170性能正常的情况下,在5个工作日,测定2批,每次测定2次上述质控,计算出均值,标准差和变异系数。
变异系数即代表精密度。
统计方法:用EXCEL来分析计算均数、标准差和变异系数。
评价方法:根据CLIA'88要求,批内精密度应≤1/4TEa,总精密度应≤1/3TEa,若CLIA'88中未做出规定,则依据中国卫生部临床检验中心室间质评要求执行或验证试剂说明书声明的精密度数据。

泰州人民医院南院检验科血气分析仪性能校准报告仪器型号: Cobas b 221仪器序列号: ****制造商: 罗氏公司鉴定结论: 合格鉴定人: *** 日期:20**年08月31日鉴定单位: *******生物科技有限公司罗氏Cobas b 221血气分析仪性能鉴定报告1.仪器工作环境:环境温度:15-31 ℃是否符合要求:②不符合环境气压:536-797 mmHg(-100~2500米) 是否符合要求:②不符合相对湿度:20-95%(无冷凝)是否符合要求:②不符合2.仪器的工作电源:100-240VAC(±10%), 50-60Hz(±5%)是否符合要求:②不符合3.各部件状况检测电极检查是否正常:②不正常温度检查是否正常:②不正常大气压检查是否正常:②不正常泵,阀工作是否正常:②不正常液体传感器工作是否正常:②不正常模块工作是否正常:②不正常打印机工作是否正常:②不正常PC显示屏工作是否正常:②不正常4.仪器的设置及维护仪器外观是否清洁:②否系统的时间设置是否正确:②否电极是否更换:②否试剂是否更换:②否进样口是否干净:②否5. 性能数据测定参数----------------------------------------------------------------------------------------------------------------------------B 全血Q 水状指控品(a)含水溶液(a)具有相似的生理离子基体和缓冲容量6. 精确性,重现性在Cobas b 221 POC system 上连续7天,每天运行两次,每次测量两次,由此得到的“重现性(S R)”和“设备内精密度(S I)”数据。
对于具有代表性或已经测定的S R和S I,其对应的测定值即为均值。
材料:Combitrol Plus B/LEVEL 1(水平1),n=28材料:Combitrol Plus B/LEVEL 2(水平2),n=287.线性经张力检测过的全血全血在37℃条件下采用高精密度混合气体进行张力测定。

1.目的:本报告中的研究为了反映酸性罗氏培养基在不同效期内、不同储存条件下和运输条件下的稳定性及有效性。
2.培养基稳定性研究方法的确定依据:2.1酸性罗氏培养基自然(长期)存放效期后的稳定性试验:在酸性罗氏培养基在实际自然贮存条件下(2-8℃)以及室温存放条件下。
2.2 酸性罗氏培养基开封后稳定性研究资料。
2.3 运输过程中,运输条件下在1℃~29℃和30℃以上(添加冰袋)对酸性罗氏培养基的稳定性影响。
3. 培养基稳定性研究的具体方法和过程:选择三个批次的产品,分别在室温、2-8℃的条件下使用结核分枝杆菌标准株(H37Rv)为阳性质控菌株,对产品从外观、无菌检测、生长试验(敏感性检测)、抑制性试验(特异性检测)、批内重复性和批间重复性几个方面进行测试,并且培养基开封后的稳定性进行测试。
模拟运输过程中的在1℃~29℃和30℃以上(添加冰袋)运输条件下对酸性罗氏培养基的稳定性影响。
3.1室温保存1天、2天、3天、4天、5天、6天、7天、8天、9天、10天,11天,12天;3.2 在2-8℃保存30天、60天、90天、120天;3.3 从培养基开封后,在不同时间分别放置0.5小时,1小时,1.5小时,2小时和3小时,分别对其进行无菌检测。
3.4 模拟运输过程中在1℃~29℃和30℃以上(添加冰袋)运输条件下对其稳定性影响。
4.样品选取和试验时间4.1 酸性罗氏培养基选择批号:批号:P2******* 生产日期:20140324批号:P2******* 生产日期:20140428批号:P2******* 生产日期:201405134.2 试验时间:P2*******从2014年3月24日开始时间,P2*******从2014年4月28日开始时间,P2*******从2014年05月13日开始时间。
试验员:徐雪英,详见下列各记录表。
5.试验方法5.2.1外观:采用目视法,在自然光线明亮处目视。
5.2.2 无菌检测:酸性罗氏培养置36±1℃普通培养箱中,48小时,无细菌生长。


性能验证报告单位名称:AAA医院科室名称:检验科实验室:生化组仪器名称:电化学发光免疫分析仪型号规格:cobas E601仪器编号:SH007/SH025验证人员:审核人:批准人:验证日期:2012年6月1日—2012年12月3日目录β人绒毛膜促性腺激素(β-HCG)方法学验证 (1)皮质醇方法学验证 (7)雌二醇(E2)方法学验证 (12)卵泡刺激素(FSH)方法学验证 (17)促黄体生成素(LH)方法学验证 (21)泌乳素(PRL)方法学验证 (26)孕酮(P)方法学验证 (31)睾酮(T)方法学验证 (36)乙型肝炎病毒核心抗体(抗HBc)定量方法学验证 (41)乙型肝炎病毒e抗体(HBeAb)定量方法学验证 (47)乙型肝炎病毒e抗原(HBeAg)定量方法学验证 (53)乙型肝炎病毒表面抗体(抗HBs)定量方法学验证 (59)乙型肝炎病毒表面抗原(HBsAg)定量方法学验证 (66)甲胎蛋白(AFP)方法学验证 (72)糖类抗原CA-125方法学验证 (78)糖类抗原CA-153方法学验证 (84)糖类抗原CA-199方法学验证 (90)癌胚抗原(CEA)方法学验证 (96)游离前列腺特异性抗原(FPSA)方法学验证 (102)总前列腺特异性抗原(TPSA)方法学验证 (108)β人绒毛膜促性腺激素(β-HCG)方法学验证一.检测系统信息:●项目:β-HCG●仪器名称:罗氏电化学发光免疫分析仪●仪器型号: cobas E601●试剂及厂商:罗氏公司校准品和试剂●检测方法:电化学发光二.厂商的相关参数:需验证参数厂商参数验证结果分析灵敏度(lowerdetectionlimit)0.1 mIU /mL 沿用厂商参数分析测量范围(AMR)0.100-10000 mIU/mL 通过实验进行验证临床报告范围(CRR)0.100-1000000 mIU/mL 根据厂家相关参数换算而来参考值区间(Expected values) 0-10mIU/mL 通过实验进行验证1/4卫生部临检中心室间质评最大允许误差,批间精密度<1/3卫生部临检中心室间质评最大允许误差。

罗氏Modular全自动生化分析仪酶指标精密度验证目的判定罗氏Modular全自动生化分析仪检测酶学指标丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)的分析性能。
方法依照美国临床实验室标准化委员会的标准文件CLSI EP5-A2以及其他有关文献的研究方式,验证罗氏Modular全自动生化分析仪对丙氨酸基转移酶以及天门冬氨酸氨基转移酶的精密程度。
结果验证的性能指标与罗氏声明的性能能力相吻合。
结论罗氏Modular生化分析在检测丙氨酸氨基转移酶以及天门冬氨酸氨基转移酶时,性能与质量目标相符合。
标签:丙氨酸氨基转移酶;天门冬氨酸氨基转移酶;分析性能医疗技术不断进步,全自动生化分析仪现已经成为临床生化检验的主要仪器。
仪器的实际性能直接和检验的质量相挂钩。
依照ISO15189《医学实验室质量和能力的专用要求》以及美国病理学会(CAP)的要求,医学实验室在开展任何一项检验项目之前,需要验证各种与性能验证有关指标并保留实验数据[1]。
本文依照有关参考资料,验证了Modular全自动生化分析仪部分项目的检验性能。
下文是罗氏Modular全自动生化分析仪酶动力学方式测量丙氨酸氨基转移酶以及天门冬氨酸氨基转移酶的性能研究报告。
1资料与方法1.1一般资料实验样本来自我院2013年8月住院患者2例,分别标记:1号、2号。
所选样本要求血清新鲜,不存在溶血、黄疸以及脂血情况。
2例标本ALT和AST的检测结果具有一定浓度差,且浓度接近试剂说明书上声明性能指标的浓度。
1.2仪器试剂所用仪器是罗氏Modular D全自动生化分析仪,试剂为罗氏原装的ALT和AST试剂。
1.3方法参照美国临床实验室标准化委员会标准文件的方法,验证2个浓度标本的批内以及批间的精密度。
1.3.1两个浓度水平的样本,每天一批(run),每个样本重复测定三次,重复测定5d。
1.3.2进行室内质控,如果发现质控结果失控,该批的所有数据应弃去不用,重新进行一批实验。

SGS RoHS测试报告模板No. CANEC13 Date: 12 May 2013Page1 of 5Test ReportCo.,LTD.SHANGMEILIN District .ShenzhenThe following sample(s) was/were submitted and identified on behalf of the clients as : SGS Job No :CP13- - GZDate of Sample 09 May 2013Received :09 May 2013 - 12 May 2013Testing Period :Selected test(s) as requested by clientTest Requested :Please refer to next page(s)Test Method :Please refer to next page(s)Test Results :Based on the performed tests on submitted samples, the results of Lead, Conclusion :Mercury, Cadmium, Hexavalent chromium, Polybrominated biphenyls (PBB),Polybrominated diphenyl ethers (PBDE) comply with the limits as set by RoHSDirective 2011/65/EU Annex II; recasting 2002/95/ECSigned for and on behalf ofSGS-CSTC Ltd.MErry LvApproved SignatoryNo. CANEC13 Date: 12 May 2013Page 2 of 5Test Report Test Results :Test Part Description :Specimen No.SGS Sample IDDescription1CAN13- Green fluidRemarks :(1) 1 mg/kg = 1 ppm = 0.0001%(2) MDL = Method Detection Limit(3) ND = Not Detected ( < MDL )(4) "-" = Not RegulatedRoHS Directive 2011/65/EUTest Method :With reference to IEC 62321:2008:(1) Determination of Cadmium by ICP-OES.(2) Determination of Lead by ICP-OES.(3) Determination of Mercury by ICP-OES.(4) Determination of Hexavalent Chromium by Colorimetric Methodusing UV-Vis.(5) Determination of PBBs / PBDEs content by GC-MS.Test Item(s)LimitUnitMDL002Cadmium (Cd)100 mg/kg2 ND Lead (Pb)1,000 mg/kg2 ND Mercury (Hg)1,000 mg/kg2 ND Hexavalent Chromium (CrVI)1,000 mg/kg2 ND Sum of PBBs1,000 mg/kg- ND Monobromobiphenyl- mg/kg5 ND Dibromobiphenyl- mg/kg5 ND Tribromobiphenyl- mg/kg5 ND Tetrabromobiphenyl- mg/kg5 ND Pentabromobiphenyl- mg/kg5 ND Hexabromobiphenyl- mg/kg5 ND Heptabromobiphenyl- mg/kg5 ND - mg/kg5 ND OctabromobiphenylNonabromobiphenyl - mg/kg5 ND Decabromobiphenyl- 5 mg/kgND Sum of PBDEs 1,000 mg/kg- ND Monobromodiphenyl ether- mg/kg5 NDNo. CANEC13 Date: 12 May 2013Page 3 of 5Test Report002Test Item(s)LimitUnitMDL5 ND Dibromodiphenyl ether- mg/kgTribromodiphenyl ether- mg/kg5 ND Tetrabromodiphenyl ether- mg/kg5 ND5 Pentabromodiphenyl ether- mg/kgND5 ND Hexabromodiphenyl ether- mg/kgHeptabromodiphenyl ether- mg/kg5 ND Octabromodiphenyl ether- mg/kg5 ND Nonabromodiphenyl ether- mg/kg5 ND Decabromodiphenyl ether- mg/kg5 NDNotes :(1) The maximum permissible limit is quoted from the directive2011/65/EU, Annex IINote: the results shown for the content of total weight in wet sample. .No. CANEC13 Date: 12 May 2013Page 4 of 5Test ReportATTACHMENTSRoHS Testing Flow Chart1) Name of the person who made testing,Michael Tso / Cutey Yu / Dayi Zhan 2) Name of the person in charge of testing,Adams Yu / Yolanda Wei3) These samples were dissolved totally by pre -conditioning method according to below flow chart(Cr6+ and PBBs/PBDEs test method excluded).Sample PreparationNo. CANEC13 Date: 12 May 2013Page 5 of 5Test Report Sample photo:CANEC13CAN13-SGS authenticate the photo on original report only *** End of Report ***。
罗氏COBAS6000全自动电化学发光免疫分析仪性能验证谭晓辉;王勇【摘要】目的按ISO15189要求对罗氏COBAS 6000全自动电化学发光免疫分析仪的性能进行验证. 方法对甲胎蛋白(alpha-fetoprotein,AFP)的精密度、准确度、临床可报告范围(clinical reportable range,CRR)、分析测量范围(analytical measurement range,AMR)、参考区间进行验证实验. 结果批内精密度变异系数(coefficient variation,CV)高低值分别为3.28%和3.46%;日间精密度CV高低值分别为4.39%和5.13%,均小于厂家提供的CV(10%).相对偏差为0.862%,小于5%.分析测量范围为0.80-1 200 ng/ml,参考区间为0-20.00 ng/ml,临床可报告范围为0-60 000 ng/ml. 结论罗氏COBAS 6000全自动电化学发光免疫分析仪的性能与厂家提供的资料基本一致,故可用其进行临床标本的检验工作,所得结果具有可信性.%Objeaive To test and verify the system performance of Roche COBAS 6000 automatic electrochemiluminescence immunoassay analyzer according to the requirements of IS015189. Methods Verification experiments were taken to measure the precision.accuracy , clinical reportable range( CRR) , analytical measurement range ( AMR ) , reference interval of alpha-feloprotein ( AFP) . Re-sults The high and low values of coefficient variation( CV) of inter-assay were 3. 28% and 3. 46% , and those of between-day precision were 4. 39% and 5. 13% , which were all less than the CV provided by the manufacturer( 1O% ) . Relative bias was 0. 862% . Analytical measurement range was 0.80 - 1 200 ng/ml.the reference interval was O - 20. 00 ng/ml, and the clinical reportable range was O 60 000 ng/ml. Conclusion The basicperformances of Roche COBAS6000 automatic electrochemiluminescence immunoassay analyzer are consistent wich the data provided by the manufacturer,so it can be used to inspect the clinical samples and the results are credible.【期刊名称】《山西医科大学学报》【年(卷),期】2011(042)001【总页数】4页(P52-55)【关键词】罗氏COBAS 6000全自动电化学发光免疫分析仪;甲胎蛋白;性能验证【作者】谭晓辉;王勇【作者单位】南方医科大学法医系,广州,510515;重庆市公安局刑警总队技术处【正文语种】中文【中图分类】R318.6罗氏COBAS6000全自动电化学发光免疫分析仪(以下简称6000)是国内医疗检验的大型主力检测系统,它是当今肿瘤标志物检测灵敏度最高的仪器,其出色的检测性能得到国内外实验室的一致认同。
罗氏自动化学发光仪测促甲状腺激素性能验证叶斌华;胡杰群;周晓;刘少正【摘要】目的:通过检测促甲状腺激素(TSH)对罗氏Cobas e602全自动化学发光仪测定进行性能验证及评价。
方法参考ISO15189:2007《医学实验室质量和能力认可准则》及相关文献,同时根据自身实际条件对本仪器的稳定性、精密度、正确度、线性相关进行检测,完成性能验证及评价。
结果本仪器稳定性4h相对偏倚为5%,8h相对偏倚-3%,测试的结果应小于厂家允许误差(厂家允许误差+10%),批内精密度及批间精密度符合厂家提供的要求。
正确度验证结果所测的校准品结果与“靶值”偏差范围为-3.0-3.9%,明显小于厂家提供的范围。
TSH在0.06-99之间线性良好,r=0.998。
结论罗氏Cobas e602稳定性、精密度、正确度、线性范围结果均符合厂家要求,验证结果全部通过。
【期刊名称】《江西医药》【年(卷),期】2016(000)002【总页数】3页(P180-182)【关键词】电化学发光免疫分析仪;促甲状腺激素;性能验证【作者】叶斌华;胡杰群;周晓;刘少正【作者单位】南昌大学第一附属医院核医学科,南昌 330006;江西省南昌市第三医院核医学科,南昌 330009;南昌大学第一附属医院核医学科,南昌 330006;南昌大学第一附属医院核医学科,南昌 330006【正文语种】中文【中图分类】R446.1甲状腺疾病是临床常见的一种疾病,根据保守估计,目前我国有超过2亿甲状腺疾病患者,据中华医学会内分泌学会《社区居民甲状腺疾病流行病学调查》显示,我国甲亢患病率为1.3%,甲减患病率6.5%。
在中国十城市社区居民甲状腺疾病流行病学调查显示,在使用灵敏度并非最高的手提便携式B超筛查,居民甲状腺结节患病率高达12.8%。
但是与高发病率形成鲜明反差的是,甲状腺疾病患者知晓率、就诊率和治疗率皆低的现状。
而促甲状腺激素(TSH)是早期实验室诊断最重要的指标,对甲状腺疾病的诊断、治疗和预防控制起着重要作用。
****医院南院检验科血气分析仪性能校准报告仪器型号: Cobas b 221仪器序列号: ****制造商: 罗氏公司鉴定结论: 合格鉴定人: *** 日期:20**年08月31日鉴定单位: *******生物科技有限公司罗氏Cobas b 221血气分析仪性能鉴定报告1.仪器工作环境:环境温度:15-31 ℃是否符合要求:②不符合环境气压:536-797 mmHg(-100~2500米) 是否符合要求:②不符合相对湿度:20-95%(无冷凝)是否符合要求:②不符合2.仪器的工作电源:100-240VAC(±10%), 50-60Hz(±5%)是否符合要求:②不符合3.各部件状况检测电极检查是否正常:②不正常温度检查是否正常:②不正常大气压检查是否正常:②不正常泵,阀工作是否正常:②不正常液体传感器工作是否正常:②不正常模块工作是否正常:②不正常打印机工作是否正常:②不正常PC显示屏工作是否正常:②不正常4.仪器的设置及维护仪器外观是否清洁:②否系统的时间设置是否正确:②否电极是否更换:②否试剂是否更换:②否进样口是否干净:②否5. 性能数据测定参数----------------------------------------------------------------------------------------------------------------------------B 全血Q 水状指控品(a)含水溶液(a)具有相似的生理离子基体和缓冲容量6. 精确性,重现性在Cobas b 221 POC system 上连续7天,每天运行两次,每次测量两次,由此得到的“重现性(S R)”和“设备内精密度(S I)”数据。
对于具有代表性或已经测定的S R和S I,其对应的测定值即为均值。
材料:Combitrol Plus B/LEVEL 1(水平1),n=28材料:Combitrol Plus B/LEVEL 2(水平2),n=287.线性经张力检测过的全血全血在37℃条件下采用高精密度混合气体进行张力测定。
电化学发光免疫检验项目性能验证报告
一、检测系统
我院检验科生化室共申请认可的电化学发光检验项目27项,各项目的检测系统配对情况如表1。
故各分析性能的验证均按其配对情况进行。
表1 生化检验项目检测系统配对情况
二、范围:
2.1 精密度(包括批内及日间精密度)。
2.2 准确度
2.3线性范围验证:
2.4 稀释度(可报告范围)
2.5 生物参考区间的验证
三方法
1、精密度评估
1.1 批内精密度;
仪器:瑞士ROCHE公司MODULAR E170全自动电化学发光免疫分析仪材料:ROCHE正常肿瘤质控(批号),ROCHE病理肿瘤质控(批号);ROCHE 正常通用质控(批号),ROCHE病理通用质控(批号);ROCHE正常杂项质控(批号),ROCHE病理杂项质控(批号)。
评估步骤:在确定ROCHE MODULAR E170性能正常的情况下,重复测定20次上述各质控品,计算出各项目的均值、标准差和变异系数。
变异系数即代表精密度。
统计方法:用EXCEL来分析计算均数、标准差和变异系数。
评价方法:根据CLIA'88要求,批内精密度应≤1/4TEa,总精密度应≤1/3TEa,若CLIA'88中未做出规定,则依据中国卫生部临床检验中心室间质评要求执行或验证试剂说明书声明的精密度数据。
结论:
1. 2 批间精密度;
仪器:瑞士ROCHE公司MODULAR E170全自动电化学发光免疫分析仪材料:ROCHE正常肿瘤质控(批号),ROCHE病理肿瘤质控(批号);ROCHE 正常通用质控(批号),ROCHE病理通用质控(批号);ROCHE正常杂项质控(批号),ROCHE病理杂项质控(批号)。
评估步骤:在确定ROCHE MODULAR E170性能正常的情况下,在5个工作日,测定2批,每次测定2次上述质控,计算出均值,标准差和变异系数。
变异系数即代表精密度。
统计方法:用EXCEL来分析计算均数、标准差和变异系数。
评价方法:根据CLIA'88要求,批内精密度应≤1/4TEa,总精密度应≤1/3TEa,若CLIA'88中未做出规定,则依据中国卫生部临床检验中心室间质评要求执行或验证试剂说明书声明的精密度数据。
结论
2、正确度评估
仪器:瑞士ROCHE公司MODULAR E170全自动电化学发光免疫分析仪试剂:卫生部临床检验中心2012年全国肿瘤标志物测定室间质评质控物(批号),2013年卫生部内分泌测定室间质评质控物(批号)作为正确度评估的标本。
评估步骤:根据卫生部临床检验中心2013年室间质评回报结果,挑选以上质控物中相对高值及相对低值质控品进行检测,每个质控品测定3次,计算出均值,标准差和变异系数。
评价方法:将上述测定结果与卫生部临检中心回馈的质评报告中相应的“靶
值”和可接受限进行比对。
计算上报的数据和设定的靶值的回收率,Bias小于
1/2TEa则认为该项目正确度符合要求。
结论:
3、线性范围验证:
仪器:瑞士ROCHE公司MODULAR E170全自动电化学发光免疫分析仪试剂:收集所有参加性能验证项目的低值及高值血清标本,高值标本越接近厂家声明的最高值最佳,低值越接近厂家声明的最低值最佳。
评估步骤:选取上述低值及高值血清标本,按如下方式稀释低值血清;5L、1H:4L、2H:3L、3H:2L、4H:1L、5H。
连续测定两次上述血清后取均值,做回归统计。
评价方法:依据EP6-A采取平均斜率方法来确定系列稀释样品含有的待测物的预期值(X),所有样品重复测定的均值为实测值(Y),将所有结果数据绘制于X-Y坐标图中。
计算回归方程:Y=bx+a , 斜率b在0.97-1.03并且r2 ≥0.95 , a 与0做t检验判断是否有差异性, 所有数据在范围内则认为线性通过验证。
结论:
4、稀释度(可报告范围)评价
仪器:瑞士ROCHE公司MODULAR E170全自动电化学发光免疫分析仪试剂:实验室收集PRL、Beta-HCG、AFP、CEA、CA153、CA199、CA125、TPSA、FERR项目的接近检测线性上限的高值血清样本。
ROCHE提供的样品稀释液。
评估步骤:使用试剂厂商提供的稀释液, 按照厂商提供的可稀释倍数来稀释,按下表做3个系列稀释倍数最大稀释倍数为厂商推荐稀释倍数,重复3次检测。
评价方法:将检测值与预计值比较, 以美国CLIA'88能力验证计划的分析质量要求为标准判定结果是否可接受,如果在可接受范围内,证明验证了该稀释倍数可靠,验证通过。
a.如稀释后检测均值回收率在80%≤R≤120%,之间,则该稀释度通过验证。
b.检测值和预期值的偏差,以1/4 CLIA’88总允许误差范围为判断限。
符合该条件的最大稀释度为该项目的最大稀释倍数.
结论:
5、生物参考区间的验证
仪器:瑞士ROCHE公司MODULAR E170全自动电化学发光免疫分析仪。
试剂:针对参加性能验证项目相应的参考区间人员分类标准选择体检合格的健康人标本,每个分类选取20份。
评估步骤:在检测系统上对上述标本进行测定,对结果进行统计并对仪器说明书提供的参考区间进行验证。
评价方法:若20份标本的检测结果均在试剂说明书提供或实验室建立的参考区间内或仅有2个标本超出,则验证通过。
否则,需进行参考区间确立实验。
结论:
三、性能验证结果
检验科生化室27项电化学发光检验项目各检测系统的性能验证结果如下表:表2 MODULAR E170检验系统各检测项目的精密度验证结果
表3 MODULAR E170检验系统各检测项目的准确度评估结果
表6 MODULAR E170检验系统各检测项目生物参考区间验证结果
四、结论:
罗氏MODULAR E170全自动电化学发光免疫分析仪检测系统的精密度、准确度、线性范围、稀释度验证实验均符合要求,生物参考区间通过验证。
通过以上各项性能验证实验的结论,罗氏MODULAR E170全自动电化学发光免疫分析仪检测系统达到检测要求,保证检测结果准确可靠,可以满足临床需求。