摩尔质量及其练习
- 格式:doc
- 大小:43.50 KB
- 文档页数:3

摩尔质量练习题集团文件版本号:(M928-T898-M248-WU2669-I2896-DQ586-M1988)摩尔质量练习题知识回顾摩尔质量(1)定义: ,符号。
(2)单位: 。
(3)物质的量(n),质量(m)和摩尔质量(M)之间的关系:。
随堂练习一、判断1.氧气的摩尔质量是32 g ( )2.氧气的摩尔质量等于氧气的相对分子质量 ( )3.1 mol氧气的质量就是氧气的摩尔质量 ( )的质量是1 g ( )4.1 mol H25.1 mol HCl的质量是36.5 g/mol ( )的摩尔质量等于它的相对分子质量 ( )6.Cl27.硫酸根离子的摩尔质量是96 g/mol ( )+所含质子数为10NA?( )8、18g?NH49.10g氖气所含原子数约为6.02×1023( )10.2.4g金属镁变为镁离子时失去的电子数为0.2NA ( )二、选择题1、下列关于摩尔质量的说法正确的是?( )A 、氯气的摩尔质量是71克?B 、氯化氢的摩尔质量为36.5g/moLC 、1摩氢气的质量为1克D 、O2的摩尔质量为16g/moL 。
2、下列说法正确的是:()①1molO 2的质量是32g ·mol -1; ②H 2的摩尔质量是2g ;③1molH +的质量是1g ;④对于原子而言,摩尔质量就是相对原子质量?A 、①②③B 、③④C 、③D 、②④3、下列叙述中错误的是()A .H 2SO 4的摩尔质量是98B .2molNO 和2molNO 2含原子数相同C .等质量的O 2和O 3中所含氧原子个数相同?D .等物质的量的CO 和CO 2中所含碳原子数相等4、0.1molNa 2CO 3中含有()A .0.1molNa +B .0.05molCO 32-C .6.02×1023个OD .0.1molC5.某气体物质质量为6.4?g ,含有6.02×1022个分子,则该气体的相对分子质量为()A.64B.32C.96D .326.甲烷(CH 4)与氧气(O 2)以物质的量之比1:2混合时极易爆炸,关于该混合气体下列叙述正确的是()A.分子数之比为1:1B.原子数之比为5:4C.质量之比为1:1D.摩尔质量之比为1:47.下列说法中不正确的是()A.1molO的质量是16gB.Na+的摩尔质量是23g·mol-1C.NH3的摩尔质量是17?g·mol-1D.氢的摩尔质量是2?g·mol-18、下列摩尔质量的说法正确的是?()A.物质的摩尔质量就是1mol物质的质量B.1mol水的质量、水的摩尔质量和水的相对分子质量在数值上都是18C.各种物质的摩尔质量不可能相同?D.与物质的质量、物质的量多少无关,但与相对分子质量一样都是物质的基本属性?9、已知1.5mol某气体的质量是48g,这种气体可能是?()A.CO2?B.SO2C.O2D.NO三、填空1、硫酸的摩尔质量是________,24.5 g硫酸的物质的量是________,氧原子的物质的量是________。

高中化学《摩尔质量》练习题(含答案解析)学校:___________姓名:___________班级:_______________一、单选题1.5.4gM和16.0gN恰好完全反应,生成0.2molX和10.2gY,则X的摩尔质量为()A.28g•mol-1 B.56g•mol-1C.84g•mol-1 D.112g•mol-12.我市南山被称为“天然氧吧”,其原因是空气中的自由电子附着在分子或原子上形成空气负离子,被称为“空气维生素”,O-就是一种空气负离子,其摩尔质量为()2A.16g B.32g C.16g/mol D.32g/mol3.摩尔质量的单位是()A.mol/g B.g/mol C.mol/L D.L/mol4.下列说法正确的是()A.硫酸的摩尔质量是98 g B.1mol O2的质量是32 gC.2 g氢气所含原子数目为1 mol D.标准状况下,11.2 LCH4含有10 mol电子5.铯是制造光电管的主要材料,铯元素的部分信息如图所示。
下列关于铯的说法中,不正确...的是()A.原子序数为 55 B.是ⅠA 族元素C.相对原子质量是 132.9 g·mol-1D.金属性比钠强6.下列说法正确的是()A.摩尔是物质数量的单位B.氢气的摩尔质量是2gC.1molOH-的质量是17g D.阿伏伽德罗常数就是6.02×10237.下列叙述正确的是()A.1 mol H2O的质量为18g/molB.CH4的摩尔质量为16gC.H2的摩尔质量与N A个氢气分子的质量在数值上相等D.CO2的摩尔质量等于它的相对分子质量8.下列叙述正确的是()A .NaOH 的摩尔质量是40.0gB .标准状况下,6.02×1022个CO 2所占的体积约是22.4LC .0.5mol CO 2中所含的CO 2分子数为3.01×1023D .在1L 水中溶解5.85gNaCl 固体,即可配制得0.1mol/L 的NaCl 溶液9.同温同压下体积均为V L 的a 、b 集气瓶中装有不同的气体(如图),瓶内气体的摩尔质量大小关系为 ( )A .a 大B .b 大C .一样大D .无法比较10.偏二甲肼(C 2H 8N 2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力。


物质的量及其单位、摩尔质量练习题一.选择题1.下列说法正确的是()A.摩尔是一种国际基本物理量B.1 molH的质量为1gC.6.02×1023称为阿伏加德罗常数D.物质的量是用0.012千克碳中所含的原子数目作为标准来衡量其他微粒集体2.下列名词中,不属于物理量的是()A.长度B.时间C.物质的量D.摩尔3.下列说法中正确的是()A.摩尔既是物质的量的单位又是物质的质量单位B.物质的量既表示物质的数量又表示物质的质量C.阿伏加德罗常数是12kg碳12中含有的碳原子数目D.1molH2O中含有10mol电子4.下列叙述中不正确的是()A.2mol铁原子B.1molFe3+C.0.5mol氧D.0.5mol氮分子5.下列说法正确的是()A.物质的量是七个基本物理量之一B.阿伏加德罗常数是没有单位的C.1mol氮气的体积是22.4LD.1mol H2O含有1个水分子6.下列说法正确的是()A.摩尔是物质的数量单位B.氢气的摩尔质量是2gC.1mol OH﹣的质量是17gD.NaCl的摩尔质量是58.5g7.下列说法不正确的是()A.磷酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等B.6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14:1C.32 g氧气所含的原子数目为2×6.02×1023D.相同质量的O2与O3,含有相同的分子数8.下列正确的是()A.1molOH﹣的质量是17B.二氧化碳的摩尔质量是44gC.铁原子的摩尔质量等于它的相对原子质量D.一个钠原子的质量约等于9.下列说法中正确的是()A.硫酸的摩尔质量是98gB.2mol OH﹣的质量是34gC.铁原子的摩尔质量等于它的相对原子质量D.1mol N2的质量是14g10.下列说法正确的是()A.摩尔是物质的质量单位B.H2的摩尔质量是2gC.1molH2O的质量是18g D.1mol氧的体积是22.4L11.下列说法中,不正确的是( )A.1 mol任何物质都含有6.02×1023个原子B.0.012 kg 12C约含有6.02×1023个碳原子C.阿伏加德罗常数表示的粒子“集体”就是1 molD.使用摩尔这一单位时必须指明粒子的种类12.下列关于摩尔质量叙述中,正确的是( )A.1 mol CO的质量是28 g·mol-1B.硫酸根离子的摩尔质量是98 gC.Cl2的摩尔质量是71 g·mol-1D.NaCl的相对分子质量是58.5 g·mol-113.下列说法中,不正确的是( )A.硫酸的摩尔质量与6.02×1023个硫酸分子的质量在数值上相等B.6.02×1023个N2和6.02×1023个O2的质量比等于7∶8 C.3.2 g O2所含的原子数目约为0.2×6.02×1023D.常温、常压下,0.5×6.02×1023个二氧化碳分子质量是44 g 14.下列物质中所含分子物质的量最多的是()A.44 g CO2B.1.5 mol H2C.64 g SO2D.3.01×1023个硫酸分子15.铅笔芯的主要成分是石墨。

化学计算练习题摩尔质量计算化学计算练习题:摩尔质量计算在化学中,摩尔质量是物质中每一摩尔的质量,常用单位为克/摩尔(g/mol)。
摩尔质量的计算是化学计算中的重要内容之一,它可以帮助我们理解和分析物质的性质以及化学反应的发生。
一、摩尔质量的定义和计算公式摩尔质量的定义是指物质的质量与其摩尔数之间的比值。
摩尔质量计算公式如下:摩尔质量(g/mol)= 物质的质量(g)/ 物质的摩尔数(mol)在计算摩尔质量时,我们需要知道物质的质量并且能够根据化学式计算出物质的摩尔数。
下面通过一些练习题来进一步理解和应用摩尔质量的计算方法。
二、练习题1. 求乙醇(C2H5OH)的摩尔质量。
根据乙醇的化学式,我们可以得知乙醇由2个碳原子、6个氢原子和1个氧原子组成。
根据元素的摩尔质量,我们可以得到碳的摩尔质量为12.01 g/mol,氢的摩尔质量为1.008 g/mol,氧的摩尔质量为16.00 g/mol。
因此,乙醇的摩尔质量可以通过以下计算得到:乙醇的摩尔质量 = 2个碳原子的摩尔质量 + 6个氢原子的摩尔质量+ 1个氧原子的摩尔质量= (2 × 12.01 g/mol)+(6 × 1.008 g/mol)+(1 × 16.00 g/mol)= 46.07 g/mol因此,乙醇的摩尔质量为46.07 g/mol。
2. 求NaCl的摩尔质量。
NaCl是氯化钠的化学式,由一个钠离子和一个氯离子组成。
钠的摩尔质量为22.99 g/mol,氯的摩尔质量为35.45 g/mol。
根据这些信息,我们可以计算得到NaCl的摩尔质量:NaCl的摩尔质量 = 钠的摩尔质量 + 氯的摩尔质量= 22.99 g/mol + 35.45 g/mol= 58.44 g/mol因此,NaCl的摩尔质量为58.44 g/mol。
3. 求硫酸铜(CuSO4)的摩尔质量。
硫酸铜由1个铜离子、1个硫酸根离子(SO4)和4个氧原子组成。

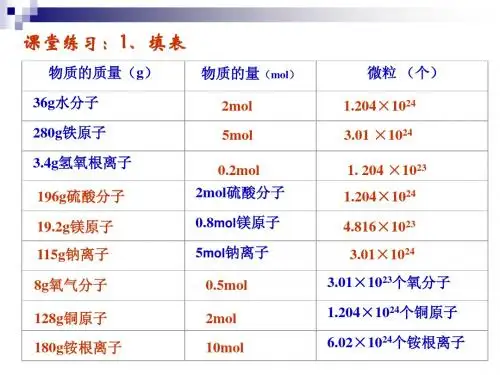
专题七摩尔质量[课堂练习1]写出下列粒子的摩尔质量。
CuN2NaClH2OOH-SO42-NH4+课堂练习2]4.9克H2SO4的物质的量是多少?[[[1.1:2.2:3.3(1)(2)(3(4MCl2的为________。
[强化练习1]1、0.2?mol?Al2(SO4)3中含有Al3+?mol、SO42-g。
2、8g氧气为?mol;?0.1mol氧气共有? mol电子。
3、已知铁的相对原子质量是56,则1个铁原子的质量是g。
4、在60g碳中,所有碳原子的最外层电子数共为个,质子的总数为个。
5、某硫酸钠溶液中含有3.01×1022个Na+,则该溶液中SO42-的物质的量是,该溶液中Na2SO4的质量为克。
6、与16g氧气所含有分子数相同的氨气是 g,与16g氧气所含原子总数相同的氨气是 g。
7、483gNa2SO4·10H2O中所含的Na+、SO42-的物质的量各是多少?所含水分子数目是多少?1.下列说法正确的是:()①-1+1g;3:25.如果2g甲烷含有x个分子,那么22gCO2中所含分子数是()A.xB.4xC.0.5xD.3x6.1gO2和1gO3中()A.所含分子数相同B.所含分子数不同C.所含原子数相同D.1gO3中所含分子数较多7.0.2gH2、2.4gC、19.6gH2SO4、19.5gZn,它们之间的物质的量之比依次为()A.2:1:2:3B.1:2:2:3C.2:1:1:3D.3:1:2:28.下列物质中质量最大的是(),分子数最多的是()A.64gSO2B.3.01×1023个N2分子C.0.75molH2SO4D.4o C时,9mlH2ON AN A,则R 2x的相对原子质量是,x值为。
14.4.5g水与g硫酸所含的分子数相等,它们所含氧原子数之比是,氢原子数之比是。
15.0.3mol氨气和0.4mol二氧化碳的质量___________(填“相等”或“不相等”,下同),所含分子数______________,所含原子数____________。


九年级化学摩尔质量专项练习摩尔质量是指物质的摩尔质量与摩尔质量单位的比值,通常以克/摩尔(g/mol)表示。
摩尔质量的计算可以通过相对原子质量或相对分子质量进行。
下面是一些九年级化学摩尔质量的专项练题。
是指物质的摩尔质量与摩尔质量单位的比值,通常以克/摩尔(g/mol)表示。
摩尔质量的计算可以通过相对原子质量或相对分子质量进行。
下面是一些九年级化学摩尔质量的专项练习题。
1. 问题:氧气(O<sub>2</sub>)的摩尔质量是多少?问题:氧气(O<sub>2</sub>)的摩尔质量是多少?回答:两个氧原子的摩尔质量为32g/mol,因此氧气的摩尔质量为64g/mol。
:两个氧原子的摩尔质量为32g/mol,因此氧气的摩尔质量为64g/mol。
2. 问题:硫酸(H<sub>2</sub>SO<sub>4</sub>)的摩尔质量是多少?问题:硫酸(H<sub>2</sub>SO<sub>4</sub>)的摩尔质量是多少?回答:根据各元素相对原子质量,氢的摩尔质量为1g/mol,硫的摩尔质量为32g/mol,氧的摩尔质量为16g/mol。
因此硫酸的摩尔质量为1 * 2 + 32 + 16 * 4 = 98g/mol。
:根据各元素相对原子质量,氢的摩尔质量为1g/mol,硫的摩尔质量为32g/mol,氧的摩尔质量为16g/mol。
因此硫酸的摩尔质量为1 * 2 + 32 + 16 * 4 =98g/mol。
3. 问题:CO<sub>2</sub>的摩尔质量是多少?问题:CO<sub>2</sub>的摩尔质量是多少?回答:一个碳原子的摩尔质量为12g/mol,两个氧原子的摩尔质量为32g/mol。
因此CO<sub>2</sub>的摩尔质量为12 + 2 * 16 = 44g/mol。

摩尔质量基础练习题篇一:摩尔与摩尔质量练习诺贝尔教育高中化学摩尔与摩尔质量练习一、选择题(每小题有1个或2个选项符合题意)1.(浙江湖州菱湖中学2021-2021学年度高一月考,5)下列对于“摩尔”的理解正确的是( )A.摩尔是国际科学界建议采用的一种物理量B.摩尔是物质的量的单位,简称摩,符号为molC.摩尔可以把物质的宏观数量与微观粒子的数量联系起来【解析】摩尔是物质的量的单位,故A、C错,B对;D目应是NA,而不应该是1mol,因摩是物质的量的单位。
【答案】 B2.(河南内乡高中2021-2021学年度高一月考,( )A.摩尔是七个基本物理量之一B.1mol氢C.摩尔是表示物质的数量单位D【解析】明微粒的种类。
【答案】 D3.(18)下列叙述错误的是( )A.1mol个原子B.C含有约23个碳原子C1个分子中可能含有多个原子,故A错误。
【答案】 A4.(河北存瑞中学2021-2021学年度高一段考,6)0.5mol Na2SO4中所含的Na离子数为( )A.3.01×1023++B.6.02×1023 D.1 -【解析】 N(Na)=2×0.5mol×6.02×1023mol1=6.02×1023。
【答案】 B诺贝尔教育高中化学5.(河南实验中学2021-2021学年度高一月考,12)现有CO、CO2、O3(臭氧)三种气体,它们分别都含有1mol氧原子,则三种气体的物质的量之比为( ) A.1∶1∶1C.3∶2∶1 B.1∶2∶3 D.6∶3∶2【解析】n(CO) ∶n(CO2) ∶n(O3)=1∶1/2∶1/3=6∶3∶2【答案】 D6.(安徽涡阳四中2021-2021学年度高一月考,10)在0.8g某一物质中含有3.01×1022)A=aNAg·mol1,则W g该原子的物质的量是W/(aNA)mol,故A、C项错误,B项正确。

物质的量计算H – 1 C -12 N-14 O-16 Cu-64 S-64 Na-23 Cl -35.5 Al-27 Fe -56 K-39 P-31物质的量练习题判断正误1 、1mol任何微粒均含有6.02×1023个微粒..2 、摩尔是国际七个基本物理量之一..3 、N A个O原子的物质的量为1mol..4 、6.02×1023个任何微粒的量均为1mol..5 、任何物质;如果它所含微粒数与12g 12C所含的碳原子数相同;我们就说它的物质的量为1mol..6 、1mol氢含有6.02×1023个氢..课堂练习1mol O 含有个O;1mol H2O 含有个H2O;1mol H+含有个H+;1mole-含有个e-;6.02×1023个12C的物质的量为mol;6.02×1023个CO的物质的量为mol;6.02×1023个OH-的物质的量为mol..思考:在0.5molO2中含有_____氧分子在0.5molO2中含有_____氧原子;含有的氧原子的物质的量为_____mol练习⑴0.5mol Na2SO4含有molNa+; molSO42-;含个O..⑵3.01×1023个氢分子含mol H、含有个质子、mol e-..⑶mol NH3;含有1.204×1024个N摩尔质量练习题1.0.4molNaCl的质量为g..2.64g氧气的物质的量为mol..3. 2.5molCu2+的质量为g..4.31g NO3-的物质的量为mol..5.2molCO2中含氧元素的质量为g..6.g Na2SO4中含有0.5mol SO42-..7. 1.5 mol SO2与g SO3含有相同质量的氧元素..8.0.04 mol某物质的质量为7.2g;则该物质的摩尔质量;其相对分子质量为..1. 11.5g NO2中含有个NO2分子; mol N; 质子; g氧元素..2.下列物质中含原子总数最多的是A. 0.5mol NH3B. 9.03×1023个HCl分子C. 9.6gCH4D. 18.4gC2H5OH一、单项选择题1.“物质的量”是指A.物质的质量与微观粒子数B.物质的微观粒子数C.物质的质量D.能把物质的宏观量如质量、体积等同微观粒子联系起来的一个基本物理量2.下列说法中不正确地是A.1摩尔氧分子B.3 molH2SO4C.1 molH D.2 mol面粉3.在1 molH2O中错误的是A.含2molH B.含1molOC.约含6.02×1023个水分子D.约含3.01×1023个氧原子4.下列说法不正确的是A.液态水的摩尔质量为18 g/mol B.水蒸气的摩尔质量为18g/mol C.Mg的摩尔质量为24g/mol D.Na的摩尔质量为23mol5.设N A表示阿伏加德罗常数的值;下列说法中正确的是A.2.4gMg变成镁离子时失去的电子数为0.1N AB.0.5molAl与足量的盐酸反应时转移电子数为1.5N AC.17gNH3含有N A电子D.2g氢气所含原子数目为N A 6.下列说法中不正确的是A.1 mol O的质量是16g B.Na+的摩尔质量是23 g·mol-1 C.NH3的摩尔质量是17 g·mol-1D.氢的摩尔质量是2 g·mol-1 7.下列关于摩尔的说法中;正确的是A.摩尔是物理量;含6.02×1023个粒子B.摩尔是物质质量的单位C.它仅运用于分子、原子D.摩尔是物质的量的单位;符号mol 8.相同质量的下列气体中;所含原子数目最多的是A.CH4B.N2 C.CO D.O2 9.下列摩尔质量的说法正确的是A.物质的摩尔质量就是1 mol物质的质量B.1 mol水的质量、水的摩尔质量和水的相对分子质量在数值上都是18 C.各种物质的摩尔质量不可能相同D.与物质的质量、物质的量多少无关;但与相对分子质量一样都是物质的基本属性10.已知1.5mol某气体的质量是48g;这种气体可能是A.CO2B.SO2C.O2D.NO 11.已知溶液中nNa+=2mol;nMg2+=2.5mol;nCl-=3mol如果溶液中还有SO42-;那么nSO42-应为A.1mol B.1.5mol C.2mol D.5mol 12.分析下列叙述正确的是A.摩尔是物质的量的单位;1mol任何物质都含有6.02×1023个分子B.1molH2的质量为2g;它含有阿伏加德罗常数个氢分子C.氧气的摩尔质量为32g;氧气的分子量也为32gD.12g碳-12所含碳原子数是阿伏加德罗常数;每摩尔物质含有阿伏加德罗常数个微粒13.0.3mol CuCl2中所含Cl-的物质的量有与多少摩尔AlCl3中所含氯离子相等A.0.2 B.0.3 C. 0.4 D.0.5二、填空题14.1 mol N2的质量是_______;Al2O3摩尔质量是_______;Fe相对原子质量是_______15.写出下列符号的意义①2 mol H②nH2O=2 mol③MCaCO3=100 g·mol-116.分别有NaCl、MgCl2、AlCl3三种溶液;已知它们所含氯离子的物质的量相等..则nNaCl:nMgCl2:nAlCl3=______________________..17.71 g Na2SO4中含有nNa+= ______;nSO42-= _____;nO= ______ 18.计算下列物质的摩尔质量NH4NO3;FeCl2;CaCO3 ;CuSO4 ___ ___ KAlSO42 ___ ___;ZnCl2;NO3-;PO43-三、计算题19.19.6g H2SO4中氧元素的质量请通过氧原子的物质的量来进行计算22.有48克氧气和48克臭氧O3求1分别求出它们所含分子的物质的量及物质的量之比2求它们所含氧原子的物质的量及物质的量之比23.有3molSO2和2molSO31求它们所含分子数之比2求它们的质量之比3求它们所含硫原子的质量之比答案:1√2√3√4×5√6×课堂学习:6.02×1023 6.02×1023 6.02×1023 6.02×1023思考:3.01×1023 6.02×1023 1练习:11 ;0.5; 2 21 6.02×1023 6.02×1023 32摩尔质量练习(1)23.4 22 3160 462 588 671 7808180 g/mol 1801、 1.505×1023 0.25 4.5152、 D单选1 D2 D3 D4 D5 D6 C7 B8 A9 B 10 C 11电荷守恒题 12B 13A二填空14 28 g 102g/mol 5615 2mol 氢原子 H 2O 的物质的量为2mol. CaCO 3的摩尔质量是100 g/mol 16 6:3:217 1 mol 0.5 mol 2 mol18 80 127 100 160 258 136 62 9519 ()2419.60.298/g n H SO mol g mol== 又因为每个H 2SO 4中含有4个氧原子;()()244n H SO n O =()()()16/0.812.8m O M O n O g mol mol g =⨯=⨯=22分子:()()222()484832/32m O g n O mol M O g mol === 氧原子23 1122()()33A A A N SO n SO N mol N mol N -=•=⨯= 即222333()()()3()()()2A A N SO n SO N n SO N SO n SO N n SO •===•222332()()()64/36()()()80/25m SO n SO M SO g mol mol m SO n SO M SO g mol mol •⨯===•⨯。
化学物质的摩尔质量练习题计算化学物质的摩尔质量化学物质的摩尔质量是指物质的摩尔质量,也称为摩尔质量或相对分子质量。
它是化学计算中的一个重要概念,用于衡量物质中分子或离子的质量。
本文将通过一些练习题来计算化学物质的摩尔质量。
练习题一:氢氧化钠(NaOH)的摩尔质量氢氧化钠是一种常见的化学物质,在工业生产和实验室中广泛应用。
我们可以通过下面的步骤来计算氢氧化钠的摩尔质量:步骤一:找到化学式中各元素的相对原子质量氢的相对原子质量为1,氧的相对原子质量为16,钠的相对原子质量为23。
步骤二:计算摩尔质量根据化学式,氢氧化钠的化学式为NaOH,其中含有一个钠原子(相对原子质量为23),一个氧原子(相对原子质量为16)和一个氢原子(相对原子质量为1)。
因此,氢氧化钠的摩尔质量为23+16+1=40克/摩尔。
练习题二:二氧化碳(CO2)的摩尔质量二氧化碳是一种常见的气体,存在于大气中,也是燃烧和呼吸等过程的产物。
下面是计算二氧化碳摩尔质量的步骤:步骤一:找到化学式中各元素的相对原子质量步骤二:计算摩尔质量根据化学式,二氧化碳的化学式为CO2,其中含有一个碳原子(相对原子质量为12)和两个氧原子(相对原子质量为16)。
因此,二氧化碳的摩尔质量为12+16*2=44克/摩尔。
练习题三:硫酸(H2SO4)的摩尔质量硫酸是一种强酸,广泛用于工业生产和实验室中。
下面是计算硫酸摩尔质量的步骤:步骤一:找到化学式中各元素的相对原子质量硫的相对原子质量为32,氢的相对原子质量为1,氧的相对原子质量为16。
步骤二:计算摩尔质量根据化学式,硫酸的化学式为H2SO4,其中含有两个氢原子(相对原子质量为1)、一个硫原子(相对原子质量为32)和四个氧原子(相对原子质量为16)。
因此,硫酸的摩尔质量为2*1+32+4*16=98克/摩尔。
练习题四:氯化钠(NaCl)的摩尔质量氯化钠是一种普遍存在于盐水和食盐中的化合物。
下面是计算氯化钠摩尔质量的步骤:步骤一:找到化学式中各元素的相对原子质量步骤二:计算摩尔质量根据化学式,氯化钠的化学式为NaCl,其中含有一个钠原子(相对原子质量为23)和一个氯原子(相对原子质量为35.5)。
物质的量及其单位——摩尔 摩尔质量 练习题1.判断正误。
(1)1 mol 小米( )(2)0.5 mol He( )(3)1 mol H 2O 中含有1 mol H( )(4)含有1 mol Na +的Na 2SO 4的物质的量为1 mol( )(5)1 mol 12C 中含有6 mol 电子( )(6)0.5 mol CO 2表示二氧化碳分子的物质的量为0.5 摩尔( )2.若a mol H 2SO 4中含有b 个氧原子,则阿伏加德罗常数可表示为________。
A :a /4b mol -1B :4b a mol -1C :a bmol -1 D :b 4amol -1 3.(1)试写出下列物质的摩尔质量:Na :__________________ Cl 2:________________SO 2-4:________________ Fe 3+:________________ (2)计算:①4 g NaOH 的物质的量:________②0.5 mol H 2SO 4的质量:________③已知一个Cl 2分子的质量为m g ,N A 表示阿伏加德罗常数,则M (Cl 2)=________________[例1] 下列说法正确的是( )A .摩尔是表示物质量的单位,每摩尔物质含有6.02×1023个分子B .2H 既可表示2个氢原子,又可表示2 mol 氢原子C .相同物质的量的CO 和CO 2所含的原子总数目之比为2∶3D .相同质量的CO 和CO 2所含的原子总数目之比为1∶1[例2] 下列有关阿伏加德罗常数(N A )的说法错误的是( )A .32克O 2所含的原子数目为N AB .0.5 mol H 2O 含有的原子数目为1.5N A ,含电子数为5N AC .1 mol H 2O 含有的H 2O 分子数目为N AD .0.5N A 个氯气分子的质量为35.5 g1.(对应考点一)下列说法正确的是( )A .物质的量是物质粒子的数量的简称B .摩尔是用来描述物质所含微粒数目多少的基本物理量C .我们把含有6.02×1023个粒子的任何粒子的集合体计量为1摩尔D.1 mol H2中含2 mol电子2.(对应考点一、二)N A代表阿伏加德罗常数,下列说法正确的是()A.0.1 mol CH4所含的电子数为0.1 N AB.46 g NO2含有的原子数为N AC.N A个CO2和N A个CO的质量分别是44 g和28 gD.0.1 mol H2SO4中含有的氢原子数为0.1 mol3.(对应考点一、二)用N A表示阿伏加德罗常数的值,下列说法不.正确的是() A.4.4 g CO2中含有0.2 N A个氧原子B.3.9 g钾变为钾离子时失去电子数为0.1 N AC.18 g H2O中所含的电子数为10 N AD.35.5克Cl-中所含的质子数为18 N A4.(对应考点二)设N A代表阿伏加德罗常数,下列说法中正确的是()A.2.3 g金属钠变成钠离子时失去的电子数目为0.2N AB.2 g氢气所含原子数目为N AC.17 g NH3所含的分子数为2N AD.N A个氧分子和N A个氢分子的质量比等于16∶15.(热点题)根据所学知识填空(N A为表示阿伏加德罗常数):(1)0.2 mol Cl2含有________ mol Cl。
化学计算练习题摩尔质量和摩尔浓度计算化学计算练习题:摩尔质量和摩尔浓度计算化学中的摩尔质量和摩尔浓度是非常重要的概念,它们在计算化学方程式中的物质转化、溶液配制和浓度调节等方面都扮演着重要的角色。
在本文中,我们将通过一些练习题来帮助巩固对摩尔质量和摩尔浓度计算的理解。
练习题1:计算盐酸的摩尔质量已知盐酸(HCl)中,氢原子的相对原子质量为1,氯原子的相对原子质量为35.5。
现求盐酸的摩尔质量。
解答:盐酸的分子式为HCl,因此盐酸的摩尔质量等于氢原子的相对原子质量加上氯原子的相对原子质量,即:摩尔质量(HCl)= 相对原子质量(H)+ 相对原子质量(Cl)= 1 + 35.5= 36.5 g/mol因此,盐酸的摩尔质量为36.5 g/mol。
练习题2:计算氯化钠溶液的摩尔浓度已知将5g的氯化钠溶解于100 mL的水中,求氯化钠溶液的摩尔浓度。
解答:首先,我们需要将题目给出的质量(5g)转化为摩尔数。
氯化钠的摩尔质量可以通过查找元素周期表得到,其中钠的相对原子质量为23,氯的相对原子质量为35.5。
因此,氯化钠的摩尔质量为23 + 35.5 =58.5 g/mol。
将质量转化为摩尔数的公式为:摩尔数 = 质量 / 摩尔质量将题目给出的质量和摩尔质量代入公式中,得到:摩尔数= 5g / 58.5 g/mol ≈ 0.085 mol接下来,我们需要将体积(100 mL)转化为升(L)。
由于1 L = 1000 mL,所以100 mL = 0.1 L。
摩尔浓度(mol/L)= 摩尔数 / 体积(L)≈ 0.085 mol / 0.1 L= 0.85 mol/L因此,氯化钠溶液的摩尔浓度为0.85 mol/L。
练习题3:计算溶液中溶质的质量若将200 mL的硫酸铜溶液浓度为0.5 mol/L的溶液中加入36.5g的盐酸(HCl),求溶液中硫酸铜的质量。
解答:首先,我们需要计算盐酸的摩尔数。
根据练习题2的计算方式,盐酸的摩尔质量为36.5 g/mol,质量为36.5g,所以盐酸的摩尔数为:摩尔数 = 36.5g / 36.5 g/mol = 1 mol根据溶液的摩尔浓度和体积的关系(摩尔浓度 = 摩尔数 / 体积),我们可以得到硫酸铜溶液中的硫酸铜的摩尔数:摩尔数 = 摩尔浓度 ×体积= 0.5 mol/L × 0.2 L= 0.1 mol接下来,我们需要计算硫酸铜的摩尔质量。
摩尔质量练习题摩尔质量是描述化学物质中含有的摩尔数的物理量,也称为摩尔质量。
摩尔质量可以通过计算一个物质中分子或原子的质量得出。
它在化学计量中扮演着重要的角色,因此在化学学习中是一个关键概念。
本文将通过一些练习题来探讨摩尔质量的计算方法和应用。
1. 计算CH4的摩尔质量。
CH4是甲烷的化学式,由一个碳原子和四个氢原子组成。
碳的相对原子质量为12.01,氢的相对原子质量为1.008。
根据化学式,我们可以计算甲烷的摩尔质量如下:摩尔质量 = (相对原子质量碳 ×原子数量碳) + (相对原子质量氢 ×原子数量氢)= (12.01 × 1) + (1.008 × 4)= 16.04 g/mol因此,甲烷的摩尔质量为16.04 g/mol。
2. 计算CaCO3的摩尔质量。
CaCO3是碳酸钙的化学式,由一个钙离子、一个碳酸根离子和三个氧原子组成。
钙的相对原子质量为40.08,碳的相对原子质量为12.01,氧的相对原子质量为16.00。
根据化学式,我们可以计算碳酸钙的摩尔质量如下:摩尔质量 = (相对原子质量钙 ×原子数量钙) + (相对原子质量碳 ×原子数量碳) + (相对原子质量氧 ×原子数量氧)= (40.08 × 1) + (12.01 × 1) + (16.00 × 3)= 100.09 g/mol因此,碳酸钙的摩尔质量为100.09 g/mol。
3. 根据摩尔质量计算物质的摩尔数。
现在我们来看一些摩尔质量的应用。
假设有25克的CH4,我们可以通过摩尔质量来计算它所含的摩尔数。
摩尔数 = 质量 / 摩尔质量= 25 g / 16.04 g/mol≈ 1.56 mol因此,25克的甲烷约含有1.56摩尔。
4. 计算化学反应中的摩尔比例。
在化学反应中,不同物质的摩尔比例对于平衡方程式的解析和理解十分重要。
专题七摩尔质量
[ 课堂练习1]写出下列粒子的摩尔质量。
Cu N2NaCl H2O
OH-SO42- NH4+
课堂练习2] 4. 9 克H2SO4的物质的量是多少?
[课堂练习3]:20g NaOH的物质的量是多少?
[课堂练习4] 2. 5 mol 铜原子的质量是多少克?
[课堂练习5]:1.50mol Na2CO3的质量是多少?
二、有关物质的量的计算的几种基本题型:
1.已知质量(物质的量)求物质的量(质量)
1:4.9g H2SO4的物质的量是;2. 5 mol 铜原子的质量是
2.已知元素的相对原子质量,求原子或离子的质量
2: 已知铁的相对原子质量为56,求1个Fe3+的质量是.
3.已知粒子数(N),阿伏伽德罗常数(N A)、物质的量(n)中的两个量,求另外一个量
3(1)某硫酸钠溶液中含有3.01×1022个Na+,则该溶液中SO42-的物质的量是。
(2)已知amolNH4+中含有b个e-(电子),则N A可表示为:.
(3)0.5molNH3中所含有的原子数为,质子数为。
(4)23.75 g某+2价金属的氯化物(MCl2)中含有3.01×1023个Cl-,则MCl2的摩尔质量为________,MCl2的相对分子质量为________,M的相对原子质量为________。
[强化练习1]
1、0.2?mol?Al2(SO4)3中含有Al3+ ?mol、SO42-g。
2、8g氧气为?mol;?0.1mol氧气共有???mol电子。
3、已知铁的相对原子质量是56,则1个铁原子的质量是g。
4、在60g碳中,所有碳原子的最外层电子数共为?个,质子的总数为????个。
5、某硫酸钠溶液中含有3.01×1022个Na+,则该溶液中SO42-的物质的量是,
该溶液中Na2SO4的质量为??克。
6、与16g氧气所含有分子数相同的氨气是??g,与16g氧气所含原子总数相同的氨气是??g。
7、483gNa2SO4·10H2O中所含的Na+、SO42-的物质的量各是多少?所含水分子数目是多少?
1. 下列说法正确的是:()
①1molO2的质量是32g·mol-1;② H2的摩尔质量是2g;③1molH+的质量是1g;
④对于原子而言,摩尔质量就是相对原子质量
A、①②③
B、③④
C、③
D、②④
2.32g某气体的分子数目与22g CO2的分子数目相同,则该气体的摩尔质量为()
A、32
B、32 g/ mol
C、64g/ mol
D、64
3.下列叙述中错误的是()
A.H2SO4的摩尔质量是98 B.2mol NO和2mol NO2含原子数相同
C.等质量的O2和O3中所含氧原子个数相同
D.等物质的量的CO和CO2中所含碳原子数相等
4.相同质量的SO2和SO3它们之间的关系是()
A.所含硫原子的物质的量之比为1:1 B.氧原子的物质的量之比为3:2
C.氧元素的质量比为5:6 D.硫元素的质量比为5:4
5.如果2g甲烷含有x个分子,那么22gCO2中所含分子数是()
A.x B.4x C.0.5x D.3x
6.1g O2和1g O3中()
A.所含分子数相同B.所含分子数不同C.所含原子数相同D.1g O3中所含分子数较多7.0.2g H2、2.4g C、19.6g H2SO4、19.5g Zn,它们之间的物质的量之比依次为()
A.2:1:2:3 B.1:2:2:3 C.2:1:1:3 D.3:1:2:2
8.下列物质中质量最大的是(),分子数最多的是()
A.64g SO2 B.3.01×1023个N2分子C.0.75mol H2SO4 D.4o C时,9mlH2O
9.相同质量的下列气体中,所含原子数最多的是( )
A 、CH 4
B 、N 2
C 、CO
D 、O 2 10.N A 表示阿伏加德罗常数,下列说法正确的是( )
A .23gNa 变为Na +时失去的电子数为N A
B .18g 水所含的电子数为N A
C .8g He 所含的分子数为N A
D .16g O 2与16g O 3所含的原子数均是N A 11. 下列叙述中正确的是( )
A.硝酸的摩尔质量63g
B.1mol CO 的质量是28g
C.2g 氢气含1mol H
D.铁的摩尔质量在数值上等于铁原子的相对原子质量
2x 的相对原子质量是 ,x 值为 。
14.4.5g 水与 g 硫酸所含的分子数相等,它们所含氧原子数之比是 ,氢原子数之比是 。
15. 0.3mol 氨气和0.4mol 二氧化碳的质量___________(填“相等”或“不相等”,下同),所含分子数______________,所含原子数____________。
16.现有A 、B 、C 三种化合物,各取40g 相混合,完全反应后,得B18g ,C49g ,还有D 生成。
已知D 的式量为106。
现将22gA 和11gB 反应,最多能生成D ( )
A 、1mol
B 、 0.5mol
C 、 0.275mol
D 、 0.25mol 17. 2.16g X 2O 5中含有0.1mol 氧原子,则X 的相对原子质量为( )
A 、21.6
B 、28
C 、14
D 、31
18. 某元素1个原子的质量为a ,1 个 C-12原子质量为b ,则该元素的这种原子的相对原子质量是( ) A .b
a 12 B .a
b 12 C .
A
N a D .a·N A
19.N A 为阿伏加德罗常数,下列叙述正确的是( )
A 、80g 硝酸铵中含有氮原子数为N A
B 、0.lmolN 5+离子中所含的电子数为3.4 N A
C 、 2mol 金属铝与足量的盐酸反应,生成氢气4g 。
D 、16 g 氧气和16 g 臭氧所含的原子数均为N A 20.试回答下列问题:
(1)0. 3mol NH 3分子中所含质子数与____________mol H 2O 分子中所含质子数相等。
(2)等物质的量的CO 和CO 2所含的原子个数之比是_______________。
(3)已知16克A 和20克B 恰好完全反应生成0.04mol C 和31.67克D ,则C 的摩尔质量为__________________。
21.Fe 、Mg 、Al 分别与盐酸反应:
(1)若盐酸足量,等物质的量的Fe 、Mg 、Al 产生H 2的质量之比为_________________, (2)若盐酸足量,等质量的Fe 、Mg 、Al 产生H 2的质量之比为________________ _,
(3)若盐酸质量分数相等,质量相等,投入相等质量的Fe 、Mg 、Al ,反应后有一种金属剩余,该金属是________________。
第一章 从实验学化学
第二节 化学计量在实验中的应用
课题二 摩尔质量答案
例题1
Cu 64g/mol N 2 28g/mol NaCl 58.5g/mol H 2O 18g/mol OH - 17g/mol SO 42- 96g/mol NH 4+ 18g/mol
例题2 0.05 mol 学与问 0.5 mol 例题3 160.0g 学与问 159.00g 有关物质的量的计算的几种基本题型: 1. 0.05mol 160.0g 2.
9.30×10-23g
3. (1) 0.025mol (2)
b/(10a )mol -1 (3) 2N A ,或1.204×1024
5N A 或3.01×1024
(4)
95 g·mol -
1 95 24
自学检测
1.C
2.C A 或者1.22×1023
当堂训练 A 组
11. 16;3 12. 24.5;1:4;1:1 13.不相等;不相等;相等
当堂训练 B 组
14.D
15.C 16.A 17.BD 18.(1)0.3(2)2:3(3)108.25g/mol 19.(1)2:2:3;(2)1/28:1/12:1/9 或者9:21:28;(3)Al
①1 mol 任何粒子的质量以克为单位时,在数值上都与该粒子的相对原子质量或相对分子质量相等。
②“摩尔质量在数值上一定等于该物质的相对分子质量或相对原子质量”。
这句话对否?为什么? ③两种原子的质量之比与其相对原子质量之比有何关系?为什么? 2.。