医疗器械标准规划(2018-2020年)
- 格式:doc
- 大小:38.13 KB
- 文档页数:8

新版中国医疗器械法规清单一、行政法规1.《医疗器械监督管理条例》(国务院令第680号)二、部门规章1.医疗器械注册管理办法(CFDA局令第4号)2.体外诊断试剂注册管理办法(CFDA局令第5号)3.医疗器械说明书和标签管理规定(CFDA局令第6号)4.医疗器械生产监督管理办法(CFDA局令第7号)5.医疗器械经营监督管理办法(CFDA局令第8号)6.药品医疗器械飞行检查办法(CFDA局令第14号)7.医疗器械分类规则(CFDA局令第15号)8.医疗器械使用质量监督管理办法(CFDA局令第18号)9.医疗器械通用名称命名规则(CFDA局令第19号)10.医疗器械临床试验质量管理规范(CFDA国家卫计委令第25号)11.医疗器械召回管理办法(CFDA局令第29号)12.体外诊断试剂注册管理办法修正案(CFDA局令第30号)13.关于调整部分医疗器械行政审批事项审批程序的决定(CFDA局令第32号)14.医疗器械标准管理办法(CFDA局令第33号)15.医疗器械网络销售监督管理办法(CFDA局令第38号)16.医疗器械不良事件监测和再评价管理办法(国家市场监督管理总局令第1号)三、通告1.关于发布第一类医疗器械产品目录的通告(CFDA通告2014年第8号)2.关于发布医疗器械产品技术要求编写指导原则的通告(CFDA通告2014年第9号)3.关于发布需进行临床试验审批的第三类医疗器械目录的通告(CFDA通告2014年第14号)4.关于发布体外诊断试剂临床试验技术指导原则的通告(CFDA通告2014年第16号)5.关于发布体外诊断试剂说明书编写指导原则的通告(CFDA通告2014年第17号)6.关于发布禁止委托生产医疗器械目录的通告(CFDA通告2014年第18号)7.关于发布医疗器械生产企业供应商审核指南的通告(CFDA通告2015年第1号)8.关于发布医疗器械临床评价技术指导原则的通告(CFDA通告2015年第14号)9.关于发布医疗器械产品出口销售证明管理规定的通告(CFDA通告2015年第18号)10.关于贯彻落实小微企业行政事业性收费优惠政策的通告(CFDA通告2015年第31号)11.关于生产一次性使用无菌注、输器具产品有关事项的通告(CFDA通告2015年第71号)2.关于发布医疗器械注册证补办程序等5个相关工作程序的通告(CFDA通告2015年第91号)3.关于发布医疗器械注册指定检验工作管理规定的通告(CFDA通告2015年第94号)4.关于发布医疗器械工艺用水质量管理指南的通告(CFDA通告2016年第14号)5.关于发布《医疗器械临床试验伦理审查申请与审批表范本》等六个文件的通告(CFDA通告2016年第58号)6.关于发布医疗器械生产企业质量管理体系年度自查报告编写指南的通告(CFDA通告2016年第76号)7.关于发布医疗器械生产企业质量控制与成品放行指南的通告(CFDA通告2016年第173号)8.关于发布医疗器械网络安全注册技术审查指导原则的通告(CFDA通告2017年第13号)9.关于发布医疗器械审评沟通交流管理办法(试行)的通告(CFDA通告2017年第19号)10.关于发布医疗器械优先审批申报资料编写指南(试行)的通告(CFDA通告2017年第28号)11.关于实施《医疗器械分类目录》有关事项的通告(CFDA通告2017年第143号)12.关于发布免于进行临床试验的体外诊断试剂临床评价资料基本要求(试行)的通告(CFDA通告2017年第179号)13.关于需审批的医疗器械临床试验申请沟通交流有关事项的通告(CFDA通告2017年第184号)14.关于发布医疗器械注册单元划分指导原则的通告(CFDA通告2017年第187号)15.关于发布移动医疗器械注册技术审查指导原则的通告(CFDA通告2017年第222号)16.关于过敏原类、流式细胞仪配套用、免疫组化和原位杂交类体外诊断试剂产品属性及类别调整的通告(CFDA通告2017年第226号)17.总局关于发布医疗器械临床试验设计指导原则的通告(2018年第6号)18.关于发布接受医疗器械境外临床试验数据技术指导原则的通告(CFDA通告2018年第13号)19.关于公布新修订免于进行临床试验医疗器械目录的通告(NMPA通告2018年第94号)20.关于发布医疗器械生产企业管理者代表管理指南的通告(NMPA通告2018年第96号)21.关于医疗器械经营企业跨行政区域设置库房办理事项的通告(NMPA通告2018年第108号)22.关于发布创新医疗器械特别审查申报资料编写指南的通告(NMPA通告2018年第127号)23.关于调整药械组合产品属性界定有关事项的通告(2019年第28号)24.关于发布医疗器械注册申请电子提交技术指南的通告(2019年第29号)四、公告17.关于医疗器械生产经营备案有关事宜的公告(CFDA公告2014年第25号)25.关于第一类医疗器械备案有关事项的公告(CFDA公告2014年第26号)26.关于公布医疗器械注册申报资料要求和批准证明文件格式的公告(CFDA公告2014年第43号)27.关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告(CFDA公告2014年第44号)28.关于施行医疗器械经营质量管理规范的公告(CFDA公告2014年第58号)29.关于发布医疗器械生产质量管理规范的公告(CFDA公告2014年第64号)30.关于发布药品、医疗器械产品注册收费标准的公告(CFDA公告2015年第53号)31.关于医疗器械临床试验备案有关事宜的公告(CFDA公告2015年第87号)32.关于发布医疗器械生产质量管理规范附录无菌医疗器械的公告(CFDA公告2015年第101号)33.关于发布医疗器械生产质量管理规范附录植入性医疗器械的公告(CFDA公告2015年第102号)34.关于发布医疗器械生产质量管理规范附录体外诊断试剂的公告(CFDA公告2015年第103号)35.关于境内医疗器械生产企业跨省新开办企业时办理产品注册及生产许可有关事宜的公告(CFDA公告2015年第203号)36.关于规范含银盐医疗器械注册管理有关事宜的公告(CFDA公告2015年第225号)37.关于发布医疗器械冷链(运输、贮存)管理指南的公告(CFDA公告2016年第154号)38.关于发布医疗器械优先审批程序的公告(CFDA公告2016年第168号)39.关于发布医疗器械生产质量管理规范附录定制式义齿的公告(CFDA公告2016年第195号)40.关于发布医疗器械技术审评专家咨询委员会管理办法的公告(CFDA公告2017年第36号)41.关于第二批规范性文件清理结果的公告(CFDA公告2017年第88号)42.关于发布医疗器械分类目录的公告(CFDA公告2017年第104号)43.关于医疗器械经营备案有关事宜的公告(CFDA公告2017年第129号)44.关于进口医疗器械注册申请人和备案人名称使用中文的公告(CFDA公告2017年第45.131号)46.关于发布医疗器械临床试验机构条件和备案管理办法的公告(CFDA公告2017年第47.145号)48.关于发布医疗器械标准制修订工作管理规范的公告(CFDA公告2017年第156号)49.关于修改医疗器械延续注册等部分申报资料要求的公告(NMPA公告2018年第53号)50.关于医疗器械规范性文件(1998—2013年)清理结果的公告(NMPA公告2018年第51.37号)52.关于发布药品医疗器械境外检查管理规定的公告(NMPA公告2018年第101号)53.关于调整医疗器械临床试验审批程序的公告(2019年第26号)54.关于实施医疗器械注册电子申报的公告(2019年第46号)五、通知性文件55.关于印发医疗器械质量监督抽查检验管理规定的通知(食药监械监〔2013〕212号)56.关于印发医疗器械生产日常监督现场检查工作指南的通知(食药监办械监〔2014〕7号)57.关于实施《医疗器械生产监督管理办法》和《医疗器械经营监督管理办法》有关事项的通知(食药监械监〔2014〕143号)58.关于实施《医疗器械注册管理办法》和《体外诊断试剂注册管理办法》有关事项的通知(食药监械管〔2014〕144号)59.关于实施第一类医疗器械备案有关事项的通知(食药监办械管〔2014〕174号)60.关于印发医疗器械检验机构开展医疗器械产品技术要求预评价工作规定的通知(食药监械管〔2014〕192号)61.关于印发境内第三类和进口医疗器械注册审批操作规范的通知(食药监械管〔2014〕208号)62.关于印发境内第二类医疗器械注册审批操作规范的通知(食药监械管〔2014〕209号)63.关于印发医疗器械生产企业分类分级监督管理规定的通知(食药监械监〔2014〕234号)64.关于印发国家重点监管医疗器械目录的通知(食药监械监〔2014〕235号)65.关于启用医疗器械生产经营许可备案信息系统的通知(食药监办械监函〔2014〕476号)66.关于印发境内第三类医疗器械注册质量管理体系核查工作程序(暂行)的通知(食药监械管〔2015〕63号)67.关于印发医疗器械经营企业分类分级监督管理规定的通知(食药监械监〔2015〕158号)68.关于印发医疗器械经营环节重点监管目录及现场检查重点内容的通知(食药监械监〔2015〕159号)69.关于印发医疗器械生产质量管理规范现场检查指导原则等4个指导原则的通知(食药监械监〔2015〕218号)70.关于印发医疗器械经营质量管理规范现场检查指导原则的通知(食药监械监〔2015〕239号)71.关于执行医疗器械和体外诊断试剂注册管理办法有关问题的通知(食药监械管〔2015〕247号)72.关于印发医疗器械检验机构资质认定条件的通知(食药监科〔2015〕249号)73.关于成立医疗器械分类技术委员会的通知(食药监械管〔2015〕259号)74.关于启用医疗器械注册管理信息系统备案子系统的通知(食药监办械管函〔2015〕534号)75.关于启用医疗器械注册管理信息系统受理和制证、技术审评、行政审批子系统的通知(食药监办械管函〔2015〕804号)76.关于医疗器械产品技术要求有关问题的通知(食药监办械管〔2016〕22号)77.关于实施《医疗器械通用名称命名规则》有关事项的通知(食药监械管〔2016〕35号)78.关于印发一次性使用无菌注射器等25种医疗器械生产环节风险清单和检查要点的通知(食药监械监〔2016〕37号)79.关于贯彻实施《医疗器械临床试验质量管理规范》的通知(食药监办械管〔2016〕41号)80.关于及时公开第二类医疗器械注册信息和第一类医疗器械产品备案信息的通知(食药监办械管〔2016〕65号)81.关于体外诊断试剂说明书文字性变更有关问题的通知(食药监办械管〔2016〕117号)82.关于印发医疗器械生产质量管理规范定制式义齿现场检查指导原则的通知(食药监械监〔2016〕165号)83.关于印发一次性使用塑料血袋等21种医疗器械生产环节风险清单和检查要点的通知(食药监械监〔2017〕14号)84.关于第一类、第二类医疗器械生产企业实施医疗器械生产质量管理规范有关工作的通知(食药监办械监〔2017〕120号)85.关于规范医疗器械产品分类有关工作的通知(食药监办械管〔2017〕127号)86.关于做好医疗器械临床试验机构备案工作的通知(食药监办械管〔2017〕161号)87.关于做好医疗器械检验有关工作的通知(食药监办械管〔2017〕187号)88.关于印发《医疗器械标准规划(2018—2020年)》的通知(食药监科〔2018〕9号)89.关于实施《医疗器械网络销售监督管理办法》有关事项的通知(食药监办械监〔2018〕31号)90.关于印发医疗器械注册技术审查指导原则制修订工作管理规范的通知(药监办〔2018〕13号)91.关于加强医疗器械生产经营许可(备案)信息管理有关工作的通知(2018年08月02日发布)92.关于贯彻实施《医疗器械不良事件监测和再评价管理办法》有关事项的通知(药监93.综械管〔2018〕35号)94.关于贯彻落实国务院“证照分离”改革要求做好医疗器械上市后监管审批相关工作95.的通知(药监综械管〔2018〕39号)96.关于贯彻落实“证照分离”改革措施进一步推进医疗器械审评审批制度改革的通知97.(药监综械注〔2018〕43号)98.关于印发医疗器械临床试验检查要点及判定原则的通知(药监综械注〔2018〕45号)六、政策解读18.《医疗器械经营监督管理办法》部分(一)(2015年01月22日发布)19.《医疗器械生产监督管理办法》部分(一)(2015年01月22日发布)20.医疗器械注册管理法规解读之一(《医疗器械注册管理办法》和《体外诊断试剂注册管理办法》部分)(2015年02月05日发布)21.医疗器械注册管理法规解读之二(《医疗器械说明书和标签管理规定》部分)(2015年02月05日发布)99. 关于《药品医疗器械飞行检查办法》的说明(2015年07月08日发布)100. 医疗器械注册管理法规解读之三(关于《医疗器械分类规则》的修订说明)(2015 年07月16 日发布)101. 医疗器械注册管理法规解读之四(2015年11 月02 日发布)102. 医疗器械注册管理法规解读之五(2015年11 月19 日发布)103. 关于《医疗器械使用质量监督管理办法》的说明(2015年11 月30日发布)104. 医疗器械注册管理法规解读之六(2016 年01 月07 日发布)105. 关于《医疗器械通用名称命名规则》的说明(2016 年01 月27 日发布)106. 《医疗器械临床试验质量管理规范》解读(2016 年03 月23 日发布)107. 关于《医疗器械优先审批程序》的说明(2016 年10 月26 日发布)108. YY/T0287-2017 idt ISO13485:2016 《医疗器械质量管理体系用于法规的要求》109.标准解读(一)(2017 年02 月04 日发布)110. YY/T0287-2017 idt ISO13485:2016 《医疗器械质量管理体系用于法规的要求》111.标准解读(二)(2017 年02 月04 日发布)112. 《医疗器械召回管理办法》解读(2017 年02 月08 日发布)113. 《体外诊断试剂注册管理办法修正案》解读(2017 年02 月08 日发布)114. 《医疗器械网络安全注册技术审查指导原则》解读(2017 年03 月02 日发布)115. 《医疗器械标准管理办法》解读(2017 年04 月26 日发布)116. 《医疗器械召回管理办法》解读之二(2017 年05 月24 日发布)117. 图解政策:《医疗器械召回管理办法》解读(2017 年06 月22 日发布)118. 图解政策:医疗器械不良事件那些事(2017 年06 月24 日发布)119. 图解政策:体外诊断试剂注册管理办法修正案(2017 年07 月28 日发布)120. 创新医疗器械特别审批程序相关问题解读(2017 年07 月31 日发布)121. 医疗器械临床试验质量管理相关问题解读(2017 年07 月31 日发布)122. 《医疗器械标准管理办法》解读之一(2017 年08 月09 日发布)123. 《医疗器械标准管理办法》解读之二(2017 年08 月09 日发布)124. 《医疗器械网络安全注册技术审查指导原则》解读(2017 年08 月09 日发布)125. 图解政策:医疗器械临床试验质量管理相关问题解读(2017 年09 月04 日发布)126. 图解政策:创新医疗器械特别审批程序相关问题解读(2017 年09 月04 日发布)127. 图解政策:ISO13485:2016《医疗器械质量管理体系用于法规的要求》标准解读128.(一)(2017 年09 月12 日发布)129. 图解政策:ISO13485:2016《医疗器械质量管理体系用于法规的要求》标准解读130.(二)(2017 年09 月12 日发布)131. 《免于进行临床试验的体外诊断试剂临床评价资料基本要求( 试行) 》解读(2017 年132. 11 月08 日发布)133. 《医疗器械临床试验机构条件和备案管理办法》解读(2017 年11 月24 日发布)134. 《医疗器械网络销售监督管理办法》解读(2017 年12 月22 日发布)135. 《移动医疗器械注册技术审查指导原则》解读(2017 年12 月29 日发布)136. 图解政策:医疗器械网络销售监督管理办法解读一(2018 年01 月12 日发布)137. 图解政策:医疗器械网络销售监督管理办法解读二(2018 年01 月15 日发布)138.医疗器械临床试验质量管理相关问题解读之二(2018年04月18日发布)139.《医疗器械分类目录》实施有关问题解读(2018年08月01日发布)140.图解政策:国家药品监督管理局办公室关于强脉冲光脱毛类产品分类界定的通知(2018年09月26日发布)141.图解政策:医疗器械注册技术审查指导原则制修订工作管理规范(2018年09月28日发布)142.图解政策:关于加强医疗器械生产经营许可(备案)信息管理有关工作的通知(2018年09月28日发布)143.免于进行临床试验医疗器械目录解读(2018年09月30日发布)144.图解政策:《医疗器械分类目录》实施有关问题解读(2018年10月09日发布)145.图解政策:新修订的《免于进行临床试验医疗器械目录》解读(2018年10月19日发布)146.图解政策:《医疗器械不良事件监测和再评价监督管理办法》之一(2018年10月24日发布)147.图解政策:《医疗器械不良事件监测和再评价监督管理办法》之二(2018年10月25日发布)148.图解政策:《医疗器械不良事件监测和再评价监督管理办法》之三(2018年10月26日发布)149.图解政策:《医疗器械不良事件监测和再评价监督管理办法》之四(2018年10月29日发布)150.图解政策:《医疗器械不良事件监测和再评价监督管理办法》之五(2018年10月30日发布)151.图解政策:《医疗器械不良事件监测和再评价监督管理办法》之六(2018年10月31日发布)152.图解政策:《医疗器械不良事件监测和再评价监督管理办法》之七(2018年11月01日发布)153.图解政策:《医疗器械不良事件监测和再评价监督管理办法》之八(2018年11月02日发布)154.《创新医疗器械特别审查程序》解读(2018年11月05日发布)155.图解政策:医疗器械生产企业管理者代表管理指南之一(2018年11月06日发布)156.图解政策:医疗器械生产企业管理者代表管理指南之二(2018年11月06日发布)157.图解政策:医疗器械生产企业管理者代表管理指南之三(2018年11月07日发布)158.图解政策:关于优化优先审评申请审核工作程序的通知(2018年11月14日发布)159.图解政策:用于罕见病防治医疗器械注册审查指导原则(之一)(2018年11月29日发布)160.图解政策:用于罕见病防治医疗器械注册审查指导原则(之二)(2018年11月30日发布)161.图解政策:关于贯彻落实“证照分离”改革措施进一步推进医疗器械审评审批制度改革的通知(2018年12月03日发布)162.图解政策:创新医疗器械特别审查程序之一(2018年12月14日发布)163.图解政策:创新医疗器械特别审查程序之二(2018年12月19日发布)164.图解政策:创新医疗器械特别审查程序之三(2018年12月19日发布)。

FOCUS焦点18大型医用设备配置三年规划发布10月30日,国家卫生健康委发布《关于发布2018~2020年大型医用设备配置规划的通知》。
《通知》指出,到2020年年底,全国规划配置大型医用设备22548台,其中新增10097台,分3年实施;甲类大型医用设备根据工作需要按年度实施,乙类大型医用设备由省级卫生健康部门制订年度实施计划。
国家卫生健康委发布《关于进一步加强健康体检机构管理促进健康体检行业规范有序发展的通知》近日,国家卫生健康委发布《关于进一步加强健康体检机构管理促进健康体检行业规范有序发展的通知》。
《通知》明确,严把准入门槛,鼓励健康体检中心连锁化、集团化经营,科学合理规划,促进区域内的资源平衡。
自《通知》发布之日起至2018年年底,各地卫生监督机构将对辖区内健康体检机构依法执业情况进行重点监督检查。
《通知》指出,地方卫生健康行政部门将健康体检机构纳入本地区医疗质量控制体系,由相关专业质控组织定期开展质量控制。
健康体检机构建立健全医疗质量管理制度,制定合理的健康体检流程,严格执行有关技术规范、标准和操作规程。
美国 FDA 公布了最新版《医疗器械、药品以及其他产品分类指南》近日,美国 FDA 公布了最新版《医疗器械、药品以及其他产品分类指南》。
该指南特别关注产品可以被分类为药品或医疗器械的情况,还涉及其他产品分类相关问题。
FDA建议分类申请者联系组合产品办公室,在分类不明确或有争议的情况下,确定拟上市产品的分类。
《中国人体器官分配与共享基本原则和核心政策》印发为深入贯彻落实《人体器官移植条例》,进一步完善人体器官分配与共享政策,保障人体器官科学公正分配,维护人民群众健康权益,近期国家卫健委对《卫生部关于印发中国人体器官分配与共享基本原则和肝脏与肾脏移植核心政策的通知》(卫医管发〔2010〕113号)进行了修订,并制定了心脏、肺脏分配与共享核心政策,形成了《中国人体器官分配与共享基本原则和核心政策》(国卫医发〔2018〕24号),自印发之日起施行。

国家药监局综合司关于印发2024年医疗器械行业标准制修订计划项目的通知文章属性•【制定机关】国家药品监督管理局•【公布日期】2024.04.10•【文号】药监综械注〔2024〕27号•【施行日期】2024.04.10•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家药监局综合司关于印发2024年医疗器械行业标准制修订计划项目的通知药监综械注〔2024〕27号北京、天津、辽宁、上海、江苏、浙江、山东、湖北、广东省(市)药品监督管理局,中检院(器械标管中心),器审中心,北京大学口腔医学院口腔医疗器械检测中心,机械工业仪器仪表综合技术经济研究所:为贯彻国务院办公厅《关于全面加强药品监管能力建设的实施意见》,落实《“十四五”国家药品安全及促进高质量发展规划》有关要求,按照国家药监局医疗器械行业标准制修订工作部署,现将2024年医疗器械行业标准制修订计划项目印发给你们,并就有关要求通知如下:一、各相关省(市)药品监督管理局要高度重视,认真组织本行政区域标准承担单位开展标准制修订工作,加强监督管理,确保按要求完成各项工作任务。
二、国家药监局器械标管中心要认真组织协调各医疗器械标准化(分)技术委员会、工作组及技术归口单位,严格按照《医疗器械标准制修订工作管理规范》开展标准制修订工作,加强业务管理和检查指导,保证标准质量和水平。
三、承担标准制修订任务的医疗器械标准化(分)技术委员会、工作组及技术归口单位要做好标准的组织起草、验证、征求意见和技术审查等工作,要广泛调研、深入研究,确保标准技术内容的科学性、合理性、适用性以及与相关政策要求的符合性。
国家药监局综合司2024年4月10日附件:2024年医疗器械行业标准制修订计划项目。

医疗器械监督管理条例(2000年1月4日中华人民共和国国务院令第276号公布2014年2月12日国务院第39次常务会议修订通过根据2017年5月4日《国务院关于修改〈医疗器械监督管理条例〉的决定》修订)第一章总则第一条为了保证医疗器械的安全、有效,保障人体健康和生命安全,制定本条例。
第二条在中华人民共和国境内从事医疗器械的研制、生产、经营、使用活动及其监督管理,应当遵守本条例。
第三条国务院食品药品监督管理部门负责全国医疗器械监督管理工作。
国务院有关部门在各自的职责范围内负责与医疗器械有关的监督管理工作。
县级以上地方人民政府食品药品监督管理部门负责本行政区域的医疗器械监督管理工作。
县级以上地方人民政府有关部门在各自的职责范围内负责与医疗器械有关的监督管理工作。
国务院食品药品监督管理部门应当配合国务院有关部门,贯彻实施国家医疗器械产业规划和政策。
第四条国家对医疗器械按照风险程度实行分类管理。
第一类是风险程度低,实行常规管理可以保证其安全、有效的医疗器械。
第二类是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。
第三类是具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。
评价医疗器械风险程度,应当考虑医疗器械的预期目的、结构特征、使用方法等因素。
国务院食品药品监督管理部门负责制定医疗器械的分类规则和分类目录,并根据医疗器械生产、经营、使用情况,及时对医疗器械的风险变化进行分析、评价,对分类目录进行调整。
制定、调整分类目录,应当充分听取医疗器械生产经营企业以及使用单位、行业组织的意见,并参考国际医疗器械分类实践。
医疗器械分类目录应当向社会公布。
第五条医疗器械的研制应当遵循安全、有效和节约的原则。
国家鼓励医疗器械的研究与创新,发挥市场机制的作用,促进医疗器械新技术的推广和应用,推动医疗器械产业的发展。
第六条医疗器械产品应当符合医疗器械强制性国家标准;尚无强制性国家标准的,应当符合医疗器械强制性行业标准。

国家药品监督管理局公告2018年第97号关于批准发布YY0042-2018《高频喷射呼吸机》等27项医疗器械行业标准的公告国家药监局2018年12月20日序号YY0042-20072018-12-202020-06-012YY0290.3-2018眼科光学人工晶状体第3部分:机械性能及测试方法YY0290.3-20084YY0778-2018射频消融导管YY0778-20102018-12-202020-06-01无菌医疗器械包装试验方法第1部分:加速老化试验指南YY/T0681.1-20092018-12-202020-01-017YY/T0734.2-2018清洗消毒器第2部分:对外科和麻醉器械等进行湿热消毒的清洗消毒器YY/T0734.3-20092018-12-202020-01-019YY/T0865.2-2018超声水听器第2部分:40MHz以下超声场用水听器的校准2020-01-0111YY/T1043.2-2018牙科学牙科治疗机第2部分:气、水、吸引和废水系统YY/T0630-2008 YY/T0725-20092018-12-202020-01-01YY/T1090-2018超声理疗设备YY1090-20092018-12-202020-01-0114人类免疫缺陷病毒抗体检测试剂盒(免疫层析法)2018-12-202020-01-01YY/T1625-2018移动式X射线计算机体层摄影设备专用技术条件18YY/T1631.1-2018输血器与血液成分相容性测定第1部分:血液成分残留评定2018-12-202020-01-01关节置换植入物肩关节假体关节盂松动或分离动态评价试验方法2018-12-202020-01-0121YY/T1635-2018 多道生理记录仪2020-01-0123YY/T1637-2018牙科学磁性附着体2018-12-202019-06-01YY/T1640-2018外科植入物磷酸钙颗粒、制品和涂层溶解性的试验方法2018-12-202020-01-0126YY/T1641-20182018-12-20 2020-01-01。

国家食品药品监督管理总局公告2018年第8号关于批准发布YY0645-2018《连续性血液净化设备》等9项医疗器械行业标准的公告(2018年第8号)YY0645-2018《连续性血液净化设备》等9项医疗器械行业标准已经审定通过,现予以公布。
标准自2019年1月1日起实施,标准编号、名称如下:YY0645-2018《连续性血液净化设备》YY/T0514-2018《牙科学气动牙科手机用软管连接件》YY/T0744-2018《移动式C形臂X射线机专用技术条件》YY/T1600-2018《医疗器械湿热灭菌的产品族和过程类别》YY/T1601-2018《超声骨组织手术设备》YY/T1602-2018《牙科学根管预备机》YY/T1603-2018《医用内窥镜内窥镜功能供给装置摄像系统》YY/T1604-2018《牙科学旋转抛光器械》YY/T1610-2018《麻醉和呼吸设备医用氧气湿化器》上述标准适用范围见附件。
特此公告。
附件:YY0645-2018《连续性血液净化设备》等9项医疗器械行业标准适用范围食品药品监管总局2018年1月19日序号标准编号标准名称代替标准号发布日期实施日期1YY0645-2018连续性血液净化设备YY0645-20082018-01-192019-01-012YY/T0514-2018牙科学气动牙科手机用软管连接件YY/T0514-20092018-01-193YY/T0744-2018移动式C形臂X射线机专用技术条件YY/T0744-20092018-01-192019-01-014YY/T1600-2018医疗器械湿热灭菌的产品族和过程类别2018-01-195YY/T1601-2018超声骨组织手术设备2018-01-192019-01-016YY/T1602-2018牙科学根管预备机2018-01-192019-01-017YY/T1603-2018医用内窥镜内窥镜功能供给装置摄像系统2018-01-192019-01-018YY/T1604-2018科学旋转抛光器械2018-01-192019-01-019YY/T1610-2018麻醉和呼吸设备医用氧气湿化器2018-01-192019-01-01。

2018年医药行业政策梳理回顾,你看了吗?2018年是“十三五”承上启下的关键一年,在这一年里,国务院大部制机构改革,政策发布之密集、力度之大、落地速度之快远超过往。
医保局、卫健委、药监局三大医疗机构崛起;全面破除以药补医,深化公立医院综合改革文件发布;仿制药一致性评价进入关键阶段;进口抗癌药实施零关税;九部委联合发文严打医药商业贿赂;17种抗癌药纳入医保报销目录;新版《国家基本药物目录》发布;国家4+7带量采购方案公布……2018年医药行业政策仍以三医联动为核心,医药端支持创新、保障药品质量;医疗端综合推进医药分开与分级诊疗,限制辅助用药品种;医保端保障用药,控制费用合理支出,本文将从医药、医疗器械、医疗、医保四方面对2018年行业政策进行梳理回顾。
医药深化审评审批政策,鼓励药品创新2018年,在推动创新药物研发方面,备受关注的药品试验数据保护制度、接受药品境外临床试验数据的技术指导原则的通告、临床试验申请默认制等政策陆续出台。
4月26日,国家药品监督管理局公布《药品试验数据保护实施办法(暂行)(征求意见稿)》,办法对于创新药、罕见病和儿童专用药给予一定期限的数据保护期,突破性地拓展了创新药和专用药的数据保护时间和范围。
作为与药品专利保护完全不同的知识产权保护体系,这一鼓励创新的后继保护措施对于支持医药研发和技术转化具有十分重要的意义。
7月10日,国家药品监督管理局发布了《关于发布接受药品境外临床试验数据的技术指导原则的通告(2018年第52号)》(以下简称为《通告》),明确境外临床试验数据可用于在中国的药品注册申报,国外新药进入中国的速度将越来越快。
7月27日,国家药品监督管理局发布《关于调整药物临床试验审评审批程序的公告》,标志着我国临床试验由“批准制”改为“默认制”。
在“批准制”情况下,我国药品临床试验的平均启动时间约为14-20个月,“默认制”的实施则意味着我国临床试验申请自申请受理并缴费之日起60日内,申请人未收到国家食品药品监督管理总局药品审评中心(CDE)否定或质疑意见的,即可开展临床试验,此举将大大提升国内创新药物临床开发进程。

XX省大型医用设备配置计划(2018-2019年)为切实加强大型医用设备配置与使用管理,统筹医疗卫生资源配置,持续优化布局结构,不断满足人民群众日益增长的医疗健康服务需求,根据《医疗器械监督管理条例》《大型医用设备配置与使用监督管理办法(试行)》《关于发布2018-2020年大型医用设备配置规划的通知》等法规、文件要求,结合我省实际,制定《XX省大型医用设备配置计划(2018-2019年)》(以下简称《配置计划》)。
《配置计划》坚持规划引领、依法准入,统筹优化、公平可及,阶梯配置、资源共享,安全有效、全程监管的原则。
以规划为引领,以促进医疗健康整体服务能力提升为导向,强化标准为基础、许可为抓手、监管为保障,严格依法依规准入,构建完善大型医用设备配置科学合理有序、准入依法依规、使用操作规范、质量控制严格、公正公开便捷的管理机制和体系。
紧紧围绕“1+5”改革发展攻坚战,统筹资源配置,优先保障县域医共体建设、“医学高峰”计划实施,加大对山区、海岛等偏远地区和资源较薄弱地区的医疗卫生资源供给,积极补齐发展短板,进一步均衡区域配置差异;坚持基本医疗优先,促进基本医疗卫生服务资源供给的更具可及性、便利性和公平性;支持健康领域新模式、新业态发展,为社会办医预留合理发展空间;引导医疗机构合理配置适宜的大型医用设备,严格控制公立医院超常装备,鼓励支持国产大型医用设备应用,促进区域内和区域间优质资源整合、共享。
一、规划目标到2019年底,全省规划新增配置大型医用设备290台,其中:高端放射治疗类设备3台;X线正电子发射断层扫描仪(PET-CT)14台;内窥镜手术器械控制系统(手术机器人)4台;64排及以上X线计算机断层扫描仪(64排及以上CT)96台;1.5T及以上磁共振成像系统(1.5T及以上MRI)126台;医用电子直线加速器(LA)(含X刀、体部伽马刀以及不包含在甲类大型医用设备中的TOMO H 型等放射肿瘤治疗设备,下同)43台;头部伽玛射线立体定向放射治疗系统(γ刀)4台。

国家卫⽣健康委员会关于发布2018―2020年⼤型医⽤设备配置规划的通知⽂号:国卫财务发[2018]41号颁布⽇期:2018-10-26执⾏⽇期:2018-10-26时效性:现⾏有效效⼒级别:部门规章各省、⾃治区、直辖市及新疆⽣产建设兵团卫⽣计⽣委(卫⽣健康委):为促进⼤型医⽤设备合理配置,根据《国务院关于修改〈医疗器械监督管理条例〉的决定》《国家卫⽣健康委员会关于发布⼤型医⽤设备配置许可管理⽬录的通知》以及国家卫⽣健康委员会、国家药品监督管理局《关于印发⼤型医⽤设备配置与使⽤管理办法(试⾏)的通知》,我委研究制定了2018-2020年全国⼤型医⽤设备配置规划,现予发布。
⼀、指导思想深⼊贯彻落实党的⼗九⼤精神,坚持新时代卫⽣健康⼯作⽅针,紧紧围绕推进健康中国建设和深化医药卫⽣体制改⾰,以维护和增进⼈民健康为核⼼,以提⾼医疗质量保障医疗安全为前提,以优化资源配置和控制医疗成本为重点,统筹规划⼤型医⽤设备配置数量和布局,科学设置配置准⼊标准,提升医疗资源供给效率,⽀撑卫⽣健康事业⾼质量发展,不断满⾜⼈民群众⽇益增长的医疗服务需求。
⼆、总体⽬标通过科学规划引导、规范准⼊管理和加强事中事后监管,努⼒形成区域布局更加合理、装备结构更加科学、配置数量与健康需求更加匹配、使⽤⾏为更加规范、应⽤质量更有保障的⼤型医⽤设备配置规划管理体系,基本满⾜临床诊疗、科研创新需要和⼈民群众多层次、多元化医疗服务需求。
三、基本原则(⼀)问题导向、统筹协调。
围绕群众主要健康问题和突出健康需求,根据建⽴分级诊疗制度和公⽴医院改⾰要求,综合考虑医学科技进步与学科发展、国民经济与社会发展⽔平、⼈民群众医疗服务需求与承受能⼒等因素,统筹规划布局。
(⼆)公平优先、兼顾效率。
优先保障基本医疗卫⽣服务的可及性,确保⼴⼤⼈民群众能够共享改⾰发展和科技创新成果,探索建⽴有利于促进资源向基层和中西部地区下沉的体制机制。
推进区域内医疗资源协同整合,提升医疗卫⽣服务体系的整体性和协同性。

29做好大型设备的配置与管理工作,对于满足患者就医需求、提高医疗诊断水平、促进全民健康和卫生事业发展有着重要意义。
为加强大型医用设备宏观配置和管理,1995年7月我国原卫生部发布《大型医用设备配置与应用管理暂行办法》43号令,在此文件中明确大型设备的概念,其品种目录由卫生部定期公布,对推动大型医用设备配置起到了规范作用。
2004年12月原卫生部、国家发展和改革委员会、财政部又联合下发《大型医用设备配置规划与使用管理办法》(卫规财发〔2004〕474 号),该管理办法将大型医用设备管理品目分为甲、乙两类,分别由国务院卫生行政部门和省级卫生行政部门管理。
从而建立了大型医用设备分级分类配置许可制度,国家和省级卫生行政部门分别针对甲乙两类大型医用设备进行集中配置管理,实行配置许可证制度。
2015年年初,在国务院改革行政审批事项过程中,“甲类大型医用设备配置许可证核发”调整为非行政许可事项。
通过简政放权,鼓励国产创新产品尽快进入临床,放宽对非公立医疗机构的设备配备限制,丰富临床技术服务,满足群众多样化健康需求。
2018年3月国家卫生健康委员会根据《国务院关于修改〈医疗器械监督管理条例〉的决定》(国务院令第680号),为进一步深化简政放权、放管结合、优化服务、促进大型医用设备科学配置和合理使用,经国务院批准,发布《大型医用设备配置许可管理目录(2018年)》。
2018年5月,国家卫生健康委员会和国家药品监督管理局联合下发了《大型医用设备配置与使用管理办法(试行)》(国卫规划发〔2018〕12号),将大型医用设备配置审批由非行政许可审批事项调整为行政许可事项,同时明确了各级卫生行政部门对甲、乙类大型设备配置和使用的监管职责。
国务院卫生行政部门通过常规开展甲类设备配置和应用前后评估,探索建立事前、事中、摘 要:文章通过分析新形势下中国大型医用设备配置与管理中出现的新问题,对完善和提高大型医用设备配置规划管理进行了探讨,希望通过探讨科学的配置评估方法,不断探索设备配置规划和标准管理的新模式,提升卫生资源的产出效益,促进医院有序配置大型设备,发挥好大型医疗设备在医院诊疗中的重要作用。
2023年医疗器械强制性行业标准制修订计划项目序标准制修被修订采用国际归口单位号标准项目名称性质i丁标准号标准号(标委会/技术归口单承担单位项目号位)医用电气设备第2“ISO 80601“ 上海市医疗器A2023001Q“87部分:高频呼吸机强制制定/ 2-87:全国麻醉相呼吸设备的基本安全和基本性性标准化技术委员会能专用要求2021械检验研究院sh全国医用电器标准化上海市医疗器A2023002-Q-2 电动j先胃机强制修订yy 1105“ / 技术委员会医用电子性2008 仪器标准化分技术委员会械检验研究院sh全国医用电器标准化上海市医疗器A2023003-Q-3 血压传感器强制修订yy 0781-/ 技术委员会医用电子性2010 仪器标准化分技术委员会械检验研究院sh全国外科植入物和矫天津市医疗器N2023004-Q-4 青接台植入器械金属强制修订yy 0018-/ 形器械标准化技术委械质量监督检接骨螺钉性2016 员会骨科植入物分技术委员会tj验中心序标准制修被修订采用国际标准项目名称(标委会/技术归口单承担单位项目号% 性质iJ 标准号标准号位)全国外科植入吻和矫天津市医疗器N2023005Q5 青接合植入器械金属强制修订yy 0017-/ 形器械标准化技术委楠质量监督检接骨板性2016 员会骨科植入吻分技术委员会验中心天津市医疗器中医器械电针治疗强制yy 0780-中医器楠标准化技术A2023006-Q-6仪性{I多i.J2018 / 归口单位械质量监督检验中心山东省医疗器一次性使用去自细胞强制yy 0329-全国医用输液器具标N2023007-Q-7滤器性修订2009 / 准化技术委员会才咸丰口药晶包装Jn检验研究院激光治疗设备调Q强制yy 0789-全国医用光学和仪器浙江省医疗器A2023008-Q-8 修订/眼科激光治疗机性2010 标准化分技术委员会械检验研究院hz -2一序标准制修被修订采用国际标准项目名称(标委会/技术归口单承担单位项目号%性质iJ标准号标准号位)广东省医疗器心肺转流系统一次性强制yy 0948-ISO 全国医用体外循环设N2023009Q9 使用动静脉插筐性修订201518193:202备标准化技术委员会楠质量监督检gz验所广东省医疗器强制yy 0790-全国医用体外循环设A2023010-Q-10血液灌流设备性{I 多iJ2010/备标准化技术委员会械质量监督检gz验所广东省医疗器-,欠性使用空'L.'纤维强制yy 0465-ISO 8637-全国医用体外循环设N2023011-Q-1 1 血浆分离器和血浆成性修订2019 3:2018备标准化技术委员会械质量监督检分分离器gz验所北京大学口腔牙科学水墓水门汀强制yy ISO 9917-全国口腔材料和器械医学院口腔医N2023012-Q-12 第2部分:树脂改性修订0271.2-设备标准化技术委员水门汀性20162: 2017�疗器械检验中bd1心-3一序标准项目名称标准制修被修订采用国际%性质iJ标准号标准号(标委会/技术归口单承担单位项目号位}北京大学口腔13 牙科学修复用人工强制yy 0300-ISO 全国口腔材料和器械医学院口腔医N2023013Q牙性修订200922112 设备标准化技术委员2017.6.疗器械检验中bd=IL,\北京大学口腔14 牙科学聚合物基冠军日强制yy 0710-ISO 全国口腔材料和器械医学院口腔医N2023014-Q-贴面材料性修订200910477:202设备标准化技术委员�比疗器械检验中bd=IL,\yy 北京大学口腔牙科学金属-陶瓷和0621.1-全国口腔材料和器械15 陶瓷-陶瓷体系的匹配强制修订2016 平日ISO 9693 医学院口腔医N2023015-Q-性试验性yy厅2019设备标准化技术委员0621.2-�比疗器械检验中bd=2020IL,\-4一。
关于印发大型医用设备配置与使用管理办法(试行)的通知发布时间:2018-06-13国卫规划发〔2018〕12号各省、自治区、直辖市及新疆生产建设兵团卫生计生委、食品药品监督管理局:根据《国务院关于修改<医疗器械监督管理条例>的决定》(国务院令第680号),为规范和加强大型医用设备配置使用管理,制定了《大型医用设备配置与使用管理办法(试行)》(可从国家卫生健康委员会官网下载)。
现印发你们,请遵照执行。
国家卫生健康委员会国家药品监督管理局2018年5月22日大型医用设备配置与使用管理办法(试行)第一章总则第一条为深入推进简政放权、放管结合、优化服务,促进大型医用设备合理配置和有效使用,保障医疗质量安全,控制医疗费用过快增长,维护人民群众健康权益,根据《行政许可法》《国务院关于修改<医疗器械监督管理条例>的决定》等法律法规规定,制定本办法。
第二条本办法所称大型医用设备,是指使用技术复杂、资金投入量大、运行成本高、对医疗费用影响大且纳入目录管理的大型医疗器械。
第三条大型医用设备目录由国家卫生健康委员会商国务院有关部门提出,报国务院批准后公布执行。
第四条国家按照目录对大型医用设备实行分级分类配置规划和配置许可证管理。
第五条国家卫生健康委员会负责制定大型医用设备配置与使用的管理制度并组织实施,指导开展大型医用设备配置与使用行为的评价和监督工作。
县级以上地方卫生健康行政部门负责本区域内大型医用设备配置与使用行为的监督管理工作。
第六条国家卫生健康委员会成立大型医用设备管理专家咨询委员会,为确定和调整管理目录、制定和实施配置规划,以及配置与使用全过程管理提供评审、咨询和论证等技术支持。
省级卫生健康行政部门可成立相应的专家组。
第七条医疗器械使用单位配置与使用大型医用设备用于医疗服务的,适用本办法。
第二章管理目录第八条国家卫生健康委员会根据医疗服务需求和医疗器械发展状况,结合资金投入、运行成本和使用费用、技术要求等因素,提出大型医用设备配置管理目录建议。
关于发布2018—2020年大型医用设备配置规划的通知发布时间:2018-10-29国卫财务发〔2018〕41号各省、自治区、直辖市及新疆生产建设兵团卫生计生委(卫生健康委):为促进大型医用设备合理配置,根据《国务院关于修改〈医疗器械监督管理条例〉的决定》《国家卫生健康委员会关于发布大型医用设备配置许可管理目录的通知》以及国家卫生健康委员会、国家药品监督管理局《关于印发大型医用设备配置与使用管理办法(试行)的通知》,我委研究制定了2018—2020年全国大型医用设备配置规划,现予发布。
一、指导思想深入贯彻落实党的十九大精神,坚持新时代卫生健康工作方针,紧紧围绕推进健康中国建设和深化医药卫生体制改革,以维护和增进人民健康为核心,以提高医疗质量保障医疗安全为前提,以优化资源配置和控制医疗成本为重点,统筹规划大型医用设备配置数量和布局,科学设置配置准入标准,提升医疗资源供给效率,支撑卫生健康事业高质量发展,不断满足人民群众日益增长的医疗服务需求。
二、总体目标通过科学规划引导、规范准入管理和加强事中事后监管,努力形成区域布局更加合理、装备结构更加科学、配置数量与健康需求更加匹配、使用行为更加规范、应用质量更有保障的大型医用设备配置规划管理体系,基本满足临床诊疗、科研创新需要和人民群众多层次、多元化医疗服务需求。
三、基本原则(一)问题导向、统筹协调。
围绕群众主要健康问题和突出健康需求,根据建立分级诊疗制度和公立医院改革要求,综合考虑医学科技进步与学科发展、国民经济与社会发展水平、人民群众医疗服务需求与承受能力等因素,统筹规划布局。
(二)公平优先、兼顾效率。
优先保障基本医疗卫生服务的可及性,确保广大人民群众能够共享改革发展和科技创新成果,探索建立有利于促进资源向基层和中西部地区下沉的体制机制。
推进区域内医疗资源协同整合,提升医疗卫生服务体系的整体性和协同性。
(三)统一规划、分级负责。
不分所有制、投资主体、隶属关系和经营性质的医疗机构,配置大型医用设备均由卫生健康行政部门实行统一规划、统一准入、统一监管。
186项医疗器械行业标准出炉(附名单)4月29日,CFDA发布公告,又有93项医疗器械行业标准已经审定通过,现予以公布。
这93项行标包括:强制性标准28项,推荐性标准65项。
加上今年2月1日公布的93项行标和1项修改单,今年CFDA已经颁布了两批共186项医疗器械行业标准。
其中强制性标准42项,推荐性标准144项,还有YY 0477—2004《角膜塑形用硬性透气接触镜》第1号修改单1项。
所有强制性标准均自2018年1月1日起实施,推荐性标准自2017年1月1日起实施,修改单自发布之日起实施。
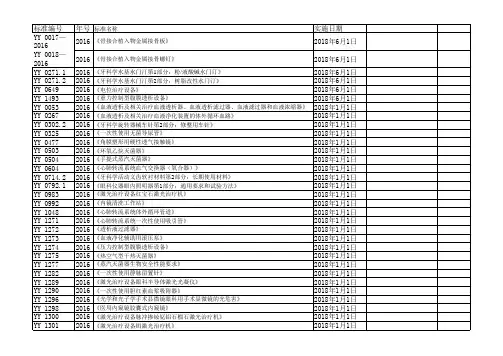
以下分别为强制性和推荐性行标的名单:序号42项强制性行标编号及名称1YY 0053—2016《血液透析及相关治疗血液透析器、血液透析滤过器、血液滤过器和血液浓缩器》2YY 0267—2016《血液透析及相关治疗血液净化装置的体外循环血路》3YY 0302.2—2016《牙科学旋转器械车针第2部分:修整用车针》4YY 0325—2016《一次性使用无菌导尿管》5YY 0477—2016《角膜塑形用硬性透气接触镜》6YY 0503—2016《环氧乙烷灭菌器》7YY 0504—2016《手提式蒸汽灭菌器》8YY 0604—2016《心肺转流系统血气交换器(氧合器)》9YY 0714.2—2016《牙科学活动义齿软衬材料第2部分:长期使用材料》10YY 0792.1—2016《眼科仪器眼内照明器第1部分:通用要求和试验方法》11YY 0983—2016《激光治疗设备红宝石激光治疗机》12YY 0992—2016《内镜清洗工作站》13YY 1048—2016《心肺转流系统体外循环管道》14YY 1271—2016《心肺转流系统一次性使用吸引管》15YY 1272—2016《透析液过滤器》16YY 1273—2016《血液净化辅助用滚压泵》17YY 1274—2016《压力控制型腹膜透析设备》18YY 1275—2016《热空气型干热灭菌器》19YY 1277—2016《蒸汽灭菌器生物安全性能要求》20YY 1282—2016《一次性使用静脉留置针》21YY 1289—2016《激光治疗设备眼科半导体激光光凝仪》22YY 1290—2016《一次性使用胆红素血浆吸附器》23YY 1296—2016《光学和光子学手术显微镜眼科用手术显微镜的光危害》24YY 1298—2016《医用内窥镜胶囊式内窥镜》25YY 1300—2016《激光治疗设备脉冲掺钕钇铝石榴石激光治疗机》26YY 1301—2016《激光治疗设备铒激光治疗机》27YY 1412—2016《心肺转流系统离心泵》28YY 1413—2016《离心式血液成分分离设备》29YY 0065—2016《眼科仪器裂隙灯显微镜》30YY 0118—2016《关节置换植入物髋关节假体》31YY 0299—2016《医用超声耦合剂》32YY 0315—2016《钛及钛合金牙种植体》33YY 0502—2016《关节置换植入物膝关节假体》34YY 0579—2016《眼科仪器角膜曲率计》35YY 0592—2016《高强度聚焦超声(HIFU)治疗系统》36YY 0605.12—2016《外科植入物金属材料第12部分:锻造钴-铬-钼合金》37YY 0621.1—2016《牙科学匹配性试验第1部分:金属-陶瓷体系》38YY 0803.3—2016《牙科学根管器械第3部分加压器》39YY 0989.6—2016《手术植入物有源植入医疗器械第6部分:治疗快速性心律失常的有源植入医疗器械(包括植入式除颤器)的专用要求》40YY 1057—2016《医用脚踏开关通用技术条件》41YY 1468—2016《用于医用气体管道系统的氧气浓缩器供气系统》42YY 1475—2016《激光治疗设备 Q开关掺钕钇铝石榴石激光治疗机》序号144项推荐性行标编号及名称1YY/T 0043—2016《医用缝合针》2YY/T 0064—2016《医用诊断X射线管组件电气及负载特性》3YY/T 0079—2016《医用金属夹》4YY/T 0243—2016《一次性使用注射器用活塞》5YY/T 0291—2016《医用X射线设备环境要求及试验方法》6YY/T 0294.1—2016《外科器械金属材料第1部分:不锈钢》7YY/T 0481—2016《医用诊断X射线设备测定特性用辐射条件》8YY/T 0583.2—2016《一次性使用胸腔引流装置第2部分:干封阀式》9YY/T 0589—2016《电解质分析仪》10YY/T 0624—2016《牙科学正畸弹性体附件》11YY/T 0625—2016《牙科学正畸丝》12YY/T 0663.3—2016《心血管植入物血管内器械第3部分:腔静脉滤器》13YY/T 0905.1—2016《牙科学场地设备第1部分:吸引系统》14YY/T 0971—2016《放射治疗用多元限束装置性能和试验方法》15YY/T 0972—2016《有源植入医疗器械植入式心律调节设备用四极连接器系统尺寸和试验要求》16YY/T 0973—2016《自动控制式近距离后装设备放射治疗计划系统性能和试验方法》17YY/T 0975—2016《麻醉和呼吸设备麻醉期间用于贴示在含药物注射器上的标签颜色、图案和特性》18YY/T 0976—2016《医用电气设备放射治疗用电离室剂量计》19YY/T 0977—2016《麻醉和呼吸设备口咽通气道》20YY/T 0978—2016《麻醉储气囊》21YY/T 0979—2016《一次性使用流产吸引管》22YY/T 0980.1—2016《一次性使用活组织检查针第1部分:通用要求》23YY/T 0981—2016《一次性使用五官冲洗器》24YY/T 0982—2016《热磁振子治疗设备》25YY/T 0984—2016《泪道塞》26YY/T 0985—2016《麻醉和呼吸设备上喉部通气道和接头》27YY/T 0987.1—2016《外科植入物磁共振兼容性第1部分:安全标记》28YY/T 0987.2—2016《外科植入物磁共振兼容性第2部分:磁致位移力试验方法》29YY/T 0987.3—2016《外科植入物磁共振兼容性第3部分:图像伪影评价方法》30YY/T 0987.4—2016《外科植入物磁共振兼容性第4部分:射频致热试验方法》31YY/T 0987.5—2016《外科植入物磁共振兼容性第5部分:磁致扭矩试验方法》32YY/T 0988.1—2016《外科植入物涂层第1部分:钴-28铬-6钼粉末》33YY/T 0988.2—2016《外科植入物涂层第2部分:钛及钛-6铝-4钒合金粉末》34YY/T 0988.11—2016《外科植入物涂层第11部分:磷酸钙涂层和金属涂层拉伸试验方法》35YY/T 0988.12—2016《外科植入物涂层第12部分:磷酸钙涂层和金属涂层剪切试验方法》36YY/T 0988.13—2016《外科植入物涂层第13部分:磷酸钙、金属和磷酸钙/金属复合涂层剪切和弯曲疲劳试验方法》37YY/T 0988.14—2016《外科植入物涂层第14部分:多孔涂层体视学评价方法》38YY/T 0988.15—2016《外科植入物涂层第15部分:金属热喷涂涂层耐磨性能试验方法》39YY/T 1031—2016《持针钳》40YY/T 1043.1—2016《牙科学牙科治疗机第1部分:通用要求与测试方法》41YY/T 1146—2016《医用光学仪器照度测试方法》42YY/T 1276—2016《医疗器械干热灭菌过程的开发、确认和常规控制要求》43YY/T1283—2016《可吸收性明胶海绵》44YY/T 1287.1—2016《颅外引流系统第1部分:颅脑穿刺外引流收集装置》45YY/T 1291—2016《一次性使用胰岛素泵用皮下输液器》46YY/T 1293.1—2016《接触性创面辅料第1部分:凡士林纱布》47YY/T 1293.2—2016《接触性创面敷料第2部分:聚氨酯泡沫敷料》48YY/T 1306—2016《熏蒸治疗仪》49YY/T 1307—2016《医用乳腺数字化X射线摄影用探测器》50YY/T 1308—2016《自动控制式近距离治疗后装设备》51YY/T 1309—2016《清洗消毒器超声清洗的要求和试验》52YY/T 1400—2016《牙科学牙科设备表面材料耐受化学消毒剂的测定》53YY/T 1401—2016《牙齿美白冷光仪》54YY/T 1402—2016《医疗器械蒸汽灭菌过程挑战装置适用性的测试方法》55YY/T 1404—2016《含铜宫内节育器用铜的技术要求与试验方法》56YY/T 1405—2016《机械避孕器械可重复使用的天然和硅橡胶阴道隔膜要求和试验》57YY/T 1406.1—2016《医疗器械软件第1部分:YY/T0316应用于医疗器械软件的指南》58YY/T 1407—2016《放射治疗模拟机影像系统性能和试验方法》59YY/T 1408—2016《单光子发射及X射线计算机断层成像系统性能和试验方法》60YY/T 1409—2016《等离子手术设备》61YY/T 1410—2016《平衡测试训练系统》62YY/T 1411—2016《牙科学对改善或维持牙科治疗机治疗用水微生物质量的措施进行评估的试验方法》63YY/T 1414—2016《血液透析设备液路用电磁阀技术要求》64YY/T 1415—2016《皮肤吻合器》65YY/T 1416.1—2016《一次性使用人体静脉血样采集容器中添加剂量的测定方法第1部分:乙二胺四乙酸(EDTA)盐》66YY/T 0127.18—2016《口腔医疗器械生物学评价第18部分:牙本质屏障细胞毒性试验》67YY/T 0316—2016《医疗器械风险管理对医疗器械的应用》68YY/T 0466.1—2016《医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求》69YY/T0467—2016《医疗器械保障医疗器械安全和性能公认基本原则的标准选用指南》70YY/T 0486—2016《激光手术专用气管导管标记和随机信息的要求》71YY/T 0496—2016《牙科学铸造蜡和基托蜡》72YY/T 0506.2—2016《病人、医护人员和器械用手术单、手术衣和洁净服第2部分:性能要求和试验方法》73YY/T 0586—2016《医用高分子制品 X 射线不透性试验方法》74YY/T 0616.1—2016《一次性使用医用手套第1部分:生物学评价要求与试验》75YY/T 0616.2—2016《一次性使用医用手套第2部分:测定货架寿命的要求和试验》76YY/T 0651.1—2016《外科植入物全髋关节假体的磨损第1部分:磨损试验机的载荷和位移参数及相关的试验环境条件》77YY/T 0652—2016《植入物材料的磨损聚合物和金属材料磨屑分离和表征》78YY/T 0734.4—2016《清洗消毒器第4部分:对非介入式等医疗器械进行湿热消毒的清洗消毒器要求和试验》79YY/T 0752—2016《电动骨组织手术设备》80YY/T 0869.1—2016《医疗器械不良事件分级编码结构第1部分:事件类型编码》81YY/T 0869.2—2016《医疗器械不良事件分级编码结构第2部分:评价编码》82YY/T 0980.2—2016《一次性使用活组织检查针第2部分:手动式》83YY/T 1015—2016《眼用持针钳》84YY/T 1286.2—2016《血小板贮存袋性能第2部分:血小板贮存性能评价指南》85YY/T 1287.2—2016《颅脑外引流系统第2部分:腰椎穿刺脑脊液外引流收集装置》86YY/T 1287.3—2016《颅脑外引流系统第3部分:颅脑外引流导管》87YY/T 1292.3—2016《医疗器械生殖和发育毒性试验第3部分:一代生殖毒性试验》88YY/T 1416.2—2016《一次性使用人体静脉血样采集容器中添加剂量的测定方法第2部分: 柠檬酸钠》89YY/T 1418—2016《眼科光学和仪器人眼像差表述》90YY/T 1419—2016《超声准静态应变弹性性能试验方法》91YY/T 1420—2016《医用超声设备环境要求及试验方法》92YY/T 1421—2016《载脂蛋白B测定试剂盒》93YY/T 1423—2016《幽门螺杆菌抗体检测试剂盒(胶体金法)》94YY/T 1424—2016《沙眼衣原体DNA检测试剂盒(荧光PCR法)》95YY/T 1425—2016《防护服材料抗注射针穿刺性能标准试验方法》96YY/T 1426.1—2016《外科植入物全膝关节假体的磨损第1部分:载荷控制的磨损试验机的载荷和位移参数及相关的试验环境条件》97YY/T 1426.2—2016《外科植入物全膝关节假体的磨损第2部分:测量方法》98YY/T 1427—2016《外科植入物可植入材料及医疗器械静态和动态腐蚀试验的测试溶液和条件》99YY/T 1428—2016《脊柱植入物相关术语》100YY/T 1429—2016《外科植入物丙烯酸类树脂骨水泥矫形外科用丙烯酸类树脂骨水泥弯曲疲劳性能试验方法》101YY/T 1430—2016《外科植入物用超高分子量聚乙烯小冲孔试验方法》102YY/T 1431—2016《外科植入物医用级超高分子量聚乙烯纱线》103YY/T 1432—2016《通过测量热封试样的密封强度确定医疗器械软性包装材料的热封参数的试验方法》104YY/T 1433—2016《医疗器械软性包装材料热态密封强度(热粘强度)试验方法》105YY/T 1434—2016《人类体外辅助生殖技术用医疗器械体外鼠胚试验》106YY/T 1436—2016《造口术和失禁辅助器具灌洗器要求和试验方法》107YY/T 1437—2016《医疗器械 YY/T 0316应用指南》108YY/T 1438—2016《麻醉和呼吸设备评价自主呼吸者肺功能的呼气峰值流量计》109YY/T 1439.2—2016《医用气体压力调节器第2部分:汇流排压力调节器和管道压力调节器》110YY/T 1440—2016《与医用气体系统一起使用的高压挠性连接》111YY/T1441—2016《体外诊断医疗器械性能评估通用要求》112YY/T 1442—2016《β2-微球蛋白定量检测试剂(盒)》113YY/T 1443—2016《甲型流感病毒抗原检测试剂盒(免疫层析法)》114YY/T 1444—2016《总蛋白测定试剂盒》115YY/T 1446—2016《医用内窥镜内窥镜器械掌式器械》116YY/T 1447—2016《外科植入物植入材料磷灰石形成能力的体外评估》117YY/T 1448—2016《脂蛋白(a)测定试剂盒》118YY/T 1449.3—2016《心血管植入物人工心脏瓣膜第3部分:经导管植入式人工心脏瓣膜》119YY/T 1450—2016《载脂蛋白A-I测定试剂(盒)》120YY/T 1451—2016《脑利钠肽和氨基末端脑利钠肽前体检测试剂(盒)(定量标记免疫分析法)》121YY/T 1452—2016《干式血液细胞分析仪(离心法)》122YY/T 1454—2016《自我检测用体外诊断医疗器械基本要求》123YY/T 1455—2016《应用参考测量程序对酶催化活性浓度赋值及其不确定度评定指南》124YY/T 1456—2016《铁蛋白定量检测试剂(盒)》125YY/T 1457—2016《无源外科植入物硅凝胶填充乳房植入物中寡聚硅氧烷类物质测定方法》126YY/T 1458—2016《抗甲状腺过氧化物酶抗体定量检测试剂(盒)(化学发光免疫分析法)》127YY/T 1459—2016《人类基因原位杂交检测试剂盒》128YY/T 1460—2016《血液流变仪》129YY/T 1461—2016《缺血修饰白蛋白测定试剂(盒)》130YY/T 1462—2016《甲型H1N1流感病毒RNA检测试剂盒(荧光PCR法)》131YY/T 1463—2016《医疗器械灭菌确认选择微生物挑战和染菌部位的指南》132YY/T 1464—2016《医疗器械灭菌低温蒸汽甲醛灭菌过程的开发、确认和常规控制要求》133YY/T 1465.1—2016《医疗器械免疫原性评价方法第1部分体外T淋巴细胞转化试验》134YY/T 1465.2—2016《医疗器械免疫原性评价方法第2部分血清免疫球蛋白和补体成分测定ELISA法》135YY/T 1466—2016《口腔X射线数字化体层摄影设备骨密度测定评价方法》136YY/T 1467—2016《医用包扎敷料救护绷带》137YY/T 1469—2016《便携式电动输液泵》138YY/T 1470—2016《一次性使用脐带剪(切)断器》139YY/T 1471—2016《含铜宫内节育器用含吲哚美辛硅橡胶技术要求与试验方法》140YY/T 1472.1—2016《胸科小切口器械第1部分:滑板式手术钳》141YY/T 1473—2016《医疗器械标准化工作指南涉及安全要求的标准制定》142YY/T 1474—2016《医疗器械可用性工程对医疗器械的应用》143YY/T 1476—2016《超声膀胱扫描仪通用技术条件》144YY/T 1477.1—2016《接触性创面敷料性能评价用标准试验模型第1部分:评价抗菌活性的体外创面模型》。
医疗器械标准规划(2018—2020年)
医疗器械标准是医疗器械研制、生产、经营、使用以及监督管理所遵循的统一技术要求,也是医疗器械产业发展水平的重要标志。
为深入贯彻《中共中央国务院关于开展质量提升行动的指导意见》以及中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,按照《医疗器械标准管理办法》和《医疗器械标准制修订工作管理规范》有关要求,进一步提升医疗器械标准化水平,助推医疗器械创新发展,充分发挥标准管理的基础保障作用,特制定本规划。
一、指导思想
贯彻落实深化药品医疗器械审评审批制度改革和国家标准化工作改革要求,加快建立“最严谨的标准”,实施医疗器械标准提高计划,完善医疗器械标准管理机制,优化医疗器械标准体系,强化医疗器械标准实施与监督,夯实医疗器械标准化技术基础,提升与国际标准一致性程度,增强医疗器械标准国际化水平,充分发挥标准的支撑和引领作用,服务医疗器械科学监管、服务人民用械安全、服务医疗器械产业发展。
二、基本原则
需求引领,统筹协调。
优先开展医疗器械科学监管和产业发
—1 —
展急需标准的制修订和贯彻实施,构建结构合理、规模适度、内容科学的医疗器械标准体系。
完善标准管理工作机制,加强标准与监管、科研、产业的密切结合,强化标准与法律法规、政策措施的协调衔接,统筹协调各方力量,充分调动各方积极性,共同推动医疗器械标准化发展。
深化改革,创新发展。
全面贯彻落实药品医疗器械审评审批制度改革和国家标准化工作改革要求,以创新发展为驱动,提升医疗器械标准科研能力,鼓励创新、自主制定标准,着力推动我国医疗器械特色优势领域技术和标准的国际化进程。
重点突破,整体提升。
找准医疗器械标准工作的主攻方向和着力点,突出优先主题和重点领域,着力推进基础性通用标准的制修订工作,突出创新医疗器械领域标准工作,推动科技成果及时转化为标准,全面提高标准制修订、实施与监督的系统性、协调性、科学性和适用性。
三、总体目标
到2020年,建成基本适应医疗器械监管需要的医疗器械标准体系。
制修订医疗器械标准300项,标准覆盖面进一步提升,标准有效性、先进性和适用性显著增强。
医疗器械标准制修订更加及时,标准制修订管理更加规范,标准实施与监督进一步强化。
医疗器械标准化国际合作交流更加深入,国际影响力和话语权逐步提升。
四、主要任务
(一)完善机制体制,健全医疗器械标准体系
加强《医疗器械标准管理办法》《医疗器械标准制修订工作管理规范》的宣传培训,确保各项标准管理制度严格落实。
以科学监管和产业发展为出发点,继续开展医疗器械强制性标准整合精简工作,对推荐性标准进行集中复审。
不断完善国家标准和行业标准相互衔接、强制性标准和推荐性标准互为支撑的医疗器械标准体系。
对不符合监管要求、不适应产业发展需求的标准进行全面清理。
加快医疗器械标准与国际接轨。
积极探索和推动在国家发展战略部署和监管亟需的领域筹建新的医疗器械标准化技术委员会,构建科学合理、满足监管需要和引领产业创新发展的医疗器械标准体系。
(二)以需求为导向,推进重点领域医疗器械标准制修订工作健全以需求为导向的标准立项机制,加强对涉及人体健康和生命安全的通用性基础标准的制修订,加快完善涵盖质量管理、临床试验管理等内容的管理标准,强化风险管理和过程控制,满足监管需求。
开展有源、无源、体外诊断试剂类重点领域医疗器械产品标准和方法标准提高工作,有效提升标准覆盖面。
①医疗器械质量管理标准化重点领域
—3 —
②有源医疗器械标准化重点领域
③无源医疗器械标准化重点领域
④体外诊断医疗器械标准化重点领域
(三)规范标准管理,有效提升医疗器械标准质量
严格按照《医疗器械标准管理办法》《医疗器械标准制修订工作管理规范》规定开展标准立项、起草、验证、征求意见、技术审查、批准发布、实施和评价、复审和废止等工作,确保标准制修订合法合规、科学可靠。
医疗器械标准管理中心强化标准制修订工作的组织管理职能,推进标准制修订全过程的精细化管理,按照有关规定对医疗器械标准化技术委员会(以下简称技委会)、医疗器械标准化分技术委员会(以下简称分技委会)和标准化技术归口单位(以下简称技术归口单位)的工作进行量化考核评估,提高标准管理水平。
进一步优化技委会、分技委会和技术归口单位的委员构成,防止出现技术垄断和不公平竞争。
(四)创新引领标准提升,逐步增强医疗器械标准科技支撑能力
坚持以科技引领标准水平提升,推动医疗器械标准化工作与国家科技创新体系深度融合,促进医疗器械标准化与科技创新、产业发展紧密结合。
持续稳定支持基础性、战略性、前沿性关键技术标准和共性标准研究。
适应科学技术快速发展形势下对标准制定的新要求,通过标准提升引领高新技术产品发展,提升我国医疗器械产业整体竞争力。
健全标准创新协同推进机制,鼓励检验研发机构、科研院校、生产企业等合作开展标准研究,培育中
—5 —
国医疗器械标准国际竞争新优势。
(五)深化国际交流合作,力争医疗器械国际标准化工作取得新突破
持续深化医疗器械标准国际交流与合作,积极引进国际标准先进管理经验,鼓励标准“走出去”和“请进来”。
深度参与并推动国际医疗器械监管者论坛(IMDRF)国际标准研究工作,继续加强与德国电工委员会、美国电气和电子工程师协会(IEEE)等国际标准化组织的深度合作,探索推动我国医疗器械优势领域抢占国际标准新高地。
健全我国医疗器械标准化专家参与国际标准工作机制,推荐我国医疗器械专家加入对口国际标准化组织,及时跟踪国际标准制修订动态,在充分研究我国国情和产业发展基础上推进国际标准转化工作,全面提升与国际标准一致性程度。
(六)全方位推进医疗器械标准实施,强化标准监督
加快医疗器械标准信息化管理进程,原则上标准发布后20个工作日内公开标准文本,涉及采标的推荐性标准文本在遵守国际(国外)标准组织版权政策前提下进行公开。
加强标准宣贯培训工作,逐步建立权威高效、层次分明的宣贯培训体系,促进标准准确有效实施。
技委会、分技委会和技术归口单位应在标准发布后开展相应领域标准宣传、培训,医疗器械标准管理中心做好组织管理工作并根据情况开展重要标准的宣贯,做好公众普遍关
注标准的解读。
技委会、分技委会和技术归口单位应加大对标准实施情况的跟踪评价,对于实施过程中发现的问题应组织研究,提出解决方案并及时报送医疗器械标准管理中心。
医疗器械标准管理中心应组织对标准实施情况进行调研,协调解决标准实施中的技术问题,不断提升标准的科学性和适用性。
医疗器械企业应当保证出厂产品符合强制性标准以及经注册或者备案的产品技术要求,食品药品监管部门强化对医疗器械企业实施情况的监督检查。
进一步畅通投诉举报渠道,加强标准实施的社会监督。
五、保障措施
(一)加强组织领导。
各医疗器械标准化有关单位要充分认识医疗器械标准工作的重要性,统一思想、提高认识,切实加强对医疗器械标准工作的统筹协调和组织领导,建立科学合理的标准管理工作机制,加大支持力度,为承担医疗器械标准制修订以及国际标准化交流合作等工作提供必要条件和基本保障。
(二)加强经费保障。
加大医疗器械标准工作的经费支持力度,形成持续稳定的经费保障机制,切实保障标准制修订、跟踪评价等工作的开展。
鼓励有条件的检验检测机构、行业企业、高校科研院所、社会团体等加大投入,参与医疗器械标准制修订工作。
强化标准工作经费管理,提高经费使用效益。
(三)加强人才队伍建设。
加强医疗器械标准管理中心和各技委会、分技委会和技术归口单位的标准管理专职人员队伍建
—7 —
设,各技委会、分技委会和技术归口单位应设专门处室和专人负责标准工作,配备与医疗器械标准工作任务相匹配的人员。
到2020年,医疗器械标准管理中心人员达到70人,各技委会、分技委会和技术归口单位秘书处承担单位标准管理人员达到200人。
医疗器械标准管理中心、各技委会、分技委会和技术归口单位应制定实施标准工作人员培训计划,注重培养具有国际视野、综合协调和组织能力强的多学科专业人才,提升医疗器械标准制修订和管理水平。
(四)加强医疗器械标准信息化建设。
加快医疗器械标准管理信息服务平台的建设,按规定实现标准文本公开和免费查询,推进医疗器械行业标准制修订全过程信息化管理,通过信息手段实现标准立项、起草、验证、征求意见、技术审查、实施和评价、复审和废止等的动态掌控,强化对各技委会、分技委会和技术归口单位标准工作的管理和指导,提高医疗器械标准制修订工作的科学性、规范性和时效性。