黄浦高中补习班高一化学《原子结构》
- 格式:doc
- 大小:235.50 KB
- 文档页数:5
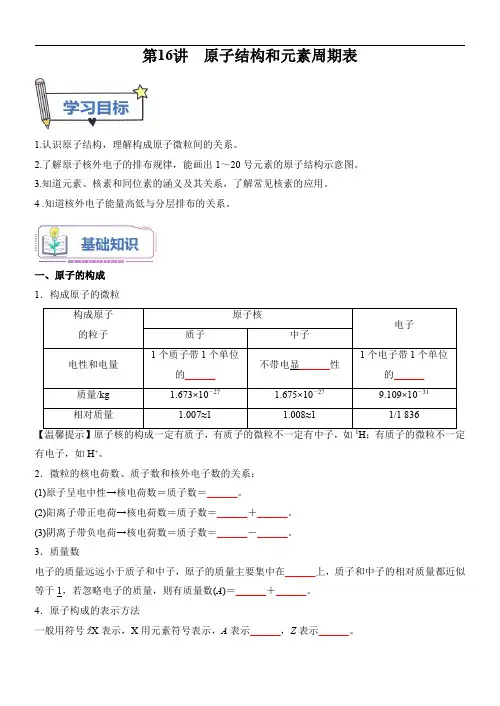
第16讲原子结构和元素周期表1.认识原子结构,理解构成原子微粒间的关系。
2.了解原子核外电子的排布规律,能画出1~20号元素的原子结构示意图。
3.知道元素、核素和同位素的涵义及其关系,了解常见核素的应用。
4.知道核外电子能量高低与分层排布的关系。
一、原子的构成1.构成原子的微粒构成原子的粒子原子核电子质子中子电性和电量1个质子带1个单位的______不带电显______性1个电子带1个单位的______质量/kg 1.673×10-271.675×10-279.109×10-31相对质量1.007≈1 1.008≈11/1836【温馨提示】原子核的构成一定有质子,有质子的微粒不一定有中子,如1H ;有质子的微粒不一定有电子,如H +。
2.微粒的核电荷数、质子数和核外电子数的关系:(1)原子呈电中性→核电荷数=质子数=______。
(2)阳离子带正电荷→核电荷数=质子数=______+______。
(3)阴离子带负电荷→核电荷数=质子数=______-______。
3.质量数电子的质量远远小于质子和中子,原子的质量主要集中在______上,质子和中子的相对质量都近似等于1,若忽略电子的质量,则有质量数(A )=______+______。
4.原子构成的表示方法一般用符号A Z X 表示,X 用元素符号表示,A 表示______,Z 表示______。
二、核外电子的排布1.核外电子分层排布(1)依据:含多个电子的原子里,电子的能量不同,运动区域离核的______不同。
(2)电子层与电子能量的关系电子层序数1234567电子层符号K L M N O P Q电子离核距离由______及______电子能量由______到______2.核外电子排布规律(1)完成下列表格:核电荷数元素名称元素符号各电子层的电子数K L M N1氢H18氧O2611钠Na28117氯Cl28718氩Ar28819钾K2881(2)观察分析上表,元素原子核外电子排布的规律特点:①______;②______;③______;④______。

第一章打开原子世界的大门第一讲从葡萄干面包模型到原子结构的行星模型学习要点: 19 世纪末到20 世纪初,几位重要的科学家及重要的科学发现。
学习难点:模型方法和实验方法对原子结构发现的作用。
【学前思虑】1、化学的研究对象是什么?2、物质是由什么组成的?【认知新知识】1、古典原子论(年代:我国战国时期)[ 问题 ](1) 祖先对物质的组成有怎样的见解?古希腊唯物主义哲学家德谟克利特认为:物质由极小的称为“原子”的微粒组成,物质只能切割到原子为止。
【思虑】从现代见解看,古代的原子学说也是很有道理的,但为什么不能够成为一个完满的理论?2、近代原子论(1)道尔顿原子论(1803 年)约翰·道尔顿( 1766— 1844)是英国化学家、物理学家。
1808 年他公布了《道尔顿原子学》,从而被誉为原子理论的创办人。
他认为原子是组成物质的最小微粒,不能再分。
道尔顿原子论的要点:①化学元素由不能再分的微粒组成,这种微粒称为原子;②原子在所有化学变化中不能再分;③同一元素的原子在质量和性质上都相同,不相同元素的原子在质量和性质上不相同;④不相同元素化合时,这些元素的原子按简单整数比结合成化合物。
【问题】同学们从已经掌握的知识去解析,道尔顿原子论可否合理?拥有哪些片面性?(2)汤姆孙葡萄干面包模型(1904 年)约瑟夫·约翰·汤姆孙,(Joseph John Thomson)1856 年 12 月 18 日生于英国曼彻斯特郊区。
1876 年入剑桥大学三一学院,毕业后,进入卡文迪许实验室。
1884 年,年仅 28 岁便当选为皇家学会会员。
同年关,又继瑞利此后担当卡文迪许实验室教授,第一个原子结构模型—葡萄干面包模型的提出者。
汤姆生认为:原子中的正电荷均匀地分布在整个原子的球形体内,电子则均匀分布在这些正电荷之间,就像葡萄干面包相同。
【课外阅读】由于 X 射线的发现,人们得出结论:原子可能还不是最小的。


第一节原子结构模型一.课标解读:1.认识原子核的结构,懂得质量数和的含义,掌握构成原子的微粒间的关系,知道元素、核素、同位素的涵义。
3.掌握原子核外电子排布的基本规律,能画出1~18号元素的原子结构示意图。
4.了解原子的最外层电子排布与元素的原子得、失电子能力和化合价的关系;掌握常见元素的电子排布式。
5.了解原子结构模型的发展历史了解氢原子光谱和玻尔的结构模型了解原子“基态”、“激发态”的概念。
6.了解原子核外电子的运动特征及四个量子数的具体含义,能用四个量子数描述原子核外电子的运动状态。
7.了解s,p,d轨道电子云的不同。
二.知识点精讲(知识再现)1.原子的构成:2.原子中有关量的关系:质子数=核电荷数=核外电子数=原子序数离子电荷数=质子数—核外电子数质量数(A)=质子数(Z)+中子数(N)质子数(Z)=离子的核外电子数+离子的电荷数(阳离子为正,阴离子为负)3.同位素:4.相对原子质量=元素的一个原子的质量/1个12C原子的质量×1/125.几种特殊粒子的结构特点:⑴离子的电子层排布:主族元素阳离子跟上一周期稀有气体的电子层排布相同;阴离子跟同一周期稀有气体的电子排布相同,如O2-、F-与Ne相同⑵等电子粒子(注意主要元素在周期表中的相对位置)①10电子粒子:CH4、N3-、NH2-、NH3、NH4+、O2-、OH-、H2O、H3O+、F-、HF、Ne、Na+、Mg2+、Al3+等②18电子粒子:SiH4、P3-、PH3、S2-、HS-、H2S、Cl-、HCl、Ar、K+、Ca2+、等(F2、H2O2、C2H6、CH3OH)③核外电子总数及质子总数均相同的阳离子有:Na+、NH4+、H3O+等;阴离子有:F-、OH-、NH2-、HS-、Cl-等。
6.氢原子光谱:广义上讲光即,可见光的真空波长在之间。
可见光的视觉颜色不同,根本原因是。
氢气在高压分解为原子后得到的光谱特点是,这种光谱是,原子光谱即为;而阳光形成光谱为,这种光谱特点是。

高中化学原子结构知识点原子结构是化学中一个非常重要的概念,它揭示了物质的微观世界,为我们理解物质的性质和变化提供了重要的依据。
在高中化学学习中,原子结构知识是基础中的基础,下面就来系统地总结一下高中化学中关于原子结构的知识点。
一、原子的组成原子由原子核和核外电子组成。
原子核由质子和中子构成,质子带正电荷,中子不带电荷,所以原子核带正电荷。
核外电子围绕原子核运动,负电子的电荷数目与正电子的电荷数目相等,因此原子是电中性的。
二、质子数与电子数在稳定原子中,质子数和电子数相等,即原子序数(Z)等于电子数,也等于质子数。
例如,氢的原子序数为1,氢原子中有一个质子和一个电子。
氦的原子序数为2,氦原子中有两个质子和两个电子。
三、原子的量子结构根据量子力学理论,原子的电子围绕原子核运动的轨道是不连续的,称为能级或壳层。
能级的内层能量较低,外层能量较高。
第一层最多容纳2个电子,第二层最多容纳8个电子,第三层最多容纳18个电子。
四、原子序数和周期表原子序数是元素在周期表中的位置,它代表了元素中质子的数目。
根据原子序数的增加规律,元素的性质也呈现出周期性变化。
元素周期表是根据元素的原子序数和原子结构排列的,它反映了元素性质的周期性规律。
五、同位素具有相同原子序数(即相同的质子数)但质量数不同的原子称为同位素。
同位素在化学性质上基本相同,在物理性质上有些微差异。
同位素在许多领域都有重要应用,比如放射性同位素用于医学诊断和治疗,稳定同位素用于示踪和标记等。
六、原子核的结构原子核由质子和中子组成,质子数和中子数的总和称为质子数。
核外电子对核的作用力是库仑引力,核内质子之间的排斥力来自短程作用力。
原子核的直径约为10^-15米,占整个原子体积的小部分,但质子和中子的质量几乎占据了整个原子质量。
七、原子核的稳定性原子核的稳定性取决于核内质子和中子的比例,质子数和中子数适当平衡时,原子核更加稳定。
如果原子核过于不稳定,可能发生放射性衰变,放出辐射而转变为其他核。

原子的结构高一知识点原子的结构在高中化学课程中,原子的结构是一个重要的知识点。
原子是物质的最小单位,所有物质都由原子组成。
本文将通过一系列的探讨,介绍原子的结构。
1. 原子的基本构成原子由三种基本粒子组成:质子、中子和电子。
质子带正电荷,中子不带电荷,电子带负电荷。
质子和中子位于原子的核心,称为原子核,而电子围绕原子核中运动,形成电子云。
2. 质子和中子质子和中子是原子核的组成部分。
质子的质量约为1.67×10-27千克,中子的质量与质子相当。
质子和中子的总数称为原子的质子数或原子序数,通常用字母Z表示。
3. 电子电子是原子中最轻的粒子,质量约为9.11×10-31千克。
电子呈负电荷,质子的正电荷和电子的负电荷相等,所以一个原子总体上是电中性的。
电子围绕着原子核中的质子和中子运动,根据不同能级可以分布在不同轨道上。
4. 原子核原子核是质子和中子组成的密集区域。
质子和中子彼此之间通过核力相互作用,在核内保持相对稳定。
原子核的大小通常比整个原子的大小小近10,000倍。
5. 原子的能级和轨道原子的电子以轨道的形式存在。
轨道是电子运动的路径,描述了电子的位置和能量。
轨道上可以存在不同能级的电子。
能级越高,电子的能量越大。
轨道和能级的概念为解释原子的化学性质提供了基础。
6. 原子的精细结构在经典物理学中,原子的结构被描述为质子和电子围绕着中子运动。
然而,量子力学的发展揭示了原子结构的更为复杂的本质。
根据量子力学,原子的电子不再按照经典轨道运动,而是分布在不同的电子云中。
这个分布被描述为电子密度,可以通过解Schrödinger方程来获得。
7. 原子的碱金属和卤素族元素碱金属和卤素族元素是高中化学中常见的原子种类。
碱金属元素的原子核只有一个质子,如钠的原子核中只有一个质子,而卤素族元素的原子核有很多中子和质子,如氯的原子核中有17个质子和18个中子。
8. 原子的同位素原子的同位素是指原子的质子数相同,但中子数不同的同一种元素。

第二节同位素和相对原子质量教学目标:1.理解同位素的概念,进一步掌握原子的构成。
2.能根据元素中各同位素的原子百分含量,计算元素的平均相对原子质量。
3.理解C-14在考古断代中的应用。
4.学习物质的量概念,学会物质的量,物质的质量和微粒数三者之间的简单换算。
情感目标:通过学习同位素在考古断代中的应用,了解我国的考古文化。
知识讲解:一.同位素思考1:我们是如何知道文物年代的学生讨论探究:同位素是怎样发现的提出问题:卢瑟福发现元素具有三种辐射,辐射以后变成了什么元素这些元素性质如何实验事实:有些元素质量相同,而化学性质不同;有些元素的质量不同,化学性质却相同。
同位素概念的提出:1913年,英国科学家索第提出了同位素的概念。
思考3:为什么同位素的化学性质相同,质量却不同推测:化学性质相同,说明他们的结构相同。
元素的化学性质是由原子的核外电子排布所决定的。
化学性质相同,一定时原子核外电子排布相同。
结论:同位素具有相同的质子数,不同的中子数。
结论:1.各同位素原子的化学性质完全相同,但它们的相对原子质量一定不同。
2天然存在的各同位素原子,他们所占的原子百分数是保持不变的。
思考5:同位素的应用十分广泛,用的较普遍的有什么方面探测金属器件缺陷,粮食育种,保存食物,医疗疾病,研究化学反响机理等二.原子核的组成探究1:从同位素的概念思索,原子核有怎样的组成讲述:两种同位素的质量不同,但电子数和质子数相同,由于只有电子实在原子核外运动的,那么构成原子核的微粒除质子外,还一定存在另一种微粒〔这种微粒称为中子〕结论:原子核由质子和中子组成。
探究2:质子和中子的质量哪个大结论:中子不带电,质量与质子的质量几乎相等。
质量数的概念:质子的相对质量〔取正整数〕和中子的相对质量〔取正整数〕之和。
质量数=质子数+中子数思考:通过以上讨论和总结,你对原子有什么认识1.原子不显电性。
2.原子的质量都集中在原子核上。
补充内容:1.元素符号的表示方法。

煌敦市安放阳光实验学校第二中学高一化学《第一章原子结构与元素周期律》知识总结必修2
一原子结构:
原子的构成:
相关知识点:原子的构成、核素、同位素、质量数、原子核外电子排布、10电子微粒、18电子微粒
2. 元素周期表和周期律
二、元素周期律与元素周期表
相关知识点:元素周期律、粒子半径大小比较、元素周期表结构、位-构-性关系。
(1)元素周期表的结构
A. 周期序数=电子层数
B. 原子序数=质子数
C. 主族序数=最外层电子数=元素的最高正价数
D. 主族非金属元素的负化合价数=8-主族序数
E. 周期表结构
(2)元素周期律()
A. 元素的金属性和非金属性强弱的比较(难点)
a. 单质与水或酸反置换氢的难易或与氢化合的难易及气态氢化物的稳性
b. 最高价氧化物的水化物的碱性或酸性强弱
c. 单质的还原性或氧化性的强弱
(注意:单质与相离子的性质的变化规律相反)B. 元素性质随周期和族的变化规律
a. 同一周期,从左到右,元素的金属性逐渐变弱
b. 同一周期,从左到右,元素的非金属性逐渐增强
c. 同一主族,从上到下,元素的金属性逐渐增强
d. 同一主族,从上到下,元素的非金属性逐渐减弱
C. 第三周期元素的变化规律和碱金属族和卤族元素的变化规律(包括物理、化学性质)
D. 微粒半径大小的比较规律:
a. 原子与原子
b. 原子与其离子
c. 电子层结构相同的离子
(3)元素周期律的用(重难点)
A. “位,构,性”三者之间的关系
a. 原子结构决元素在元素周期表中的位置
b. 原子结构决元素的化学性质
c. 以位置推测原子结构和元素性质
B. 预测元素及其性质。


高一化学原子结构与性质知识点原子是构成物质的最基本单位,掌握原子结构与性质对于深入理解化学世界至关重要。
本文将为您详细介绍高一化学原子结构与性质的相关知识点。
一、原子结构原子由带正电的原子核和围绕核运动的电子构成。
1. 原子核:原子核由带正电的质子和中性粒子——中子组成。
质子质量为1,带正电;中子质量为1,电荷中性。
2. 电子:电子是质量很轻、带负电的粒子。
每个原子的电子数与质子数相同,使得原子整体电荷为中性。
二、原子质量原子质量是指一个原子的质子数和中子数之和。
以质子质量为基础,可以计算出原子质量的相对大小。
1. 原子质量单位:原子质量单位(缩写:u)定义为^12C的质量的1/12。
相对质量较小的元素,其原子质量是小数;较重的元素,原子质量通常为整数。
2. 原子质量数:原子质量数是指原子核中质子数和中子数之和。
用A表示,如氧的原子质量数为16。
三、元素周期表元素周期表是由Dmitri Mendeleev按照原子序数和性质将元素分类而成的表格。
使用元素周期表可以了解元素的基本性质和结构。
1. 元素周期表的构成:元素周期表按序数递增排列,横排称为周期,竖排称为族。
2. 元素周期表的分区:- 主族元素:位于周期表的1A至8A族元素,具有较为相似的性质。
- 过渡元素:位于主族元素之后,包括3B至2B族元素。
- 稀有气体:位于元素周期表最后一列的18族元素,具有稳定的八电子外层。
- 锕系和锔系元素:位于元素周期表下方的两行分别为锕系和锔系元素。
四、原子的电子结构原子的电子结构指的是原子内电子的排布方式,可分为主壳层、次壳层和轨道。
1. 主壳层:原子中离核越远的电子主壳层数值越大。
主壳层的编号使用数字和字母表示(如1、2、3...K、L、M)。
2. 次壳层:主壳层内部的层级,由数字表示(如1s、2s、2p 等)。
3. 轨道:次壳层下的进一步划分,用字母表示(如s、p、d、f 等)。
五、原子的化学键和分子原子间的化学键和分子为物质的结构和性质提供了基础。

《原子结构》课件一、教学内容本节课我们将学习《化学》教材第四章第二节“原子结构”的内容。
详细内容包括原子理论的发展历程、原子的组成结构,以及原子中各粒子之间的关系。
二、教学目标1. 让学生了解原子理论的发展历程,理解原子结构的组成及特点。
2. 使学生掌握原子中各粒子之间的关系,并能运用这些关系解释一些化学现象。
3. 培养学生的观察、分析和解决问题的能力,激发学生对化学学科的兴趣。
三、教学难点与重点教学难点:原子结构的理解,原子中各粒子之间的关系的掌握。
教学重点:原子结构的组成,原子中正电荷与电子的分布关系。
四、教具与学具准备1. 教具:原子模型、PPT课件、实验器材。
2. 学具:笔记本、教材、练习册。
五、教学过程1. 实践情景引入通过展示一些日常生活中的化学现象,如燃烧、腐蚀等,引导学生思考这些现象背后的原因,从而引出原子结构的学习。
2. 理论讲解利用PPT课件,讲解原子理论的发展历程,重点介绍道尔顿、汤姆逊、卢瑟福等科学家的原子模型。
3. 例题讲解以氦原子为例,讲解原子中各粒子之间的关系,强调原子序数、质子数、中子数、电子数之间的对应关系。
4. 随堂练习让学生根据所学内容,分析一些简单化学现象,如氧化、还原等,并解释其原理。
5. 实验演示演示原子吸收光谱的实验,让学生直观地了解原子结构的特点。
七、作业设计1. 作业题目:(1)简述道尔顿、汤姆逊、卢瑟福的原子理论。
(2)解释为什么原子是电中性的。
(3)某元素的原子序数为20,其原子中有多少个质子、电子和中子?2. 答案:(1)道尔顿:原子是不可分割的小颗粒;汤姆逊:原子是一个带正电荷的均匀分布的球体,电子镶嵌在其中;卢瑟福:原子由一个带正电荷的核和围绕核旋转的电子组成。
(2)原子是电中性的,因为原子核中的质子数等于核外的电子数,正负电荷相互抵消。
(3)该元素的原子核中有20个质子,核外有20个电子,中子数不确定。
八、课后反思及拓展延伸本节课学生对原子结构有了基本的认识,但在理解原子中各粒子之间的关系方面还存在一定困难。
化学张S老师秋季教学安排高一化学教学计划与学校教学进度一致,在学校基础上进行提高和拓展,计划完成高一上册三个专题的教学内容和高一下物质的量浓度的计算(大多数学校都要提前讲)、期末复习,让学生化学成绩能成为班级或学校里的佼佼者。
专题一:打开原子世界的大门1.从葡萄干面包模型到原子结构的行星模型2.原子结构和相对原子质量3.揭开原子核外电子运动的面纱专题二:开发海水中的卤素资源1.以食盐为原料的化工产品2.海水中的氯3.海水中提取溴和碘4.物质的量浓度的计算5.氧化还原反应6.氧化还原反应的配平专题三:探索原子构建物质的秘密1.原子间的相互作用离子键2.共价键3.分子间作用力、四种晶体的对比期末复习专题:全面梳理复习有机化学专题:1.甲烷的性质、烷烃的命名和同分异构体的书写2.乙烯的性质、石油在冶炼期末复习专题:全面梳理复习四、常见金属元素版块复习1.铁及重要含铁化合物的性质、工业炼铁、炼钢2.铝及重要含铝化合物的性质、铝的图像分析3.钠及重要含钠化合物的性质、过氧化钠有关计算技巧4.镁及重要含镁化合物的性质、工业制镁5.铜及重要含铜化合物的性质、工业炼铜五、化学实验版块复习1.化学实验基础知识梳理2.气体压强在化学实验中的应用3.常见物质的分离和提纯的方法归纳4.定量测定实验方案的设计技巧5.教材上三个定量实验和镀锌铁皮锌镀层厚度的测定6.化学实验的设计与评价分析7.解答无机工业流程实验题的几种思维视角8.例析化学实验中PH值的控制、化学实验中温度的控制、化学实验中的晶体洗涤六、化学计算版块复习1.常见基本计算方法整理2.重要计算题型分析和解答技巧传承这个学期共18次课,上述内容包括了大部分高中化学主干知识和版块所占分值接近100分,肯定会延续到后续上课时间如寒假班或春季班。
高一化学知识点难点一、原子结构和元素周期表高一化学中,原子结构和元素周期表是学习的重点和难点之一。
原子结构包括原子的组成、结构和性质等方面的内容,而元素周期表则是元素分类和性质规律的重要依据。
1. 原子的组成原子由电子、质子和中子组成。
电子质量很小,带有负电荷,环绕在原子核外层;质子重,带有正电荷,位于原子核内;中子重,没有电荷,也位于原子核内。
电子和质子数量相等,保持原子的电中性。
2. 原子的结构原子的结构可通过核外电子层的排布表示。
电子层按能级从内到外排列,能级低的电子能量较低。
最靠近原子核的是K层,其次是L层,然后是M层,依此类推。
每个电子层有一定的容纳电子数目上限。
3. 元素周期表的构成元素周期表依据元素的原子序数(即核外电子数)和元素性质排列。
元素周期表可以分为周期和族两个方向进行分类。
周期数对应的是元素各电子层的数量;族数对应的是元素外层电子分布规律相似的族群。
二、化学键和化学方程式化学键和化学方程式是学习高一化学课程的难点之一。
化学键描述了原子之间的结合方式,而化学方程式则描述了化学反应的反应物和生成物之间的物质变化过程。
1. 化学键的类型共价键是通过电子共享而形成的键,常见于非金属原子间;离子键是通过电子转移而形成的键,常见于金属和非金属之间;金属键是金属原子之间的共享电子形成的键。
2. 化学方程式的书写规则化学方程式应符合质量守恒和电荷守恒原则。
反应物在方程式左侧,生成物在方程式右侧,反应物和生成物之间用箭头连接。
反应物和生成物的摩尔比例应符合实验结果。
三、化学反应与化学平衡化学反应和化学平衡是学习高一化学知识中的难点内容。
化学反应描述了化学物质之间的转化过程,而化学平衡则是指反应物和生成物之间的摩尔比例达到动态平衡的状态。
1. 化学反应类型化学反应可以分为合成反应、分解反应、置换反应、酸碱反应和氧化还原反应等。
不同类型的反应有不同的特征和表示方法。
2. 化学平衡的条件化学平衡需要满足反应容器密闭、温度恒定、浓度不变等条件。
高一化学知识点原子结构中的电子分布规律在高中化学学习的过程中,原子结构是一个重要的知识点。
电子分布规律是了解原子结构的基础,对于理解元素周期表、化学键和化学反应等方面都具有重要的作用。
本文将重点介绍高一化学知识点原子结构中的电子分布规律。
一、电子分布的基本原理根据量子力学理论,电子在原子中的分布有一定的规律。
首先,每个原子都有一组能量不同的轨道,每个轨道能容纳一定数量的电子,称为电子壳层。
电子壳层由内到外依次编号为1、2、3、4……。
其中第一壳层最靠近原子核,电子数最少,依次类推。
其次,每个壳层中存在不同的亚壳层,亚壳层由字母s、p、d、f表示。
s亚壳层最先填充,容纳电子数最少,其次是p亚壳层,然后是d 亚壳层,最后是f亚壳层。
每个亚壳层可以容纳的电子数分别为:s亚壳层-2个电子,p亚壳层-6个电子,d亚壳层-10个电子,f亚壳层-14个电子。
最后,每个亚壳层中的每一个轨道都可以容纳两个电子。
这是由泡利不相容原理决定的,即同一轨道上的两个电子的自旋量子数不能相同。
二、电子分布的填充顺序根据以上原理,我们知道电子分布的填充顺序是有规律的。
在填充亚壳层时,先填充能量较低的亚壳层。
在同一亚壳层内,先填充完一个轨道的电子,再填充下一个轨道的电子。
例如,对于第一壳层(1s)来说,先填充1s轨道的第一个电子,再填充1s轨道的第二个电子。
具体的填充顺序是:1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f、5d、6p、7s……通过这种填充顺序,我们可以了解每个元素电子分布的规律,从而推导出元素的化学性质。
三、电子分布的周期性元素周期表是根据元素的电子分布规律而建立的。
在元素周期表中,水平行称为周期,垂直列称为族。
根据电子分布规律,我们可以看出,元素周期表中每一周期的最后一个元素的电子布局满足一个完整的壳层分布。
以第一周期为例,第一周期只有两个元素:氢和氦。
氢原子只有一个电子,电子分布为1s1;氦原子有两个电子,分布为1s2。
黄浦新王牌高中补习班高一化学上期知识拓展第一部分:原子结构一、原子的结构 1、原子的结构微粒 电子 质子 中子质量(kg ) 9.109×10-31 1.673×10-27 1.675×10-27 相对质量 0.0054841.0071.008电量 1.602×10-19 1.602×10-19 0电荷1个单位负电荷1个单位正电荷2、质量数 (1)概念:(2)关系式:原子中 核电荷数(Z )= 质子数=核外电子数 质量数(A )=质子数(Z )+中子数(N )阳离子中X AZ n +: 核外电子数= Z -n 质量数(A )=质子数(Z )+中子数(N ) 阴离子中XAZ n -: 核外电子数= Z +m 质量数(A )=质子数(Z )+中子数(N )3、原子结构的表示方法(1)原子结构示意图 (2)电子式 (3)核素表示法 (4)核外电子排布式 (5)轨道表示式 二、核素1、元素:具有相同质子数的同一类原子的总称。
2、核素:把具有一定数目质子和一定数目中子的一种原子称为核素。
一种原子就是一种核素,一种元素可能包括几种核素。
3、同位素:质子数相同而中子数不同的同一元素的不同核素互称为同位素。
(1)氢元素的三种核素11H12H13H名称 氢 重氢 超重氢 符号HD T原 子原子核核外电子每个质子带一个单位正电荷 相对质量约为 1质子的数目决定 元素种类质子中子中子不带电相对质量约为 1决定 相同 元素的不同原子,影响原子的质量围绕原子核做高速运动每个电子带 一个单位负 电荷相对质量为一个质子(中子)的1/1836核外电子层排布:最外层电子数目决定 原子的化学性质质子数 1 1 1 中子数12(2)性质:a 、同位素的化学性质相同,物理性质有一定差别。
b 、天然存在的同一元素的各同位素所占的百分组成不变。
(3)应用: ①金属探伤 ②消除静电 ③治疗肿瘤 ④示踪原子,跟踪研究化学反应 ⑤作核燃料 ⑥用14C 考古 ⑦环保治污等4、元素的相对原子质量(1)定义:由各种天然核素相对原子量与其原子百分组成计算出的平均值 。
(2)计算式: M =M 1×n 1 % + M 2×n 2 % + M 3×n 3 % +…同位素1735Cl 的相对原子质量为34.969,在自然界占75.77%(原子数的百分含量),1737Cl 为36.966,在自然界中占24.23%,则Cl 的相对原子质量为:34.969×75.77%+36.966×24.23% =35.45 (3)元素的近似相对原子质量:用质量数代替核素的相对原子质量,求其平均值。
例如氯元素的近似相对原子质量为:35ⅹ75.77%+37ⅹ24.23%=35.48 三、核外电子的分层排布 1.核外电子运动特征:(1)核外电子的特征:a:电子的质量极___;b:电子绕核运动是在_______的空间(原子的直径约___m )中进行;c:电子绕核作__速运动(运动的速度接近__,约为__)。
(2)核外电子运动特征:电子绕核运动__确定的轨道,__精确测定或计算电子在任一时刻所在的位置,____描绘出其运动轨迹。
我们只能指出___________。
2、核外电子的运动区域:(1)原子核外电子的运动与核外的电子能量的关系:能量低的在离核近的区域运动,能量高的在离核远的区域运动。
(2)电子层:划分依据:离核的远近不同以及能量高低 电子层的名称与相互关系: 3、核外电子的排布规律: (1)核外电子是分层排布的(2)电子总是由内向外排布,先排布离核最近的电子层,然后依次往外。
(3)每个电子层最多容纳2n 2个电子。
(4)最外层最多容纳8个电子,次外层最多容纳18个电子,倒数第三层最多容纳32个电子。
4,元素的性质与原子的电子层排布的关系(1)元素的化学性质与核外电子排布密切相关,特别是最外层电子数。
(2)元素的主要化合价与原子的最外层电子数有关。
元素 Na Mg Al Si P S Cl 最外层电子数 1 2 3 4 5 6 7 得失电子数 1 2 3 4 得3 得2 得1 最外层电子数(后) 8 8 8 8 8 8 8 主要化合价+1+2+3+4-3-2-1【典型例题】例1、 X 、Y 、Z 、R 分别代表四种元素,如果aX m +、bY n +、cZ n -、dR m -四种离子的电子层结构相同,(a 、b 、c 、d 为元素的原子序数),下列关系正确的是( )A. a -c =m -n B. a -b =n -m C. c -d =m +n D . b -d =n +m电子层 名称 第一层 第二层 第三层 第四层 第五层 第六层 第七层 K L M N O P Q 电子亚层与原子核 的距离越 来 越 远各层电子 的能量越 来 越 高例2、下列指定微粒的个数比等于2:1的是()A. 12H原子的中子数和质子数 B. 1836Ar原子中的质量数和中子数 C. 48Be2+离子中的质子数和电子数 D. 1226Mg2+离子中的中子数和电子数例3、已知NaH是由一种阳离子和一种阴离子构成的化合物,请回答:(1)画出这两种离子的结构示意图:_____________、_____________(2)这两种离子中,结构的稳定性较差的是_____________,其稳定性较差的主要表现是_____________。
(3)NaH易跟水反应,H2O为氧化剂,写出化学方程式:____________________________________________________原子结构练习题1、物质的量相同的Mg2+、F-、H2O三种微粒,一定含有相同的()A.电子数 B.质子数 C.中子数 D.质量数2、医学研究证明,用放射性53135I治疗肿瘤可收到一定疗效,下列有关53135I的叙述正确的是()A.53153I是碘的一种同素异形体B.53135I是一种新发现的元素C.53135I核内的中子数与核外电子数之差为29 D.53135I位于元素周期表中第4周期ⅦA族3、某电子层当它作为最外层时,最多只能容纳8个电子,当它作为次外层时,最多只能容纳18个电子,该电子层可能是()A.M层 B.K层 C.L层 D.P层4、硼有两种天然同位素510 B和511 B,硼元素的相对原子质量为10.80,则对硼元素中510B的质量百分含量的判断正确的是() A.20% B.大于20% C.大于20% D.80%5、下列说法正确的为()A. 12C、13C、14C、金刚石、石墨都是碳元素的的同位素B. 同种元素的原子,质量数一定相同C. 互为同位素的原子,质子数一定相同 D. 由一种元素组成的物质,一定是纯净物6、正电子、反质子等都属于反粒子,它们跟普通电子、质子的质量、电量均相等,而电性相反。
科学家设想在宇宙的某些区域可能存在完全由反粒子构成的物质——反物质。
1998年初和年底,欧洲和美国的科研机构先后宣布:他们分别制造出9个和7个反氢原子,这是人类探索反物质的一大进步。
你推测反氢原子是()A. 由1个带正电的质子和1个带负电的电子构成 B. 由1个带负电的质子和1个带正电的电子构成 C. 由1个不带电的中子和1个带负电荷的电子构成 D. 由1个带负电荷的质子和1个带负电荷的电子构成7、氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的是()A. 35Cl 原子所含质子数是18 B. 1/18mol的1H35Cl分子所含中子数约为6.02×1023 C. 3.5g的35Cl 2气体的体积为2.24LD. 35Cl 2气体的摩尔质量为70g/mol8、下列说法正确的是()A. 原子的种类由原子核内质子数、中子数决定 B. 分子的种类由分子组成决定 C. 23He代表原子核内有2个质子和3个中子的氦原子 D. 817O和818O原子的核外电子数是前者大9、某原子核外K层和L层电子总数等于M层和N层的电子数之和,该原子的核电荷数为()A. 2B. 8C. 10D. 2010、下列结构示意图中,表明阴离子的是()11、下列微粒中,最外电子层不是稳定结构的是()A. 氖原子B. 氯原子C. 镁离子D. 硫离子12、某元素的微粒最外电子层有8个电子,该微粒()A. 是稀有气体原子 B. 是阳离子C. 是阴离子D. 无法确定13、在核电荷数为1~18的元素中,符合最外层电子数是电子层数2倍的元素有()A. 1种B. 2种C. 3种D. 4种B14、某元素R,原子最外层电子数是核外电子总数的1/3,该元素的氧化物可能是()A. R2O B、R2O5C、RO2D、RO315、某元素原子的最外层电子数是次外层的X倍(X>1),则该原子核内的质子数是()A. 2XB. 2X+2C. 2X+10D. X+216、某元素原子核内质子数为m,中子数为n,则下列论断正确的是( )A、不能由此确定该元素的相对原子质量 B 、这种元素的相对原子质量为m+n C 、若12C 原子质量为W g ,则此元素原子的质量为(m+n)W g D 、该元素原子核内中子的总质量小于质子的总质量17、据报道,月球上有大量3He 存在,以下关于3He 的说法正确的是( )A 、是4He 的同素异形体B 、比4He 多一个中子C 、是4He 的同位素D 、比4He 少一个质子18、1 mol D 2O 和1 mol H 2O 不相同的是( )A .含氧原子的数目 B .质量 C .含有质子的数目 D .含有中子的数目19、Se 是人体必需微量元素,下列关于7834Se 和8034Se 说法正确的是( )A .7834Se 和8034Se 互为同素异形体 B .7834Se 和8034Se 互为同位素 C .7834Se 和8034Se 分别含有44和46个质子 D .7834Se 和8034Se 都含有34个中子20、阴离子X n -含中子N 个,X 的质量数为A ,则a g X 的氢化物中含质子的物质的量是( )A .)(a N aA - molB .)(A n nA a++ molC .)(n N n a A ++ molD .)(n N A nA a+-+ mol21、A 原子最外层电子数为a ,次外层电子数为b ;B 原子M 层电子数为(a -b),L 层电子数为(a +b),则a =____________,b =____________A 的元素名称是___________,B 的元素符号是________,它们的原子结构示意图分别为:A_____________B_____________ 。