次氯酸钠溶液稳定性
- 格式:doc
- 大小:52.00 KB
- 文档页数:6



净水用次氯酸钠溶液的稳定性任凌颖;王蒙蒙;施冰慧;周薇薇;苗丛瑶【摘要】研究含碱量、有效氯初始浓度及储存方式对次氯酸钠溶液稳定性的影响.含碱量越低,次氯酸钠溶液稳定性越差;有效氯初始浓度越高,次氯酸钠溶液稳定性越差;存放在室内的PE桶储存次氯酸钠溶液不影响其稳定性.同时,结合饮用水消毒特点,提出了次氯酸钠溶液含碱量要求,及水厂次氯酸钠溶液消毒的使用有效氯浓度、存储能力和使用周期.【期刊名称】《净水技术》【年(卷),期】2018(037)0z2【总页数】3页(P29-31)【关键词】次氯酸钠;稳定性;影响因素;饮用水消毒【作者】任凌颖;王蒙蒙;施冰慧;周薇薇;苗丛瑶【作者单位】上海华严检测技术有限公司,上海200082;山东简约净化科技有限公司,山东济南250000;山东简约净化科技有限公司,山东济南250000;上海华严检测技术有限公司,上海200082;上海华严检测技术有限公司,上海200082【正文语种】中文【中图分类】TU991.25消毒工艺在生活饮用水处理中必不可少。
以往国内水厂普遍使用的消毒剂是氯气。
氯气有剧毒,属于二类危险化学品、公共安全重大风险源。
在氯气的运输、储存和使用过程中,易因氯气泄漏导致安全事故。
自2008年北京奥运会和2010年上海世博会举办以来,北京和上海相继采用次氯酸钠溶液替代氯气消毒,并在全国供水行业广泛推广。
饮用水采用次氯酸钠溶液消毒,其运输、储存、使用比较安全,投加管理便捷。
但是,由于次氯酸钠溶液属于不稳定性产品,有效氯易衰减,消毒过程中对次氯酸钠的储存和使用提出了较高的管理要求。
我国尚未制定净水用次氯酸钠标准。
同时,开展温度对次氯酸钠溶液稳定性的影响研究很多,但对于次氯酸钠溶液含有的游离碱、有效氯初始浓度等对次氯酸钠溶液稳定性的影响,并将之与生产应用相结合的研究较少,本文针对次氯酸钠溶液稳定性影响因素与饮用水消毒的生产应用展开了初步研究,研究成果为次氯酸钠溶液在饮用水消毒的科学应用提供技术支撑。


稳定性次氯酸钠溶液的制备和评价李建生【摘要】In order to solve spontaneous decomposition and storage stability problems of sodium hypochlorite solution, a stabilized sodium hypochlorite solution containing 5. 0% ( mass fraction) active chlorine,8. 8% ( mass fraction) sodium sulfamate ,4. 8% (mass fraction) sodium tripolyphosphate, and 2.0% (mass fraction) free sodium hydroxide has been preparated by adding industrial sodium hypochlorite solution into solution of sodium sulfamate and sodium tripolyphosphate. In rapid stability evaluation tests,a stabilized sodium hypochlorite solution was stored for 14 d at 54 t and 12. 6% active chlorine was lost and a validity period of 12 months could be predicted. Machanism of stabilization was that an aggregation of molecules of sodium sulfamate and sodium hypochlorite in solution was formed by co-valent effect, so that spontaneous decomposition of sodium hypochlorite solution was inhibited effectively.%为解决次氯酸钠溶液自发分解和贮存稳定性问题,向氨基磺酸钠和三聚磷酸钠溶液中加入工业次氯酸钠溶液,制得有效氯含量5.0%(质量分数)、氨基磺酸钠含量8.8%(质量分数)、三聚磷酸钠含量4.8%(质量分数)、游离氢氧化钠含量2.0%(质量分数)的稳定性次氯酸钠溶液.在稳定性快速评价试验中,次氯酸钠溶液在54℃下贮存14d,有效氯下降率为12.6%,推定有效期可达12个月.氨基磺酸钠稳定剂的作用机理是氨基磺酸钠与次氯酸钠在溶液中通过共价作用形成了分子团,从而有效抑制次氯酸钠溶液的自发分解.【期刊名称】《无机盐工业》【年(卷),期】2011(043)012【总页数】3页(P47-49)【关键词】次氯酸钠;氨基磺酸;三聚磷酸钠;稳定性【作者】李建生【作者单位】天津职业大学,天津300410【正文语种】中文【中图分类】TQ131.12次氯酸钠溶液广泛应用于纺织、印染、造纸、工业水处理行业及日常生活中。

次氯酸钠说明书中文名次氯酸钠英文名 Sodium hypochlorite别名次氯酸钠溶液次氯酸钠(液体) 褪色,漂白剂安替福民次亚氯酸钠溶液其他名称次氯酸钠溶液次氯酸钠(液体) 褪色,漂白剂安替福民次亚氯酸钠溶液分子式 NaOCl分子量 74.43物性数据1. 性状:次氯酸钠为白色粉末,在空气中极不稳定。
受热后迅速自行分解,在碱性状态时较稳定。
一般工业品是无色或淡黄色液体,含有效氯为100~140g/L。
2. 密度(g/mL 25毒理学数据1.急性毒性[1]LD50:8500mg/kg(大鼠经口)2.刺激性[2] 家兔经眼:10mg,中度刺激。
3.致突变性[3] 微生物致突变:鼠伤寒沙门菌1mg/皿。
DNA损伤:大肠杆菌420μmol/L。
细胞遗传学分析:人淋巴细胞100ppm(24h)。
姐妹染色单体交换:人类胚胎149mg/L。
4.致癌性[4] IARC致癌性评论:G3,对人及动物致癌性证据不足。
生态学数据1.生态毒性暂无资料2 .生物降解性暂无资料3.非生物降解性暂无资料4.其他有害作用[5] 该物质对环境有危害,应特别注意对水体的污染。
分子结构数据计算化学数据性质与稳定性1.避免接触酸,还原剂,易氧化材料,有机材料,二氧化碳,胺,氨。
2.水溶液与碱金属,碱土金属和许多有机无机的活性化学药品是不相容的。
3.易溶于水生成烧碱和次氯酸,次氯酸再分解生成氯化氢和新生氧,因新生氧的氧化能力很强,所以次氯酸钠是强氧化剂。
其稳定度受光、热、重金属阳离子和pH值的影响。
具有刺激气味。
尚未分离出无水试剂。
碱性溶液为无色液体。
缓慢分解出NaCl,NaClO3和O2。
分解速度与浓度和游离碱有关。
光照或加热能加速分解。
4.高浓度的次氯酸钠溶液在储存过程中浓度会自动降低。
固体次氯酸钠无论是在含有5个结晶水还是无水状态下均易发生爆炸。
它也是一种强氧化剂,因此应避免长时间的皮肤接触或吸入。
5.具有强氧化性和腐蚀性。
皮肤接触会引起烧伤。



次氯酸钠不稳定的原因1. 引言1.1 次氯酸钠的简介次氯酸钠是一种常用的消毒剂和漂白剂,化学式为NaClO,常见的市售形式为漂白水。
它是一种卤素次氯酸盐,呈现为白色固体或无色液体。
次氯酸钠在水中易溶解,可以通过电解食盐水或氯碱法制备。
在工业上,次氯酸钠被广泛用于漂白纺织品、杀菌消毒和水处理等领域。
由于其强氧化性和杀菌作用,次氯酸钠受到广泛应用。
次氯酸钠在水中会迅速分解生成次氯酸和氢氧化钠,次氯酸是其活性物质,具有强氧化性和杀菌作用。
次氯酸钠在储存和使用过程中往往容易失去稳定性,导致其活性下降或失效。
正确理解次氯酸钠不稳定的原因以及如何保持其稳定性至关重要。
接下来将具体探讨次氯酸钠不稳定的化学结构,以及光照、温度、与其他化学物质的反应、存储条件等因素对其稳定性的影响。
1.2 次氯酸钠的应用次氯酸钠广泛用于消毒和漂白工业中。
在消毒领域,次氯酸钠被用于净水处理、游泳池水处理、医疗器械消毒等方面。
由于其具有高效而广谱的杀菌能力,被广泛应用于食品加工、医疗卫生、公共场所清洁等领域。
次氯酸钠还可以用作漂白剂,用于漂白棉纺织品、洗衣粉、造纸、塑料、皮革等行业。
在环保领域,次氯酸钠也被应用于废水处理、河道净化等方面。
除了上述应用领域外,次氯酸钠还可以用于卫生护理产品、农业和畜牧业等方面。
在卫生护理产品中,次氯酸钠被添加到清洁剂、洗手液、口腔漱口水等产品中,起到杀菌、除臭的作用。
在农业和畜牧业中,次氯酸钠可以用作消毒剂,帮助控制疾病传播、保障动植物健康。
次氯酸钠的应用范围非常广泛,涉及到多个行业和领域。
其杀菌、漂白等特性使其成为许多工业和日常生活中不可或缺的化学品。
保证次氯酸钠的稳定性至关重要,以确保其有效发挥作用,并避免因不稳定而导致的安全问题和环境污染。
2. 正文2.1 次氯酸钠不稳定的化学结构次氯酸钠是一种常用的消毒剂和漂白剂,但由于其不稳定的化学结构,可能会导致其失去活性或产生有害物质。
次氯酸钠的化学结构包括一个氯原子和一个氧原子与钠离子结合而成。

次氯酸钠使用方法及注意事项次氯酸钠是一种常用的消毒剂,广泛应用于日常生活和公共卫生领域。
本文将深入探讨次氯酸钠的使用方法及注意事项,以帮助读者全面了解该物质的特性和正确的使用方法。
【引言】随着人们对卫生和健康意识的提高,消毒成为日常生活中的重要环节。
次氯酸钠作为一种高效的消毒剂,具有广泛的应用前景。
然而,正确的使用方法和注意事项对确保消毒效果和安全性至关重要。
本文将从不同角度探讨次氯酸钠的使用方法及注意事项。
第一部分:次氯酸钠的性质和特点【性质描述】次氯酸钠的化学式为NaClO,是一种白色结晶粉末。
其溶于水后能形成次氯酸溶液,具有很强的氧化和消毒能力。
【杀菌原理】次氯酸钠能与微生物细胞膜上的脂类反应,破坏微生物细胞结构,从而达到杀灭细菌、病毒和真菌的目的。
【稳定性】次氯酸钠在常温下相对较稳定,但会受光、热和金属离子等因素的影响,降低其稳定性和消毒效果。
储存和使用过程中需注意保持其稳定性。
【安全性】次氯酸钠具有一定的刺激性,使用时需佩戴防护手套和眼镜,避免直接接触皮肤和眼睛。
应避免与酸性物质接触,避免产生有害气体。
第二部分:次氯酸钠的使用方法【浓度选择】次氯酸钠的消毒效果与使用浓度直接相关。
不同情况下可选择适当的浓度,一般建议在1000~5000mg/L之间。
【使用对象】次氯酸钠可以应用于各种场所和物体的消毒,如食品加工厂、医院、学校、家庭等。
需根据具体情况选择合适的消毒对象。
【使用方法】1. 准备次氯酸钠溶液:按照所需浓度将适量次氯酸钠溶解于水中,充分搅拌至溶液均匀。
2. 清洁表面:在使用次氯酸钠消毒之前,应先用清水和洗涤剂清洁表面,确保无杂质和脏污。
3. 消毒处理:使用喷雾器、拖把或浸泡等方式,将次氯酸钠溶液均匀地喷洒、涂抹或浸泡在待消毒的表面上。
4. 处理时间:根据消毒对象的不同,处理时间一般在10~30分钟之间,确保消毒效果。
5. 清洗残留物:消毒结束后,用水充分冲洗表面,确保次氯酸钠残留物被彻底清除。
第一部分化学品及企业标识化学品中文名:次氯酸钠溶液化学品英文名:Sodium hypochlorite solution产品推荐及限制用途:用于水的净化,作消毒剂,纸浆漂白剂等,医药工业中用于制氯胺等。
第二部分危险性概述紧急情况概述:具有强氧化性。
受高热分解产生有毒的腐蚀性烟气。
与可燃性、还原性物质反应很剧烈,与酸反应也会放出氯气。
具有腐蚀性。
GHS危险性类别:根据《危险化学品分类信息表》(2015)危险性类别判定,该产品属于皮肤腐蚀/刺激,类别1B;严重眼损伤/眼刺激,类别1;危害水生环境-急性危害,类别1;危害水生环境-长期危害,类别1。
标签要素:-象形图:-警示词:危险危险信息:可引起严重的皮肤灼伤和眼睛损伤,一次接触可能导致消化系统损害,对水生生物毒性非常大并且有长期持续影响。
防范说明:-预防措施:密闭操作,注意通风,远离高热。
操作尽可能机械化、自动化。
操作人员必须经过专门培训,阅读并了解所有预防措施。
按要求使用个体防护装备。
严格遵守操作规程。
建议操作人员佩戴自吸过滤式防毒面具(全面罩),穿橡胶耐酸碱服,戴橡胶耐酸碱手套。
远离易燃、可燃物。
防止蒸气泄漏到工作场所空气中。
避免与还原剂、酸类接触。
搬运时要轻装轻卸,防止包装及容器损坏。
工作场所不得进食、饮水。
-事故响应:如发生火灾,根据具体的着火物质选择合适的灭火剂。
皮肤接触:立即脱去污染的衣着,用2%硼酸液或大量清水彻底冲洗。
如果有灼伤,就医治疗。
眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。
就医。
吸入:迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸困难,给输氧。
如呼吸停止,立即进行人工呼吸。
就医。
食入:用水漱口,给饮牛奶或蛋清。
就医。
被污染的衣物应清洗干净后再使用。
-安全储存:保持容器密闭。
储存于阴凉、干燥、通风的库房。
远离火种热源。
严禁与还原剂、酸类混储。
-废弃处置:若可能回收使用。
在规定的处理厂处理和中和。
滤出固体,当作有害废物在规定场所掩埋。
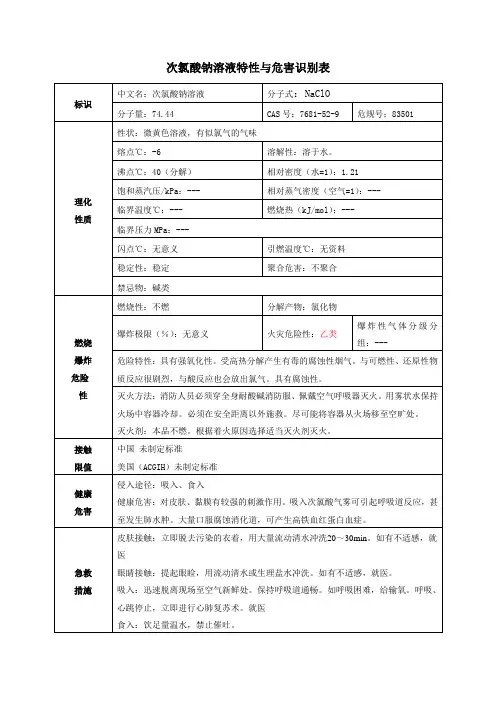
次氯酸钠安全使用说明书一、物质的理化常数国际编号:83501 CAS:7681-52-9英文名称:Sodium hypochlorite solution 中文名称:次氯酸钠别名:漂白水分子式:NaClO;NaOCl 分子量:74.44密度:相对密度(水=1)1.10 熔点:-6℃蒸汽压:102.2℃溶解性:溶于水外观与形状:微黄色溶液,有似氯气的气味稳定性:不稳定危险标记:20(腐蚀品)用途:用于水的净化,以及作消毒剂、纸浆漂白等,医疗工业中制氯胺等二.对环境的影响:1、健康危害侵入途径:吸入、食入、经皮吸收。
健康危害:次氯酸钠放出的游离氯可引起中毒,亦可引起皮肤病。
已知本品有致敏作用。
用次氯酸钠漂白液洗手者,手掌大量出汗,指甲变薄,毛发脱落。
2、毒理学资料及环境行为急性毒性:LD505800mg/kg(小鼠经口)危险特性:受高热分解产生有毒的腐蚀性气体。
有腐蚀性。
燃烧(分解)产物:氯化物。
三.现场应急监测方法:水质快速比色管法(日本制,次氯酸根)四.实验室监测方法:气相色谱法《食品中添加剂的分析方法》,马家骧等译五.应急处理处置方法:1、泄漏应急处理疏散泄漏污染区人员至安全区,禁止无关人员进入污染区,建议就急处理人员戴好防毒面具,穿相应的工作服。
不要直接接触泄漏物,在确保安全情况下堵漏。
用沙土、蛭石或其它惰性材料吸收,然后转移到安全场所。
如大量泄漏,利用围堤收容,然后收集、转移、回收或无害处理后废弃。
2、防护措施呼吸系统防护:高浓度环境中,应该佩带防毒口罩。
紧急事态抢救或逃生时,建议佩带自给式呼吸器。
眼睛防护:戴化学安全防护眼镜。
防护服:穿工作服(防腐材料制作)。
手防护:戴橡皮手套。
其它:工作后,淋浴更衣。
注意个人清洁卫生。
3、急救措施皮肤接触:脱去污染的衣着,用大量流动清水彻底冲洗。
眼睛接触:立即提起眼睑,用大量流动清水彻底冲洗。
吸入:脱离现场至空气新鲜处。
必要时进行人工呼吸。
就医。
食入:误服者给饮大量温水,催吐,就医。
次氯酸钠溶液稳定性研究摘要:综述了国内提高次氯酸钠稳定性的研究成果。
次氯酸钠的不稳定性是由于次氯酸根离子价层电子对空间构型的高度不对称性和次氯酸根离子中阳离子Cl+的高离子势所决定的。
介绍了次氯酸钠分解反应的热力学性质和动力学性质;讨论了温度、溶液的pH、重金属离子、稳定剂对次氯酸钠水溶液稳定性的影响。
指出降低次氯酸钠溶液的浓度,低温和避光储存,控制次氯酸钠溶液的酸度及添加稳定剂是提高次氯酸钠水溶液稳定性的有效途径。
关键词:次氯酸钠溶液、性质、稳定性、稳定剂前言:次氯酸钠溶液的生产工艺简单,成本低廉,在常温下可发挥高效的漂白、杀菌和氧化作用,是国内外使用最普遍、应用最广泛的含/氯0漂白、消毒剂、防腐剂和水的净化剂,特别是在生产规模较小的卫生纸厂、纱布和织带等生产厂家直接用于漂白工序的就是成品次氯酸钠溶液.然而,次氯酸钠溶液的稳定性较差,极易分解[1-3].由于次氯酸钠溶液的不稳定性,在贮运过程中会渐渐失去有效氯,产品的漂白、杀毒作用也随之降低,因此成为这类产品在运输、贮存和使用中存在的一大问题。
目前,国内外对次氯酸钠稳定性方面的研究尚未成熟,表现在:(1)还没有一个成熟的、工业化的次氯酸钠溶液稳定的技术成果。
(2)还没有一种价格低廉、应用方便、无毒副作用、应用效果显著的工业化的保持次氯酸钠水溶液稳定剂。
一.次氯酸钠的物理性质次氯酸钠水溶液俗称漂白水,英文名Sodium hypochlorite aqueous solution,分子式NaClO,分子量74.442。
次氯酸钠具有刺激气味。
固态次氯酸钠为白色粉末,有多种含结晶水化合物,分别是NaClO•H2O、NaClO•2.5H2O、NaClO•5H2O、NaClO•6H2O 和NaCl•7H2O,NaClO•H2O,熔点为75~80℃,NaClO•2.5H2O 熔点58℃,NaClO•5H2O 熔点27℃,NaClO•6H2O 和NaClO•7H2O 熔点18~21℃。
氯化钠对次氯酸钠溶液稳定性影响的研究
苏秀霞;李仲谨;匡俊艳
【期刊名称】《陕西科技大学学报(自然科学版)》
【年(卷),期】2006(24)5
【摘要】以不同浓度的氯化钠作为稳定剂,观察其对含有效氯0.5%的次氯酸钠溶
液化学稳定性的影响,实验表明,加入0.6%的氯化钠溶液能显著提高次氯酸钠溶液
的稳定性:在75℃敞口情况下放置4 h,有效氯仍保留初始浓度的91.73%,而未加氯化钠的对照样本仅保留初始浓度的87.78%;在75℃于密闭容器内放置19 h后,有
效氯为初始浓度的83.95%,而未加氯化钠的对照样本仅为初始浓度的79.75%.0.6%氯化钠对次氯酸钠溶液的稳定性具有增强作用.
【总页数】4页(P45-47,54)
【作者】苏秀霞;李仲谨;匡俊艳
【作者单位】陕西科技大学化学与化工学院,陕西,咸阳,712081;陕西科技大学化学与化工学院,陕西,咸阳,712081;陕西科技大学化学与化工学院,陕西,咸阳,712081【正文语种】中文
【中图分类】TQ124.4+2
【相关文献】
1.次氯酸钠溶液稳定性的研究 [J], 张河仪;胡斌
2.血液、血清和次氯酸钠溶液对生物陶瓷材料固化时间和抗压强度影响的研究 [J], 范金琪;侯本祥
3.净水用次氯酸钠溶液的稳定性 [J], 任凌颖;王蒙蒙;施冰慧;周薇薇;苗丛瑶
4.次氯酸钠溶液稳定性的探讨 [J], 王周善
5.β-环糊精对次氯酸钠溶液稳定性影响的研究 [J], 王世岭;孔繁凤;常东
因版权原因,仅展示原文概要,查看原文内容请购买。
次氯酸钠溶液稳定性的研究张河仪;胡斌【摘要】研究了影响次氯酸钠稳定性的因素,提出如下建议:以用纯水稀释32%烧碱得到的溶液为原料生产次氯酸钠;在产品次氯酸钠溶液中加入稳定剂30 mg/L氮化硼[或2%(质量分数)硅酸钠或0.1%(质量分数)碳酸氢钠],可使其稳定性大幅提高,并且其活性没有明显降低;企业根据次氯酸钠产品的应用领域,选择合适的稳定剂.【期刊名称】《氯碱工业》【年(卷),期】2018(054)007【总页数】4页(P34-37)【关键词】次氯酸钠;稳定性;纯水;工业水;氮化硼;硅酸钠;碳酸氢钠【作者】张河仪;胡斌【作者单位】福建省厦鹭电化有限公司,福建漳州363900;福建省厦鹭电化有限公司,福建漳州363900【正文语种】中文【中图分类】TQ124.44次氯酸钠溶液是一种优良的漂白剂和杀菌剂,不需要高温即可发挥漂白、杀菌、消毒的作用,在医院、饮食业及工业循环水等方面应用广泛。
其缺点是:在常温下很不稳定,容易分解(NaClONaCl+[O],NaClO+H2ONaOH+HClO),造成有效氯含量的降低,消毒性能下降,同时也给运输、贮存和使用带来诸多不便。
因此,提高次氯酸钠溶液的稳定性具有极大的工业价值。
笔者采用控制变量法、正交试验、空白试剂对比等方法,对控制次氯酸钠水溶液的稳定性进行了研究。
1 次氯酸钠物化性质次氯酸钠溶液别名漂白水,一般工业品是无色或淡黄色液体,含有效氯为10%。
次氯酸钠是强氧化剂,其稳定性受光照、浓度、温度、金属阳离子杂质和pH值等影响较大。
2 试剂与仪器试剂:次氯酸钠(福建省厦鹭电化有限公司生产有效氯10%左右的工业品),硅酸钠,碳酸氢钠,氮化硼;所有分析用试剂均为分析纯。
仪器:101A-l型恒温箱,碘量瓶,大试管,均符合国家标准。
有效氯检验方法采用GB 19106—2013 《次氯酸钠》[1]规定的检验方法。
3 影响次氯酸钠溶液稳定性的因素及试验设计对于成熟的次氯酸钠工业产品,因为光照、温度及其浓度和pH值都是相对稳定的,不容易改变,因此,下面重点研究金属阳离子和稳定剂对次氯酸钠稳定性的影响,从而找出经济适用的方法来提高次氯酸钠溶液的稳定性。
次氯酸钠溶液稳定性研究摘要:综述了国内提高次氯酸钠稳定性的研究成果。
次氯酸钠的不稳定性是由于次氯酸根离子价层电子对空间构型的高度不对称性和次氯酸根离子中阳离子Cl+的高离子势所决定的。
介绍了次氯酸钠分解反应的热力学性质和动力学性质;讨论了温度、溶液的pH、重金属离子、稳定剂对次氯酸钠水溶液稳定性的影响。
指出降低次氯酸钠溶液的浓度,低温和避光储存,控制次氯酸钠溶液的酸度及添加稳定剂是提高次氯酸钠水溶液稳定性的有效途径。
关键词:次氯酸钠溶液、性质、稳定性、稳定剂前言:次氯酸钠溶液的生产工艺简单,成本低廉,在常温下可发挥高效的漂白、杀菌和氧化作用,是国内外使用最普遍、应用最广泛的含/氯0漂白、消毒剂、防腐剂和水的净化剂,特别是在生产规模较小的卫生纸厂、纱布和织带等生产厂家直接用于漂白工序的就是成品次氯酸钠溶液.然而,次氯酸钠溶液的稳定性较差,极易分解[1-3].由于次氯酸钠溶液的不稳定性,在贮运过程中会渐渐失去有效氯,产品的漂白、杀毒作用也随之降低,因此成为这类产品在运输、贮存和使用中存在的一大问题。
目前,国内外对次氯酸钠稳定性方面的研究尚未成熟,表现在:(1)还没有一个成熟的、工业化的次氯酸钠溶液稳定的技术成果。
(2)还没有一种价格低廉、应用方便、无毒副作用、应用效果显著的工业化的保持次氯酸钠水溶液稳定剂。
一.次氯酸钠的物理性质次氯酸钠水溶液俗称漂白水,英文名Sodium hypochlorite aqueous solution,分子式NaClO,分子量74.442。
次氯酸钠具有刺激气味。
固态次氯酸钠为白色粉末,有多种含结晶水化合物,分别是NaClO•H2O、NaClO•2.5H2O、NaClO•5H2O、NaClO•6H2O 和NaCl•7H2O,NaClO•H2O,熔点为75~80℃,NaClO•2.5H2O 熔点58℃,NaClO•5H2O 熔点27℃,NaClO•6H2O 和NaClO•7H2O 熔点18~21℃。
它们在空气中极不稳定,受热后迅速自行分解,在碱性状态时较稳定。
次氯酸钠25℃时溶解度为45%(溶液百分比)。
易溶于水成烧碱和次氯酸,次氯酸再分解生成氯化氢和新生氧,新生氧的氧化能力很强,次氯酸钠是强氧化剂。
一般工业品是无色或淡黄色液体,含有效氯为100~140g/L。
其稳定性受光照、浓度、温度、金属阳离子杂质、空气中二氧化碳和pH 值等的影响。
次氯酸钠溶液对不同金属均有程度不等的腐蚀作用,其腐蚀程度变化与溶液中有效氯质量浓度有关。
【1】二.次氯酸钠的化学性质次氯酸钠与酸作用时产生次氯酸,与过量的盐酸反应产生氯气。
次氯酸钠与氨或尿素反应生成肼,这是制肼的重要方法。
次氯酸钠能被氧化成氯酸钠。
次氯酸钠与有机物反应,同时具备氧化剂和氯化剂双重功能,应用于以卤仿氧化反应制备羧酸;霍夫曼重排制造胺和肼;炔烃制氯代炔;环戊二烯或茚氯化合成全氯环戊二烯或1,1,3-三氯茚;脂肪族肟和伯、仲硝基化合物转化为氯代硝基链烷;对称二烃基肼氧化成偶氮化合物;含酚废水处理等。
三.NaClO的结构及性能1.ClO-的结构特征:次氯酸钠溶液是强氧化剂,化学性质极不稳定,这是由ClO-的结构决定的。
次氯酸根离子的价层电子对排布方式为四面体结构,氯原子以sp3杂化轨道和氧原子成键【2】,酸根中存在着3个未成键的孤对电子。
由于酸根离子价层电子对空间构型的高度不对称性和中心原子氯有较大的离子势(Z/r),导致次氯酸盐不稳定,具有较强的获得电子转化为更稳定的Cl2分子或Cl-的能力,即表现为ClO-具有较强的氧化能力。
2. NaClO参与反应的热力学:(1)ClO-的强氧化性:ClO-在酸性或碱性条件下参加的反应及其电极电位如下[3]:HClO+H++e —1 /2Cl2+H2O 1. 63 V (1)HClO+H++2e —Cl-+H2O 1. 49 V (2)ClO-+H2O+2e—Cl-+2OH-0. 89 V (3)【3】从式(1)~(3)可知,无论是在酸性环境中,还是在碱性环境中,ClO-都具有很强的氧化性,也就是说遇到还原剂时会发生还原反应而分解。
(2)NaClO分解反应的热力学次氯酸钠的不稳定性主要表现在没有还原剂存在时,自身发生分解反应。
主要是在光照、加热、酸性环境或重金属离子存在下,自发发生分解反应,主要反应方程式见式(4)~(7)。
2NaClO—2NaCl+O2(4)3NaClO—2NaCl+NaClO3(5)2HClO—2HCl+O2(6)HClO+HCl—H2O+Cl2(7)【4】由于次氯酸钠大多是采用氢氧化钠溶液吸收氯气的方法进行制备,在强碱环境下,次氯酸钠不仅水解程度较小,而且稳定性较好。
反应(4)~(7)在标准状态下的热力学性质变化值摩尔反应焓变、摩尔反应吉布斯自由能变和摩尔反应熵变的计算结果列于表1。
由表1可知,在298. 15 K时,标准状态下反应(4),(5)和(6)为自发的,且自发进行的趋势很大。
反应(7)虽属于吸热反应,但反应的$rG m< 0,表明在标准状态下也有自发进行的趋势,且升高反应温度有利于该分解反应的进行。
所以,从热力学的角度看,次氯酸钠具有自发进行分解反应的趋势,表明次氯酸钠的热力学稳定性很差3. NaClO溶液的分解动力学次氯酸钠溶液性能不稳定,即使是在常温下也会自然分解放出新生态原子氧,而新生态原子氧具有强烈的氧化作用,能进一步引起一系列反应。
邵黎歌等[4]报道,次氯酸钠溶液中含有NaClO,NaCl,H2O,HClO,NaOH,HCl,NaClO3,O2,9种组分,且随着反应条件的变化,组成也在不断地变化。
文献[5]认为同时存在以下主要反应:NaClO —NaCl+[O]NaClO +H2O—NaOH+HClONaClO+2HClO—NaClO3+2HClNaClO+HCl—NaCl+HClO2HClO—2HCl+O2HClO+HCl—H2O+Cl2刘少友等【6】则认为在次氯酸钠分解体系中同时存在以下主要反应:NaClO—NaCl+[O]HCl+[O] —HClONaCl+3[O]—NaClO32[O]—O2总之,次氯酸钠的分解反应十分复杂,这些反应都会直接或间接地消耗NaClO,从而使有效氯含量降低。
最新研究【7】表明,在碱性条件下,次氯酸钠水溶液的分解主要是由反应(4)引起的一系列反应中的各组分相互作用的宏观结果,其中原子氧的放出是其分解的关键步骤,分解反应宏观上表现为准一级反应。
由于次氯酸钠的分解反应是由一组复杂的反应所组成的,并随浓度、温度、pH等因素的变化而变化,占优势的反应会随着反应条件的变化而改变。
根据阿伦尼乌斯定律可知,当浓度一定时,温度升高,反应速度增大,因此,次氯酸钠溶液适宜在低温保存【8】。
由于次氯酸钠的分解反应在宏观上属于准一级反应,因此当反应温度不变时,增大NaClO浓度,分解速率也随之增大。
因此,从提高储存稳定性的角度看,次氯酸钠适宜在低浓度下储存。
但是,这样会大大提高储存、运输等成本。
四.提高NaClO溶液稳定性的方法次氯酸钠水溶液具有不稳定性,常常受到环境温度、溶液PH值以及存放时间等因素影响,科研工作者就提高次氯酸钠水溶液稳定性做了很多研究,得出无机碳酸盐、硅酸盐、磷酸盐可以作为次氯酸钠溶液的稳定剂,提高次氯酸钠水溶液的稳定性;还有一些科研工作者研究得出有机试剂和无机盐试剂复合配制的添加剂也有助于提高次氯酸钠水溶液的稳定性。
次氯酸钠水溶液具有较强的氧化性,所以为了避免溶液腐蚀容器,在储存和运输时应该避免抗腐蚀性差的材料。
对提高次氯酸钠水溶液稳定性研究结果有以下几点:李荣,李金兵等人通过实验,研究了复合稳定剂对次氯酸钠水溶液稳定性的影响,当EDTA、硅酸钠、碳酸氢钠和氯化钠四种稳定剂成分的配比是0.005%:1%:0.1%:0.2%时,可使次氯酸钠溶液中有效氯含量在5 d内维持在较高值,氯酸钠溶液的稳定性提高10%以上【9】。
苏秀霞,姚宝晶等人通过实验得出以下结论(1)加入一种稳定剂时,Na2CO3、NaCl 对次氯酸钠溶液有较好的稳定效果.(2)Na2SiO3单独作为稳定剂时,稳定效果不明显,但是复配使用时却有很好的效果.(3)单一稳定剂的稳定效果显然没有复配效果好.(4)在100 g次氯酸钠溶液中加入0.03 g Na2SiO3和0.1 g Na2CO3作为复配稳定剂,可以确保次氯酸钠溶液在储存期间有效氯浓度不至很快降低【10】。
浙江科技学院杨志祥等通过初选,确定以Na3PO4、Na2HPO4、NaH2PO4为工业次氯酸钠水溶液稳定剂组成,通过正交试验的方法确定了高效复合无机钠盐稳定剂配方,Na3PO4、Na2HPO4、NaH2PO4比例为0.3%∶0.1%∶0.1%。
该配方用于工业次氯酸钠水溶液稳定,夏季常温30d 分解率由不添加稳定剂的38.3%下降到12.7%【11】。
广州大学谢丽琼通过对有效氯含量的比较,考察不同的稳定剂硅酸钠、硼酸和氯酸钾等和表面活性剂BS-12、ALES 和AES 等对NaClO 水溶液的稳定性的影响,在pH 值为12.5 的条件下,加入2%的硅酸钠和1%的AES能较好地增加NaClO溶液的稳定性【12】。
张婉枫和胡满成教授通过实验得出这个以下结论:(l)储存时应该尽量在较低温度条件下避光储存;(2)生产、储存、运输过程中对生产设备、输送管路、储存容器材质的选择应做到尽量避免耐腐蚀性能差的金属材料和含镍量高的耐腐蚀金属材料,以降低金属离子含量,用不透明的耐腐蚀塑料做容器或耐腐蚀塑料容器内衬最佳,保持储存次氯酸钠溶液容器的密封性对延长次氯酸钠溶液保存期有很大帮助;(3)在化学法生产次氯酸钠过程中对具体的操作工艺条件进行改进如氯气流速、氢氧化钠的初始浓度、操作温度控制等等对次氯酸钠溶液稳定性影响,以及保持溶液总碱度,增加次氯酸钠溶液中游离碱含量,提高次氯酸钠溶液的pH值;(4)降低次氯酸钠溶液的初始浓度也可以延长保存期的一种方法;(5)引入添加剂来提高次氯酸钠溶液稳定性"【13】。
五.结束语1、结论:通过对次氯酸钠水溶液稳定性的研究,我们知道了稳定剂、温度、PH值、复合添加剂以及次氯酸钠溶液的初始浓度这些条件都会影响其稳定性。
在生活以及生产中,我们可以有意识的利用这些条件增加次氯酸钠溶液的稳定性。
2、研究方向和指导意义:前面已经提到国内目前的研究现状,对次氯酸钠水溶液稳定性的研究有助于得到一个成熟的、工业化的次氯酸钠溶液稳定的技术成果,而且可以选择一种价格低廉、应用方便、无毒副作用、应用效果显著的工业化的保持次氯酸钠水溶液稳定的稳定剂。
由于日常生活中的消毒剂的主要成分就是次氯酸钠,稳定性提高了,产品的质量有所提高,这样将给企业带来良好的生产效益,促进企业的经济发展。