高中化学 2.2 钠、镁及其化合物知识点总结 苏教版必修1
- 格式:doc
- 大小:204.50 KB
- 文档页数:4

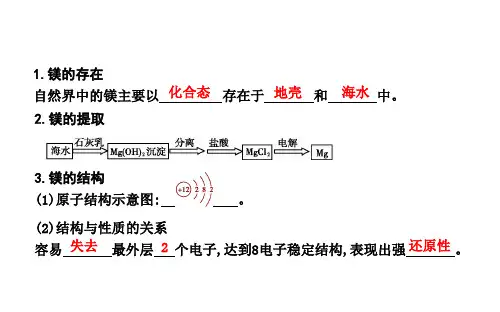


一、知识梳理(一)钠1.物理性质银白色金属,质软,密度比水小钠的密度大于煤油小于水熔点低、具有良好的导电性和导热性。
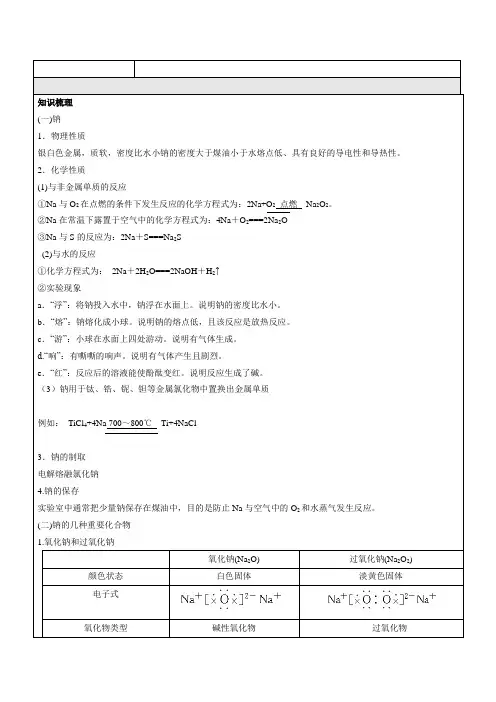
2.化学性质(1)与非金属单质的反应①Na与O2在点燃的条件下发生反应的化学方程式为:2Na+O2点燃Na2O2。
②Na在常温下露置于空气中的化学方程式为:4Na+O2===2Na2O③Na与S的反应为:2Na+S===Na2S(2)与水的反应①化学方程式为:2Na+2H2O===2NaOH+H2↑②实验现象a.“浮”:将钠投入水中,钠浮在水面上。
说明钠的密度比水小。
b.“熔”:钠熔化成小球。
说明钠的熔点低,且该反应是放热反应。
c.“游”:小球在水面上四处游动。
说明有气体生成。
d.“响”:有嘶嘶的响声。
说明有气体产生且剧烈。
e.“红”:反应后的溶液能使酚酞变红。
说明反应生成了碱。
(3)钠用于钛、锆、铌、钽等金属氯化物中置换出金属单质例如:TiCl4+4Na 700~800℃Ti+4NaCl3.钠的制取电解熔融氯化钠4.钠的保存实验室中通常把少量钠保存在煤油中,目的是防止Na与空气中的O2和水蒸气发生反应。
(二)钠的几种重要化合物1.氧化钠和过氧化钠氧化钠(Na2O) 过氧化钠(Na2O2) 颜色状态白色固体淡黄色固体电子式氧化物类型碱性氧化物过氧化物氧元素化合价-2 -1阴阳离子数之比1∶2 1∶2生成条件常温下加热或点燃金属钠稳定性不稳定,可继续氧化稳定跟水反应Na2O+H2O===2NaOH 2Na2O2+H2O===4NaOH+O2↑跟CO2反应Na2O+CO2===Na2CO32Na2O2+2CO2=== 2Na2CO3+O2跟酸反应Na2O+2HCl===2NaCl+H2O2Na2O2+4HCl=== 4NaCl+2H2O+O2↑用途制NaOH,用途较少作供氧剂、氧化剂、漂白剂等2.氢氧化钠俗称:烧碱、火碱、苛性钠。
(1)主要物理性质:白色固体,易吸收空气中的水蒸气而潮解,易溶解于水,并且放出大量的热量,有强腐蚀性。



2.2 钠、镁及其化合物3【知识要点】三、镁的提取及应用1(1)Mg 2++2OH -==Mg(OH)2↓,(2)Mg(OH)2+2H +==Mg 2++2H 2O ,(3)MgCl 2Mg+Cl 2↑。
(不用电解MgO 的方法制取Mg ,这是因为MgO 的熔点太高,很难将MgO 熔融,且成本太高。
)2.镁的性质:(1)物理性质:密度小熔点较低,硬度较小,银白色金属;(2)化学性质①跟O 2及其它非金属反应常温下,在空气中因生成氧化膜,具有抗腐蚀能力。
Mg+O 22MgO ;3Mg+N 2Mg 3N 2;Mg+Br 2MgBr 2;2Al+3S Al 2S 3 ②跟某些氧化物2Mg+CO 22MgO+C③跟非氧化性酸的反应Mg+2H +==Mg 2++H 2↑④跟水的反应Mg + 2H 2OMg(OH)2 + H 2↑(反应后的溶液中滴入酚酞,溶液变红)【例题精析】三、镁的提取及应用例1.海水中有取之不尽的化学资源,从海水中可提取多种化工原料。
下图是某工厂对海水资源的综合利用的示意图。
(1)粗盐中含有Ca 2+、Mg 2+、SO 42-等杂质,精制后可得NaCl 饱和溶液,精制时通常在溶液中依次加入过量的BaCl 2溶液、过量的NaOH 溶液和过量的Na 2CO 3溶液,最后加入盐酸至溶液呈中性。
请写出加入盐酸后可能发生的化学反应的离子方程式:_______________________________________________________________________________________。
(2)海水提取食盐后的母液中有K +、Na +、Mg 2+等阳离子。
从离子反应的角度思考,在母液里加入石灰乳起什么作用?(3)海水里的镁元素处于游离态还是化合态?从海水中提取氯化镁的反应是不是氧化还原反应?用电解法冶炼金属镁的反应是不是氧化还原反应?为什么?(4)电解无水氯化镁所得的镁蒸气冷却后即为固体镁。



高中化学学习材料唐玲出品第二单元 钠、镁及其化合物 班级 姓名考点一:了解钠的性质和用途(B )1. 钠的物理性质:银白色,热、电的良导体,质软、密度小、熔点低。
2. 化学性质(1) 钠与水反应的化学方程式:2Na +2H 2O===2NaOH +H 2↑;离子方程式:2Na +2H 2O===2Na ++2OH -+H 2↑。
钠与水反应的现象及解释:① 浮(说明钠的密度比水的密度小);② 熔(说明钠的熔点低;该反应为放热反应);③ 响(说明有气体产生);④ 游(说明有气体产生);⑤ 溶液中滴入酚酞显红色(说明生成的溶液呈碱性)。
(2) 与氧气反应:4Na +O 2===2Na 2O ;2Na +O 2=====点Na 2O 2。
3. 用途:① 制取钠的重要化合物,如Na 2O 2;② 作为中子反应堆的热交换剂;③ 冶炼钛、铌、锆、钒等金属;④ 钠光源。
4. 制备:2NaCl (熔融)=====通电2Na +Cl 2↑注意:电解饱和食盐水的化学方程式为:2NaCl +2H 2O=====通电2NaOH +Cl 2+H 2↑ 5. 保存:少量的钠保存在煤油中。
考点二:关注钠的氧化物的性质和在生产、生活中的应用(B )Na 2O 2可用于供氧、消毒、杀菌和漂白。
考点三:比较碳酸钠、碳酸氢钠的溶解性、热稳定性、与酸的反应(B )并初步学会鉴别碳酸钠和碳酸氢钠的方法(D )1、溶解性:Na 2CO 3>NaHCO 3;2、热稳定性(固体):Na 2CO 3>NaHCO 3(2NaHCO 3=====△Na 2CO 3+H 2O +CO 2↑); 3、与酸反应:Na 2CO 3<NaHCO 3(Na 2CO 3+2HCl===2NaCl +H 2O +CO 2↑,NaHCO 3+HCl===NaCl +H 2O +CO 2↑);等浓度都呈碱性,且碱性:Na 2CO 3>NaHCO 3;4、与BaCl 2或CaCl 2反应:Na 2CO 3—白色沉淀,NaHCO 3—无明显现象;5、与Ba(OH)2或Ca(OH)2都能生成沉淀。
点燃700~800o C点燃点燃点燃 江苏省灌南高级中学2020年高中化学《钠、镁及其化合物》知识点总结学案 苏教版必修1结 构 钠原子最外层只有一个电子,化学反应中易失去电子而表现出强还原性。
物 理性 质 质软、银白色,有金属光泽的金属,具有良好的导电导热性,密度比水小,比煤油大,熔点较低。
化 学 性 质与非金属单质 钠在常温下切开后表面变暗:4Na+O 2=2Na 2O (灰白色)钠在氯气中燃烧,黄色火焰,白烟: 2Na+Cl 2 ==== 2NaCl与化合物与水反应,现象:浮、游、球、鸣、红 2Na +2H 2O=2NaOH+H 2↑与酸反应,现象与水反应相似,更剧烈,钠先与酸反应,再与水反应。
与盐溶液反应:钠先与水反应,生成NaOH ,H 2,再考虑NaOH 与溶液中的盐反应。
如:钠投入CuSO 4溶液中,有气体放出和蓝色沉淀。
2Na+2H 2O+CuSO 4===Cu(OH)2↓+Na 2SO 4+H 2↑与某些熔融盐:4Na+TiCl 4========4NaCl+Ti存 在 自然界中只能以化合态存在 保 存 煤油或石蜡中,使之隔绝空气和水制 取2NaCl(熔融)====2Na+Cl 2↑用 途1、 钠的化合物2、钠钾合金常温为液体,用于快中子反应堆热交换剂3、作强还原剂4、作电光源碳酸钠(Na 2CO 3)碳酸氢钠(NaHCO 3)俗 名 纯碱、苏打小苏打 溶解性 易溶(同温下,溶解度大于碳酸氢钠)易溶热稳定性 稳定2NaHCO 3△Na 2CO 3+CO 2↑+H 2O ↑碱性 碱性(相同浓度时,碳酸钠水溶液的PH 比碳酸氢钠的大)碱性与 酸盐酸 Na 2CO 3+2HCl=2NaCl+H 2O+CO 2↑ NaHCO 3+HCl=NaCl+H 2O+CO 2↑碳酸Na 2CO 3+ H 2O+CO 2= 2NaHCO 3不能反应与 碱 NaOH不能反应 NaHCO 3+NaOH=Na 2CO 3+H 2OCa(OH)2 Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH 产物与反应物的量有关三、镁的性质 物理性质银白色金属,密度小,熔沸点较低,硬度较小,良好的导电导热性化学性质与O 22Mg+O 2====2MgO与其他 非金属Mg+Cl 2====MgCl 2,3Mg+N 2==== Mg 3N 2通电点燃HCl通电 与氧化物2Mg+CO 2====2MgO+C 与水反应 Mg+2H 2OMg(OH)2↓+H 2↑与酸 Mg+2HCl=MgCl 2+H 2↑ 与盐溶液反应Mg+Cu 2+= Mg 2++ Cu制 取 MgCl 2+Ca(OH)2=Mg(OH)2↓+CaCl 2 Mg(OH)2+2HCl=MgCl 2+2H 2OMgCl 2•6H 2O==== MgCl 2+6H 2O ↑ MgCl 2(熔融)===== Mg +Cl 2↑ 用途1、镁合金-密度小,硬度和强度都较大2、氧化镁-优质耐高温材料四、侯氏制碱法(由氯化钠制备碳酸钠)向饱和食盐水中通入足量氨气至饱和,然后在加压下通入CO 2,利用NaHCO 3溶解度较小,析出NaHCO 3,将析出的NaHCO 3晶体煅烧,即得Na 2CO 3。
金属钠的性质与应用学习目标:1、掌握金属钠的物理性质和化学性质;2、了解金属钠的存在和用途;3、了解金属钠的生产原理。
一、金属钠的性质实验探究【实验一】取一小块金属钠,用滤纸吸干表面的煤油,用小刀切去一端的表层,观察表面的颜色;将其放置在空气中,观察表面颜色的变化。
【实验现象】【实验结论】1、钠是一种色、有、质地(能用刀切开),常温下为态的金属。
2、钠在空气中容易被氧化,表面变,生成白色的(化学式为)。
【实验二】取一小块金属钠放在石棉网上加热,观察实验现象。
【实验现象】加热时,形状不规则的钠熔化成,剧烈燃烧,产生色火焰,在石棉网上留下色固体。
【实验结论】1、钠的熔点较,受热易熔化。
2、加热条件下,钠与氧气反应生成色的(化学式为)。
【实验三】向一只盛有水的小烧杯中滴加几滴酚酞溶液,然后投入一小块金属钠,观察实验【实验探究】将一小块金属钠投入到煤油和水的混合液体中,请猜测实验现象。
【钠的保存】金属钠通常保存在中,是为了隔绝和。
【思考】1、金属钠能否保存在水中?2、金属钠能否保存在四氯化碳中?(提示:四氯化碳密度大于钠,且钠与四氯化碳不反应)二、金属钠的性质归纳【练习】请用双线桥法标出下列反应电子的转移情况,并指出反应中的氧化剂和还原剂。
4Na +O2=== 2Na2O 氧化剂:还原剂:2Na +O2 △Na2O2氧化剂:还原剂:2Na + 2H2O = 2NaOH + H2↑氧化剂:还原剂:【思考】金属钠在反应中作氧化剂还是还原剂?你能从原子结构的角度对此进行分析吗?三、金属钠的存在、制备与用途1、钠的存在【思考】为什么钠通常以化合态形式存在?2、钠的制备电解熔融的氯化钠:+3、钠的用途【例题巩固】1.下列液体可以用来保存金属钠的是()A.水B.浓NaOH溶液C.煤油l(密度大于水)42.钠与水反应时的现象与钠的下列性质无关的是()A.钠的熔点低B.钠的密度小C.钠的硬度小D.钠有强还原性3.下列关于金属钠的叙述,错误的是()A.很软,具有银白色光泽B.是电和热的良导体C.比水轻,比煤油重,熔点低于100℃D.和FeCl3溶液反应可以置换出单质铁4.将一小块金属钠投入氯化铁溶液中的化学反应方程式为5.金属钠着火时,能用来灭火的是()A.水B.湿抹布盖灭C.干沙D.泡沫灭火剂。
2.2 钠、镁及其化合物2【知识要点】二、碳酸钠的性质与应用(一)碳酸钠和碳酸氢钠的比较一览表3(二)电解质1.电离、电离方程式(1)电离:酸、碱、盐等溶于水或受热熔化时,离解成能够自由移动的离子的过程。
(2)电离方程式:表示电解质电离的化学方程式。
电离方程式用“”4.电解质在水溶液中反应的实质多种电解质在水溶液中发生电离,产生能够自由移动的离子,不同离子之间发生反应生成沉淀、气体、水等。
(1)离子反应:在溶液中或熔融状态时自由移动的离子之间的反应。
(2)离子反应发生的条件——物质之间能发生复分解反应①生成难溶物或微溶物:如Ba2+与CO32-、Ag+与Br-、Ca2+与SO42-、Ca2+与OH-、Mg2+与CO32-、OH-等之间发生离子反应。
②生成气体或挥发性物质:如NH4+与OH-,H+与OH-、CO32-、HCO3-、S2-、HS-、HSO3-、SO32-等之间发生离子反应。
③生成弱电解质:如H+与CH3COO-、CO32-、S2-、SO32-、F-等生成弱酸;OH-与NH4+、Cu2+、Fe3+等生成弱碱;H+与OH-生成水(水也是种弱电解质)。
5.离子方程式(1)书写离子方程式的步骤①写:写出正确的化学方程式;②拆:将化学方程式中易溶解于水且能完全电离的物质拆写成阴、阳离子符号;而难溶于水的物质、气态物质和水仍用化学式表示;③删:删去方程式等号两边重复的离子;④查:检查是否满足元素原子守恒、反应前后电荷守恒等。
(2)书写离子方程式的方法①离子反应是在溶液中或熔融状态时进行的反应,凡非溶液中进行的反应一般不能写离子方程式,亦即没有自由移动离子参加的反应,不能写离子方程式。
如NH4Cl固体和Ca(OH)2固体混合加热,虽然也有离子和离子反应,但不能写成离子方程式,只能写化学方程式。
②单质、氧化物在离子方程式中一律写化学式;弱酸(HF、H2S、HClO、H2SO3等)、弱碱(如NH3·H2O)等难电离的物质必须写化学式;难溶于水的物质(如CaCO3、BaSO4、FeS、PbS、BaSO3、Fe(OH)3等)必须写化学式。
第二单元钠、镁及其化合物钠的物理性质:银白色固体、有金属光彩、密度比煤油大比水小、质软、熔点低、能导电导热。
钠的化学性质:1.钠与水反响在烧杯中加一些水,滴入几滴酚酞溶液,而后把一小块钠放入水中。
为了安全应在烧杯上加盖玻璃片。
察看到的现象及由现象得出的结论有:(1)钠浮在水面上(钠的密度比水小)(2)钠熔成一个闪亮的小球(钠与水反响放出热量,钠的熔点低)(3)钠在水面上四周游动(有气体生成)(4)发出嘶嘶的响声(生成了气体,反响强烈)(5)预先滴有酚酞试液的水变红(有碱生成)反响方程式:2Na+2H2O=2NaOH+H2↑2.钠与氧气反响在常温时 :4Na+O2=2Na2O (白色粉末)在点燃时 :2Na+O2=△=Na2O2 (淡黄色粉末)3.钠与钛、锆、铌等金属氯化物反响4Na+TiCl4== 熔融 ==4NaCl+Ti (条件为高温且需要氩气做保护气)增补4.与酸溶液反响钠与水反响实质是和水中氢离子的反响,所以钠与盐酸反响,不是先和水反响,钠与酸溶液的反响波及到钠的量,假如钠少许,只好与酸反响,如钠与盐酸的反响:2Na+2HCl=2NaCl+H2↑假如钠过度,则优先与酸反响,而后再与酸溶液中的水反响。
5.与盐溶液反响将钠投入盐溶液中,钠先会和溶液中的水反响,生成的氢氧化钠假如能与盐反响则持续反响。
如将钠投入硫酸铜溶液中:2Na+2H2O=2NaOH+H2↑2NaOH+CuSO4=Na2SO4+Cu(OH)2↓钠的制取:电解熔融氯化钠2NaCl(熔融) =电解 =2Na+Cl2↑钠的化合物1.碳酸钠与碳酸氢钠的性质比较Na2CO3 NaHCO3 1.物理性质俗名纯碱、苏打小苏打色态白色粉末白色晶体溶解性(水)溶解度 Na2CO3>NaHCO3溶液酸碱性碱性 Na2CO3>NaHCO3(PH)2.化学性质与盐反响Na CO+CaCl =CaCO↓+NaCl2 不反响2 3 2 3与碱反响Na2CO3+Ca(OH)2=CaCO3↓+NaOH 2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO+2H O(少许 Ca(OH) )3 2 2NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O(过度 Ca(OH)2)与酸反响Na CO+2HCl=2NaCl+CO↑+H O NaHCO+HCl=NaCl+CO↑+H O2 3 2 3 2 2注:NaHCO3与酸反响生成气体更迅速热稳固性 2NaHCO3△ Na2CO3+H2O+CO2↑互相转变Na CO+H O+CO=2NaHCO 2NaHCO△ Na CO+HO+CO↑2 3 2 2 3 3 2 3 2 2饱和3.用途制皂、玻璃、造纸、纺织等、热纯发酵粉、泡沫灭火器、治胃酸。
专题二从海水中获得的化学物质
第二单元钠、镁及其化合物
钠的物理性质:
银白色固体、有金属光泽、密度比煤油大比水小、质软、熔点低、能导电导热。
钠的化学性质:
1.钠与水反应
盖玻璃片。
观察到的现象及由现象得出的结论有:
(1)钠浮在水面上(钠的密度比水小)
(2)钠熔成一个闪亮的小球(钠与水反应放出热量,钠的熔点低)
(3)钠在水面上四处游动(有
(4)发出嘶嘶的响声(生成了气体,反应剧烈)
(5)事先滴有酚酞试液的水变红(有碱生成)
反应方程式:
2Na+2H2O=2NaOH+H2↑
2.钠与氧气反应
在常温时:4Na+O2=2Na2O (白色粉末)
在点燃时:2Na+O2=△=Na2O2 (淡黄色粉末)
3.钠与钛、锆、铌等金属氯化物反应
4Na+TiCl4==熔融==4NaCl+Ti(条件为高温且需要氩气做保护气)
补充
4.与酸溶液反应
钠与水反应本质是和水中氢离子的反应,所以钠与盐酸反应,不是先和水反应,钠与酸溶液的反应涉及到钠的量,如果钠少量,只能与酸反应,如钠与盐酸的反应:2Na+2HCl=2NaCl+H2↑ 如果钠过量,则优先与酸反应,然后再与酸溶液中的水反应。
5.与盐溶液反应
将钠投入盐溶液中,钠先会和溶液中的水反应,生成的氢氧化钠如果能与盐反应则继续反应。
如将钠投入硫酸铜溶液中:
2Na+2H2O=2NaOH+H2↑ 2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
钠的制取:
电解熔融氯化钠
2NaCl(熔融)=电解=2Na+Cl2↑
钠的化合物
2.区分碳酸钠与碳酸氢钠的方法
⑴加热固体。
产生能使石灰水变浑浊的无色气体的是碳酸氢钠。
2NaHCO3 = Na2CO3 + H2O + CO2
⑵溶解,加入氯化钙溶液,产生沉淀的是碳酸钠。
Na2CO3 + CaCl2 = 2NaCl + CaCO3↓
⑶在固体中加入相同浓度的盐酸,反应剧烈的是碳酸氢钠。
侯氏制碱法
反应原理
NaCl+NH3+CO2+H2O==NaHCO3+NH4Cl
2NaHCO3△Na2CO3+H2O+CO2↑
离子反应
强电解质:强酸(硫酸、盐酸、硝酸)、强碱(氢氧化钠、氢氧化钾)、大多数盐在水溶液中
完全电离的一类电解质。
弱电解质:弱酸(碳酸、醋酸)、弱碱(一水和铵)在水溶液中不能完全电离的一类电解质。
离子方程式书写
用实际参加反应的离子符号来表示反应的式子。
它不仅表示一个具体的化学反应,而且表示同一类型的离子反应。
复分解反应这类离子反应发生的条件是:生成沉淀、气体或水。
书写方法: 写:写出反应的化学方程式
拆:把易溶于水、易电离的物质拆写成离子形式 删:将不参加反应的离子从方程式两端删去 查:查方程式两端原子个数和电荷数是否相等
海水中提取镁的方法
化学反应方程式:
镁的化学性质:
1、与空气的反应
2Mg + O 2 === 2MgO
3Mg + N 2 ===2Mg 2N 3
2Mg + CO 2 === 2MgO + C
2、与水的反应
Mg+2H 2O === Mg(OH)2+H 2↑
3、与酸的反应
Mg + H 2SO 4 === MgSO 4 + H 2↑
镁的用途:
1)镁合金的密度较小,但硬度和强度都较大,因此被用于制造火箭.导弹和飞机的部件 2)镁燃烧发出耀眼的白光,因此常用来制造通信导弹和焰火; 3)氧化镁的熔点很高,是优质的耐高温材料
点燃
点燃
点燃
写出下列物质之间的转化的化学方程式:。