化学反应工程习题第7章答案
- 格式:doc
- 大小:505.01 KB
- 文档页数:8

第一章习题1有一反响在间歇反响器中进行,经过8min 后,反响物转化掉80%,经过18min 后,转化掉90%,求表达此反响的动力学方程式。
解2A A min 18A0min 8A0AA A0d d 219.019.0181)(218.018.081)(11kc tc kc kc x x c kt =-=-⋅==-⋅=-⋅=为假设正确,动力学方程 2在间歇搅拌槽式反响器中,用醋酸与丁醇生产醋酸丁酯,反响式为:()()()()S R B A O H H COOC CH OH H C COOH CH 2943SO H 94342+−−→−+反响物配比为:A(mol):B(mol)=1:4.97,反响在100℃下进行。
A 转化率达50%需要时间为24.6min ,辅助生产时间为30min ,每天生产2400kg 醋酸丁酯〔忽略别离损失〕,计算反响器体积。
混合物密度为750kg·m -3,反响器装填系数为0.75。
解3313111111i 1.2m 0.750.8949总体积反应0.8949m 0.910.9834有效体积反应0.91hr6054.6折合54.6min 3024.6总生产时间hr 0.9834m 750737.5换算成体积流量hr 737.5kg 634.1103.4总投料量hr 634.1kg 744.97724.1B 4.97:1B :A hr 103.4kg 601.724折算成质hr 1.724kmol 0.50.862的投料量A ,则50%转化率hr 0.862kmol 116100hr 100kg 2400/24R 116 74 60 M S R B A ==⨯==+=⋅=+⋅=⨯⨯=⋅=⨯⋅=⋅=⋅=+→+-------器器投料量则量流量产量3反响(CH 3CO)2O+H 2O →2CH 3COOH 在间歇反响器中15℃下进行。
一次参加反响物料50kg ,其中(CH 3CO)2O 的浓度为216mol·m -3,物料密度为1050kg·m -3。



化学反应工程_华东理工大学中国大学mooc课后章节答案期末考试题库2023年1.对简单不可逆二级反应,根据要求的处理量、初浓度和转化率,所需的反应器体积最小。
参考答案:平推流2.工业反应过程优化的决策变量包括参考答案:操作方式_工艺条件_结构变量3.均相反应应该满足下述哪2个条件?参考答案:反应体系互溶_预混合过程很快4.对串联反应而言,存在一个最优反应温度使反应产物收率最大。
参考答案:错误5.化学反应工程的研究方法是经验放大方法参考答案:错误6.连续流动釜式反应器中物料浓度和温度处处相等,并且等于反应器进口物料的浓度和温度。
参考答案:错误7.理想间歇反应器中搅拌越激烈,混合越均匀,则反应速率越快。
参考答案:错误8.化学反应的前提是参与反应的所有物料达到分子尺度上的均匀,成为均一的气相或液相。
参考答案:错误9.产生返混的原因是参考答案:不均匀的速度分布_空间上的反向流动10.限制返混的措施包括参考答案:横向分割_纵向分割11.化学反应工程的研究对象是以化学实验室中进行的化学反应过程。
参考答案:错误12.化学反应工程优化的技术指标是参考答案:反应选择率_能耗_反应速率13.活化能E与反应的热效应相关,活化能大的反应其反应热也大。
参考答案:错误14.零级反应的重要特征是反应时间由残余浓度决定,与初始浓度关系不大。
参考答案:错误15.可逆放热反应的最优温度随转化率xA变大而增大。
参考答案:错误16.限制返混的措施是分割,主要是横向分割。
参考答案:正确17.理想管式反应器的径向具有严格均匀的速度分布,也就是在径向不存在浓度变化,所以反应速率随空间位置的变化将只限于轴向。
参考答案:正确18.对自催化反应A+P®P+S而言,必定存在最优反应时间使反应的转化率最大。
参考答案:错误19.小于1级的简单不可逆反应,反应转化率可以在有限时间里达到100%。
参考答案:正确20.空速1000(1/h)表示每小时能够处理的进口物料体积为反应器体积的1000倍。
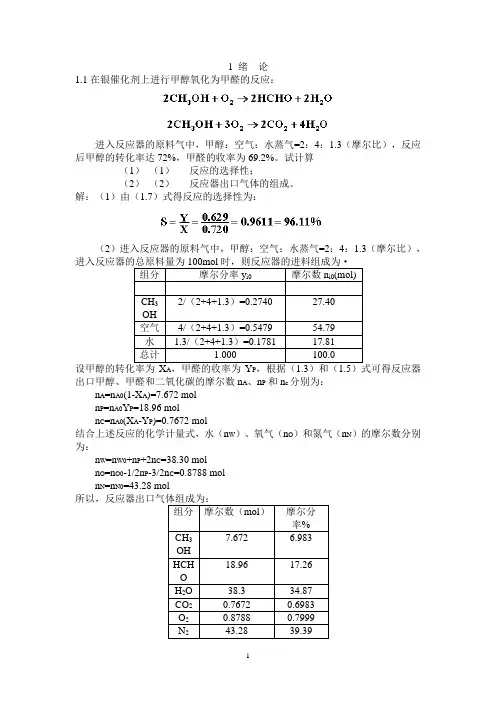
1 绪论1.1在银催化剂上进行甲醇氧化为甲醛的反应:进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1)(1)反应的选择性;(2)(2)反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),组分摩尔分率y i0 摩尔数n i0(mol)CH32/(2+4+1.3)=0.2740 27.40OH空气4/(2+4+1.3)=0.5479 54.79水 1.3/(2+4+1.3)=0.1781 17.81总计 1.000 100.0A P出口甲醇、甲醛和二氧化碳的摩尔数n A、n P和n c分别为:n A=n A0(1-X A)=7.672 moln P=n A0Y P=18.96 moln C=n A0(X A-Y P)=0.7672 mol结合上述反应的化学计量式,水(n W)、氧气(n O)和氮气(n N)的摩尔数分别为:n W=n W0+n P+2n C=38.30 moln O=n O0-1/2n P-3/2n C=0.8788 moln N=n N0=43.28 mol组分摩尔数(mol)摩尔分率%7.672 6.983CH3OH18.96 17.26HCHOH2O 38.3 34.87CO2 0.7672 0.6983O2 0.8788 0.7999N2 43.28 39.392 反应动力学基础2.4在等温下进行液相反应A+B→C+D,在该条件下的反应速率方程为:若将A和B的初始浓度均为3mol/l的原料混合进行反应,求反应4min时A的转化率。
解:由题中条件知是个等容反应过程,且A和B的初始浓度均相等,即为1.5mol/l,故可把反应速率式简化,得由(2.6)式可知代入速率方程式化简整理得积分得解得X A=82.76%。
2.6下面是两个反应的T-X图,图中AB是平衡曲线,NP是最佳温度曲线,AM是等温线,HB是等转化率线。



化学反应工程_中国石油大学(华东)中国大学mooc课后章节答案期末考试题库2023年1.反应平衡常数随温度变化关系,与()成正比。
答案:反应热2.关于动力学方程,以下正确的认识是:答案:一般反应的动力学方程和计量方程间无必然联系3.停留时间分布密度函数E(t)没有单位答案:错误4.对于一恒容反应,以下说法正确的是:答案:达到相同的转化率时,在间歇式反应器中进行需要的反应时间与在平推流反应器中进行需要的空时相等5.以下对离析流模型描述正确的是答案:宏观流体可以采用离析流模型计算_离析流模型中流体粒子可看做间歇釜反应器_离析流模型中流体粒子之间不存在物质交换6.影响轴向分散系数D的因素包括答案:湍流扩散_分子扩散_流体速率分布7.如果一个反应的瞬时收率与反应物浓度关系曲线有极大值,采用全混流-平推流进行串联也是个不错的选择。
答案:正确8.轴向分散系数与分子扩散系数,下面论述正确的是答案:分子扩散系数是物质本身的一种属性_两者实质上是不同的_轴向分散系数是与流动有关系的9.从反应器停留时间分布测定中求得无因次方差为0.99,反应器可视为答案:全混流10.二个相同体积的全混釜串联操作,其无因次停留时间分布的方差值为答案:0.511.由示踪实验测得一反应器的停留时间分布密度函数【图片】可计算流体在该反应器内平均停留时间为 min。
答案:1012.理想活塞流反应器E(t)曲线的方差是答案:13.停留时间分布函数F(t)取值范围是答案:[0, 1]14.关于我们选择反应器类型时需要考虑的因素,以下描述对不对?答案:以上因素均需要考虑15.对于在间歇式反应器中进行的不可逆反应,以下说法正确的是答案:一级反应的转化率与反应物的初始浓度无关16.对于不可逆气相反应A+2B→2C,在一的全混流反应器中进行,若进料中A与B的摩尔比为1:3,空时为8min,反应器出口A的转化率为80%,则物料在反应器中的平均停留时间为:答案:等于10min17.关于一个反应器的物料衡算方程,以下说法正确的是答案:对着眼组分i的物料衡算方程表达为:单位时间内i组分流入控制体积的摩尔数+单位时间内控制体积内因反应而生成的i组分的摩尔数=单位时间内流出控制体积的i的摩尔数+单位时间内控制体积内累积的i组分的摩尔数_方程中i组分累积的速率是指控制体积中i组分单位时间内增加的摩尔数18.不管哪种反应器类型,某反应物的转化率都可根据器内该组分摩尔数的变化来计算答案:错误19.对于不可逆气相反应A+2B→2C,在一恒温恒压的平推流反应器中进行,若进料中A与B的摩尔比为1:3,空时为8min,反应器出口A的转化率为80%,则物料在反应器中的平均停留时间为:答案:不能确定其具体数值20.对于平行-连串反应A+B→R,R+B→S,如果要有利R的生成,A应该采用平推流侧线小股进料。

题目:全混流连续操作反应器,反应器内温度、浓度处处均匀一致,故所有物料粒子在反应器内的停留时间相同。
正确答案:错题目:相同条件下,分别用下列反应器处理物料,比较反应器有效容积的大小。
①单段全混流反应器(V R1)②四个体积相同的全混流反应器串联(V R2)③两个体积相同的全混流反应器串联(V R3)④平推流反应器(V R4)则(V R4)>(V R2)>(V R3)>(V R1)正确答案:错题目:设备放大,造成微元停留时间分布和返混程度改变,放大时反应结果恶化。
正确答案:对题目:生产能力是相同条件下,单位时间、单位反应器体积所能获得的(产物量),或完成相同生产任务,所需反应器的(体积)。
题目:化工生产中应用于均相反应过程的化学反应器主要有(釜式)反应器和(管式)反应器。
题目:釜式反应器的基本结构主要包括反应器(壳体)、(搅拌器)、(密封装置)和(换热装置)等。
题目:手孔或人孔的安设是为了检查(内部空间)以及安装和拆卸设备(内部构件)。
题目:釜式反应器中夹套式换热器适用于传热面积(较小),传热介质压力(较低)的情况。
题目:基元反应的级数即为化学反应式的(计量系数),对非基元反应的级数通过(实验)确定。
题目:单一反应利用(转化率)可以确定反应物转化量与产物生成量之间的关系。
题目:间歇反应,只要C AO相同,无论处理量多少,达一定(转化率)每批所需的(反应时间)相同。
题目:对同一反应在相同条件下,达到相同转化率,全混釜反应器所需有效体积(最大),平推流反应器所需有效体积(最小),多釜串联全混釜所需有效体积(介于其间)。
题目:一级不可逆反应,其反应速率方程为(-r A =kC A a ),反应时间与转化率的关系为(kt )x 11ln(A =-)。
题目:复合反应动力学为由两个以上(化学反应计量式)或(动力学方程式)表示的化学反应过程。
题目:间歇釜式反应器有效体积不但与(反应时间)有关,还与(非生产时间)有关。


《化学反应工程》课程习题集一、单选题1.某反应的速率常数k=0.0462-1,又知初始浓度为0.1mol.dm-3,则该反应的半衰期为:(A) 1/(6.93×10-2×0.12) (B) 15分(C) 30分 (D) 1/(4.62×102×0.1)分2.某一级反应, 当反应物的浓度降为起始浓度的1%时,需要t1秒, 若将反应物的浓度提高一倍, 加快反应速率, 当反应物浓度降低为起始浓度的1%时, 需时为t2, 则:(A ) t1﹥t2 (B) t1=t2(C) t1﹤t2 (D) 不能确定二者关系3.某反应物反应掉7/8所需的时间恰好是它反应掉1/2所需时间的3倍, 则该反应的级数是:(A) 零级 (B) 一级反应 (C) 三级反应 (D) 二级反应4.若两个相同类型的气相双分子反应的△H⊙值相等, 又在400k时,它们的活化熵之差△S1⊙-△S2⊙=10 J.mol-1,则两反应的速率常数之比为:(A) K1/K2=0.300 (B) K1/K2=0.997(C) K1/K2=1.00 (D) K1/K2=3.335.对反应A+B→C, 由下列数据C A0/mol.dm-3 C B0/mol.dm-3 r0/ mol.dm-31.0 1.0 0.152.0 1.0 0.301.02.0 0.15则该反应的速率方程为:(A) r=K C B (B) r=K C A C B(C) r=K C A (D) r=K C A C B26.一个反应的活化能是33kJ·mol-1, 当 T = 300K 时,温度每增加1K,反应速率常数增加的百分数约是___。
A. 4.5%B. 90%C. 11%D. 50%7.下列叙述正确的是_ 。
A. 吸热反应的活化能比放热反应的活化能高B. 一个反应的反应速率与化学方程式中出现的所有作用物浓度都有关C. 催化反应的速率与催化剂的浓度无关D. 反应速率常数与作用物浓度无关8.关于催化剂的使用,下列叙述中不正确的是_ 。
第一章习题1化学反应式与化学计量方程有何异同?化学反应式中计量系数与化学计量方程中的计量系数有何关系?答:化学反应式中计量系数恒为正值,化学计量方程中反应物的计量系数与化学反应式中数值相同,符号相反,对于产物二者相同。
2 何谓基元反应?基元反应的动力学方程中活化能与反应级数的含义是什么?何谓非基元反应?非基元反应的动力学方程中活化能与反应级数含义是什么?答:如果反应物严格按照化学反应式一步直接转化生成产物,该反应是基元反应。
基元反应符合质量作用定律。
基元反应的活化能指1摩尔活化分子的平均能量比普通分子的平均能量的高出值。
基元反应的反应级数是该反应的反应分子数。
一切不符合质量作用定律的反应都是非基元反应。
非基元反应的活化能没有明确的物理意义,仅决定了反应速率对温度的敏感程度。
非基元反应的反应级数是经验数值,决定了反应速率对反应物浓度的敏感程度。
3若将反应速率写成tc rd d AA -=-,有什么条件? 答:化学反应的进行不引起物系体积的变化,即恒容。
4 为什么均相液相反应过程的动力学方程实验测定采用间歇反应器?答:在间歇反应器中可以直接得到反应时间和反应程度的关系,而这种关系仅是动力学方程的直接积分,与反应器大小和投料量无关。
5 现有如下基元反应过程,请写出各组分生成速率与浓度之间关系。
(1)A+2B →C (2)A+2B →C (3)2A+2B →CA+C →D B+C →D A+C →D C+D →E 解(1)D4C A 3D D 4C A 3C 22BA 1C C22B A 1B D4C A 3C 22B A 1A 22c k c c k r c k c c k c k c c k r c k c c k r c k c c k c k c c k r -=+--=+-=+-+-=(2)E6D C 5D 4C B 3D E 6D C 5D 4C B 3C 22BA 1C D4C B 3C 22B A 1B C22B A 1A 22c k c c k c k c c k r c k c c k c k c c k c k c c k r c k c c k c k c c k r c k c c k r +--=+-+--=+-+-=+-=(3)D4C A 3D D 4C A 3C 22B2A 1C C22B 2A 1B D 4C A 3C 22B 2A 1A 2222c k c c k r c k c c k c k c c k r c k c c k r c k c c k c k c c k r -=+--=+-=+-+-=6 气相基元反应A+2B →2P 在30℃和常压下的反应速率常数k c =2.65×104m 6kmol -2s -1。
化学反应工程第三版课后答案【篇一:化学反应工程第二版课后习题】> 2何谓基元反应?基元反应的动力学方程中活化能与反应级数的含义是什么?何谓非基元反应?非基元反应的动力学方程中活化能与反应级数含义是什么? 345现有如下基元反应过程,请写出各组分生成速率与浓度之间关系。
(1)a+2b?c a+c? d (2)a+2b?c b+c?d c+d→e (3)2a+2b?ca+c?d10mkmols。
现以气相分压来表示速率方程,即(?ra)=kppapb,求kp=?(假定气体为理想气体)46-2-12化学反应式与化学计量方程有何异同?化学反应式中计量系数与化学计量方程中的计量系数有何关系?若将反应速率写成?ra??dcadt,有什么条件?为什么均相液相反应过程的动力学方程实验测定采用间歇反应器? 78反应a(g) +b(l)→c(l)气相反应物a被b的水溶液吸收,吸收后a与b生成c。
反应动力学方程为:?ra=kcacb。
由于反应物b在水中的浓度远大有一反应在间歇反应器中进行,经过8min后,反应物转化掉80%,经过18min后,转化掉90%,求表达此反应的动力学方程式。
反应2h2?2no?n2?2h2o,在恒容下用等摩尔h2,no进行实验,测得以下数据总压/mpa 半衰期/s10 考虑反应a?3p,其动力学方程为?ra??容下以总压表示的动力学方程。
11 a和b在水溶液中进行反应,在25℃下测得下列数据,试确定该反应反应级数和反应速度常数。
116.8 319.8 490.2 913.8 1188 时间/s-312 丁烷在700℃,总压为0.3mpa的条件下热分解反应:c4h10→2c2h4+h2 (a) (r)(s)起始时丁烷为116kg,当转化率为50%时?dprdnsdya,?。
dtdtdtdpadt?0.24mpa?s?13-1-1-3-33-10.0272265 0.0326 186 0.0381 135 0.0435 104 0.0543 67求此反应的级数。
第一章习题1化学反应式与化学计量方程有何异同?化学反应式中计量系数与化学计量方程中的计量系数有何关系?答:化学反应式中计量系数恒为正值,化学计量方程中反应物的计量系数与化学反应式中数值相同,符号相反,对于产物二者相同。
2 何谓基元反应?基元反应的动力学方程中活化能与反应级数的含义是什么?何谓非基元反应?非基元反应的动力学方程中活化能与反应级数含义是什么?答:如果反应物严格按照化学反应式一步直接转化生成产物,该反应是基元反应。
基元反应符合质量作用定律。
基元反应的活化能指1摩尔活化分子的平均能量比普通分子的平均能量的高出值。
基元反应的反应级数是该反应的反应分子数。
一切不符合质量作用定律的反应都是非基元反应。
非基元反应的活化能没有明确的物理意义,仅决定了反应速率对温度的敏感程度。
非基元反应的反应级数是经验数值,决定了反应速率对反应物浓度的敏感程度。
3若将反应速率写成tc rd d AA -=-,有什么条件? 答:化学反应的进行不引起物系体积的变化,即恒容。
4 为什么均相液相反应过程的动力学方程实验测定采用间歇反应器?答:在间歇反应器中可以直接得到反应时间和反应程度的关系,而这种关系仅是动力学方程的直接积分,与反应器大小和投料量无关。
5 现有如下基元反应过程,请写出各组分生成速率与浓度之间关系。
(1)A+2B ↔C A+C ↔ D (2)A+2B ↔C B+C ↔D C+D →E(3)2A+2B ↔CA+C ↔D 解(1)D4C A 3D D 4C A 3C 22BA 1C C22B A 1B D 4C A 3C 22B A 1A 22c k c c k r c k c c k c k c c k r c k c c k r c k c c k c k c c k r -=+--=+-=+-+-=(2)E6D C 5D 4C B 3D E 6D C 5D 4C B 3C 22BA 1C D4C B 3C 22B A 1B C22B A 1A 22c k c c k c k c c k r c k c c k c k c c k c k c c k r c k c c k c k c c k r c k c c k r +--=+-+--=+-+-=+-=(3)D4C A 3D D 4C A 3C 22B2A 1C C22B 2A 1B D 4C A 3C 22B 2A 1A 2222c k c c k r c k c c k c k c c k r c k c c k r c k c c k c k c c k r -=+--=+-=+-+-=6 气相基元反应A+2B →2P 在30℃和常压下的反应速率常数k c =2.65×104m 6kmol -2s -1。
(完整版)⼤学化学后7章答案5.2 习题及详解⼀.判断题1.铝、铬⾦属表⾯的氧化膜具有连续结构并有⾼度热稳定性,故可做耐⾼温的合⾦元素。
(√)2.在Δr G -T图中,直线位置越低,Δf G 越负,则反应速率越快。
(×)3.Mg 是活泼⾦属,但由于常温下不与冷⽔反应,所以不容易腐蚀。
(×)4.Na 与H 2O 反应时,⽔是氧化剂。
(√)5.298K 时,钛可与氧、氮、硫、氧等⾮⾦属⽣成稳定化合物,故在炼钢时加⼊钛以除去这些杂质。
(×) 6.某溶液中可同时含有Na +、[Al(OH)4]- 和Cr 2O 72–。
(×)7.MnO 4–的还原产物只与还原剂有关。
(×)8.反应Zn(s)+Cu 2+(aq)→Zn 2+(aq)+Cu(s)的发⽣可⽤电离能说明。
(×)⼆.选择题1.下列元素在常温时不能与氧⽓(空⽓)作⽤的是(B )A . LiB . SnC . ScD .Mn2.常温下,在⽔中能稳定存在的⾦属是(D )A .CeB . CaC . CrD .Ni3.下列⾦属中,能与⽔蒸⽓作⽤⽣成相应氧化物的是(B )A .BaB .FeC .HgD . Pb4.过渡元素的下列性质中错误的是(A )A .过渡元素的⽔合离⼦都有颜⾊B .过渡元素的离⼦易形成配离⼦C .过渡元素有可变的氧化数D .过渡元素的价电⼦包括ns 和(n-1)d 电⼦5.第⼀过渡系元素的单质⽐第⼆、第三过渡系活泼,是因为(D )A .第⼀过渡系元素的原⼦半径⽐第⼆、第三过渡系⼩B .第⼆、第三过渡系元素的单质的外层电⼦数⽐第⼀过渡系多C .第⼀过渡系元素的离⼦最外层d轨道屏蔽作⽤⽐第⼆、第三过渡系的⼩D .第⼆、第三过渡系⽐第⼀过渡系元素原⼦的核电荷增加较多,且半径相近6.易于形成配离⼦的⾦属元素位于周期系中的(D )A .p 区B .s 区和p 区C .s 区和f 区D .d 区和 ds 区7.钢铁⼚炼钢时,在钢⽔中加⼊少量钛铁,是因为(A )A .钛铁可除去钢中的⾮⾦属杂质B .钛铁具有抗腐蚀性C .钛铁密度⼩D .钛铁机械强度⼤8.在酸性溶液中,下列各对物质能共存的是(C )A .SO 32- 、 MnO 4-B . CrO 2- 、 Sc 3+C .MnO 4- 、 Cr 2O 72-D . CrO 3 、 C 2H 5OH9.贮氢合⾦是两种特定⾦属的合⾦,其中⼀种可⼤量吸进氢⽓的⾦属是(D )A . s 区⾦属B .d 区⾦属C .ds 区⾦属D .稀⼟⾦属10.需要保存在煤油中的⾦属是(A )(A )Ce (B) Ca (C) Al (D) Hg θm θm三.填空1.将⾦属按化学活泼性分类,活泼⾦属元素在_ s 区和IIIB _____ 区,中等活泼⾦属元素在_ d ,ds ,P _____ 区,不活泼⾦属元素在__ d ,ds _____ 区。
第7章化学反应工程习题答案7-1 试述物理吸收与化学吸收的区别。
解:对于物理吸收过程*=A A A P H C 0 对于化学吸收过程**+=AA BA P P C C αα10,式中A KH =α,其中K 为化学平衡常数;0B C 为吸收剂中的活性组分浓度;0A C 是与A 组分分压*A P 平衡的气体浓度;A H -A 组分溶解度系数。
从以上两式可以看出物理吸收和化学吸收区别如下:1.物理吸收气体溶解度与气体压力呈正比关系,化学吸收呈渐近线关系,当分压较高时,气体溶解度趋近化学计量的极限,因此为了减低能耗,导致操作方式不同,压力较低宜采用化学吸收,压力较高宜采用物理吸收。
2.热效应不同,物理吸收热效应较小,每摩尔数千焦耳,而化学吸收可达数万焦耳。
导致吸收剂的再生方式不同,物理吸收过程吸收剂减压再生为主,化学吸收过程的吸收剂再生除减压外还需加热。
3.物理吸收选择性主要体现各种气体在溶解度系数的差异,而化学吸收取决于A KH =α,由于化学反应特定性,吸收选择性不同。
化学吸收选择性高于物理吸收。
7-2解释下列参数的物理意义:无因次准数M 、增大因子β及液相利用率η。
分别写出一级不可逆和二级不可逆反应无因次准数M 的计算式。
解:无因次准数M 的物理意义通过液膜传递速率液膜内的化学反应速率增大因子β的物理意义为速率单纯物理吸收时的传质过气液界面的传质速率液膜内有化学反应时通液相利用率η的物理意义为的反应速率液相均处于界面浓度下吸收速率对于一级不可逆反应211LAL L L k kD k k M ==δ对于二级不可逆反应22LBLAL k C k D M =7-3 纯二氧化碳与氢氧化钠水溶液进行反应,假定液相上方水蒸气分压可不计,试按双膜模型绘出气相及液相二氧化碳浓度分布示意图。
解:气模 液膜 P CO2,gP CO2,iC CO2,i C CO2,L7-4应用双模理论对下列情况分别绘出气相及液相中反应物及反应产物浓度分布示意图:(1)反应两种气体A、B被同一吸收剂S同时吸收,A的吸收是0=ALC的中速反应,B的吸收是1〈〈MaL慢;(2)反应两种气体A、B被同一吸收剂S同时吸收,A的吸收是气膜控制的瞬间反应,B的吸收是1〉〉MaL慢速反应。
解:(1)(2)P A,iP A,g气模液膜C S,LC S,iC A,i→ALC≠=LxAdxdcδC S,L气模液膜P B,gP B,iC B,i气模液膜P A,gC A,iC S,LC S,i7-5 一级不可逆反应过程,已知s m k L /104-=,s m D L /105.129-⨯=,试讨论:(1) 反应速率常数1k 高于什么数值时,将是膜中进行的快反应过程;1k 低于什么数值时,将是液流主体中进行的慢反应。
(2) 如果111.0-=s k 。
试问L a 达到多大以上反应方能在液流主体中反应完毕,此时传质表面上的平均液膜厚度将是多少? (3) 如果1110-=s k ,30=L a ,试求η和β。
解:(1)当3≥M 时将是在膜中进行的快反应过程,即921≥LAL k k D ,解1160-≥s k当02.0≤M 时将是在膜中进行的快反应过程,即421104-⨯≤LAL k k D ,解1311067.2--⨯≤s k(2)当()M th M a L 11〉〉-时反应方能在液流主体中反应完毕,由于即1105.1101.0105.128921〈〈⨯=⨯⨯==---LAL k k D M ,此时M M th →,上式可以简化为()M a L 〉〉-1,6.67≥L α。
气模 液膜 P B,g P B,i C B,iC S,L C B,L →0m k D L L L 549105.110105.1---⨯=⨯==δ (3)5.11010105.18921=⨯⨯==--LAL k k D M ,此时满足()M th M a L 11〉〉-,所以45.1==M th M β 032.0)(1==M th M L αη或带入原公式()[]()[]44.115.15.1)130(5.1)130(22.15.1111=+-+-=+-+-=th th M th M a Mth aM ML Lβ7-6 对于不可逆一级快速反应过程,试讨论温度和浓度对吸收速率的影响。
()[]()[]032.0111=+-+-=M th M a M a M th a M LLL η解:气-液反应它与均相反应有着根本不同的特性,气-液反应必须首先通过气体的溶解,然后与液相中的反应物进行反应,因此它是气体的溶解和与液相反应的一种总和。
对于不可逆一级快速反应过程,其吸收速率i L i L C D k C k M N 1== 温度对吸收速率的影响:气体溶解绝大多数为放热过程,即随着温度升高溶解度系数降低,使气体在气-液界面浓度i C 降低,温度提高使反应速率常数1k 和扩散系数增加,因此温度对气-液吸收速率的影响吸收速率取决于反应速率常数、扩散系数和气体溶解度的此消彼涨,例如氨水碳化过程的实验数据表明:温度对它们的影响刚好对消,因此吸收速率与温度无关。
反应物浓度的影响:反应物浓度升高通常会是反应速率加快,但是当反应物浓度增高时,溶液中反应物和生成物浓度都随之升高,气体在液相中的溶解度系数降低,并且溶液浓度的增加会使溶液粘度增大,导致扩散系数和传质系数降低,因此对于大多数气-液反应系统,存在一个最佳浓度。
7-7在20℃下用9=pH 的缓冲溶液吸收二氧化碳分压力为0.01MPa 的气体,已知s m k L /104-=,14110-=s C k OH ,s m D L O C /104.129,2-⨯=,若反应可视为拟一级不可逆反应,气膜传质阻力可以忽略不计,1000=α,)/(0014.032MPa m kmol H CO •=,试求吸收速率。
解:2854921104.1101010104.1----⨯=⨯⨯⨯==LAL k k D M 14104.110002=⨯⨯=-M L α属于持液大的拟一级慢反应,此时 934.0)1(=+-=M M M L L αδβ由于气膜传质阻力可以忽略不计,因此气相主体二氧化碳分压等于气液界面分压。
吸收速率)/(103.10014.001.010934.0394,2s m kmol C k N i CO L •⨯=⨯⨯⨯==--β7-8 用42SO H 来吸收压力MPa 005.0的3NH ,该反应为极快的不可逆反应,为了使吸收过程以最快的速率进行。
试问吸收时42SO H 的浓度最低应为多少?试求吸收速率。
已知数据:)/(100.824s MPa m kmol k g •⋅⨯=-,s m k L /1035-⨯=,1/,,423=L SO H L NH D D解:反应方程式为:424423)(2121SO NH SO H NH =+为了使吸收过程以最快速率进行,硫酸浓度必须达到临界浓度。
354/0667.0005.01031085.0))(()(242342m kmol p D D k k C CO SO H NH L g c SO H =⨯⨯⨯⨯==--υ 吸收速率)/(104005.010821082s m kmol p k N CO g •⨯=⨯⨯==--7-9 用OH N a 吸收气体中的2NO ,2NO 分压为0.005MPa ,溶液中的OH N a 浓度为0.5L mol /,如果)/(0.52h MPa m kmol k g ••=,s m k L /1055-⨯=,二级反应速率常数)/(10342s kmol m k •=,)/(25.032MPa m kmol H NO •=,s m D L CO /108.129,2-⨯=,7.1/,,2=LCOL OH N D D a,试求吸收速率;并判断是否可用拟一级反应模型计算?解:对于二级不可逆反应:601055.010108.1549,2=⨯⨯⨯⨯==--LLB L kC kD M首先按气流主体二氧化氮分压计算二氧化氮在气-液界面i CO C ,2值,如果按此值计算i β值已经很大,那么实际i β还会更大。
681)005.025.01/(5.07.11)/(1,,22=⨯⨯⨯+=+=i CO L CO NaOH L NaOH i C D C D υβ由上述计算可知:M i 2φβ,因此可用拟一级反应模型计算。
此时M =β 此吸收过程为不可逆反应,液流主体中二氧化氮平衡分压为零 吸收速率为**=-=C K C C K N L L L )( 其中Lg L k k H K β11+=,带入数据得: 18.513105601)3600/5(25.0115=⨯⨯+=+=-L g L k k H K β,s m K L /1095.13-⨯= )/(1043.2005.025.01095.1)(233s m kmol C K C C K N L L L •⨯=⨯⨯⨯==-=--**7-10 气体中2CO 在2000φmm 塔中被30℃的氨水鼓泡吸收,2CO 含量由10%降低至1%,气量(STP )为6500h m /3,设氨水游离氨为0.3L mol /,操作压力0.56MPa (绝压),反应过程可视为虚拟一级不可逆反应,设氨水2CO 的二级反应速率常数)/(30032s kmol m k •=,鼓泡层液相混合均匀,试求鼓泡层的VS d a 、、ε和该塔所需净有效高度。
已知:)/(146.032MPa m kmol H CO •=,s m D L CO /105.129,2-⨯=,s m k L /1034-⨯= ,)/(0.12h MPa m kmol k g ••=,氨水物性:3/960m kg L =ρ,s Pa L •⨯=-3109.0μ ,m N L /1062-⨯=σ。
解:按气相为平推流、液相为全混流的简化模型考虑,折合成反应条件下氨气的加料速率为h m /1305)56.0/1013.0()273/303(65003=⨯⨯ 表观气速 s m u OG /115.01360013052=⨯⨯=π气泡直径按12.012.02235.0226---⎪⎪⎭⎫ ⎝⎛⎪⎪⎭⎫⎝⎛⎪⎪⎭⎫⎝⎛=R OG L L R L L R RvsgDu gD gD D d μρσρ计算12.05.012.023235.022])281.9(115.0[])109.0(960281.9[)106960281.9(226-----⨯⨯⨯⨯⨯⨯⨯⨯⨯⨯=VS dm 31033.1-⨯=气含率按247434)1(⎪⎪⎭⎫⎝⎛⎪⎪⎭⎫ ⎝⎛=-LL L L L OG G Gg u C μσρσμεε计算,对电解质25.0=C5.0])109.0(81.9)106(960)[106109.0115.0(25.0)1(24/74332234=⨯⨯⨯⨯⨯⨯⨯=-----G Gεε 经试差解得 2.0=G ε 比表面积 323/9021033.12.066mm d a VS G =⨯⨯==-ε 由题可知,此二级反应可按拟一级反应处理;5.1)103(3.0300105.1,249223=⨯⨯⨯⨯==--L LNH L k C k D M由M 值不能判断该反应特征,需要进一步判别。