高二化学浙江专用苏教版选修4课件:2.3化学平衡的移动
- 格式:ppt
- 大小:2.10 MB
- 文档页数:15








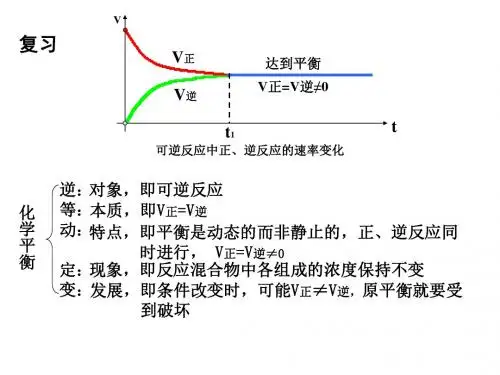

高中化学学习材料唐玲出品专题2 第3单元一、选择题1.压强变化不会使下列化学反应的平衡发生移动的是( )A.H2(g)+Br2(g)2HBr(g) B.N2(g)+3H2(g)2NH3(g)C.2SO2(g)+O2(g)2SO3(g) D.C(s)+CO2(g)2CO(g)【解析】对于气体体积不变的反应,改变压强时化学平衡不移动。
【答案】 A2.对于平衡CO2(g)CO2(aq) ΔH=-19.75 kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是( )A.升温增压B.降温减压C.升温减压D.降温增压【解析】正反应放热,要使平衡右移,应该降低温度;另外正反应为气体分子数减少的反应,所以为了增加CO2在水中的溶解度,应该增大压强,故选D。
【答案】 D3.在常温常压下,向5 mL 0.1 mol·L-1 FeCl3溶液中滴加0.5 mL 0.01 mol·L-1的NH4SCN溶液,发生如下反应:FeCl3+3NH4SCN Fe(SCN)3+3NH4Cl,所得溶液呈红色,改变下列条件,能使溶液颜色变浅的是( )A.向溶液中加入少量的NH4Cl晶体B.向溶液中加入少量的水C.向溶液中加少量无水CuSO4,变蓝后立即取出D.向溶液中滴加2滴2 mol·L-1的FeCl3【解析】从反应实质看,溶液中存在的化学平衡是:Fe3++3SCN-Fe(SCN)3,Fe(SCN)3溶液显红色,加入NH4Cl晶体,因为在反应中NH4+、Cl-未参与上述平衡,故对此平衡无影响;加水稀释各微粒浓度都变小,且上述平衡逆向移动,颜色变浅;CuSO4粉末结合水,使各微粒浓度变大,颜色加深;加2滴2 mol·L-1FeCl3,增大c(Fe3+),平衡正向移动,颜色加深(注意,若加入FeCl3的浓度≤0.1 mol·L-1,则不是增加反应物浓度,相当于稀释)。
【答案】 B4.合成氨工业上采用了循环操作,主要原因是( )A.加快反应速率B.提高NH3的平衡浓度C.降低NH3的沸点D.提高N2和H2的利用率【解析】合成氨工业上采用循环压缩操作,将N2、H2压缩到合成塔中循环利用于合成氨,提高了N2、H2的利用率。