高中化学竞赛 第四章 配合物结构和新型配合物课件
- 格式:ppt
- 大小:2.40 MB
- 文档页数:56

高中化学奥林匹克竞赛辅导配合物(配位化合物)化学基础【竞赛要求】配位键。
常见的配合物的中心离子(原子)和常见的配体(水、羟离子、卤离子、拟卤离子、氨分子、酸根离子、不饱和烃等)。
螯合物及螯合效应。
常见的络合剂及常见的配合反应。
定性说明配合反应与酸碱反应、沉淀反应、氧化还原反应的联系。
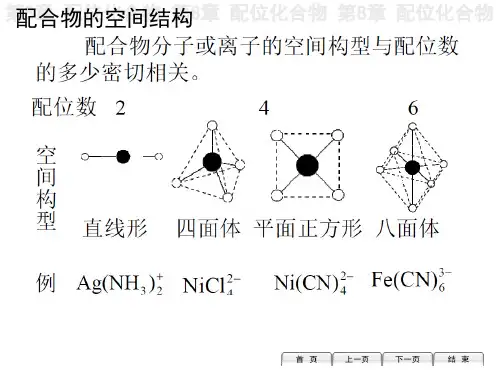
配合物几何构型和异构现象的基本概念。
配合物的杂化轨道理论。
八面体配合物的晶体场理论。
Ti(H2O)6的颜色。
路易斯酸碱的概念。
1.配合物:由中心离子(或原子)和几个配体分子(或离子)以配位键相结合而形成的复杂分子络合物。
如[Co(NH3)6]3+、[Cr(CN)6]3–、Ni(CO)4都是配位单元,分别称作配阳离子、配阴离子、配分子。
判断物质是配合物的关键在于物质是否含有配位单元。
配合物和复盐的区别:前者一定含有配位键,后者没有配位键,如KCl·MgCl2·6H2O是复盐,不是配合物。
2.配合物的组成:为外界,内外界(1)配合物的内界和外界:以[Cu(NH3)4]SO4为例,[Cu(NH3)4]2+为内界,SO-24之间是完全电离的。
内界是配位单元,外界是简单离子。
又如K3[Cr(CN)6]之中,内界是[Cr(CN)6]3–,外界是K+。
配合物可以无外界,但不能没有内界,如Ni(CO)4。
(2)中心离子(原子)和配位体:a.中心离子(原子):又称配合物的形成体或中心体,多为过渡金属离子,如Fe3+、Fe2+、Co2+、Ni2+、Cu2+,也有电中性的原子为配合物的中心原子,如Ni(CO)4、Fe(CO)5中的Ni和Fe都是电中性的原子。
只要能提供接纳孤对电子的空轨道的离子或原子均可作中心体。
b.配位体:含有孤对电子的阴离子或分子。
如NH3、Cl—、CN—等。
配位体中直接同中心原子配合的原子,叫做配位原子。
如[Cu(NH3)4]2+配阳离子中,NH3是配位体,其中N原于是配位原子。
配位原子经常是含有孤对电子的原子。