钠及钠氧化物
- 格式:ppt
- 大小:1.53 MB
- 文档页数:17

第11讲 钠及其氧化物复习目标 1.掌握钠及其氧化物的性质及应用。
2.初步建立宏观现象推理物质性质、结构决定性质的思维模型。
考点一 钠的重要性质1.钠的物理性质银白色,有金属光泽的固体,质地柔软,熔点低(小于100 ℃),密度比水的小,但比煤油的大。
2.从钠的原子结构认识钠的化学性质——还原性Na :――――――――――→O 2、Cl 2、H 2O 、H +等失去e-Na +:(1)与非金属单质(如O 2、Cl 2)反应O 2⎩⎨⎧常温:4Na +O 2===2Na 2O ;加热:2Na +O 2=====△Na 2O 2。
Cl 2:2Na +Cl 2=====△2NaCl 。
(2)与水反应离子方程式:2Na +2H 2O===2Na ++2OH -+H 2↑。
(3)与盐酸反应离子方程式:2Na +2H +===2Na ++H 2↑。
3.钠的制取及保存(1)制取:化学方程式为2NaCl(熔融)=====电解2Na +Cl 2↑。
(2)保存:密封保存,通常保存在石蜡油或煤油中。
4.钠的用途(1)钠钾合金(液态)可用于原子反应堆的导热剂。
(2)用作电光源,制作高压钠灯。
(3)冶炼某些金属金属钠具有强还原性,熔融状态下可以用于制取金属,如4Na +TiCl 4=====熔融4NaCl +Ti 。
1.钠可以保存在四氯化碳溶液中( )2.金属钠着火时,可用泡沫灭火器或干燥的沙土灭火( ) 3.钠表面自然形成的氧化层能够保护内层金属不被空气氧化( ) 4.金属钠具有强还原性,可与TiCl 4溶液反应制取金属Ti( ) 5.钠的金属性比钾强,工业上用钠制钾的原理为Na +KCl熔融K ↑+NaCl( )6.实验结束后剩余的金属钠不能随意丢弃,应放回原试剂瓶中( ) 答案 1.× 2.× 3.× 4.× 5.× 6.√一、钠与水反应的信息提取1.用镊子从煤油中取出一块钠,用滤纸吸干表面的煤油后,用小刀切取两小块钠,截面呈银白色,很快变暗。
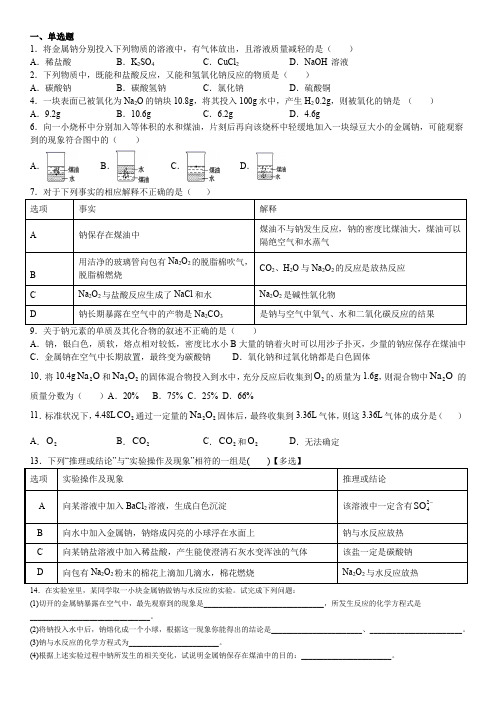
一、单选题1.将金属钠分别投入下列物质的溶液中,有气体放出,且溶液质量减轻的是( ) A .稀盐酸 B .K 2SO 4 C .CuCl 2 D .NaOH 溶液 2.下列物质中,既能和盐酸反应,又能和氢氧化钠反应的物质是( ) A .碳酸钠 B .碳酸氢钠 C .氯化钠 D .硫酸铜4.一块表面已被氧化为Na 2O 的钠块10.8g ,将其投入100g 水中,产生H 2 0.2g ,则被氧化的钠是 ( ) A .9.2g B .10.6g C .6.2g D .4.6g6.向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入一块绿豆大小的金属钠,可能观察到的现象符合图中的( ) A .B .C .D .A .钠,银白色,质软,熔点相对较低,密度比水小B 大量的钠着火时可以用沙子扑灭,少量的钠应保存在煤油中C .金属钠在空气中长期放置,最终变为碳酸钠D .氧化钠和过氧化钠都是白色固体10.将10.4g 2Na O 和22Na O 的固体混合物投入到水中,充分反应后收集到2O 的质量为1.6g ,则混合物中2Na O 的质量分数为( )A .20%B .75%C .25%D .66%11.标准状况下,4.48L 2CO 通过一定量的22Na O 固体后,最终收集到3.36L 气体,则这3.36L 气体的成分是( ) A .2OB .2COC .2CO 和2OD .无法确定14.在实验室里,某同学取一小块金属钠做钠与水反应的实验。
试完成下列问题:(1)切开的金属钠暴露在空气中,最先观察到的现象是________________________________,所发生反应的化学方程式是________________________________。
(2)将钠投入水中后,钠熔化成一个小球,根据这一现象你能得出的结论是________________________、________________________。


高中化学钠及其氧化物知识点总结高中化学钠及其氧化物知识点总结钠是我们生活中非常常见的一种金属元素,它在自然界中以化合物的形式存在,如食盐和碱金属矿物。
钠及其氧化物在高中化学学科中是非常重要的内容,下面我们来总结一下相关的知识点。
一、钠的性质及常见化合物钠是一种质软、银白色的金属,可以用刀切割而不会被压碎。
它的密度较小,熔点低,属于活泼金属。
钠在空气中容易氧化,会被氧气反应生成氧化钠。
钠可溶于水,与水剧烈反应,产生氢气和氢氧化钠。
在实验室中常用酒精燃烧钠的方法制取纯净钠金属。
常见的钠化合物有氯化钠、硫酸钠、碳酸钠等。
氯化钠是我们日常所说的食盐,它是一种无色晶体,可溶于水。
硫酸钠是一种白色结晶固体,不容易溶于水,且可以吸湿。
碳酸钠是一种白色结晶固体,可溶于水,呈碱性溶液。
二、氧化钠(Na2O)氧化钠是一种无机化合物,它由钠元素与氧元素反应得到。
氧化钠是一种白色晶体固体,熔点高且易溶于水。
它是一种强碱性物质,与酸反应产生盐和水的中和反应。
氧化钠也可以与二氧化碳反应生成碳酸钠。
氧化钠是生活中很重要的工业原料,在玻璃工业中起着重要的作用。
三、过氧化钠(Na2O2)过氧化钠是一种含有过氧基(O22-)的无机化合物。
它是一种白色结晶固体,在空气中不稳定,容易分解释放出氧气。
过氧化钠可以作为氧化剂,广泛应用于有机合成和脱色等领域。
同时,过氧化钠也具有一定的漂白作用,被广泛应用于纺织、制浆、造纸等工业中。
过氧化钠与酸反应会产生较强的氧化反应。
四、过氧化氢(H2O2)过氧化氢与氧化钠有异曲同工之妙,它是由氢元素与氧元素反应而得到的。
过氧化氢是一种无色液体,可以溶于水。
它是一种强氧化剂,常用于漂白、消毒以及制取化学试剂等。
过氧化氢在生物体中也具有重要作用,是人体中许多生物氧化反应的催化剂。
总结:钠及其氧化物是高中化学课程中的重要内容,钠是一种常见的金属元素,可溶于水且容易氧化。
氧化钠具有强碱性,可以与酸进行中和反应。

《钠和钠的氧化物》教学设计“钠及其化合物”是高中化学必修课程中的核心内容之一,是学生应学习的重点内容,本节课为其内容的第一课时——钠及其钠的氧化物。
钠元素是典型的金属元素,钠和钠的化合物在生产生活中应用广泛。
通过学习,可以建立基于物质类别、元素价态和原子结构预测和检验物质性质的认识模型,发展物质性质和物质用途关联、化学物质及其变化的社会价值的认识水平,提高解决实际问题的水平。
一、教学和评价目标1、教学目标(1)通过实验探究钠及其钠的氧化物的主要物理及其化学性质,初步形成基于物质类别、元素价态和原子结构对物质的性质进行预测和检验的认识模型。
(2)通过含钠元素物质及其转化关系的认识过程,建立物质性质与物质用途的关联。
(3)通过实验探究过程,感受化学物质及其变化的价值,进一步增强合理使用化学品的意识。
2、评价目标(1)通过学生自行分析推测物质转化的产物,诊断学生实验探究物质性质的水平(基于经验水平、基于概念原理水平)和认识物质的水平(孤立水平、系统水平)。
(2)通过对钠和氧气反应、钠与水的反应、过氧化钠和水的反应实验设计方案的交流与点评,发展学生物质性质的实验探究的设计的水平(孤立水平、系统水平)。
(3)通过对含钠物质的转化的讨论和点评,发展学生对物质及其转化思路的认识水平(孤立水平、系统水平)。
(4)通过对联系生活实际的例题处理,诊断并发展学生解决实际问题的能力水平(孤立水平、系统水平)以及对化学价值的认识水平(学科价值视角、社会价值视角、学科和社会价值视角)。
二、教学和评价思路三、教学流程1、课前预习与交流【学习任务1】课前,对该部分知识进行预习,对该部分知识有大致了解,并且在课上能够提出相关问题进行交流,根据老师的演示实验、观察现象,得出结论。
【评价任务1】诊断学生实验探究物质性质的水平(基于经验水平、基于概念原理水平)和认识物质的水平(孤立水平、系统水平)。
2、研讨改进和实施【学习任务2】讨论、汇报、改进和实施实验方案。

钠和钠的氧化物教学设计教学设计:钠和钠的氧化物一、教学目标:1. 了解钠的基本性质和特点;2. 理解钠的氧化物的物理和化学性质;3. 掌握钠与氧化物的相关实验操作技能;4. 培养学生的科学观察、实验设计和数据分析能力。
二、教学准备:1. 实验室器材和药品:钠片,干燥器,滴管,试管,酒精灯,亚甲蓝溶液,氢氧化钠固体,水,酸性高锰酸钾溶液等;2. 教辅资料:包括钠和氧化物的研究报告、相关实验方法和操作指导。
三、教学过程:1. 导入(10分钟)通过图片或实物展示钠和钠的氧化物,并向学生提问:“你们知道钠的性质是怎样的?钠的氧化物又是什么样子的?请大家发表一下自己的猜想。
”2. 学习钠的性质(20分钟)2.1. 教师介绍钠的一般性质,如金属光泽、导电、导热等;2.2. 学生自主学习钠的反应性质,如与水反应、与氧气反应等;2.3. 师生互动探讨钠的性质与应用领域。
3. 进行实验(40分钟)实验1:钠与水的反应3.1. 教师向学生展示实验装置和操作步骤;3.2. 学生根据实验要求,依次进行实验操作;3.3. 学生观察实验现象,记录数据,并完成实验报告。
实验2:钠和氧气的反应3.4. 学生自行设计一种实验方案,探究钠和氧气反应的条件和产物;3.5. 学生收集资料并展示自己的实验方案;3.6. 学生实施实验,记录并分析实验数据;3.7. 学生总结实验结果,并进行讨论和发表自己的见解。
4. 学习钠的氧化物(30分钟)4.1. 教师介绍钠的氧化物的常见种类和特点;4.2. 学生根据教师提供资料,学习钠的氧化物的结构、性质和应用;4.3. 学生进行小组讨论和展示,分享自己的研究成果。
5. 实验结果分析(20分钟)学生根据实验数据和资料,分析钠和氧化物的反应过程和机理,并就实验结果进行评价和讨论。
四、课堂小结与延伸(10分钟)1. 教师对学生的表现给予评价和肯定;2. 教师进行课堂小结,概括钠和钠的氧化物的学习内容;3. 针对学生的学习兴趣和能力,提出延伸学习的问题或任务。