无机化学金属有机化合物的亲核反应
- 格式:pdf
- 大小:191.22 KB
- 文档页数:10

化学反应中的亲核取代反应化学反应是物质之间发生变化的过程,其中亲核取代反应是一种重要的反应类型。
亲核取代反应是指一个亲核试剂与一个电子不足的反应物发生反应,亲核试剂中的亲核基团取代掉反应物中的一个离去基团。
这种反应在有机合成中具有广泛的应用,可以用于合成各种有机化合物。
亲核取代反应可以分为两类:亲核试剂为中性物质的亲核取代反应和亲核试剂为离子的亲核取代反应。
中性物质的亲核取代反应通常发生在有机化合物中,而离子的亲核取代反应则发生在无机化合物或离子中。
中性物质的亲核取代反应中,亲核试剂通常是一种带有孤对电子的原子或分子,如氨、水、醇等。
这些亲核试剂通过与反应物中的电子不足的原子或分子发生反应,形成新的化学键。
例如,氨与醛反应可以生成胺,水与酰氯反应可以生成醛或酮。
离子的亲核取代反应中,亲核试剂通常是带有正电荷的离子,如氢离子、钠离子等。
这些亲核试剂通过与反应物中的带有负电荷的离子或原子发生反应,形成新的化学键。
例如,氢离子与氢氧根离子反应可以生成水,钠离子与氯离子反应可以生成氯化钠。
亲核取代反应的速率通常受到多种因素的影响,如反应物浓度、温度、溶剂等。
在一些情况下,亲核取代反应可能会出现竞争性反应,即不同的亲核试剂与反应物中的不同位置发生取代反应。
这时,反应的选择性就成为一个重要的问题。
在有机合成中,亲核取代反应可以用于合成各种有机化合物,包括药物、农药、染料等。
通过选择不同的反应条件和亲核试剂,可以实现对目标化合物的选择性合成。
亲核取代反应还可以用于构建碳-碳键和碳-杂原子键,从而构建复杂的有机分子。
总之,亲核取代反应是化学反应中的一种重要反应类型,广泛应用于有机合成中。
通过选择不同的亲核试剂和反应条件,可以实现对目标化合物的选择性合成。
亲核取代反应的研究对于发展新的有机合成方法和合成新的有机化合物具有重要意义。
![[解答]无机化学反应之亲电反应与亲核反应详解](https://uimg.taocdn.com/3f26693103020740be1e650e52ea551810a6c965.webp)
[解答]无机化学反应之亲电反应与亲核反应详解亲电反应和亲核反应详解一、目的和要求通过本节课的学习,达到:1. 掌握共价键的断裂方式2. 掌握有机化学反应类型的分类3. 掌握亲电试剂和亲核试剂的概念4. 掌握亲电和亲核概念5. 掌握亲电和亲核反应的历程要求能够辨别亲电反应和亲核反应。
引言(提出问题)我们说乙炔和溴的四氯化碳溶液反应生成1,2—二溴乙烯,进一步反应生成1,1,2,2—四溴乙烷的反应为亲电加成,反应式如下:BrBrBrBrBr2CCl4CCHHCHCBr+(亲电加成)2HCHCHCCl4BrBr乙炔1,1,2,2-四溴乙烷 1,2-二溴乙烯同样是乙炔,在碱的存在下,和甲醇发生反应生成甲基乙烯基醚是亲核加成反应,反应式如下:KOH(亲核加成)HCCOCHOHCHHCHC23+3H加热、加压甲基乙烯基醚乙炔在有机化学的学习过程中,亲电和亲核是让很多同学困惑的概念,为了说明亲电和亲核的概念,让我们从共价键的断裂说起,来阐明亲核反应和亲电反应。
二、共价键的断裂方式有机化学反应的实质是旧键的断裂和新键的形成过程。
组成有机化合物的化学键主要是共价键,共价键是由电子云重叠而成,每根共价键由电子对(2个电子)构成,共价键的断裂方式有两种:1 均裂均裂:A:B ? A? , B?即构成共价键的电子对在断裂时平均分配到两个原子上,形成带有单电子的活泼原子或基团——游离基(又叫自由基),这种断裂方式称为共价键的均裂。
2 异裂-++- 异裂:A:B ? A ,B(或A , B)即构成共价键的电子对在断裂时完全转移到1个原子上,形成正离子和负离子,这种断裂方式称为共价键的异裂。
三、有机反应类型分类根据共价键断裂方式分类根据共价键的断裂方式分类,可分为协同反应、自由基反应、离子型反应: 协同反应:在反应过程中,旧键的断裂和新键的形成都相互协调地在同一步骤中完成的反应称为协同反应。
协同反应往往有一个环状过渡态。
它是一种基元反应。

有机化学反应机理总结一、引言有机化学是研究有机物合成和反应规律的科学领域。
在有机化学中,了解反应机理对于准确预测反应产物以及设计新的合成路径至关重要。
本文将总结几种常见的有机化学反应机理,包括亲核取代、酸催化、碱催化和自由基反应等。
二、亲核取代反应机理亲核取代反应是指一个亲核试剂(通常是负电荷较高的电子富余分子)与一个受体分子发生反应,取代掉受体分子中的某个官能团。
这类反应的机理通常分为四个步骤:出发物生成电子富余中间体、亲核试剂攻击中间体、负离子生成和负离子与溶剂或其他分子反应。
亲核取代反应具有广泛的应用,例如取代烯烃、芳香化合物和醇等。
三、酸催化反应机理酸催化反应是指在酸性条件下进行的一系列有机化学反应。
酸催化反应机理通常包括质子化、核迁移、亲核试剂攻击和质子转移等步骤。
酸催化反应广泛应用于合成复杂有机分子,如酯化、缩合和环化反应等。
四、碱催化反应机理碱催化反应是指在碱性条件下进行的一系列有机化学反应。
碱催化反应机理通常包括质子解离、亲电试剂攻击、质子转移和负离子生成等步骤。
碱催化反应常见于酯水解、亲电取代和醇酸碱中和反应等。
五、自由基反应机理自由基反应是指在自由基存在下进行的一系列有机化学反应。
自由基反应机理通常包括自由基生成、自由基与稳定分子反应、自由基重组和自由基转移等步骤。
自由基反应广泛应用于合成烯烃和环化反应等。
六、结论有机化学反应机理的理解对于有机化学的学习和应用具有重要意义。
通过掌握亲核取代、酸催化、碱催化和自由基反应等常见反应的机理,我们能更好地理解有机化学反应中的规律,合理设计合成路线,并预测反应的产物。
在未来的有机化学研究和实践中,深入了解和掌握有机化学反应机理将会取得重要的成果。

考研化学无机化学重要反应总结在考研化学中,无机化学是一个重要的科目。
熟练掌握无机化学的重要反应对于考研的成功非常关键。
下面我将对考研化学无机化学重要反应进行总结,希望能够对考生们有所帮助。
一、氧化还原反应氧化还原反应是无机化学中最重要的一类反应。
其中,常见的重要反应包括:1. 活动性金属与酸反应:活动性金属(如铁、锌、铝等)与酸(如盐酸、硫酸等)反应会生成相应金属的盐和氢气。
例如:2HCl + Zn → ZnCl2 + H22. 金属与非金属元素反应:金属与非金属元素的反应通常是氧化还原反应,其中金属元素被氧化,非金属元素被还原。
例如:2Mg + O2 → 2MgO3. 单质与氧化剂反应:单质与氧化剂反应的热稳定性变化可用来判断其是否是还原剂。
例如:2Cu + O2 → 2CuO4. 非金属氧化物与碱反应:非金属氧化物与碱反应会生成相应的盐和水。
例如:SO2 + 2NaOH → Na2SO3 + H2O二、配位化学配位化学是无机化学中另一个重要的分支。
其中,与配位化学相关的重要反应包括:1. 配位络合反应:配体与金属离子之间的反应称为配位络合反应。
在配位化学中,常见的络合反应有配体取代、加成、还原等反应。
例如:[Fe(H2O)6]3+ + 6NH3 → [Fe(NH3)6]3+ + 6H2O2. 配位置换反应:配位置换反应是指一个配体从金属离子中脱离,同时另一个配体与金属离子结合。
例如:[Cu(NH3)4]2+ + 2H2O → [Cu(H2O)4]2+ + 4NH3三、反应动力学反应动力学是研究化学反应速率和反应机理的科学。
了解反应动力学对于掌握无机化学重要反应非常重要。
下面是一些值得关注的重要反应动力学内容:1. 反应速率:反应速率描述了反应物的消耗和反应物产物的生成之间的关系。
例如:2NO2 → 2NO + O22. 反应速率常数:反应速率常数是描述反应速率与反应物浓度关系的常数。
例如:rate = k[NO2]^23. 反应机理:反应机理是描述反应物转化为产物的详细过程。

金属有机化学反应机理解析金属有机化学是研究金属和有机化合物之间相互作用以及相关的反应机理的学科。
金属有机化合物广泛应用于有机合成、材料科学和均相催化等领域。
对金属有机化学反应机理的深入理解对于合成新型化合物、优化反应条件以及提高反应效率至关重要。
1. 金属有机化合物的形成机制金属有机化合物的形成机制主要包括基于配位键和基于氧化还原反应两种方式。
基于配位键的形成机制是指金属离子与有机配体形成化学键,产生稳定的配位化合物。
这种形成机制通常发生在溶液中,金属离子的电子轨道与配体的孤对电子进行共价键形成,使得金属离子与有机配体产生配位键。
这是很多有机金属反应中常见的机理,比如金属催化的有机合成反应。
另一种机制是基于氧化还原反应的形成机制。
在这种机制下,金属离子通过接受或者捐赠电子来与有机物发生反应。
这种反应机制在金属催化的氧化还原反应中经常出现,同时也涉及到电子转移和质子转移等步骤。
2. 金属有机化学反应的步骤金属有机化学反应的步骤通常包括配体的配位、金属间的电子转移、金属间的化学键形成等。
在金属有机化学反应中,有机配体通过与金属离子形成化学键来配位,产生配位化合物。
这一过程可以通过配体置换实验、质子核磁共振等方法来研究。
配体的选择和配体排列方式会对反应活性和选择性产生重要影响。
接下来,金属间的电子转移是一个关键步骤。
这一过程中金属离子可以通过电子交换和电子移动来完成。
电子转移也可以跨越不同金属中心,形成金属间的键。
最后,金属间的化学键形成是整个反应的最终步骤。
金属间的键可以通过配位变化和配体置换等反应来实现。
3. 金属有机化学反应的机理解析对于金属有机化学反应的机理解析通常使用实验和理论计算相结合的方法。
实验可以通过各种技术手段来研究反应的速率、产物和反应过渡态等。
核磁共振、质谱等技术可以用来确定反应物和产物的结构。
同时,通过温度控制、溶剂效应等条件变化可以研究反应的速率和选择性。
理论计算可以通过量子化学方法对反应进行模拟,在原子和分子尺度上研究反应机理。

高考化学中的无机化学重要反应式解析无机化学是化学的重要分支之一,它研究的是无机物质的性质、结构和反应。
在高考化学中,无机化学是一个非常重要的部分,它占据了整个化学考试的一大部分内容。
而无机化学的学习重点之一就是要掌握一些重要的反应式。
本文将针对高考化学中的无机化学重要反应式进行解析和探讨。
一、酸碱反应酸碱反应是无机化学中最基础且最重要的反应之一。
在高考化学中,我们常见的酸碱反应有酸与碱的中和反应,酸与金属的反应等。
1.酸与碱的中和反应酸与碱的中和反应是指酸和碱反应生成盐和水的反应。
其中最典型的就是硫酸与氢氧化钠的中和反应,反应式如下:H2SO4 + 2NaOH → Na2SO4 + 2H2O2.酸与金属的反应酸与金属的反应是指酸和金属反应生成盐和氢气的反应。
其中最常见的就是盐酸与锌的反应,反应式如下:2HCl + Zn → ZnCl2 + H2↑二、氧化还原反应氧化还原反应是无机化学中另一个非常重要的反应类型。
在高考化学中,我们需要重点掌握一些典型的氧化还原反应。
1.金属与非金属氧化物的反应金属与非金属氧化物的反应是指金属与非金属氧化物反应生成盐的反应。
其中最经典的就是铜与硫的反应,反应式如下:Cu + S → Cu2S2.金属与酸的反应金属与酸的反应是指金属与酸反应生成盐和氢气的反应。
这类反应中,盐的配离子和酸中的阳离子相同。
其中最常见的就是铁与盐酸的反应,反应式如下:Fe + 2HCl → FeCl2 + H2↑三、沉淀反应沉淀反应是指两种溶液混合后产生沉淀的反应。
在高考化学中,我们需要掌握一些常见的沉淀反应。
1.银盐的沉淀反应银盐的沉淀反应是指银盐溶液与氯化物溶液混合后产生沉淀的反应。
其中最典型的就是银盐与氯化钠的反应,反应式如下:AgNO3 + NaCl → AgCl↓ + NaNO32.硫酸钙的沉淀反应硫酸钙的沉淀反应是指硫酸钙溶液与硫酸溶液混合后产生沉淀的反应。
其中最常见的就是硫酸钙与硫酸铵的反应,反应式如下:CaCl2 + (NH4)2SO4 → CaSO4↓ + 2NH4Cl总结:无机化学中的重要反应式对于高考化学的学习至关重要,掌握这些反应式有助于我们理解无机化学的基本原理和反应机制。

有机化学中的金属有机化合物和金属催化反应原理有机化学是研究碳基化合物的性质和反应的科学,而金属有机化合物和金属催化反应则是有机化学中的重要分支,应用广泛,影响深远。
一、金属有机化合物金属有机化合物指的是含有金属-碳键的化合物,其中金属通常是过渡金属。
这类化合物具有很多特殊的化学性质,例如可以参与金属催化反应,也可以作为有机合成中的试剂。
1. 有机锂化合物有机锂化合物是一类常用的金属有机化合物,由于锂的电负性较低,因此有机锂化合物具有非常强的亲电性。
常见的有机锂化合物包括丁基锂、叔丁基锂等。
有机锂化合物常用于有机合成中的羧酸酯化反应、卤代烃的取代反应等反应中。
2. 有机铜化合物有机铜化合物与有机锂化合物一样具有很强的亲电性,但由于铜的电负性较锂高,因此有机铜化合物通常比有机锂化合物更加稳定。
常见的有机铜化合物包括第一类和第二类有机铜试剂。
有机铜化合物在有机合成中主要用于烯丙基化反应、自由基反应等反应中。
3. 有机铁化合物有机铁化合物是一类特殊的金属有机化合物,其中铁通常是三价的。
常见的有机铁化合物包括费希尔试剂和格氏试剂等。
有机铁化合物在有机合成中常用于羰基化反应、烯烃羰基化反应等反应中。
二、金属催化反应金属催化反应是指在金属催化剂的作用下进行的有机合成反应,通过金属催化剂的引发、传递或者接受中间体上的电子或质子,加速有机物之间的化学反应,并且能够在较温和的条件下实现。
1. 氧化还原反应氧化还原反应是有机合成中常见的反应,而金属催化剂常用于氧化还原反应中。
例如钯、铑、钌等金属常用于氧化还原反应中,例如Suzuki反应、Heck反应等。
金属催化氧化还原反应具有高效、温和、反应通用等优点。
2. 烯丙基化反应烯丙基化反应是有机合成中重要的反应,它广泛用于生物活性物质及金属有机化合物的合成中。
在烯丙基化反应中,常用钯、镍等金属作为催化剂,通过催化剂引发的活化,将烯丙基试剂与底物反应,生成烯丙基化产物。
3. 环合成反应环合成反应是指将一条链状分子合成成为一个环状分子的过程。

亲核水解亲电水解
亲核水解是指通过亲核试剂对溶液中的化合物进行水解反应。
亲核试剂是指能够与碳中的亲电中心结合的碱性或亲核性分子,比如碱金属和碱土金属离子、羰基化合物、亚硫酸盐、胺等。
亲核试剂与化合物之间发生亲核加成反应,将化合物中的某个或多个键断裂,生成新的化合物。
亲电水解是指通过亲电试剂对溶液中的化合物进行水解反应。
亲电试剂是指具有亲电性的分子,能够从其他分子中夺取电子或电子密度较高的区域,比如阳离子、卤素、羧基、酸等。
亲电试剂与化合物之间发生亲电解离反应,将化合物中的某个或多个键断裂,生成新的化合物。
总的来说,亲核水解和亲电水解都是通过不同的试剂对化合物进行水解反应,但在反应机理和反应条件上有所不同。

河北省考研化学复习资料有机化学与无机化学重点反应机理解析在河北省考研化学复习中,有机化学和无机化学是两个非常重要的学科领域。
掌握有机化学和无机化学的重点反应机理是化学考研的核心内容之一。
本文将从有机化学和无机化学的角度,对一些重点反应机理进行解析。
一、有机化学重点反应机理解析1. 反应类型分类有机化学中常见的反应类型包括取代反应、消除反应、加成反应、重排反应等。
其中取代反应是有机化学中最为常见的一类反应,它包括亲核取代反应和电子取代反应。
亲核取代反应是指亲核试剂攻击电子不足的位点,将其取代,同时生成新的共价键;电子取代反应是指电子不足的试剂攻击亲电子的位点,将其取代,同样生成新的共价键。
2. 重要反应机理在有机化学中,有一些反应机理是考研中不容忽视的重点内容。
例如,氢化反应是有机化学中重要的加成反应,它可以将烯烃或炔烃转化为烷烃。
氢化反应主要有催化氢化反应和不对称氢化反应两种类型,其中催化氢化反应常常需要使用过渡金属催化剂,而不对称氢化反应可以得到具有手性的产物。
3. 共轭体系与色谱分析共轭体系是有机化学中的重要概念之一,它指的是含有相连的多个共轭键的化合物,可以通过共轭π电子的共享,增加分子的稳定性,影响化合物的光学性质等。
色谱分析是化学分析中常用的一种方法,其中气相色谱和液相色谱是两种常见的色谱技术。
其中气相色谱主要基于化合物在固定相和流动相之间的分配系数来实现分离,而液相色谱则可通过溶剂在固定相上的吸附和洗脱来进行分离。
二、无机化学重点反应机理解析1. 金属氧化还原反应无机化学中最为重要的反应之一是金属氧化还原反应,其本质是金属离子在反应过程中失去或得到电子。
金属的氧化状态通常以“+”号表示,而还原状态则以“-”号表示。
金属氧化还原反应分为红ox反应(有机氧化还原反应)和电ox反应(氧化还原反应)两类,红ox反应是指有机物被氧化代谢得到一种较稳定的原始物质,而电ox反应是指金属与非金属之间的电的相互作用。

亲电反应和亲核反应详解一、目的和要求通过本节课的学习,达到:1. 掌握共价键的断裂方式2. 掌握有机化学反应类型的分类3. 掌握亲电试剂和亲核试剂的概念4. 掌握亲电和亲核概念5. 掌握亲电和亲核反应的历程要求能够辨别亲电反应和亲核反应。
引言(提出问题)我们说乙炔和溴的四氯化碳溶液反应生成1,2—二溴乙烯,进一步反应生成1,1,2,2—四溴乙烷的反应为亲电加成,反应式如下:CH CH Br2CCl4CHCHBrBr Br2CCl4CH CHBrBrBr Br+乙炔1,2-二溴乙烯1,1,2,2-四溴乙烷(亲电加成)同样是乙炔,在碱的存在下,和甲醇发生反应生成甲基乙烯基醚是亲核加成反应,反应式如下:CH CH CH3OHKOHCH2CHOCH3+加热、加压乙炔甲基乙烯基醚(亲核加成)在有机化学的学习过程中,亲电和亲核是让很多同学困惑的概念,为了说明亲电和亲核的概念,让我们从共价键的断裂说起,来阐明亲核反应和亲电反应。
二、共价键的断裂方式有机化学反应的实质是旧键的断裂和新键的形成过程。
组成有机化合物的化学键主要是共价键,共价键是由电子云重叠而成,每根共价键由电子对(2个电子)构成,共价键的断裂方式有两种:1 均裂均裂:A:B →A·+B·即构成共价键的电子对在断裂时平均分配到两个原子上,形成带有单电子的活泼原子或基团——游离基(又叫自由基),这种断裂方式称为共价键的均裂。
2 异裂异裂:A:B →A-+B+(或A++B-)即构成共价键的电子对在断裂时完全转移到1个原子上,形成正离子和负离子,这种断裂方式称为共价键的异裂。
三、有机反应类型分类根据共价键断裂方式分类根据共价键的断裂方式分类,可分为协同反应、自由基反应、离子型反应:协同反应:在反应过程中,旧键的断裂和新键的形成都相互协调地在同一步骤中完成的反应称为协同反应。
协同反应往往有一个环状过渡态。
它是一种基元反应。
自由基型反应:由于分子经过均裂产生自由基而引发的反应称为自由基型反应。
亲核反应的五种反应名称亲核反应是有机化学中常见的一种反应类型,它涉及到亲电子的攻击和亲核试剂的参与。
根据亲核试剂的性质和反应机理的不同,亲核反应可以分为以下五种反应。
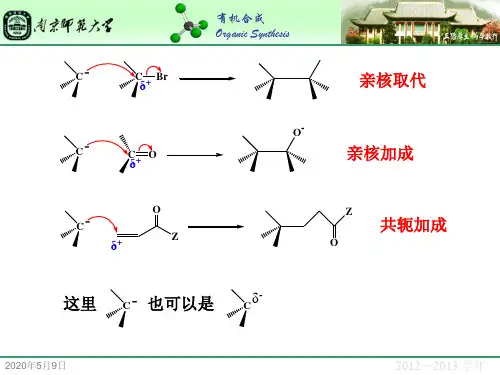
1. 亲核取代反应(Nucleophilic Substitution Reaction)亲核取代反应是最常见的亲核反应类型之一。
在亲核取代反应中,亲核试剂攻击一个含有亲电子的基团,将其替换掉。
常见的亲核取代反应包括SN1和SN2反应机理。
2. 亲核加成反应(Nucleophilic Addition Reaction)亲核加成反应中,亲核试剂与含有多键(通常是双键或三键)的官能团发生反应,形成一个新的化合物。
亲核试剂通常通过给予亲电子中心以亲电子形式进行反应。
3. 亲核消除反应(Nucleophilic Elimination Reaction)亲核消除反应涉及到亲核试剂与含有一对相邻碳原子之间的键的官能团发生反应。
在这种反应中,亲核试剂不仅与官能团发生反应,还通过攻击相邻的碳原子断裂化学键,从而使得官能团消失。
4. 亲核加合反应(Nucleophilic Addition-Elimination Reaction)亲核加合反应结合了亲核加成和亲核消除两种反应类型。
在亲核加合反应中,亲核试剂首先与含有多键的官能团发生加成反应,然后通过消除反应使得官能团发生重新排列。
5. 亲核环化反应(Nucleophilic Cyclization Reaction)亲核环化反应是一种特殊的亲核反应,发生在含有适当官能团的分子中。
在这种反应中,亲核试剂与官能团内的一个亲电子中心发生反应,形成一个新的环状结构。
这五种亲核反应在有机合成中起着非常重要的作用,能够构建复杂的有机分子结构,并提供了合成有机化合物的有效途径。
在实际应用中,化学家们常常根据反应条件和所需产物的特性选择适当的亲核反应类型进行研究和应用。
无机化学中的金属反应无机化学中,金属反应是一个非常重要的部分。
金属反应是指金属与其他元素、化合物发生化学反应的过程。
这些反应往往涉及到电荷转移,会导致化学特性发生改变。
下面我们来具体讨论一些常见的金属反应。
1. 氧化还原反应氧化还原反应是金属反应中最常见的一种。
在这种反应中,金属通常被氧化或还原,同时与非金属之间的原子转移电子,以形成离子或化合物。
例如,铁可以被氧化成铁氧化物,如铁锈,同时氧就被还原了。
这种反应经常在潮湿或潮湿的条件下发生。
氧化还原反应还涉及到酸和碱,也称为酸碱反应。
在这种情况下,酸被还原,而碱被氧化。
例如,当硫酸和钠氢氧化物反应时,产生水和氯化钠,过程如下:H2SO4 + 2NaOH → 2H2O + Na2SO42. 配位反应配位反应是另一种典型的金属反应。
它涉及到金属与配体之间的配位键形成和破裂。
配体通常是电子富余的分子或离子,例如氨、水和氯离子等。
这些配体中的自由电子对可以与金属的空的反键轨道形成化学键。
一些常见的金属配位反应包括:金属离子与水或氨配位:如Cu2+ + 4NH3 → [Cu(NH3)4]2+金属离子与一些有机配体配位:如Ni2+ + EDTA4- →[Ni(EDTA)]-3. 毒性反应对于一些较为反应活泼的金属,例如铅、铜等,与一些非常普遍的物质——氧化剂和还原剂相遇时,会发生毒性反应。
例如,铜和硝酸发生化学反应时,会生成亚硝酸盐,而在加热的情况下,亚硝酸盐会分解成氮氧化物。
氮氧化物会对人体造成危害,是一种空气污染物。
4. 金属互溶性金属互溶性是指两个或多个金属在混合时会形成一个单一的固体。
这种金属相互作用通常是金属晶格中的圆形空穴容易与其他金属的圆球排列起来的原因。
从而形成中间原子间的化学键。
这种反应在金属加工、冶炼和合金制造过程中非常重要。
总结以上是无机化学中的一些常见金属反应。
这些反应有时被用于一些非常实用的应用领域,如电池制造、合金制造和酸碱平衡控制,等等。
亲核反应和亲电反应区别
①亲核反应
在《基础有机化学》中指出,亲核试剂是电子对的给予体,它在化学反应过程中以给出电子或共用电子的方式和其他分子或离子生成共价键.
亲核试剂通常是路易斯碱,例如,HO—、RO—、Cl—、Br—、CN—、
R3N:、H2O、ROH等。
多重键的π电子对也被看作是亲核试剂,能提供电子与反应物的缺电子部分形成新键的试剂,反应试剂在反应过程中,对与之相互作用的原子或体系给予或共享电子对者,称为亲核试剂
②亲电反应
亲电反应,顾名思义是亲电试剂在化学反应中取代其它官能团的一种反应类型,其常发生于芳香族类化合物中,亲电试剂从名字上可以理解为缺少电子的基团或原子,由于缺少电子,容易进攻反应物上带部分负电荷的位置,由这类亲电试剂进攻而发生发反应称为亲电反应.
常见的亲电试剂有:H+、Cl+、Br+等带正电荷试剂或BF3、AlCl3等路易斯酸
综上所述,两者的区别是:
亲核反应通常发生于卤代烃,羟醛缩合类反应当中,羰基碳正电性强的活性强,空间阻碍小的活性强,连有吸电子基可使正电性加强,推电子基减弱,这部分不会考活性比较的,重点是亲核取代
而亲电反应一般发生在亲电加成中,并且是反式加成,加成中间体为卤桥正离子,反应是分步进行的。
亲核反应1. 引言亲核反应是有机化学中的一类重要反应,其特点是在化学反应中,亲核试剂攻击亲电子亚基,从而形成新的化学键。
亲核反应广泛应用于合成有机化合物、药物研发、材料科学等领域,具有重要的理论和实际价值。
2. 反应机理亲核反应是由亲核试剂与亲电子亚基之间的反应所驱动的。
通常情况下,亲核试剂是带有孤对电子或具有较高电负性的分子,例如醇、胺、卤代烷等。
而亲电子亚基是带有正电荷或具有较低电负性的分子,例如卤代烃、酮、醛等。
亲核试剂通过与亲电子亚基发生反应,攻击亲电子亚基上的带正电荷或较低电负性的原子,从而形成新的化学键。
这个过程也被称为亲核试剂的亲核取代反应。
亲核反应的机理可以分为两类:亲核取代反应和亲核加成反应。
亲核取代反应指的是亲核试剂中的亲核碳与亲电子亚基中的碳发生取代反应,形成新的化学键。
而亲核加成反应则是指亲核试剂中的亲核原子与亲电子亚基上的地位较高的原子(通常是羰基碳)形成新的化学键。
3. 亲核取代反应亲核取代反应是亲核试剂中的亲核碳与亲电子亚基中的碳发生取代反应,形成新的化学键。
常见的亲核取代反应有SN1和SN2反应。
3.1 SN1反应在SN1反应中,亲核试剂首先与亲电子亚基中的碳形成中间化合物。
这一步骤通常是一个较慢的步骤,不受亲核试剂的浓度影响。
然后,中间化合物进一步发生解离,生成离去基离开,形成新的化学键。
SN1反应的速率常常受到溶剂的极性、离去基的稳定性和碳离子的稳定性等因素的影响。
此外,SN1反应中生成的离子中间体可以与溶剂、其它分子发生求核反应,从而产生副产物或杂质化合物。
3.2 SN2反应在SN2反应中,亲核试剂直接攻击亲电子亚基上的碳,从而实现取代反应。
在这个过程中,亲核试剂和离去基发生竞争性反应,因此SN2反应的速率受到亲核试剂和离去基的浓度、亲核试剂的亲核性能和亲电子亚基的立体因素等因素的影响。
SN2反应的立体选择性非常高,亲核试剂和离去基的排布方式对反应速率和产物选择性都有很大的影响。
亲电反应和亲核反应详解一、目的和要求通过本节课的学习,达到:1. 掌握共价键的断裂方式2. 掌握有机化学反应类型的分类3. 掌握亲电试剂和亲核试剂的概念4. 掌握亲电和亲核概念5. 掌握亲电和亲核反应的历程要求能够辨别亲电反应和亲核反应。
引言(提出问题)我们说乙炔和溴的四氯化碳溶液反应生成1,2—二溴乙烯,进一步反应生成1,1,2,2—四溴乙烷的反应为亲电加成,反应式如下:CH CH Br2CCl4CHCHBrBr Br2CCl4CH CHBrBrBrBr同样是乙炔,在碱的存在下,和甲醇发生反应生成甲基乙烯基醚是亲核加成反应,反应式如下:CH CH CH3OHKOHCH2CHOCH3在有机化学的学习过程中,亲电和亲核是让很多同学困惑的概念,为了说明亲电和亲核的概念,让我们从共价键的断裂说起,来阐明亲核反应和亲电反应。
二、共价键的断裂方式有机化学反应的实质是旧键的断裂和新键的形成过程。
组成有机化合物的化学键主要是共价键,共价键是由电子云重叠而成,每根共价键由电子对(2个电子)构成,共价键的断裂方式有两种:1 均裂均裂:A:B →A·+B·即构成共价键的电子对在断裂时平均分配到两个原子上,形成带有单电子的活泼原子或基团——游离基(又叫自由基),这种断裂方式称为共价键的均裂。
2 异裂异裂:A:B →A-+B+(或A++B-)即构成共价键的电子对在断裂时完全转移到1个原子上,形成正离子和负离子,这种断裂方式称为共价键的异裂。
三、有机反应类型分类根据共价键断裂方式分类根据共价键的断裂方式分类,可分为协同反应、自由基反应、离子型反应:协同反应:在反应过程中,旧键的断裂和新键的形成都相互协调地在同一步骤中完成的反应称为协同反应。
协同反应往往有一个环状过渡态。
它是一种基元反应。
自由基型反应:由于分子经过均裂产生自由基而引发的反应称为自由基型反应。
自由基型反应分链引发、链转移和链终止三个阶段:链引发阶段是产生自由基的阶段。