【分享】IVD试剂冻干形式介绍与选择
- 格式:pdf
- 大小:588.57 KB
- 文档页数:3

冷冻干燥的试剂储存技术嘿,咱今儿就来聊聊这冷冻干燥的试剂储存技术。
你说这技术,那可真是个宝贝呀!咱先想想,那些普通的试剂储存方式,是不是有时候会让咱头疼呀?温度不合适了,试剂就可能变质失效,那多让人郁闷呐!但冷冻干燥技术就不一样啦!它就像是给试剂穿上了一层超级保护衣。
冷冻干燥是咋回事呢?简单说,就是把试剂里的水分给弄走,让它变成干干的状态。
这就好比是把一个水灵灵的苹果变成了脆脆的苹果干。
但可别小瞧了这个过程,这里面的门道可多着呢!经过冷冻干燥处理的试剂,那稳定性可强了去了。
就像一个坚强的战士,不管遇到啥恶劣环境,都能稳稳地站在那。
它们能保存更长时间,不会轻易就坏掉。
你想想,要是没有这技术,咱得浪费多少试剂呀,那得是多大的损失呀!而且哦,冷冻干燥后的试剂,体积还变小了呢!这多好呀,不占那么多地方了,储存起来也方便多啦。
就好比是把一个大大的棉花糖变成了小小的一颗糖豆,多省空间呀!再说了,这冷冻干燥的试剂,用起来也很方便呀。
需要的时候,加点水或者其他溶剂,它们就能迅速恢复到原来的状态,就像变魔术一样神奇。
这就好比是沉睡的小精灵被唤醒了,又能活力满满地开始工作啦。
你说这冷冻干燥技术是不是很牛?咱得好好珍惜它呀!有了它,咱做实验、搞研究就更有保障啦!那些珍贵的试剂也能更好地发挥它们的作用啦!难道不是吗?这技术可真是给咱的科研工作带来了大大的便利呀!咱可得好好利用,让它为咱的科学事业添砖加瓦呀!你说是不是这个理儿呢?咱再想想,要是没有冷冻干燥技术,那些需要长期保存的试剂该咋办呀?说不定就因为保存不当而浪费掉了,那多可惜呀!所以说呀,冷冻干燥技术真的是太重要啦!它就像是试剂的守护天使,默默地守护着它们的安全和稳定。
咱平时在使用冷冻干燥试剂的时候,也要注意一些小细节哦。
比如说要按照正确的方法来储存和使用,可别马马虎虎的。
不然,再好的技术也可能发挥不出它的最佳效果呀。
就像一把好刀,你得会用它才能发挥出它的威力呀!总之呢,冷冻干燥的试剂储存技术真是个了不起的技术呀!咱可得好好了解它、掌握它,让它为咱的科研工作服务呀!这可是咱科研路上的一个得力助手呀,可不能小瞧了它哟!。
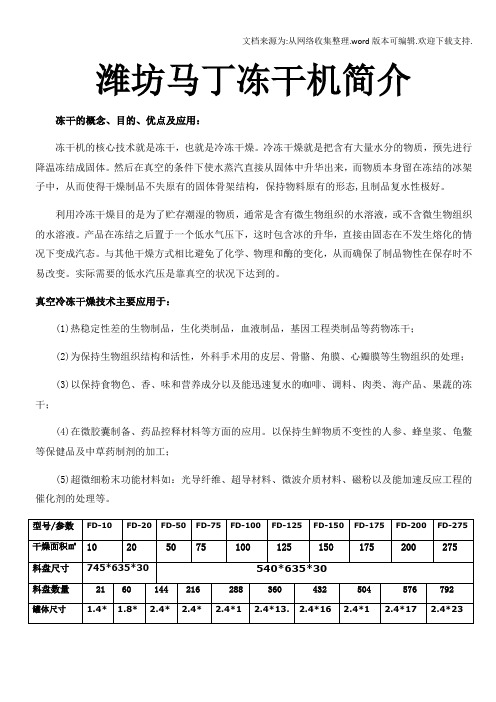
潍坊马丁冻干机简介冻干的概念、目的、优点及应用:冻干机的核心技术就是冻干,也就是冷冻干燥。
冷冻干燥就是把含有大量水分的物质,预先进行降温冻结成固体。
然后在真空的条件下使水蒸汽直接从固体中升华出来,而物质本身留在冻结的冰架子中,从而使得干燥制品不失原有的固体骨架结构,保持物料原有的形态,且制品复水性极好。
利用冷冻干燥目的是为了贮存潮湿的物质,通常是含有微生物组织的水溶液,或不含微生物组织的水溶液。
产品在冻结之后置于一个低水气压下,这时包含冰的升华,直接由固态在不发生熔化的情况下变成汽态。
与其他干燥方式相比避免了化学、物理和酶的变化,从而确保了制品物性在保存时不易改变。
实际需要的低水汽压是靠真空的状况下达到的。
真空冷冻干燥技术主要应用于:(1)热稳定性差的生物制品,生化类制品,血液制品,基因工程类制品等药物冻干;(2)为保持生物组织结构和活性,外科手术用的皮层、骨骼、角膜、心瓣膜等生物组织的处理;(3)以保持食物色、香、味和营养成分以及能迅速复水的咖啡、调料、肉类、海产品、果蔬的冻干;(4)在微胶囊制备、药品控释材料等方面的应用。
以保持生鲜物质不变性的人参、蜂皇浆、龟鳖等保健品及中草药制剂的加工;(5)超微细粉末功能材料如:光导纤维、超导材料、微波介质材料、磁粉以及能加速反应工程的催化剂的处理等。
多台并联式技术参数1速溶饮品行业、营养保健品行业以及军需、 粉、蛋粉、贝汁 味品及配料:葱、姜、 美洲大樱桃、美国菠萝、黄桃, 酱、乳酪、茶饮等等。
2xFD-75 2xFD-100 2xFD-200 4xFD-504xFD-75 4xFD-100150200400200300432 576 1152 1152 864 我们马丁客户现场2、升华干燥中的传热与传质要维持升华干燥的不断进行,必须满足两个基本条件,即热量的不断供给和生成水蒸汽的不断排除。
在干燥开始阶段,如果物料温度相对较高,升华所需要的潜热可取自物料本身的显热。

ivd体外诊断试剂标准及要求IVD(In Vitro Diagnostic)体外诊断试剂是指用于检测人体样本中各种疾病标志物(包括但不限于蛋白质、荷瘤标志物、细胞因子、细菌、病毒等)的试剂盒。
由于其在临床诊断中的重要性,对其标准和要求也需要非常严格。
下面将介绍一下IVD体外诊断试剂的标准和要求。
首先,在试剂的物理特性方面,IVD体外诊断试剂需要达到一定的要求。
首先,试剂应具有足够的稳定性,不容易失活或降解,确保其能够保持长期有效。
其次,试剂需要具备一定的溶解性和溶液稳定性,以便在使用过程中能够方便地溶解,并保持一定的稳定性,不易引起试剂效果上的变化。
另外,试剂的包装也要符合一定的标准要求,包括密封性、防潮、耐热性等。
其次,在试剂的成分和纯度方面,也有一定的要求。
试剂的成分需要明确,并且纯度要达到一定的标准。
其中,关键成分的含量要足够高,以确保准确的检测结果。
此外,试剂中不能含有未列明或不允许使用的有害物质,否则可能对人体健康产生不良影响。
在制备过程中,也需要遵循一定的质量控制标准,确保试剂的质量稳定性。
另外,试剂的性能和准确性是IVD体外诊断试剂标准要求的重点。
试剂的性能需要符合一定的敏感性和特异性要求,即能够准确地检测出目标物质且没有误报。
试剂的准确性也很重要,即在实际临床应用中的检测结果与真实情况相符。
为了达到这些要求,试剂需要进行严格的验证和验证过程。
此外,IVD体外诊断试剂标准还要求试剂具备一定的可重复性和可靠性。
可重复性是指在相同条件下,试剂能够得到一致的结果;可靠性是指试剂能够在不同实验室和不同操作者之间得到相似的结果。
这是因为临床诊断往往需要多次重复测试,如果试剂的可重复性和可靠性不好,将会影响临床诊断结果的准确性和可信度。
最后,IVD体外诊断试剂标准要求试剂具备一定的安全性。
试剂的使用应符合一定的操作规范和安全要求,以避免对操作者和患者造成伤害或危险。
此外,对于一些可能具有传染性的标志物(如病毒),试剂需要具备灭活或去除的能力,以防止其传播。

药品冻干配方参数
药品的冻干配方参数是指在制备冻干药品(冻干粉剂)时所涉及的一系列配方和工艺参数。
这些参数的设定和优化对于获得高质量的冻干制品非常重要。
以下是一些可能涉及的参数:
药物配方:
活性成分:药品的主要药效成分,其含量和纯度需要准确测定。
辅助成分:辅助成分,如稳定剂、保护剂、缓冲剂等,对于药品的稳定性和制备过程都有影响。
冻干工艺参数:
凍結步驟(Freezing Step):冻结的速率和温度,影响形成冻结结构的质量。
主干脱水步驟(Primary Drying Step):主要是控制冻结结构中水的去除,通常在真空条件下进行。
次级脱水步驟(Secondary Drying Step):剩余的水分在较高温度下去除,确保最终产品的干燥。
冻干设备参数:
真空度:在冻干过程中维持的真空度对于水的蒸发速率至关重要。
温度:冻结和脱水步骤中的温度控制。
冷却剂:冷却剂的选择和温度,影响冻结的速度和质量。
容器和包装:
容器类型:冻干制品的存储容器,应选择符合药品特性的材料。
包装:防潮、氧气隔离等包装手段,确保产品的稳定性。
制备记录和控制:
制备记录:记录所有制备步骤和参数,以确保质量可追溯。
在线监测:在制备过程中对关键参数进行实时监测,以及时调整和纠正。
这些参数的设定和优化需要在药品的具体特性、用途和制备工艺中进行综合考虑。
同时,制药过程需要符合相关的药品质量管理和法规要求,以确保最终冻干产品的质量、稳定性和安全性。
因此,在进行药品冻干制备时,建议与专业的制药科学家或工程师合作,并严格遵守相关法规和标准。

试剂冻干工艺开发
试剂冻干工艺开发是指对试剂进行冻干(即冷冻干燥)加工的工艺开发过程。
冻干是一种将溶液或悬浮液在低温下冷冻,并通过减压蒸发水分的方法将样品转化为固态的干燥物的过程。
以下是试剂冻干工艺开发的一般步骤:
1. 选择试剂:确定需要进行冻干的试剂,包括化学试剂、生物试剂等。
2. 制备试剂溶液:根据试剂的性质和需要冻干的形式,制备相应的试剂溶液。
通常需要考虑到溶液浓度、缓冲剂、保护剂等因素。
3. 冷冻:将试剂溶液注入冷冻容器(如冰盒、冷冻罐),使其迅速冷冻至低温。
冷冻过程中,试剂的水分会以固态结晶的形式存在。
4. 真空脱水:将冷冻的试剂置于真空条件下,利用低温下水的升华特性,将试剂内的水分逐渐从固态转化为气态,以减少试剂中的水含量。
真空脱水的时间和温度需要根据试剂的特性进行调整。
5. 密封包装:脱水后的试剂通常需要进行密封包装,以避免水分吸附和污染。
可以选择使用密封袋、瓶子或管子进行包装。
6. 质量控制:对冻干试剂进行质量控制,包括外观检查、重量
测定、溶解度检查、活性测定等。
7. 工艺优化:根据实际情况和需求,对冻干工艺进行优化,以提高冻干试剂的稳定性、活性和储存寿命等性能。
需要注意的是,不同试剂可能具有不同的冻干特性,因此在开发冻干工艺时需充分考虑试剂本身的特性和需求。
同时,冻干工艺开发也需要结合设备、环境条件等因素进行调节和优化。

一文对体外诊断试剂(IVD)临床试验部分的解读体外诊断试剂(IVD)临床试验定义体外诊断试剂的临床试验(包括与已上市产品进行的比较研究试验)是指在相应的临床环境中,对体外诊断试剂的临床性能进行的系统性研究。
临床试验注意的问题1.临床机构的选择2.临床试验方案3.参比系统的选择4.样品种类和数量5.临床试验数据的统计和分析法规对临床机构的要求1.第三类体外诊断试剂申请人应当选定不少于3家(含3家)、第二类体外诊断试剂申请人应当选定不少于2家(含2家)临床试验机构,按照有关规定开展临床试验。
2.体外诊断试剂的临床试验机构应获得国家食品药品监督管理总局资质认可。
3.申请人应根据产品特点及其预期用途,综合不同地区人种、流行病学背景、病原微生物的特性等因素选择临床试验机构。
临床试验机构必须具有与试验用体外诊断试剂相适应的专业技术人员及仪器设备,并能够确保该项试验的实施。
临床试验前的准备工作1.提交证件:营业执照、医疗器械生产企业许可证、医疗器械经营企业许可证、机构代码等2.提交注册检验报告3.提交说明书:考核试剂的说明书、参比试剂说明书4.自检报告5.提交食品药品监督管理部门备案情况说明6.与临床试验机构签订协议伦理的不同点1.临床试验必须符合赫尔辛基宣言的伦理学准则,必须获得临床试验机构伦理委员会的同意。
2.研究者应考虑临床研究用样本,如血液、羊水、胸水、腹水、组织液、胸积液、组织切片、骨髓等的获得或研究结果对受试者的风险性,应提交伦理委员会的审查意见及受试者的知情同意书。
3.对于例外情况,如客观上不可能获得受试者的知情同意或该临床研究对受试者几乎没有风险,可不提交伦理委员会的审评意见及受试者的知情同意书,但临床研究者应提供有关伦理事宜的说明。
4.对于例外情况,如客观上不可能获得受试者的知情同意或该临床试验对受试者几乎没有风险,可经伦理委员会审查和批准后免于受试者的知情同意。
伦理委员会材料1.提交三证:2.提交注册检验报告3.提交说明书4.自检报告5.提交食品药品监督管理部门备案情况说明6.与临床试验机构签订协议7.临床试验方案8.免知情同意说明书(如需要)9.主研人的基本情况表10.其他(伦理委员会要求的)免知情同意书主要内容1.属于第几类体外诊断试剂,样本类型2.试验样本如何取得,是否为此次临床试验专门采集的样本,能否与患者进行接触和沟通3.此次试验结果是否作为辅助诊断依据(说明书列举的所有功能)4.此次检测报告单是否提供给患者5.是否需要姓名,家庭地址(随访等),是否涉及个人隐私6.此次临床试验结果的用处法规对临床试验的要求申请人应在符合要求的临床单位,在满足临床试验最低样本量要求的前提下,根据产品临床预期用途、相关疾病的流行率和统计学要求,制定能够证明其临床性能的临床试验方案,同时最大限度地控制试验误差、提高试验质量并对试验结果进行科学合理的分析。
注射用无菌粉末俗称粉针,是指药物制成的供临用前用适宜的无菌溶剂配制成澄清溶液或均匀混悬液的无菌粉末或无菌块状物。
可用适宜的注射用溶剂配制后注射,也可以用静脉输液配制后静脉滴注。
凡是在水溶液中不稳定的药物,如某些抗生素(青霉素类、头抱菌素类)、一些酶制剂(胰蛋白、辅酶A)及血浆等生物制剂,不能制成水溶性注射剂,更不能在溶液中加热灭菌,均须制成注射用无菌粉末。
近年也将中药注射剂研制成粉针以提高其稳定性,如双黄连粉针、茵桅黄粉针等。
根据生产工艺的不同,注射用无菌粉末可分为两大类:注射用无菌分装制品和注射用冷冻干燥制品。
注射用无菌分装制品注射用无菌分装制品系将采用灭菌溶剂结晶法、喷雾干燥法制得的无菌原料药在无菌条件下直接分装于洁净灭菌的小瓶或安甑中,密封而成。
常用于抗生素药品,如注射用青霉素钠、注射用头抱吠辛钠等。
(一)制备流程注射用无菌分装制品制备流程,如下图。
再确定。
干燥灭菌「|「麻I- - I~■■~I节呼菌| ∣x¾∣υ贴签1I I冷⅜P I 1口I ,r I_I1 r√T_I(二)基本工艺1、原材料及容器准备无菌原料可在无菌条件下采用结晶法或喷雾干燥法制备,必要时在无菌条件下进行粉碎、过筛等操作,制得符合分装要求的注射用无菌粉末。
安甑或玻璃瓶与胶塞的处理按注射剂的要求均需进行灭菌处理。
安甑或玻璃瓶可于180。
C干热灭菌1.5小时或于250。
C干热灭菌45分钟,胶塞洗净后要用硅油进行处理,再用125。
C干热灭菌2.5小时或于121。
C湿热,灭菌30分钟灭菌好的空瓶应在净化空气下存放,时间不应超过24小时,具体存放时间应经过验证后2、无菌粉末的分装分装必须在A级洁净环境中按无菌操作法进行,分装时多以容积进行定量,可用人工法或机械分装法。
手工分装常采用刮板式分装器,机械分装设备有螺旋式自动分装机、直管式自动分装机和真空吸粉自动分装机等。
分装机宜有局部层流装置。
分装后的小瓶应立即加塞并用铝盖密封。
------------------------------------------ 最新资料推荐------------------------------------IVD中有关“品”介绍IVD中的品在IVD生产企业中与品有关的工作太多太多了。
有产品的生产、产品的质量检验、产品的销售总之,任何的工作都会与产品两个字有关,而与产品有关的同时就与产品的质量相联系。
在现代企业的质量管理中,产品的优与劣、好与坏深入人心的已经不再是产品质量依赖于检验,而是产品始于设计。
既然产品始于设计,那么回到我们的研发实验室看一下哪些与品有关系的工作吧。
今天借助这个主题,我们来聊一些研发实验室用到的那些与品有关系的物品。
一、参考品在研发实验室或者是研发系统中,我个人更喜欢将参考品称之为参考系统。
在开发一个全新的产品(这里是说对研发企业来说是新的没有的产品,而不是指市场上没有的)之前,我们都知道需要进行研发调研和立项,很多企业也规定了要做这项工作,纵观我们的研发立项工作很多情况下做的非常完美,但是却在研发开始之初就遇到了一个很大的瓶颈产品的研究开发到达要怎么评价,特别是没有国家参考物质没有国际参考物质的情况下,怎么说我的产品算是开发成功呢?市场要如何接收我研发的产品呢?对于这样的问题要如何进行破解呢?让我们借用最近刚刚发布的HPV注册指南中的一段话来说明问题:5.企业参考品:应详细说明有关企业参考品的原料选择、制备、定值过程等试验资料。
企业参考品的核酸性质(DNA或RNA)应与产品预期检测的靶物质一致。
鉴于HPV病毒尚不能体外培养,企业参考品可采用感染HPV的细胞系,也可采用人工克隆或合成的HPV基因组DNA (或转录RNA)等。
具体要求如下:5.1阳性参考品和阴性参考品无论试剂盒能否进行HPV基因分型,阳性参考品均应针对所有适用的HPV基因型分别设置。
阴性参考品应考虑检测特异性的评价,适当纳入其他HPV基因型样品和其他病原体样品。
体外诊断试剂冻干工艺
体外诊断试剂冻干工艺是一种将体外诊断试剂中的水分通过冻结和干燥的方式去除,使其变为冻干粉,以便在使用时再加入适量的溶剂进行重组。
这种工艺主要包括以下几个步骤:
1. 制备冻结液:根据试剂成分的要求,配制适当的冻结液。
冻结液通常包括缓冲剂、保护剂和冻结剂等。
2. 冻结:将试剂液体加入冻结器中,使其在适当的温度下迅速冷却,并形成冻结状态。
冻结时需要控制冷却速率,避免试剂成分的结晶过大。
3. 干燥:将冻结的试剂样品移至干燥器中,进行干燥处理。
干燥时通常采用减压干燥或冷冻干燥的方式,以使水分以固体的形式蒸发出来,从而使试剂变为冻干粉。
4. 包装:将冻干粉装入合适的容器中,密封保存,防止湿气和光线的影响。
冻干工艺在体外诊断试剂的生产中具有重要的意义。
通过冻干处理,可以有效地延长试剂的保存时间,并提高其稳定性和使用方便性。
此外,冻干粉的重组也便于调配,能够更好地保持试剂的活性和准确性。
国外关于核酸分子试剂冻干形式介绍
国外关于核酸分子试剂冻干形式的介绍如下:
冻干技术是通过冷冻干燥的方法将液体中的水分移除,这是一个多步骤的过程。
冷冻干燥是一个精细的过程,必须彻底控制才能达到所需的产品质量。
完整的冷冻干燥过程分为四个阶段:预处理、冷冻、升华干燥、解析干燥。
预处理阶段包括选择合适的容器,考虑样品中的活性成分的热和化学特性,以及确定样品中存在的任何溶剂在该特定浓度下可以经历适当的冻结。
同时,还要添加赋形剂,如在固体含量低的溶液中添加膨松剂以稳定饼状结构,或添加塌陷温度调节剂以提高货架温度,使诊断试剂更安全、更快地升华。
以上内容仅供参考,建议查阅关于核酸分子试剂冻干形式的国外文献,获取更全面准确的信息。
【分享】IVD试剂冻干形式介绍与选择
原创乔燕春 简逸生物
近几年国内医疗诊断需求不断提升,I V D行业发展快速,特别是分子诊断的兴起,更让国内检验技术得到了长足发展。
市场对诊断试剂产品质量及应用场景的要求越来越高,从而推进了产品的不断升级,I V D冻干也被越来越多的厂家所关注。
对于I V D产品来讲快速、便捷、稳定、价格适中成为新的核心优势。
有些客户比较纠结要开发哪种形式的冻干试剂?
接下来我们简单分析一下:西林瓶、八连管、异形管、冻干微芯这几种形式的冻干试剂,希望能够帮到大家。
1西林瓶冻
干
优势:对于冻干制品来讲玻璃包材是最佳的,稳定无风险,工艺也最简单最成熟,灌装,进料,出料都是非常成熟的流程,标准冻干机基本就能满足需求,配套设备也是标准化设备,产线建设也最简单最快;
缺点:产品使用起来比较麻烦,需要分量、配制;
优点:可以分量冻干,产品使用方便;对于设备要求和冻西林瓶差不多;
缺点:需要冻干托固定;装载量与冻干机捕水量差距甚大;包材阻水率不佳,容易造成吸潮,对产品稳定性有影响,难以摆脱冷链;因为包材需要托固定,且接触不良,导致冻干工艺难调整,批一致性差,冻干效率低下;冻干后不能完成真空封盖,封盖设备需定制;
3异型管冻干
优缺点跟八连管差不多;如果要解决包材阻水率问题,需定制玻璃包材,投入相对较大;
4不锈钢盘冻干
其实很多客户问这个问题,冻成冻干粉后再进行分装可以吗?在一些要求不高的小分子药物中是有应用的,例如抗生素一类的,但是在I V D 中应用较难,冻干粉分装时难度较大,对于定量要求相对较高的I V D 产品这种形式基本很难实现,再加上分装过程吸潮的控制也很难,会有一系列的问题造成产品质量不稳定;
2八连管冻干
5冻干微芯
优点:精准定量,单人单份,产品使用方便;可实现特殊工艺处理,防止吸潮,对包材没有要求,可以分装到八连管、微流控芯片、各种生物芯片、卡、流式管、96孔板等包材里,而且可以实现常温储存;因为没有包材限制,它的产能可以发挥到冻干机极限;
缺点:首先是它的配方开发要求非常严格,除了性能方面的要求,它对刚性要求也很高,因为冻干之后没有包材包裹,而且要经过后续防吸潮处理及分装,所以要求它要非常结实,不能有掉粉,易碎的情况,还要有一定的复溶速度,配方开发有一定难度;设备方面除了冻干机其他辅助设备市场上还比较少,可能需要定制;设备其实并不是最重要的,最重要的是上下游的一个衔接,如果冻干机厂家不能提供工艺服务,以及后续的分装/封装的等定制化服务,那么很有可能会造成冻干机购买后被闲置的风险;还有关于产线建设,因为需要定制化,相对周期会比传统产线建设周期略长,但同样级别的冻干机产能要比传统产线高出几倍,所以说要求同样产能的情况下,对冻干机的平方数要求要小很多;
总结:冻干微芯基本满足了快速、便捷、稳定的产品要求,但相对开发难度要大一点,如果需要自建产线设备大部分需要定制化,周期略长。
冻干工艺服务
我们团队拥有十几年的药品及生物制剂冻干产线建设及冻干工艺研发经验,近几年一直致力于冻干试剂的开发,特别是冻干微芯的开发与生产,我们的优势:
*已有几十个品种的研发经验,基本上1-3个月完成辅料筛选,完成冻干工艺验证;
*我们可以将m i x或者原料酶、d N T P开发成单个反应体系的微芯,这对检验操作人员意义重大;
*我们从产品设计到配方研发,报证及咨询,再到产业化方案,设备设计,定制,产线建设已经形成了一个完整的服务闭环;
*客户可以选择C D M O,我们有符合条件的质量体系及G M P生产车间;也可以选择自行建线,我们会提供整体解决方案;
我们希望能够做到冻干工艺研发与冻干设备研发完美结合,帮助客户缩短产品开发周期,加速产品上市,降低开发风险及成本。