化学化学式与化合价第三课时
- 格式:ppt
- 大小:693.50 KB
- 文档页数:29

化合价教案(总7页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--课题4 化学式与化合价一、教学目标1.知识与技能(1)、了解常见元素及原子团的化合价;(2)、能用化学式表示某些物质的组成,并能利用化合价推求化学式;(3)、了解相对分子质量的涵义,并能利用相对原子质量和相对分子质量计算物质的组成;(4)、能看懂某些商品标签或说明书上标示的物质成分和含量。
2.过程与方法:(1)、通过对图、表的观察,让学生学会对学过的知识进行整理归纳并初步运用;(2)、通过讨论交流、活动探究,培养学生利用所学的知识解决实际问题的能力和基本计算能力;3.情感、态度与价值观:(1)、通过自编化合价口诀,激发学生的学习兴趣和求知欲;(2)、通过讨论交流、活动探究,发展学生善于合作、勤于思考、勇于实践的精神。
二、教学资源分析本课题安排在第四单元的最后一部分,包括“什么是化学式”、“化合价”和“有关相对分子质量的计算”这三部分内容,它们是学习化学的重要工具,是“双基”的重要部分。
虽然有元素符号知识作为基础,但仍是初三化学学习中的知识分化点。
本课题的内容比较抽象,教材首先讲述了化学式的概念,以学生最熟悉的纯净物——水为例,介绍了化学式表示的意义;接着介绍化合价知识,并以推求五氧化二磷的化学式为例讲解推求的步骤和方法,在此基础上,介绍化学式的读法;最后是有关相对分子质量的计算。
课程标准对这些内容要求不高,故教学中不需要任意扩展与加深。
1教学策略分析在前面的学习中,学生已具有了有关元素符号的知识,用元素符号来表示某种元素,学生兴致很高;那么,对于物质能否用专门的符号来表示呢?学生对此的求知欲望很强。
但最基本的元素、原子团化合价的记忆却又是那么枯燥乏味,因此,教师要充分发挥学生的主观能动性,以试编口诀、讨论交流、活动探究等多种形式活跃课堂气氛,提高教学的效率。
2教学重、难点重点:化合价知识及其应用、有关相对分子质量的计算。


化学式与化合价导教案(课时3)一、学习目标(1)认识化学式的涵义,并能用化学式表示某些常有物质的组成。
(2)熟记某些常有元素及原子团的化合价。
(3)能用化合价推求化学式。
(4)认识相对分子质量的涵义,并能利用相对原子质量、相对分子质量进行物质构成的简单计算。
(5)能看懂某些商品标签或说明书上标示的物质成分及其含量。
二、学习重难点要点(1)化学式的书写(2)化学式的读写规律(3)常有元素的化合价(4)相关相对分子质量的计算难点(1)化学式的涵义(2)化合物化学式的读写规律(3)物质相对分子质量的计算三、自主研究一、学习导航二、阅读课文83-84 页,并达成以下填空1、用元素符号和数字的组合表示物质构成的式子,叫做_____。
2、写出以下物质的化学式(1)氧气 ___, (2) 水___,(3)二氧化碳 ___, (4)氮气 __, (5)氢气__, (6)四氧化三铁 ___, (7)硫___ , (8) 氯化钠 _____。
上述物质中属于单质的是 _____,属于化合物的是 _______。
3、化学式 H2O 的意义有: (1)表示 ________,(2)表示___________________, (3)表示 ___________________, (4)表示 ___________________。
4、由两种元素构成的化合物的名称,一般读作某化某。
例如 NaCl 读作 ______, P2O5 读作 ______, SO2 读作 ______。
【合作学习与研究】1、每种物质的构成是固定不变的,所以每种物质的化学式只有 ___个。
2、物质的构成是经过实验测定的,所以化学式的书写一定依照 _______。
3、化学式的书写分单质化学式书写和化合物化学式书写(1)单质化学式书写①由原子直接构成的物质,用_____表示。
比如:硫___,磷___,铁 ___,氦气 ____;②双原子分子或多原子分子构成的单质,用__________________________ 表示。

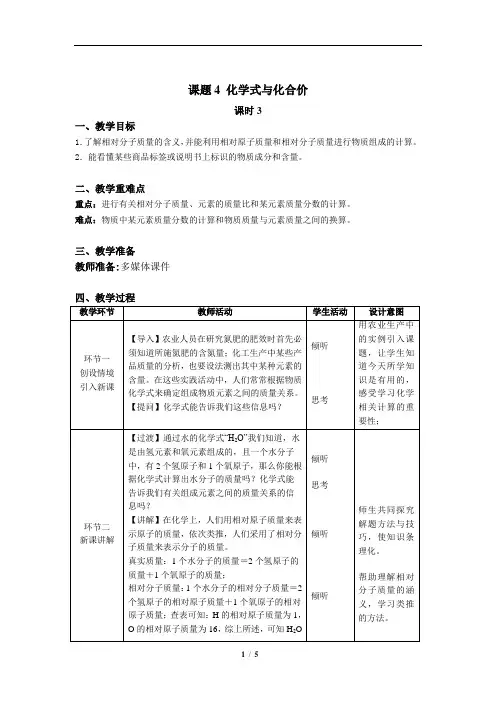
课题4 化学式与化合价课时3一、教学目标1.了解相对分子质量的含义,并能利用相对原子质量和相对分子质量进行物质组成的计算。
2.能看懂某些商品标签或说明书上标识的物质成分和含量。
二、教学重难点重点:进行有关相对分子质量、元素的质量比和某元素质量分数的计算。
难点:物质中某元素质量分数的计算和物质质量与元素质量之间的换算。
三、教学准备教师准备:多媒体课件四、教学过程元素的原子个数与它的相对原子质量乘积之间的比值。
如:计算二氧化碳(CO2)中碳元素(C)和氧元素(O)的质量比。
【解答】m(C):m (O)=12:(16×2)=12:32=3:8.【注意事项】在计算物质组成元素的质量比时,要注意一下几点:①看清各元素质量比的顺序;②结果约简成最简整数比;③区分元素质量比与原子个数比。
④某些物质的化学式中,同种元素并不写在一起的,这时要注意原子个数。
⑤【练习】计算:Ca(OH)2、H2O2、NH4NO3下列物质中各元素的质量比。
(H-1 C-12 N-14 O-16)Ca(OH)2中钙、氧、氢元素的质量比=40:(16×2):(1×2)=20:16:1H2O2中氢、氧元素的质量比=1×2:16×2=1:16NH4NO3中氮、氢、氧元素的质量比=(14×2) :(1×4) :(16×3)=7:1:124.计算物质中某元素的质量分数【讲解】某元素的质量分数(ω),就是该元素的质量与组成物质的元素总质量之比,可根据化学式计算。
即:如:计算NH4NO3中氮元素的质量分数。
(H-1 N-14 O-16)【解答】步骤1:NH4NO3的相对分子质量=14×2+1×4+16×3=80;步骤2:NH4NO3中氮元素的质量分数===35%。
【练习】计算:CaCO3中碳元素的质量分数。
(Ca-40 C-12 N-14 O-16)CaCO3中碳元素的质量分数=【练习】计算:某新型胃药的一个分子中含有5个氮原子,其中氮原子的质量分数约为35%,则其相对分子质量为多少?【练习】如图为某分子的结构模型,请回答下列问题:(C-12 O-16)(1)该分子的化学式为________,其相对分子质量为______。



课题4 化学式与化合价【三维目标】1.知识与技能(1)了解什么是化学式及化学式的意义;(2)熟记常见元素及原子团的化合价;(3)能利用化学式简单推求化合价,进而能用化学是正确地表示常见物质的组成;(4)学会简单化学式的读法。
2.过程与方法(1)通过化学式意义的学习,使学生学会用化学语言表述物质的组成;(2)通过化合价概念、特点的学习使学生初步学会运用观察。
比较、概括等处理信息的方法。
3.情感态度与价值观(1)通过化学式的学习,让学生感受化学语言独特的魅力,增强对化学学科的喜爱;(2)通过不同的化合价记忆方法的交流,培养合作精神和竞争意识;(3)通过激励学生用不同的方法记忆元素及原子团的化合价,培养学生的创造精神;(4)通过化学式和化合价的学习,使学生领会必须根据客观事实和化合物的组成写化学式,建立科学的物质观和实事求是的科学精神。
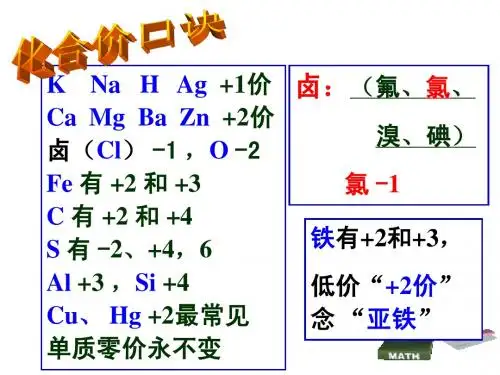
【教学重点】1.熟记常见元素及原子团的化合价;2.用化学式表示某种物质的组成,并利用化合价推求化学式。
【教学难点】1.化学式的书写;2.利用化合价写化学式。
第一课时化合价与化学式导入:各行各业都有自已的语言,它方便易懂易记,同样化学也有自已的语言,且世界通用。
这就是我们今天学习的化学用语——化学式。
【课堂练习】1.书写下列元素的元素符号并分类(指出单质存在的状态)He 、Ne、 Ar、 Kr、 Xe ;F、 Cl 、Br、 I、 H、 O、 N ;K、 Ca、 Na、 Mg、 Al、 Zn、 Fe、 Cu、 Hg、 Ag ;金属________________________________________________,存在状态 ______。
非金属,存在状态。
稀有气体,存在状态。
2.下列符号分别代表某些物质,从组成中所含元素的种类判断各属哪一类物质。
Al、 CuO、 He 、H2、NH3、SO2、ZnO、 NaCl 、KMnO4单质;化合物;氧化物。
一、化学式1.定义:用元素符号和数字的组合表示物质组成的式子叫做化学式。


化学式与化合价(精选5篇)化学式与化合价篇1一、--思路课题分析本课题包括化学式、化合价和有关相对分子质量的计算三部分内容,它们是学习化学的重要工具,是“双基”的重要部分。
化学式的书写是同学必需把握的,尤其是要能够应用元素或根的化合价来推求化合物的化学式,这是教学中的重点。
计算相对分子质量和组成物质各元素的质量比,计算物质中某元素的质量分数是学校同学应把握的基本计算,也是教学中的重点,这些基本计算必需建立在对化学式涵义的理解透彻的基础之上,因此这是教学中的难点。
设计思路第一部分是化学式及其涵义。
教学时实行嬉戏加上争论来完成该内容的教学,以便将更好地激发同学的学习爱好,也要利于突破化学式的涵义这个教学难点。
其次部分是化合价与化学式。
教学中主要通过小组合作竞赛记忆元素及原子团的化合价来突破记忆化合价的难点;利用化合价推求化合物的化学式主要是反复多次训练便可实现教学目标。
第三部分是有关相对分子质量的计算。
教学中主要实行讲练结合以让同学娴熟把握计算相对分子质量和组成物质各元素的质量比,计算物质中某元素的质量分数是学校同学应把握的基本计算。
课后分小组到商店去调查几种氮肥的价格,并通过计算得出购买哪种氮肥最划算,以达到学以致用的功效。
二、--课题化学式授课人邵世祥学校恩施市屯堡中学教学目标学问与技能1、了解化学式的涵义。
2、知道一些常见元素和根的化合价。
3、能用化学式表示某些物质的组成,并能利用化合价推求化学式。
4、计算相对分子质量和组成物质各元素的质量比,计算物质中某元素的质量分数。
5、能看懂某些商品标签或说明书上标示的物质成分和含量。
过程与方法1、通过争论法来突破理解化学式涵义的教学难点。
2、通过嬉戏竞赛法来解决元素或原子团化合价记忆的难关。
3、通过讲练结合,反复多练的方法让同学娴熟把握计算相对分子质量和组成物质各元素的质量比,计算物质中某元素的质量分数等基本计算。
情感态度与价值观培育同学擅长合作、勤于思索、严谨求实、勇于创新和实践的科学精神,体验探究胜利的乐趣。
学科:_________ 教师:________ 班级:________时间:_________化合物相对分子质量、各元素的质量比、某一元素的质量分数1. 如图是某反应的微观示意图,下面结论正确的是( )A .该反应中,参加反应的微粒个数比为2:3B .碳元素在反应中化合价降低,氮元素化合价升高C .该反应生成两种氧化物D .该反应生成物的质量比为22:72. “长征5号”的助推器是用液氧、煤油作推进剂的,航空煤油可由优质石油分馏而来,十二烷(C 12H 26)是航空煤油中的成分之一,关于C 12H 26的说法正确的是( ) A .十二烷分子由碳、氢两个元素组成 B .十二烷由12个碳原子和26个氢原子构成 C .十二烷中碳元素的质量分数计算式为12121212+126⨯⨯⨯×100% D .十二烷中碳元素与氢元素的质量比为12:26【考点】考察各元素的质量比、某一元素的质量分数【设计意图】通过具体情境考察化合物中某元素的质量分数=100%⨯⨯相对原子质量原子个数相对分子质量 。
3. 走进化学变化的微观世界,在“宏观一微观一符号”之间建立联系,有利于我们进一步认识化学变化,图是某化学变化的微观示意图,请根据图示回答下列问题:(1)甲、乙、丙、丁四种物质中属于氧化物的有 种。
(2)甲物质中碳、氢元素的质量比为 。
(3)参加反应的甲物质与反应生成的丙物质中碳元素质量(选填“相等”或“不相等”)。
(4)该反应前后分子的数目(选填“有”或“没有”)发生变化。
(5)写出该反应的文字表达式。
4. 阅读下面科普短文苹果含有维生素A、维生素C、钾、钙、铁等人体所需的营养成分。
苹果可增加饱腹感,热量较低,常吃苹果可以帮助降低胆固醇,也适合减肥的人群。
食用苹果时,应避免食用果核部分。
因苹果籽中会有氰苷,氰苷在人体中易转化为剧毒物质氢氰酸(化学式为HCN)。
另外,苹果中含有大量的维生素C,不易与磺胺类药物同服,会影响药物效果。
人教版九年级化学上册:第四单元课题4:化学式与化合价(第三课时)教案一、教学目标1.理解化学式的概念;2.掌握化合价的确定方法;3.能够根据给定的化合价写出相应的化学式;4.运用化学式和化合价的知识解决实际问题。
二、教学内容1.化学式的概念及写法;2.化合价的确定方法;3.化学式和化合价在实际问题中的应用。
三、教学过程导入(5分钟)老师通过实际例子引出化学式的概念,让学生感受化学式在生活中的应用。
知识讲解(15分钟)1.化学式的概念:化学式是用元素符号表示化合物中各个元素的种类和相对原子数量的表示方法。
例如,H2O表示水分子中有2个氢原子和1个氧原子。
2.化合价的确定方法:化合价是元素在化合物中的相对电荷数。
化合价的确定方法主要有两种:–通过化合物的离子价确定,例如,CaCl2中,Ca的化合价为+2,Cl的化合价为-1;–通过元素在化合物中与其他元素形成配位键的价态确定,例如,在NH3中,氮元素的化合价为-3。
案例演示(20分钟)1.案例一:根据化合价写化学式。
例如,钠离子的化合价为+1,氯离子的化合价为-1,根据化合价可以写出NaCl的化学式。
2.案例二:根据化学式确定化合价。
例如,化学式为H2SO4的化合物,根据化学式可以确定其中氢元素的化合价为+1,硫元素的化合价为+6,氧元素的化合价为-2。
小组讨论(15分钟)学生分组讨论以下问题,并向全班汇报讨论结果: 1. 根据给定的化合价确定化学式; 2. 根据给定的化学式确定化合价。
练习(15分钟)1.根据给定化合价写化学式:氧元素的化合价为-2,氢元素的化合价为+1,写出氢氧化钠的化学式。
2.根据给定化学式确定化合价:化学式为CO2的化合物,根据化学式确定其中氧元素的化合价为-2,写出碳元素的化合价。
拓展应用(15分钟)老师出示一些实际问题,学生运用所学的化学式和化合价的知识进行分析和解答。
四、教学反馈老师与学生进行互动,对学生的表现给予评价和指导,并对学生的问题进行解答。
课题3 化学式与化合价说课稿一、说教材化学式与化合价是第四单元课题四的有关内容,本课题包括化学式、化合价和有关相对分子质量的计算三部分内容,他们是学习化学的重要工具,因此是双基的重要组成部分,能够较好的掌握它们,对于今后的化学学习有很大的帮助。
教材首先讲述了化学式的概念,指出了由于纯净物有固定的组成,因此每种物质只有一个化学式,同时还指出物质的组成是通过实验测得的,所以化学式的书写必须依据实验的结果,但是化学式的书写,主要是通过化合价来推求。
从教材方面看,化合价内容比较抽象、难懂;从学生方面看,学生只知道了书写化学式的一般规则,还不会确定元素的原子个数比,而且还没有核外电子排布和最外层电子得失的知识基础。
因此对九年级学生说,学习这样一个抽象概念并掌握其应用,是有一定难度的。
⑴分析本节课的教学背景化合价是初中化学课程中要求达到了解水平的基础知识。
在此以前涉及到的有化学式,物质结构的初步知识。
另外学生掌握本节知识将对以后的学习有十分重要的影响,尤其是对酸、碱、盐的学习。
也就是说,本节课是初中化学知识链中的重要一环,它贯穿着化学学习的始终。
⑵展示本节课的教学目标:在《化学课程标准》中指出:教学要把培养学生学习化学的兴趣,提高科学素养放在首要位置,要从促进学生发展的角度出发去制定教学目标,据此我制定如下的教学目标:①用原子结构的初步知识,使学生认识元素的化合价是元素的一种性质。
原子结构决定了元素的化合价;识记常见元素和原子团的化合价。
②培养学生对化合价在理解基础上进行记忆的能力③使学生懂得只有确实存在的物质,才能写出它的化学式。
对学生进行实事求是的教育。
⑶本节课教学重、难点的确定及解决方法教学重点:通过对《化合价》第一课时的学习,不但要让学生真正领会化合价的实质,而且要让学生通过对本节课的学习能在后续课中应用常见元素及原子团的化合价及化合物中元素正、负化合价代数和为零的原则,快速而准确的书写化学式和化学方程式。