叶绿素的提取实验
- 格式:ppt
- 大小:5.16 MB
- 文档页数:36

提取叶绿素的实验原理是
叶绿素是植物和一些浮游植物中的重要色素,其含有的镁离子使其呈绿色。
叶绿素起主要的光合作用和光能转化作用,是植物能够进行光合作用的关键物质。
提取叶绿素的实验原理基于其在溶剂中的溶解性。
通常使用的提取溶剂包括酒精、醋酸乙酯和二氯甲烷等有机溶剂。
实验过程大致分为以下几个步骤:
1. 取适量的植物叶片,切碎或捣碎使细胞破碎,使叶绿素释放到溶剂中。
2. 将破碎的植物组织与溶剂混合,振荡或搅拌一段时间,以使叶绿素充分溶解。
3. 将混合物过滤,以除去植物残渣和细胞碎片。
4. 收集过滤液,即叶绿素提取液。
此液体中含有溶解在溶剂中的叶绿素。
5. 利用分光光度计或其他光谱仪器,测量叶绿素提取液的吸光度。
叶绿素在可见光区域(特别是绿光区)有很强的吸收能力,因此可以通过测量吸光度来确定叶绿素的浓度。
通过上述实验原理,可以将叶绿素从植物组织中提取出来,并对其进行浓度测定。
这对于研究植物生物化学和光合作用等方面具有重要意义。

提取叶绿素的实验报告探究叶绿素在光合作用中的重要性和功能。
实验材料:1. 叶绿体提取液:通过离心植物组织获得的液体。
2. 植物叶片:新鲜且健康的绿色植物叶片。
3. 75% 乙醇:用于提取叶绿素的有机溶剂。
4. 富含二氧化碳的水:提供光合作用所需的二氧化碳。
5. 无色试剂:用于检测叶绿素的存在。
实验步骤:1. 准备:将乙醇和富含二氧化碳的水分别倒入两个玻璃瓶中,并为每个瓶子准备一片植物叶片。
2. 反应前处理:将一片植物叶片放入乙醇玻璃瓶中,摇晃约1分钟,待叶绿素溶解入乙醇,使叶绿素变成绿色提取液。
3. 提取叶绿素:将叶绿体提取液缓慢倒入富含二氧化碳的水中,同时观察溶液颜色变化。
4. 观察结果:根据溶液颜色变化,可以得出叶绿素在光合作用中的功能。
实验结果:通过实验观察,溶液从橙黄色逐渐变成绿色,说明叶绿体提取液中的叶绿素受到光的作用后发生了变化。
这表明叶绿素在光合作用中起到了重要的作用。
实验讨论:叶绿素是一种存在于植物和某些浮游生物中的绿色色素,它是光合作用中的关键物质。
通过吸收光能,叶绿素能够将阳光转化为植物可用的化学能。
在光合作用中,叶绿素通过光合色素复合体吸收光能,并将其转化为电子能和激发态能。
这些能量在光合色素复合体中传递,最终用于合成葡萄糖等有机物质并释放出氧气。
实验中,通过将叶绿体提取液与富含二氧化碳的水混合,我们可以观察到溶液颜色的变化。
这一变化表明叶绿素受到光的激发后发生了变化。
光能激发了叶绿素分子中的电子,使其从基态跃迁到激发态。
随后,叶绿素分子中的电子通过光合色素复合体传递,最终用于光合作用的化学反应。
叶绿素的存在使植物能够进行光合作用,从而合成有机物质并释放出氧气。
光合作用是地球上生物圈中最重要的能量转换过程之一,它不仅为植物提供了能量,也为其他生物提供了能量来源。
叶绿素的作用不仅体现在能量转换上,还参与了光合作用的调节和保护等多个方面。
综上所述,叶绿素在光合作用中起到了重要的作用。
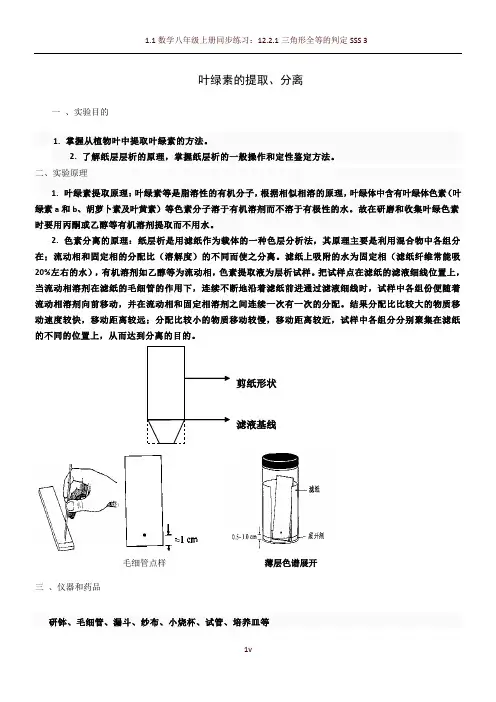
叶绿素的提取、分离一、实验目的1.掌握从植物叶中提取叶绿素的方法。
2. 了解纸层层析的原理,掌握纸层析的一般操作和定性鉴定方法。
二、实验原理1. 叶绿素提取原理:叶绿素等是脂溶性的有机分子,根据相似相溶的原理,叶绿体中含有叶绿体色素(叶绿素a和b、胡萝卜素及叶黄素)等色素分子溶于有机溶剂而不溶于有极性的水。
故在研磨和收集叶绿色素时要用丙酮或乙醇等有机溶剂提取而不用水。
2. 色素分离的原理:纸层析是用滤纸作为载体的一种色层分析法,其原理主要是利用混合物中各组分在;流动相和固定相的分配比(溶解度)的不同而使之分离。
滤纸上吸附的水为固定相(滤纸纤维常能吸20%左右的水),有机溶剂如乙醇等为流动相,色素提取液为层析试样。
把试样点在滤纸的滤液细线位置上,当流动相溶剂在滤纸的毛细管的作用下,连续不断地沿着滤纸前进通过滤液细线时,试样中各组份便随着流动相溶剂向前移动,并在流动相和固定相溶剂之间连续一次有一次的分配。
结果分配比比较大的物质移动速度较快,移动距离较远;分配比较小的物质移动较慢,移动距离较近,试样中各组分分别聚集在滤纸的不同的位置上,从而达到分离的目的。
毛细管点样薄层色谱展开三、仪器和药品研钵、毛细管、漏斗、纱布、小烧杯、试管、培养皿等剪纸形状滤液基线95%酒精、丙酮、石油醚碳酸钙,石英砂四、实验步骤(1)取菠菜或其他植物新鲜叶片20g左右,洗净,用滤纸擦干,去掉叶柄和中脉剪碎,放入研钵。
(2)研钵中加入少量碳酸钙和石英砂,加4-5ml 无水乙醇,研磨至糊状,再加10ml 无水乙醇充分混匀以提取叶片匀浆中的色素,15-20分钟后,过滤入50ml锥形瓶中加塞待用。
分离:(1)取圆形定性滤纸一张(直径15cm),将其剪成滤纸条(15cm×2cm),将其2cm一端剪去两侧,中间留一长约1.5cm,宽约0.5cm的窄条,并在滤纸剪口上方用铅笔画一条直线,作为画滤液细线的基准线(注意:滤液线必须距底边1-1.5cm)。

从菠菜中提取叶绿素实验报告6篇从菠菜中提取叶绿素实验报告 (1)1.1 仪器与试剂仪器:研钵、分液漏斗、显微载玻片、毛细管、层析柱(20×10 cm)、UV-240紫外分光光度计试剂:石油醚、乙醇(95%)、菠菜叶、丙酮(化学纯)、乙酸乙酯(化学纯)、无水硫酸钠、硅胶G、中性氧化铝(150目~160目)1.2 提取与分离1.2.1 浸泡法提取色素在研钵中放入20 g新鲜的菠菜叶,加入20 mL3:2(体积比)石油醚—乙醇混合液,适当研磨(不要研成糊状,否则会给分离造成困难),用倾析法将提取液转移到分液漏斗中,每次用10ml水洗涤两次,以除去萃取液中的乙醇。
洗涤时要轻轻旋荡,以防乳化。
弃去水乙醇层,石油醚层用无水硫酸钠干燥,干燥后滤入小圆底烧瓶,在水浴上蒸发浓缩至大约l m L。
1.2.2 薄层层析取四块显微载玻片,硅胶G经0.5%羧甲基纤维素钠调制后制板,在室温下晾干后在110°C活化1h。
选取效果最好的一块进行点样。
展开剂:(1)石油醚—丙酮=8:2(体积比)(2)石油醚—乙酸乙酯=6:4(体积比)取活化后的层析板,点样,放入预先选定展开剂的广口瓶。
瓶的内壁贴一张高5cm,绕周长4/5的滤纸,下部浸入展开剂中,盖上瓶盖。
待展开剂上升至规定高度时,取出层析板,晾干,做出标记。
分别用两种展开剂展开,比较不同展开剂的展开效果。
观察斑点在板上的位置并排列出胡萝卜素、叶绿素和叶黄素的Rf值的大小。
注意更换展开剂时,需干燥层析瓶,不允许前一种展开剂带入后一系统。
1.2.3 柱层析取少量脱脂棉在小烧杯中用石油醚浸润后,挤压除去气泡,放在层析柱底部。
在层析柱中加15cm石油醚。
加入中性氧化铝8克,打开柱下活塞,保持石油醚高度不变,氧化铝在柱子中堆积。
装完后,打开下端活塞,放出溶剂,直到氧化铝表面剩下1—2mm高为止(不能使氧化铝表面露出液面)。
将浓缩液用滴管加到柱顶部,打开下端活塞,让液面下降到柱面以下1mm,关闭活塞,加数滴石油醚,打开活塞,使液面下降,几次反复,使色素全部进入柱体。


叶绿素的提取与分析测定叶绿素是一类广泛存在于植物、藻类和一些细菌中的色素分子,它在光合作用中起着重要的作用。
叶绿素的提取和分析测定是植物生理学、植物生态学、环境科学等领域的研究中常用的实验操作之一、本文将介绍叶绿素的提取和分析测定的方法及其应用。
1.取新鲜叶片,将其放置于干净的细网纱袋中,用乙醇浸泡片刻,使其浸润。
2.将浸泡的细网纱袋取出,轻轻挤压以使叶绿素溶出。
3.用乙醇将溶液稀释至一定浓度。
4.离心沉淀,将上清液取出,即可得到叶绿素溶液。
叶绿素的浓度可以通过分光光度法进行测定。
分光光度法是根据不同物质对光的吸收特性来测定其浓度的一种分析方法。
具体步骤如下:1.将提取得到的叶绿素溶液置于紫外可见分光光度计中。
2. 使用合适的波长进行测定,一般波长为663 nm和645 nm。
3.依次测定样品和纯溶剂(如乙醇)的吸光度,并计算其差值。
4.根据比色法原理,利用比色计算公式或标准曲线,计算叶绿素的浓度。
叶绿素的分析测定可以帮助我们了解植物光合作用的效率、叶片的生理状态、环境因子对植物的影响等。
叶绿素浓度的变化可以指示植物对环境的适应能力和营养状态。
因此,叶绿素的提取与分析测定在植物生态学研究、农业生态学研究、环境科学研究等领域中得到广泛应用。
叶绿素的提取与分析测定方法的选择应根据具体的研究目的和实验条件进行优化。
例如,在进行叶片叶绿素含量测定时,应尽量选择含有丰富叶绿素的叶片样品,避免阳光直射、避免用硬物破坏叶片结构等。
在选择测定波长时,要根据叶绿素的特性选择吸收峰值附近的波长,以提高测定的准确性。
总之,叶绿素的提取与分析测定是植物生理学、植物生态学、环境科学等领域研究中常用的实验操作。
通过选择合适的提取方法和测定方法,可以准确测定叶绿素的含量,从而为相关研究提供重要的数据支持。

叶绿素的提取与分析测定叶绿素的提取与分析测定是一项重要的生物技术实验,主要用于研究植物光合作用中的重要色素——叶绿素。
下面将详细介绍实验的步骤、方法和数据分析。
一、实验目的本实验旨在提取和分析测定叶绿素,了解其在植物光合作用中的重要作用,并为进一步研究植物生长和发育提供基础数据。
二、实验原理叶绿素是植物进行光合作用的主要色素,它能够吸收太阳光能,并将其转化为化学能,为植物的生长和发育提供能量。
叶绿素广泛存在于植物的绿色组织中,尤其在叶片中含量最为丰富。
本实验将采用有机溶剂(如乙醇、丙酮等)从植物组织中提取叶绿素。
提取后的叶绿素可通过分光光度法进行定量分析。
三、实验步骤1.样品准备:选取新鲜植物组织(如叶片),用蒸馏水冲洗干净,滤纸吸干表面水分,称取一定质量(m)的样品备用。
2.叶绿素提取:将样品放入研钵中,加入适量有机溶剂(如乙醇-丙酮混合液),研磨成匀浆。
将匀浆转入离心管中,于低温下离心(如4℃、10000 r/min),收集上清液备用。
3.叶绿素定量分析:取一定体积(V)的上清液,加入适量蒸馏水稀释,用分光光度计在663nm和646nm波长下测定吸光度(A)。
根据朗伯-比尔定律,叶绿素的浓度(C)可由吸光度计算得出。
公式如下:C = (11.77A663 -2.59A646) / m / V4.数据记录:记录每个样品在各波长下的吸光度,并计算出叶绿素浓度。
5.数据分析:对所得数据进行统计分析,比较不同样品间的叶绿素含量差异,并绘制柱状图或饼图等图形表示结果。
四、实验结果与数据分析假设我们选取了三种不同植物的叶片进行实验,以下是实验所得的数据:1.三种植物叶片中叶绿素的含量存在差异,其中样品1的叶绿素含量最高,样品3的含量最低。
这可能与不同植物的生物学特性有关。
2.根据所得数据绘制柱状图或饼图等图形,可以直观地展示不同样品间的叶绿素含量差异。
这有助于我们进一步了解植物间的差异以及叶绿素在植物生长和发育中的作用。

叶绿素的提取和分离实验
叶绿素的提取:称取5 g的绿叶,剪碎,放入研钵中→加入少量二氧化硅、碳酸钙和10 mL无水乙醇→研磨→过滤→收集到试管内并塞严试管口。
准备过滤纸条:将过滤纸条剪成略小于试管长度和直径的过滤纸条,将滤纸条的一端剪去两角,在距离剪角一端1cm处用铅笔画一条细的横线。
画滤细线:用毛细管吸取少量滤液,并沿铅笔线均匀划出一条细线,待滤液干后再画1~2次。
叶绿素分离:在试管中倒入适量层析液。
得到滤纸上的四种颜色、不同宽度的色素带。
叶绿素提取注意事项:
准备滤纸时,要将滤纸的一端剪去两角,这样可使色素扩散到滤纸上,以便于观察实验结果。
过滤时不用滤纸过滤而用单层尼龙布过滤是因为滤纸对色素具有吸附作用,若用其过滤,会导致收集到的滤液色素含量少,使实验效果不明显或失败。

一种叶绿素提取方法
叶绿素提取是从植物中获取纯化叶绿素的过程。
以下是一种常用的叶绿素提取方法:
材料:
- 鲜叶样本
- 95%乙醇
- 丙酮
- 50%甲醇
- 丙酸乙酯
步骤:
1. 准备叶样:选择新鲜的绿叶样本,剪碎并将其放入称量瓶中。
记录叶样的重量。
2. 使用95%乙醇溶解:向剪碎的叶样中加入足够的95%乙醇,使其浸泡在溶剂中。
搅拌叶样片刻,以促进叶绿素的溶解。
3. 离心:将溶液以约5000-10000rpm的速度离心5-10分钟,以沉淀固态残余物质。
4. 过滤:小心地将上清液转移到另一个容器中,通过过滤纸将溶液过滤,以除去残余的固态颗粒。
5. 分离叶绿素:将过滤的溶液加入丙酮中,并搅拌15-20分钟,以促进叶绿素从溶液中分离出来。
可以使用离心机将叶绿素沉淀到底部。
6. 提取叶绿素:将上清液转移到干净的容器中,加入50%甲醇,并用离心机进行离心操作。
7. 再次过滤:将离心后的溶液通过过滤纸过滤,以去除残留的固态颗粒。
8. 浓缩叶绿素:将过滤的溶液转移到锥形瓶中,使用丙酸乙酯作为提取剂,进行浓缩叶绿素。
9. 干燥叶绿素:将浓缩的叶绿素放置在通风的地方,使其自然干燥。
10. 测定叶绿素浓度:使用光度计等工具测定干燥的叶绿素溶液的浓度。
请注意,这个方法只是一种常见的叶绿素提取方法,不同的实验目的和植物样本可能需要使用不同的提取方法。
在进行叶绿素提取实验前,请确保熟悉所用方法,并遵循对应的安全操作规范。

提取叶绿素实验报告提取叶绿素实验报告引言:叶绿素是植物体内的一种重要色素,它在光合作用中起着关键的作用。
为了深入了解叶绿素的结构和功能,我们进行了一次提取叶绿素的实验。
本篇报告将详细介绍实验的目的、过程和结果,并对实验结果进行分析和讨论。
实验目的:本次实验的目的是通过提取叶绿素,观察叶绿素的溶解性和吸收光谱特性,从而了解叶绿素的结构和功能。
实验材料和方法:1. 实验材料:- 新鲜的叶片样本(如菠菜、植物苗等)- 丙酮、乙醇、二氧化碳等有机溶剂- 室温下的蒸馏水- 研钵、研杵、滤纸等实验器材2. 实验步骤:1) 将新鲜的叶片样本切碎,并放入研钵中。
2) 加入适量的丙酮,用研杵研磨叶片,使叶绿素溶解在丙酮中。
3) 将研磨后的混合液过滤,得到含有叶绿素的丙酮溶液。
4) 将丙酮溶液转移至离心管中,离心5分钟,使悬浮在溶液中的杂质和叶绿素分离。
5) 将上清液转移到另一个离心管中,加入适量的乙醇,使叶绿素重新溶解。
6) 将乙醇溶液通过滤纸过滤,得到纯净的叶绿素提取物。
7) 将提取物转移到试管中,用分光光度计测量其吸光度,得到吸收光谱。
实验结果:通过实验,我们成功提取到了叶绿素,并得到了其吸收光谱。
在可见光波长范围内,叶绿素的吸光度呈现出两个峰值,分别位于绿色和红色光波段。
其中,绿色峰值的波长大约在430-450nm左右,红色峰值的波长大约在640-660nm 左右。
实验分析与讨论:1. 叶绿素的溶解性:通过实验我们发现,叶绿素在丙酮中具有良好的溶解性。
这是因为丙酮是一种极性有机溶剂,能够有效溶解叶绿素的疏水性结构。
而乙醇则起到了将叶绿素重新溶解的作用。
2. 叶绿素的吸收光谱特性:叶绿素的吸收光谱特性是由其分子结构所决定的。
叶绿素分子中的大环结构(叶绿素a)和侧链结构(叶绿素b)使其能够吸收可见光中的特定波长,从而实现光能的转化。
绿色峰值的波长对应着叶绿素吸收蓝光的能力,而红色峰值的波长则对应着叶绿素吸收红光的能力。

叶绿素的提取与分离方法:1 纸层析法2 薄层色谱法3柱色谱法综合各方因素,经济,简便操作,易于获取等方面,考虑到实验无需过于精确,故此处采用第一种方法,以下是其详细说明:提取: (1) 取菠菜或其他植物新鲜叶片4-5片(2g左右),洗净,擦干,去掉中脉剪碎,放入研。
(2) 研钵中加入少量石英砂及碳酸钙粉,加2-3ml 95%乙醇,研磨至糊状,再加10-15ml 95%乙醇,离心35min,提取上清液过滤于三角瓶中,残渣用10ml 95%乙醇冲洗,一同过滤于三角瓶中。
(3) 如无新鲜叶片,也可用事先制好的叶干粉提取。
取新鲜叶片(以菠菜叶最好),先用105℃杀青,再在80℃下烘干,研成粉末,密闭储存。
用时称叶粉2g放入小烧杯中,加95%乙醇20-30ml 浸提,并随时搅动。
待乙醇呈深绿色时,滤出浸提液备用。
分离: (1) 取圆形定性滤纸一张(直径11cm),将其剪成滤纸条(9cm×3cm),用滴管吸取乙醇叶绿体色素提取液,沿纸条的长度方向涂在纸条的一边(距边约1cm),使色素扩散的宽度限制在0.5cm以内,风干后,再重复操作数次。
(2) 在层析缸中加入适量的推动剂,将滤纸条带有色素的一端插入层析缸中,使滤纸条下端浸入推动剂中。
迅速盖好层析缸盖。
此时,推动剂借毛细管引力顺滤纸条向上扩散,并把叶绿体色素向上推动,不久即可看到各种色素的条带。
(3) 当推动剂前沿接近滤纸边缘时,取出滤纸,风干,即可看到分离的各种色素:叶绿素a为蓝绿色,叶绿素b为黄绿色,叶黄素为鲜黄色,胡萝卜素为橙黄色。
用铅笔标出各种色素的位置和名称。
各种色素在层析液中的溶解度不同,溶解度高的随层析液在滤纸上扩散的快,反之则慢。
最快:胡萝卜素次之:叶黄素次之:叶绿素A 最慢:叶绿素B 最宽的是叶绿素A 最窄的是胡萝卜素胡萝卜素和叶绿素B最远叶绿素A和叶绿素B最近另外,绿叶中的色素中叶绿素含量约占3/4 类胡萝卜素含量约占1/4 光照中,红光有利于淀粉合成,蓝紫光有利于蛋白质的合成以下是实验改进方面要求:1 实验材料的改进:应根据不同地区不用气候选用不同叶片,但切记一点不用含蜡质叶片2:提取液的改进:丙酮易挥发且有毒,可选用无水乙醇替代3:层析液改进:一般教材给出两种配方:93号汽油或者20份石油醚+2份丙酮+1份苯,经研究发现以下四种方法较好:1:CCI4+少许NASO42: 95%酒精3:9份95%酒精+1份苯4: 20份汽油+2份丙酮+2份石油醚+1份苯此处有一疑问:研磨时加碳酸钙是为了保护叶绿素不分解即叶绿素分子骨架中镁离子不被有机酸给置换出来,此处为何又要除镁离子呢?诸位可好生想下!除叶绿素中镁离子的方法1:选取黄色的叶子,此类树叶缺镁离子,因为镁离子可从老叶自由移动至新叶,故老叶无,即无须耗费精力去除了2:加酸,使所捣碎研磨液中含镁络合物吡啶环中镁离子被氢离子取代,3:加醋酸铜,铜离子取代镁离子,同上方法3:叶子未捣碎前浸入硫酸铜溶液使其染为绿色,铜代叶绿素。
叶绿素提取实验步骤引言:叶绿素是一种广泛存在于植物、藻类和部分细菌中的绿色色素,具有光合作用的关键作用。
叶绿素的提取是研究光合作用和进行植物生物化学研究的基础实验之一。
本文将介绍叶绿素提取的实验步骤。
一、材料准备1. 鲜叶样品:从植物中选择新鲜、健康的叶片作为实验材料。
2. 丙酮、酒精和乙醚:用于叶绿素的溶剂。
3. 水浴锅和恒温器:用于控制溶剂的温度。
4. 研钵和研杵:用于研磨叶片。
5. 滤纸:用于过滤提取液。
二、叶片研磨1. 将新鲜的叶片取出,用清水洗净表面的尘土和杂质。
2. 将叶片剪碎或撕成小片,放入研钵中。
3. 用研杵将叶片研磨成细腻的绿色混合物。
三、叶绿素提取1. 将研磨后的叶片混合物转移到一个容器中。
2. 加入适量的丙酮,使其完全浸没叶片混合物。
3. 使用搅拌器或玻璃棒搅拌叶片混合物和丙酮,使其充分混合。
4. 将混合物放入水浴锅中,控制水浴锅的温度在60-70摄氏度之间,保持一定时间(一般为20-30分钟),以促进叶绿素的释放。
四、叶绿素溶解1. 将获得的叶绿素提取液放置在冰箱中冷却,使其保持低温。
2. 在低温下,加入少量的酒精,使叶绿素溶解。
3. 搅拌溶液,使叶绿素充分溶解。
五、叶绿素分离1. 将叶绿素溶液倒入一个漏斗中,放置在一个容器下。
2. 在漏斗中加入少量乙醚,与叶绿素溶液充分混合。
3. 静置一段时间,等待乙醚与叶绿素溶液分层。
4. 打开漏斗的龙头,将乙醚层取出,得到叶绿素。
六、过滤和保存1. 将提取的叶绿素溶液倒入一个干净的容器中。
2. 使用滤纸过滤溶液,去除其中的杂质。
3. 将滤液转移到一个干燥的玻璃瓶中,避免光照,可在冰箱中保存。
结论:通过上述步骤,我们成功地提取到了叶绿素。
叶绿素是一种重要的光合色素,具有广泛的应用价值。
在光合作用研究、植物生物化学研究和食品工业中都有重要的作用。
叶绿素提取实验为我们深入了解叶绿素的性质和功能提供了基础。
通过不断改进实验方法和技术手段,我们可以进一步提高叶绿素的提取效率和纯度,为相关领域的研究和应用提供更好的支持。
高中生物叶绿素的提取
高中生物叶绿素的提取主要涉及到以下几个步骤:
1. 将新鲜菠菜叶片洗净擦干,去掉叶柄及中间脉络,称取10克去掉中间脉络的叶片,剪碎置于研钵内,加入少许固体碳酸钠或碳酸钙和10毫升丙酮,迅速研磨成匀浆,再加15毫升丙酮充分研磨提取叶绿素。
2. 在玻璃漏斗底部垫一小团脱脂棉,将匀浆通过脱脂棉过滤到已装有15毫升石油醚的分液漏斗中,再用少量丙酮冲洗叶片残渣和研钵,合并滤液。
3. 沿分液漏斗的壁小心加入30毫升蒸馏水,轻轻转动加入4 -8毫升饱和氯化钠水溶液,静止几分钟待分层清楚后,弃去下面的丙酮一水层。
再加入30毫升蒸馏水,轻轻晃动分液漏斗,以洗去石油醚中残留的丙酮,弃去水层。
共洗两次。
将含色素的石油醚提取液放入具塞锥形瓶中,置暗处或用黑纸包好备用。
请注意,叶绿素的提取与分离需要一定的技巧和耐心,同时要注意实验安全。
建议在专业人员的指导下进行。
实验步骤:1.叶绿素的提取▲ 将新鲜菠菜(Spinacia)叶片洗净擦干,去叶柄及叶脉。
称取样品8g,剪碎置研钵内,加入8cm3 丙酮及少许固体碳酸钠,迅速研磨成匀浆;然后再加入20cm3 丙酮充分研磨。
▲ 在一玻璃漏斗底部垫一小团脱脂棉,将匀浆通过脱脂棉过滤至已装有20cm3 石油醚的分液漏斗中,再用少量的丙酮冲洗叶片残渣及研钵,合并滤液。
▲ 沿分液漏斗的壁小心加入40cm3 蒸镏水,轻轻摇动,使色素转移到上面的石油醚层静置数分钟,待分层清楚后弃去下面的丙酮一一水层。
如发生乳化现象可加入2-3cm3 饱和NaCl 溶液。
▲ 在分液漏中再加入40cm3 蒸镏水,轻轻摇动,以洗去石油醚中残留的丙酮,共洗两次。
然后将叶绿素的石油醚提取液放入具塞锥形瓶中,置暗处或用黑纸包好备用。
2.叶绿素理化性质的观察▲ 光对叶绿素的破坏作用分别在两支具塞试管中注入2cm3 叶绿素的石油醚提取液,盖紧塞子。
一支置暗处,一支置强光(如太阳光)下,2-3h 后,观察比较两者的变化差异,或在分光光度计的663nm 处图17.1 叶绿素分子式17.叶绿素的提取及理化性质的鉴定67比较二者的吸光度值的差异,将结果记录在实验报告中。
▲ 叶绿素的皂化反应在一支试管中先加入2cm3 叶绿素石油醚提取液,再加入2cm3 新配制的30%KOH-甲醇溶液,用力摇动混匀后静置,待分层清楚后观察各层的变化,将观察结果记录在实验报告中。
▲ 去镁叶绿素的形成在一支试管中加2cm3 叶绿素石油醚提取液,然后小心加入3cm3 6mol/dm3 HC1,摇动混匀后静置,待分层后观察各层的变化,记录观察结果。
▲ 铜的取代作用在一支试管中加入3cm3 叶绿素丙酮提取液,然后加入3cm3 6mol/dm3 HC1,摇匀后再加入一小块醋酸铜结晶,将试管在水溶中微微加热,观察溶液的颜色变化,记录观察结果。
▲ 叶绿素的荧光在一支试管中加入2cm3 叶绿素石油醚提取液,在与入射光(如窗口的自然光)相垂直的方向观察叶绿素荧光,记录观察结果。
提取叶绿素的实验原理
叶绿素的提取实验是一种常用的生物化学实验,它的实验原理如下:
1. 选择叶绿素丰富的植物材料,如菠菜、苔藓等。
这些植物中含有较高浓度的叶绿素,便于提取。
2. 将植物样品研磨成细碎的颗粒状,加入适量的提取液。
通常使用的提取液是无水乙醇或丙酮等有机溶剂,这些溶剂能够溶解叶绿素。
3. 将样品与提取液混合均匀,可以使用研钵和研钉搅拌,也可以使用搅拌器。
4. 将混合物放入冰箱中冷藏,使其在低温下浸泡一段时间。
这一步是为了提高叶绿素的溶解度。
5. 使用离心机将混合物离心,将溶液与固体分离。
6. 取出上清液或溶液,在低温下用试管或容器保存。
此时溶液中含有叶绿素。
7. 准备合适的小瓶或试管,将溶液转移到小瓶中。
可使用滤纸过滤溶液,去除其中的杂质。
8. 使用紫外-可见光谱仪或色度计等测量设备,测定提取液中叶绿素的吸光度。
叶绿素在紫外-可见光谱范围内有较强的吸光性,可通过吸光度测量来定量叶绿素的含量。
叶绿素的提取实验通过以上原理,能够有效地将叶绿素从植物材料中分离出来,并用于后续的研究和分析。
叶绿素的提取方法
叶绿素提取的准备工作是在一个半暗的房间里,室温保持在25℃。
提取步骤如下:
20℃)进行萃取,直到过滤、清洗后的叶子碎片为无色。
的大部分丙酮和水溶杂质被丢弃,只剩石油醚溶液。
(4)将石油醚溶液用蒸馏水再次净化后,用含有石油醚和0.01克
草酸的200ml80%的甲醇溶液清洗5次以上,最后得到黄绿色悬浮液。
(5)用无水硫酸钠对悬浮液进行干燥,并将其渗入到3cm厚的蔗
糖粉末制成柱中,然后用石油醚清洗沉淀的色素去掉类胡萝卜素,使之只含有天然的叶绿素。
(6)含有天然叶绿素的蔗糖柱分两层,绿层有4-10mm的叶绿素b
层,另一蓝层为2-6mm的叶绿素a层。
(7)将位于蓝层正中的部分(约占蓝层的一半) 放入醚中,对此悬
浮液进行过滤、洗提,用蒸馏水清洗,用硫酸钠干燥,再用器皿进行过滤后,得到叶绿素a。
(8)将(6)中的绿层中间部分移出,迅速放入醚中过滤、洗提,制
成叶绿素b醚溶液。
提取叶绿素实验原理
叶绿素是一种存在于植物和一些浮游植物体内的绿色色素,它具有很强的吸收、传递和转化光能的能力。
提取叶绿素的实验原理是基于叶绿素在有机溶剂中的溶解性。
下面是提取叶绿素的实验步骤:
1. 取新鲜的植物叶片,洗净后切碎成小段。
2. 取一定量的叶片放入研钵中,加入少量乙醇溶液,用玻璃杆将叶片压破,使其细胞内的叶绿素溶解在乙醇中。
3. 将研钵中的混合溶液过滤,得到含有叶绿素的乙醇溶液。
4. 将乙醇溶液转移至离心管中,进行离心分离,使得叶绿素沉淀在离心管底部。
5. 倒掉上清液,加入一定量的乙醇,将叶绿素沉淀重新悬浮。
6. 反复洗涤叶绿素沉淀,直至洗涤液完全清晰,去除其他杂质。
7. 最后,将叶绿素沉淀溶解在乙醇中,即可得到纯净的叶绿素提取液。
通过这个实验原理,我们可以从植物叶片中提取出纯净的叶绿素,从而用于后续的分析研究。