物理化学实验——表面张力
- 格式:ppt
- 大小:1.52 MB
- 文档页数:13

实验三十二 液体表面张力的测定一、实验目的1. 测定不同浓度的乙醇水溶液的表面张力,计算表面吸附量和乙醇分子的横载面积。
2. 了解表面张力的性质及表面张力和表面吸附量的关系3. 掌握最大泡压法测定溶液表面张力和表面吸附量的原理和技术。
二、原理液相与气相之间的界面层可看作是介乎液体与气体性质的第三相。
界面层分子受液体内部分子的吸引力远大于外部蒸气分子对它的吸引力,致使表面层分子受到向内的拉力使表面积趋于最小(球形),以达到受力平衡。
揭示表面层这一特征的方法很多, 最常用的为表面张力(surface tension, 用γ表示),或可定义为单位表面吉布斯自由能(surface Gibbs free energy ,用G ∆表示)。
液体的表面张力与温度、纯度等因素有关。
温度愈高,表面张力愈小;纯度发生变化时,表面张力也相应发生变化,其变化的大小决定于溶质的本性和加入量的多少。
根据能量最低原理,若溶液质能降低溶剂的表面张力,则表面层溶质的浓度应比溶液内部的浓度大;如果所加溶质能使溶剂的表面张力增加,那么,表面层溶液质的浓度应比内部低,这种现象为溶液的表面吸附,用吉布斯(Gibbs)公式表示:P T CRT C ,)(∂∂-=Γγ 式中,Γ为表面吸附量(mol ⋅m -2);γ为表面张力(J ⋅m -2);T 为绝对温度(K);C 为溶液浓度(mol ⋅L -1);P T C ,)(∂∂γ 表示在一定温度下表面张力随浓度的变化率。
P T C,)(∂∂γ<0,Γ>0,溶质能增加溶剂的表面张力,溶液表面层的浓度大于内部的浓度,称为正吸附作用。
P T C,)(∂∂γ>0,Γ<0,溶质能增加溶剂的表面张力,溶液表面层的 浓度小于内部的浓度,称为负吸附作用。
可见,通过测定溶液的浓度随表面张力的变化关系可以求得不同浓度下溶液的表面吸附量。
吸附量与浓度之间的关系可以用Langmuir 等温吸附方程式表示:KCKC+Γ=Γ∞1式中,Γ表示吸附量,通常指单位质量吸附剂上吸附溶质的摩尔数;∞Γ表示饱和吸附量;C 表示吸附平衡时溶液的浓度;K 为常数。
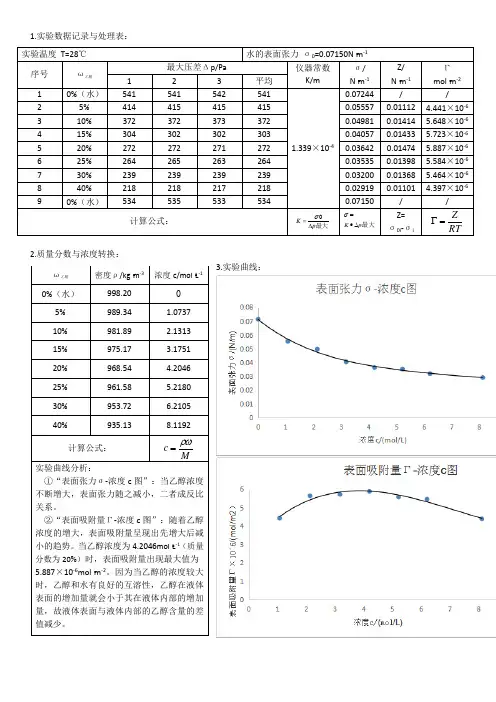
1.实验数据记录与处理表:2.质量分数与浓度转换:3.实验曲线:实验温度 T=28℃ 水的表面张力 σ0=0.07150N ▪m -1序号 ω乙醇 最大压差Δp/Pa仪器常数K/mσ/ N ▪m -1 Z/ N ▪m -1 Γmol ▪m -2 1 2 3 平均 1 0%(水) 541 541 542 541 1.339×10-40.07244 //2 5% 414 415 415 415 0.05557 0.01112 4.441×10-63 10% 372 372 373 372 0.04981 0.01414 5.648×10-6 4 15% 304 302 302 303 0.040570.01433 5.723×10-6 5 20% 272 272 271 272 0.03642 0.014745.887×10-66 25% 264 265 263 264 0.03535 0.01398 5.584×10-67 30% 239 239 239 239 0.03200 0.01368 5.464×10-6 8 40% 218 218 217 218 0.02919 0.01101 4.397×10-6 90%(水)5345355335340.07150/ /计算公式:最大p K ∆=σ最大p K ∆•=σZ= σ0i -σiRTZ=Γ ω乙醇 密度ρ/kg ▪m -3浓度c/mol ▪L -10%(水) 998.20 05% 989.34 1.0737 10% 981.89 2.1313 15% 975.17 3.1751 20% 968.54 4.2046 25% 961.58 5.2180 30% 953.72 6.2105 40%935.138.1192计算公式:Mc ρω=实验曲线分析:①“表面张力σ-浓度c 图”:当乙醇浓度不断增大,表面张力随之减小,二者成反比关系。

流体的表面张力和毛细现象流体的表面张力和毛细现象是液体力学中重要的概念,它们对于理解和解释许多自然现象和工程应用具有重要意义。
本文将围绕流体的表面张力和毛细现象展开讨论,并探索其背后的物理原理和实际应用。
一、表面张力的概念及原理表面张力是指液体表面处分子间存在的相互作用力所表现出来的力。
液体分子之间存在吸引力,使得液体表面处的分子相对于内部的分子所受到一个净向内的作用力,导致液体表面呈现出类似于弹性膜的性质,这就是表面张力。
表面张力的强度决定了液体表面的特性,对于液体的凝聚性、润湿性以及与固体的相互作用有重要影响。
表面张力可通过实验测量得到,常用的实验方法包括测量液体在浮体上的起伏高度、测量液体的静水压强以及测量液滴的形态等。
表面张力的数值通常用单位长度的力来表示,国际单位制中以N/m表示。
二、毛细现象的定义及原理毛细现象是指液体在细小的毛细管内上升或下降的现象。
当液体与毛细管接触时,由于液体与固体间的相互作用力,液体在毛细管中会产生一定的上升或下降效应,这就是毛细现象。
毛细现象广泛存在于自然界和工业应用中,如植物的输水现象、药丸溶解以及吸管吸水等。
毛细现象的产生与表面张力密切相关。
当液体进入细小的毛细管内时,其表面张力会对液体产生一个向内的作用力,导致液面在毛细管内呈现弯曲或上升的形态,直至与液体内部的重力产生平衡。
毛细现象符合普通的液体静力学原理,可以通过毛细管的直径、液体的性质以及环境条件等因素来调控。
三、流体表面张力和毛细现象的应用流体的表面张力和毛细现象在许多实际应用中有着重要的作用。
下面将介绍一些相关的应用。
1. 毛细管现象在植物中的输水过程中起着重要作用。
植物通过根部吸水,利用毛细管现象将水分输送到树叶,并通过蒸腾作用将水分蒸发到空气中。
2. 在医药领域,毛细现象被用来研究药物的溶解速率和释放速度,通过控制毛细管的直径和液体的性质,可以调控药物的释放速度,从而实现针对性的治疗效果。


液体表面张力系数的测定实验报告一、实验目的。
本实验旨在通过测定液体表面张力系数的实验,掌握液体表面张力系数的测定方法,加深对表面张力的理解,提高实验操作能力。
二、实验原理。
液体表面张力系数是表征液体分子间相互作用力的物理量,通常用$\gamma$表示。
液体表面张力系数的测定方法有很多种,常用的有悬铁环法、悬滴法、悬水滴法等。
本实验采用悬水滴法测定液体表面张力系数。
三、实验仪器和试剂。
1. 一台天平。
2. 一根细丝。
3. 一根细管。
4. 一根毛细管。
5. 一根水平的细管。
6. 一些水。
四、实验步骤。
1. 将一根细丝固定在天平上,使其水平。
2. 用细管将水滴在细丝上,形成一个悬水滴。
3. 用毛细管在悬水滴下方加入一些水,使悬水滴增大,直到悬水滴脱落。
4. 测量水滴的质量$m$,并记录下悬水滴的直径$d$。
五、实验数据处理。
根据实验数据,可以计算出液体表面张力系数$\gamma$的值。
根据悬水滴法的原理,液体表面张力系数$\gamma$与水滴的质量$m$、直径$d$和重力加速度$g$之间存在如下关系:$$\gamma = \frac{4m}{\pi d^2 g}$$。
六、实验结果与分析。
根据实验数据和计算公式,可以得到液体表面张力系数$\gamma$的数值。
通过对实验数据的分析,可以发现液体表面张力系数与水滴质量和直径呈反比关系,与重力加速度呈正比关系。
这与表面张力的性质相符合。
七、实验结论。
通过本实验的实验操作和数据处理,成功测定了液体表面张力系数$\gamma$的数值。
实验结果与理论预期相符,验证了悬水滴法测定液体表面张力系数的可行性。
八、实验中的注意事项。
1. 实验操作要细致,保证悬水滴的稳定性。
2. 测量数据要准确,避免误差的产生。
3. 实验结束后要及时清理实验仪器和试剂。
九、参考文献。
1. 《物理化学实验》。
2. 《实验化学》。
十、致谢。
感谢实验指导老师的悉心指导和同学们的配合,使本次实验取得了圆满成功。

物理化学中的表面张力研究表面张力是物理化学领域的一个重要概念,它是一个液体分子团在气液或液液界面上所表现的一种自发性的性质,可以用来描述液体表面分子间的相互作用力。
表面张力的研究对于许多实际应用具有重要意义,如液滴形态稳定性、液滴合并和分裂、泡沫的稳定性、液体扩展和吸附的特性等等。
表面张力是很多物理和化学现象的基础。
它是由于液体表面上的分子间相互作用力的不平衡所产生的。
表面张力是液体表面分子的内聚力和对外作用力之间的平衡状态。
在纯水表面,由于水分子间的氢键作用力,表面上的水分子会紧密地排列在一起形成一层水膜。
这层水膜对周围环境有一定的张力,使水膜尽量缩小表面面积。
在液体表面任何液体分子,都会被表面上的液体分子吸引,从而形成一层分子膜,这个膜就是所说的表面张力,它的大小决定了液体表面的稳定性。
表面张力可以通过各种方法测量,其中最常用的方法是用自由垂直管法。
自由垂直管法是通过铂铱制成的一根带有三段毛细管的管子,在管子一端开口的位置带有底部宽口和内胆,内部充满液体。
在测量前,将整个测量系统洗净并填充液体,并且使管子与水平面垂直,底部宽口的液面要比管子的液面高约10毫米。
这样,水的表面张力和毛细管相互平衡,从而可以得到水的表面张力值。
表面张力在科学研究和工业生产中都具有重要的应用。
在科学研究方面,比如微流控液滴的生成和控制及液滴的稳定性研究中,表面张力是非常重要的因素。
在工业生产中,液体表面张力也发挥着巨大的作用。
一些化学工程和物理学工程中液体界面的应用都离不开对表面张力的研究,如喷雾器、泡沫剂、泡沫塑料等。
总之,表面张力是物理化学领域中一个非常重要的概念,不仅在学术和工业研究中起着重要的作用,也有着广泛的实际应用。
它的研究不仅有助于深入理解物理化学领域的一些基本现象,同时也为新产品开发和技术改良提供了重要的基础理论。


表面张力系数的测定实验报告实验目的,通过实验测定不同液体的表面张力系数,探究不同因素对表面张力系数的影响。
实验仪器和试剂,蒸馏水、乙醇、甘油、二极管、平衡臂、悬线秤、毛细管、滴管、比色皿、烧杯、试管。
实验原理,表面张力系数是液体分子间相互作用力和表面分子受到的引力共同作用的结果,可用下式表示,γ = F/2L。
实验步骤:1. 实验前准备,将实验器材清洗干净,准备好所需试剂。
2. 实验一,测定蒸馏水的表面张力系数。
a. 取一根毛细管,将其两端用火烧热,使其两端成圆形。
b. 将烧杯中注满蒸馏水,将毛细管的一端插入水中,使水面刚好与毛细管齐平。
c. 用滴管往毛细管中滴水,记录下水面的升高高度h。
d. 重复实验三次,取平均值计算表面张力系数γ。
3. 实验二,测定乙醇的表面张力系数。
a. 重复实验一的步骤,将烧杯中注满乙醇,进行毛细管法实验。
b. 记录下水面的升高高度h,计算表面张力系数γ。
4. 实验三,测定甘油的表面张力系数。
a. 重复实验一的步骤,将烧杯中注满甘油,进行毛细管法实验。
b. 记录下水面的升高高度h,计算表面张力系数γ。
实验结果与分析:实验一,蒸馏水的表面张力系数为γ1 = 0.072 N/m。
实验二,乙醇的表面张力系数为γ2 = 0.022 N/m。
实验三,甘油的表面张力系数为γ3 = 0.063 N/m。
通过实验数据可知,不同液体的表面张力系数存在差异。
蒸馏水的表面张力系数最大,乙醇的表面张力系数最小,而甘油的表面张力系数居中。
这与液体分子间的相互作用力有关,分子间作用力越大,表面张力系数越大。
实验结论,不同液体的表面张力系数受到分子间相互作用力的影响,实验结果符合理论预期。
表面张力系数的测定对于液体的性质研究具有重要意义,也为液体表面现象的研究提供了实验依据。
实验注意事项:1. 实验中要小心操作,避免毛细管破裂或试剂溅出。
2. 实验数据要准确记录,避免误差的出现。
3. 实验后要及时清洗实验器材,保持实验环境整洁。

最大气泡压力法测定溶液的表面张力实验报告最大气泡压力法测定溶液的表面张力实验报告引言:表面张力是液体分子间相互作用力所导致的现象,它对于液体的性质和行为具有重要影响。
本实验采用最大气泡压力法来测定溶液的表面张力,通过实验数据的分析,探究不同溶液浓度对表面张力的影响。
实验目的:1. 了解表面张力的概念和测定方法;2. 掌握最大气泡压力法测定溶液表面张力的实验操作;3. 分析不同溶液浓度对表面张力的影响。
实验原理:最大气泡压力法是一种常用的测定溶液表面张力的方法。
实验中,将一根细玻璃管插入液面,通过调节压力差,使气泡从玻璃管中产生并脱离液面,此时气泡的半径与液体表面张力成正比。
通过测量气泡的半径和液体的密度,可以计算出溶液的表面张力。
实验步骤:1. 准备实验所需材料和仪器,包括细玻璃管、溶液、压力计等;2. 将细玻璃管插入液面,调节压力差,使气泡从玻璃管中产生并脱离液面;3. 测量气泡的半径和液体的密度;4. 计算溶液的表面张力。
实验结果与分析:根据实验数据计算得到不同溶液浓度的表面张力值,并进行比较分析。
实验结果显示,随着溶液浓度的增加,表面张力呈现下降的趋势。
这是因为溶液浓度的增加会导致溶质分子在液体表面的分布增多,从而减弱液体分子间的相互作用力,进而降低表面张力。
实验误差分析:在实验过程中,由于操作技巧和仪器精度等因素的影响,可能会产生一定的误差。
例如,测量气泡半径时,由于气泡形状的不规则性,可能会导致测量结果的误差。
此外,实验中还需要考虑环境因素对实验结果的影响,如温度、湿度等。
实验改进:为减小实验误差,可以采取以下改进措施:1. 提高操作技巧,尽量保持气泡形状的规则性;2. 使用更精确的仪器和测量方法,如使用显微镜观察气泡形状,使用更精确的测量仪器测量气泡半径;3. 控制实验环境的温度和湿度,避免外界因素对实验结果的干扰。
结论:通过最大气泡压力法测定溶液的表面张力,我们得出了不同溶液浓度对表面张力的影响。

表面张力实验报告表面张力是液体中分子间相互作用力的一种体现,是液体与外界之间的一种现象。
本实验主要通过测量液体中的表面张力来对其进行研究。
实验方法:1. 实验仪器与材料- 表面张力测量仪器:包括腊固定架、测力计、外围配件等。
- 实验液体:可以选择水、酒精等。
2. 实验步骤- 准备工作:搭建表面张力测量仪器,确保测力计的水平。
- 设置初始读数:将测力计调零,使读数为零。
- 测量撤离力:将测力计固定在架子上,将液体样品注入平台上的圆形竖直槽内,使一部分液体的表面与圆形槽底形成相等的两个半圆,读取测力计上的力的读数,这个力即为撤离力。
- 测量粘附力:将一个小片玻璃板轻轻压在液体表面上,然后以与表面垂直的方向慢慢将其抬离液体表面,当液体跟着板子一同离开液面时,停止抬离,这时读取测力计上的力的读数,这个力即为粘附力。
3. 数据处理与分析- 计算表面张力:表面张力的计算公式为 T = (P1 - P2) / 2πR ,其中P1为半圆面上的力,P2为板离开液体的力,R为半圆半径。
- 比较不同液体的表面张力:可以选择不同液体进行实验,并进行比较分析,找出液体表面张力的规律。
实验结果与讨论:根据实验测得的数据,可以进行表面张力的计算与比较。
比较不同液体的表面张力,可以得出一些结论与讨论,如:- 一般情况下,有机溶剂的表面张力要小于水。
- 随着温度的升高,液体的表面张力会下降。
- 表面张力与液体的种类、纯度、温度有关。
实验结论:通过本实验,我们验证了液体的表面张力存在并且能够通过实验测量得到。
不同液体的表面张力存在一定差异,并且液体的表面张力与温度有关。
此外,实验结果还表明,在撤离力和粘附力方面,水的表面张力较大,而有机溶剂的表面张力相对较小。
参考文献:1. 《物理化学实验》,祝万福,高等教育出版社,2004年。
2. 《表面张力实验报告范文》, 李晓华,教育科技信息,2017年。
3. 《表面张力实验研究》,陈红波,化学通报,2010年第9期。
物理化学实验报告学号: 姓名: 班级:表面张力的测定--最大气泡法平均室温:10.9 ℃ 平均气压:98.81Kpa 同组人 日期 一、实验目的1、掌握最大气泡法测定表面张力的原理和技术。
2、通过对不同浓度正丁醇溶液表面张力的测定,加深对表面张力、表面自由能和表面吸附量关系的理解。
3、了解弯曲液面下产生附加压力的本质,熟悉拉普拉斯方程,吉布斯吸附等温式,了解兰格 缪尔单分子层吸附公式的应用。
4、测定不同浓度正丁醇溶液的表面张力,计算饱和吸附量, 由表面张力的实验数据求正丁醇分子的截面积及吸附层的厚度。
二、实验原理1、表面张力的产生纯液体和其蒸气组成的体系体相分子:自由移动不消耗功。
表面分子:液体有自动收缩表面而呈球形的趋势。
要使液体表面积增大就必须要反抗分子的内向力而作功以增加分子位能。
这位能就是表面自由能。
W =A σ-∆如果ΔA 为1m 2,则-W ′=σ是在恒温恒压下形成1m 2新表面所需的可逆功,所以σ称为比表面吉布斯自由能,其单位为J·m -2。
也可将σ看作为作用在界面上每单位长度边缘上的力,称为表面张力,其单位是N·m -1。
液体单位表面的表面能和它的表面张力在数值上是相等的。
2、附加压力与表面张力将待测表面张力的液体装于表面张力仪中,使毛细管的端面与液面相切,由于毛细现象液面即沿毛细管上升,打开抽气瓶的活塞缓缓抽气,系统减压,毛细管内液面上受到一个比表面张力仪瓶中液面上(即系统)大的压力,当此压力差——附加压力(Δp = p 大气 - p 系统) 在毛细管端面上产生的作用力稍大于毛细管口液体的表面张力时,气泡就从毛细管口脱出,此附加压力与表面张力成正比,与气泡的曲率半径成反比,其关系式为拉普拉斯公式:ΔP=2σ/ R3、溶液中的表面吸附-吸附现象的发生当加入某种溶质形成溶液时,表面张力发生变化。
把溶质在表面层中与本体溶液中浓度不同的现象叫做溶液的表面吸附。
遵守吉布斯(Gibbs)吸附方程:TC d = -RT dCσΓ() 式中,Г为表层吸附量(mol.m -2);σ为表面张力; 4、吸附量的计算以表面张力对浓度作图,可得到σ-C 曲线。
物理化学中的表面张力理论及实验在物理化学中,表面张力是一个非常重要的概念。
它描述的是液体表面各点之间存在的纵向相互作用力,也就是液体表面对外施加的垂直于表面的张力。
表面张力在很多领域中都是一个至关重要的参数,如液体的流动规律、波浪的传播、泡沫的形成、涂料的涂布等,因此综合实验和理论基础研究表面张力十分必要。
表面张力的理论计算主要基于两个因素,一是表面分子数密度,二是表面分子间相互作用力。
一般理论推导时会假设表面分子和体内分子的性质相同,从而可以得到表面张力与分子形状、大小和可替代性等有关的重要理论公式。
其中最著名的就是杨-拉普拉斯方程,它是计算液体表面张力的一个重要理论公式,它描述了一个圆形液滴表面张力与液滴半径和液体和外界介质之间的表面张力和体积张力之间的关系。
实验上,表面张力是通过测量附着于平衡液体表面的一个小物体(如金属环)所受到的引力来测量的。
由此可以求出表面张力。
把表面活性剂分子引入液面会改变其表面张力,对其进行定量测定即可确定其表面活性剂浓度。
表面张力的实验应用十分广泛。
例如,在制药工业中,通过测量药物的表面张力可以确定药物分子在肺部的吸附能力,从而确定药物的最佳给药方式和剂量。
在油漆和涂料工业中,了解涂层表面张力的变化可以确定涂层的与基材的附着性能。
在生物学领域中,通过测量细胞膜的表面张力可以研究细胞接触和交互行为,了解细胞机制。
表面张力的研究也有很多挑战。
例如,表面张力在不同形态、不同化学组成的液体中的变化情况,以及在液体中添加表面活性剂或其他添加剂后表面张力的变化。
这些都需要涉及到比较繁琐的理论推导和实验测量。
同时,表面张力的实验测量可能还会受到环境因素的影响,自然条件和测量方法误差等。
总之,表面张力理论和实验研究仍然是化学、生物学等领域的一个重要研究领域。
深入研究表面张力的基本特性和变化规律,可以为液体流动规律、波浪的传播、涂料的涂布技术等各领域的发展提供更加深入的理论和实验基础。
表面张力与液滴形状的物理化学解析液体是一种流动的物质,分子之间存在着各种相互作用力。
其中,表面张力是液体表面的一种特殊力量,它决定了液体的形状和表面性质。
本文将通过物理化学的角度解析表面张力与液滴形状之间的关系。
一、表面张力的基本概念表面张力是指液体表面上的分子与内部分子相互作用形成的一种力。
表面张力使液体表面呈现出一种类似于弹性膜的特性,使得液体表面有一定的弹性和紧绷度。
正是由于表面张力的存在,液体在开放的容器中会呈现圆形或近似圆形的形状,因为这种形状可以最大程度地减少液体与外界的接触面积,从而降低了表面自由能。
二、表面张力的原因表面张力的产生主要与分子之间的相互作用力有关。
在液体的内部,分子之间会产生各种各样的引力,使得液体能够保持相对稳定的形状。
然而,液体表面上的分子由于没有相同种类的分子在上方,所以受到的引力会与内部相互作用力不同。
这种不同的相互作用力导致了表面张力的产生。
三、表面张力与液滴形状的关系表面张力对液滴形状的影响主要体现在两个方面:液滴的几何形状和液滴的稳定性。
1. 液滴的几何形状液滴的几何形状主要由表面张力和重力共同作用决定。
当液滴的体积较小时,表面张力可以抵消重力的作用,使得液滴呈现出球形的形状。
这是因为球形的液滴可以最大程度地减小表面积,从而降低表面自由能。
一旦液滴的体积增大,重力将逐渐占主导地位,使液滴变形成扁平的形状。
2. 液滴的稳定性表面张力对液滴的稳定性也有重要影响。
在液滴的表面上,表面张力形成了一个薄膜,使得液滴内部的液体趋向于减小表面积。
这种趋向使得液滴能够尽可能地保持不变形,从而保持稳定。
当液滴内部的液体受到外力的扰动时,表面张力将使得液滴能够迅速回复原状,保持形状的稳定性。
四、液滴变形与表面张力的关系液滴的形状在很多实际应用中都是非球形的,如液滴在固体表面上展开的形态、液滴在液体中的形态等。
这些非球形的液滴形状变化是由于表面张力的不均匀分布所引起的。
当液滴接触到异相界面(如固体表面或液体表面)时,液滴表面上的分子与异相界面的分子之间会发生相互作用。
水的表面张力实验报告水的表面张力实验报告引言:水是地球上最常见的物质之一,也是生命存在的基础。
然而,水的性质却是非常复杂的,其中之一就是水的表面张力。
本实验旨在研究水的表面张力以及探究其产生的原因。
实验材料和方法:材料:水、各种不同形状的物体(如硬币、针、塑料片等)方法:1. 准备一个小容器,注入适量的水。
2. 将不同形状的物体轻轻放在水的表面,观察其现象。
3. 观察物体在水面上的浮沉情况。
4. 重复以上步骤,记录观察结果。
实验结果:通过实验观察,我们发现以下几个现象:1. 不同形状的物体放在水面上,可以浮在水面上。
2. 物体在水面上会出现一层凹陷的水面,形成类似于水膜的现象。
3. 当物体被轻轻放在水面上时,水面会稍微凹陷,形成一个小坑。
实验讨论:水的表面张力是由于水分子之间的相互作用力导致的。
水分子由一个氧原子和两个氢原子组成,氧原子与氢原子之间通过共价键相连。
在水中,氢原子的部分正电荷与氧原子的部分负电荷形成静电作用力,这种作用力被称为氢键。
氢键使得水分子之间产生一种相互吸引的力量,这就是水的表面张力的来源。
在实验中,我们观察到不同形状的物体可以浮在水面上。
这是因为水的表面张力使得水分子在水面上形成了一层类似于薄膜的结构。
当物体放在水面上时,它会与水分子之间的相互作用力相抵消,从而使物体能够浮在水面上。
这也解释了为什么一些轻盈的昆虫能够在水面上行走。
另外,我们还观察到当物体被轻轻放在水面上时,水面会稍微凹陷。
这是因为物体的重力作用使得水面发生了变形,形成了一个小坑。
这种现象与水的表面张力有关,因为水的表面张力越大,水面受到的变形越小。
实验总结:通过本次实验,我们深入了解了水的表面张力的性质以及产生的原因。
水的表面张力是由水分子之间的相互作用力所导致的,这种力量使得水分子在水面上形成了一层类似于薄膜的结构。
这一性质使得水能够支撑一些轻盈的物体浮在水面上。
同时,水的表面张力也与物体在水面上的浮沉情况有关,表面张力越大,水面受到的变形越小。