氨气的性质表
- 格式:docx
- 大小:21.90 KB
- 文档页数:2

化学式NH3
1、物理性质
相对分子质量17.031
氨气在标准状况下的密度为0.7081g/L
氨气极易溶于水,溶解度1:700
有刺激性气味
2、化学性质
(1)跟水反应
氨溶于水时,氨分子跟水分子通过*氢键结合成一水合氨
(NH3•H2O),一水合氨能小部分电离成铵离子和氢氧根离子,所以氨水显弱碱性,能使酚酞溶液变红色。
氨在水中的反应可表示为:
一水合氨不稳定受热分解生成氨和水
氨水中存在三分子、三离子、三平衡
分子:NH3、NH3•H2O、H2O;
离子:NH4+、OH-、H+;
三平衡:NH3+H2O NH3•H2O NH4++OH-
H2O H++OH-
氨水在中学化学实验中三应用
①用蘸有浓氨水的玻璃棒检验HCl等气体的存在;②实验室用它与铝盐溶液反应制氢氧化铝;③配制银氨溶液检验有机物分子中醛基的存在。
(2)跟酸反应
2NH3+H2SO4===(NH4)2SO4
3NH3+H3PO4===(NH4)3PO4
NH3+CO2+H2O===NH4HCO3
(反应实质是氨分子中氮原子的孤对电子跟溶液里具有空轨道的氢离子通过配位键而结合成离子晶体。
若在水溶液中反应,离子方程式为:
8NH3+3Cl2===N2+6NH4Cl
(黄绿色褪去,产生白烟)
反应实质:2NH3+3Cl2===N2+6HCl
NH3+HCl===NH4Cl
总反应式:8NH3+3Cl2===N2+6NH4Cl。
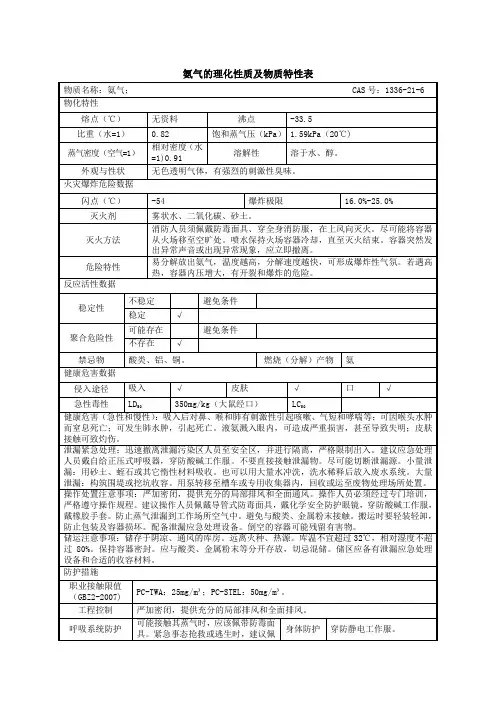
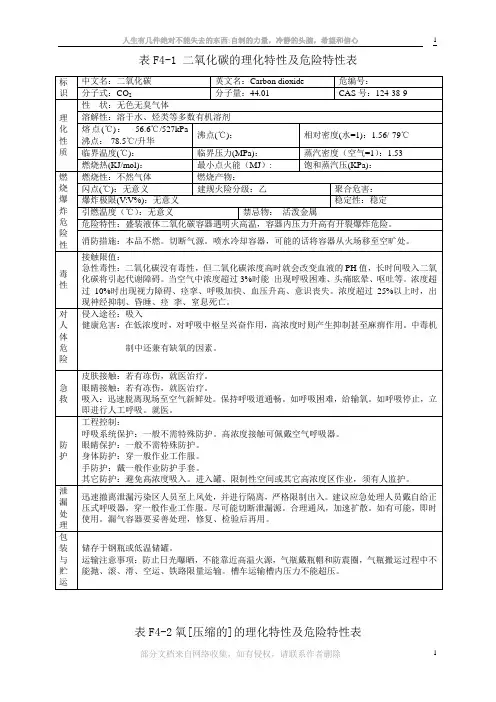

表- 氨气的理化性质及危险特性表 - 氨气的理化性质及危险特性
该表列出了氨气的一些重要理化性质以及其危险特性。
氨气(NH3)是一种无色气体,具有强烈刺激性气味。
它在常温下呈液态,沸点为-33.34°C。
氨气可溶于水,与水反应形成氢氧化铵。
它
是非可燃物质,在火焰存在下能生成有毒气体。
高浓度氨气可以导
致窒息和窒息。
此外,氨气还对皮肤、眼睛和呼吸道有强烈刺激性。
请注意,由于氨气的危险性,使用和处理时应遵循相关安全规
定和操作指南,以确保人身安全和环境保护。


氨气化学性质氨气化学性质是指氨气在不同条件下的化学反应性质。
作为一种重要的化学物质,氨气在各个领域都有广泛应用,如农业、化工、医药等。
本文将重点介绍氨气的化学性质及其相关反应。
一、氨气的性质概述氨气分子式为NH3,是一种无色气体。
在常温常压下,它有着强烈的刺激性气味,容易使人窒息,具有较强的剧毒性。
另外,氨气也是一种比较强的碱性物质,它可以与酸反应生成盐和水。
二、氨气的化学性质1.氨气与酸的反应氨气是一种碱性物质,在与酸发生反应时会中和酸的酸性。
以盐酸为例,氨气与盐酸反应生成氯化铵,反应方程式为:NH3 + HCl → NH4Cl2.氨气与金属离子的反应氨气与金属离子发生反应时,能够形成相应的配合物。
在这些配合物中,氨分子作为配体与金属原子形成配合物。
以Cu2+为例,氨气与Cu2+反应生成[Cu(NH3)4]2+配合物,反应方程式为:Cu2+ + 4NH3 → [Cu(NH3)4]2+3.氨气与酰氯的反应氨气与酰氯在适当条件下发生反应时,可以生成相应的酰胺。
以乙酰氯为例,氨气和乙酰氯反应生成乙酰胺,反应方程式为:NH3 + CH3COCl → CH3CONH2 + HCl4.氨气与羧酸的反应卡巴瓦日反应(Carbamide Reaction)即为羧酸与氨气在高温高压下发生结合和解离互相转化的反应,其反应产物为尿素和水。
反应方程式如下:2NH3 + CO2 -> NH2COONH4NH2COONH4 -> CO(NH2)2 + H2O羧酸与氨气的反应除了形成尿素之外,还会生成相应的氨基酸和脲酶等化合物。
5.氨气的氧化反应在氧气或臭氧存在的条件下,氨气能够进行氧化反应。
以氧气为例,氨气与氧气反应生成氮氧化物和水,反应方程式为:4NH3 + 5O2 → 4NO + 6H2O在空气中,氨气也能够进行慢速氧化反应,生成氧化氮和水,反应方程式为:4NH3 + 5O2 → 4NO + 6H2O6.氨气的还原反应氨气在适当条件下也可以发生还原反应。


氨气物理性质作用
氨气是一种有刺激性气味的气体,对人体的眼、鼻、喉等有刺激作用。
如果不慎接触过多的氨气而出现病症,要及时吸入新鲜空气和水蒸气,并用大量水冲洗眼睛。
氨气很容易液化,在常压下冷却至-33.5℃或在常温下加压至700KPa至800KPa,气态氨就液化成无色液体,同时放出大量的热。
液态氨汽化时要吸收大量的热,使周围物质的温度急剧下降,所以氨常作为制冷剂。
氨气极易溶于水,在常温、常压下,1体积水能溶解约700体积的氨气。
氨气的主要用途包括NH用于制氨水、液氨、氮肥(尿素、碳铵等)、HNO、铵盐、纯碱,广泛应用于化工、轻工、化肥、制药、合成纤维、塑料、染料、制冷剂等,是近现代化工的基础原料。
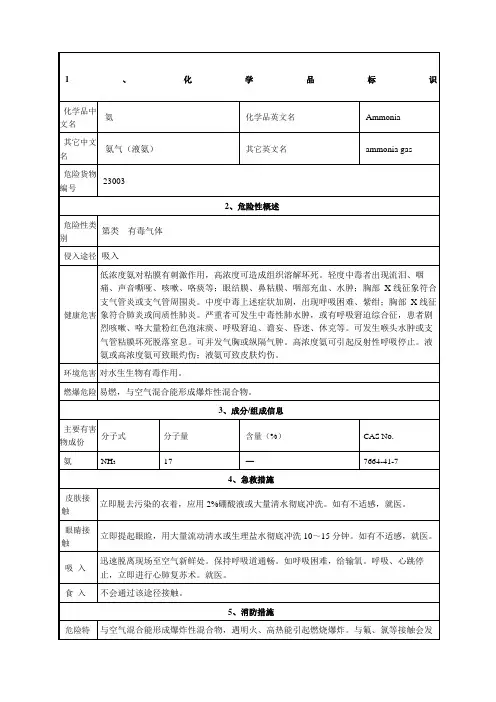

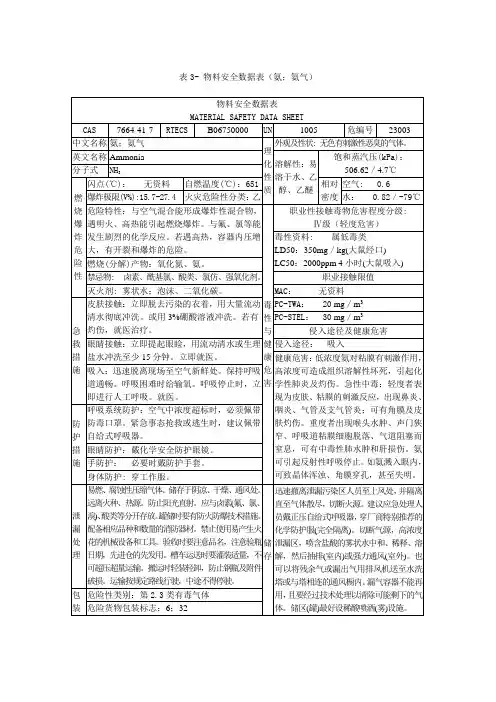
氨的理化性质、危害及应急处理知识1. 氨的理化性质和用途:分子式 NH3有毒气体沸点(℃) -33.5 易溶于水、乙醇、乙醚无色有刺激性恶臭的气体。
主要用途用做制冷剂及制取铵盐和氮肥。
储于耐压钢瓶或钢槽中由气态氨液化而得。
2. 燃烧爆炸特性:易燃、爆炸下限(%)15.7 爆炸上限(%)27.4 ,与空气混合能形成爆炸性混合物。
遇明火、高热能引起燃烧爆炸。
与氟、氯等接触会发生剧烈反应。
若遇高热,容器内压增大,有开裂和爆炸的危险。
3. 灭火方法:必须穿戴全身防火防毒服。
切断气源。
若不能立即切断气源,则不允许熄灭正在燃烧的气体。
喷水冷却容器,可能的话将容器从火场移至空旷处。
使用灭火剂:雾状水、干粉、二氧化碳、砂土。
4. 健康危害:吸入低浓度氨对粘膜有刺激作用,高浓度可造成组织溶解坏死。
高浓度氨可引起反射性呼吸停止。
5. 急救措施:皮肤接触,立即脱去被污染的衣着,应用2%硼酸液或大量清水彻底冲洗,就医。
眼睛接触,立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟,就医。
吸入迅速脱离现场至空气新鲜处,保持呼吸道通畅,如呼吸困难,给输氧,如呼吸停止,立即进行人工呼吸,就医。
6. 泄漏应急处理:迅速撤离泄漏污染区人员至上风处,并立即隔离150m ,严格限制出入。
切断火源。
建议应急处理人员戴自给正压式呼吸器,穿防毒服。
尽可能切断泄漏源。
合理通风,加速扩散。
漏气容器要妥善处理,废弃或修复、检验后再用。
爆炸下限(V%): 15.7 爆炸上限(V%): 27.4危险特性:与空气混合能形成爆炸性混合物,遇明火、高热能引起燃烧爆炸。
与氟、氯等能发生剧烈的化学反应。
若遇高热,容器内压增大,有开裂和爆炸的危险。
燃烧(分解)产物:氧化氮、氨。
稳定性:稳定禁忌物:卤素、酰基氯、酸类、氯仿、强氧化剂。
聚合危害:不能出现灭火方法:切断气源。
若不能立即切断气源,则不允许熄灭正在燃烧的气体。
喷水冷却容器,可能的话将容器从火场移至空旷处。
液氨的品质参数、主要特性、危害及泄漏处理措施一、液氨的品质参数二、氨的主要特性氨属可燃、易爆、有毒物质,危险类别为2.3类,其主要性质见下表:1、易气化扩散发生泄漏时,由液态变为气态,液氨会迅速气化,体积迅速扩大,没有及时气化的液氨以液滴的形式雾化在蒸汽中;在泄漏初期,由于液氨的部分蒸发,使得氨蒸汽的云团密度高于空气密度,氨气随风飘移,易形成大面积染毒区和燃烧爆炸区,需及时对危害范围内的人员进行疏散,并采取禁绝火源措施。
2、易中毒伤亡氨有毒,有刺激性和恶臭味的气体,容易挥发,氨泄漏至大气中,扩散到一定的范围,易造成急性中毒和灼伤,每立方米空气中最高允许浓度为30mg/m3,当空气中氨的含量达到0.5-0.6%,30分钟内即可造成人员中毒;氨气侵入人体的主要途径是皮肤,感觉器官,呼吸道和消化道等部位.轻度中毒症状为:眼口有干辣感,流泪,流鼻涕,咳嗽,声音嘶哑,吞咽食物困难,头昏疼痛,检查时可见眼膜充血水肿,肺部可听到少数干罗音;重度中毒症状为:在高浓度氨气作用下,头,面部等外露部位皮肤或造成重二度化学灼伤,还可出现昏迷,精神错乱,痉挛,也可造成心肌炎或心力衰竭,少数因反射性声门痉挛或呼吸停止呈触电式死亡。
3、易燃烧爆炸氨既是有毒气体,又是一种可燃气体,氨的自燃点为651℃,燃烧值为2.37-2.51J/m3,临界温度为132.5℃,临界压力为11.4Mpa,氨在空气中的含量达11-14%时,遇明火即可燃烧,其火焰呈黄绿色,有油类存在时,更增加燃烧危险;当空气中氨的含量达15.7%-27.4%时,遇火源就会引起爆炸,最易引燃浓度17%,产生最大爆炸压力0.58Mpa;液氨容器受热会膨胀,压力会升高,能使钢瓶或储罐爆炸.4、易污染环境氨可以污染空气,在风力的作用下,这种有毒气体随风飘移,造成大范围的空气污染,对人畜产生危害;如果液氨大量泄漏流到河流,湖泊,水库等水域,则造成水污染,严重时该水域的水未经处理不能使用.5、易发生次生事故氨不稳定,遇热分解,与氟,氯等接触会发生剧烈的化学反应,若遇高热,容器内压增大,有开裂和爆炸的危险。
氨气铵盐[要点分析]一、氨的分子结构和性质的关系:3.NH3有孤对电子,可以和H+形成配位键,因此NH3可以和酸反应。
4.NH3中N元素化合价为-3价,具有还原性,可以与氧化剂发生氧化还原反应。
5.=17,小于空气的平均式量29,密度小于空气密度。
二、氨气的物理性质氨气为无色、有刺激性气味的气体,易液化,极易溶于水。
氨水的浓度越大,密度越小。
氨水的密度小于水的密度。
三、氨气的化学性质1.与水反应,溶液呈碱性说明:①氨水中所含粒子:NH3、H2O、NH3·H2O、NH4+、OH-、H+,氨水中溶质通常看作NH3,而不是NH3·H2O。
②固态NH3为分子晶体③制备NH3可以通过加热浓氨水的方法,利用NH3·H2O NH3↑+H2O原理制备;也可以利用往浓氨水中加入烧碱制备,原理:烧碱溶于水为放热反应,促进NH3·H2O的分解,增大[OH -]使上述可逆反应向左移动,而产生NH 3。
2.与酸反应NH 3+HNO 3=NH 4NO 3HCl+NH 3=NH 4ClH 2SO 4+2NH 3=(NH 4)2SO 4前两个反应实验现象产生大量的白烟,因为HCl 、HNO 3都挥发,而H 2SO 4不挥发,因此看不到白烟。
利用产生白烟的现象可以相互鉴别。
3.还原性:4NH 3+3O 2(纯氧) 2N 2+6H 2O8NH 3+3Cl 2=N 2+6NH 4Cl (反应前后压强比11∶1)(此反应分两步进行:2NH 3+3Cl 2=N 2+6HCl ,NH 3+HCl=NH 4Cl )四、氨气的制法(1)反应原理:铵盐(NH 4Cl 、(NH 4)2SO 4)与消石灰混合加热来制取氨气2NH 4Cl+Ca(OH)2 CaCl 2+2NH 3↑+2H 2O(2)装置:固—固反应加热装置,发生装置与制氧气相似(3)收集:由于氨气极易溶于水,密度比空气小,所以只能用向下排空气法。
20 >25 25 100 <500 ~700 >1000 >2000 >5000任何人都感到臭味有毒范围最高容许浓度开始引起粘膜刺激.可耐6小时眼睛、鼻子感到强烈的刺激,可耐0.5~1小时几分钟内可严重侵蚀眼鼻,小于0.5小时不会造成永久性影响激烈咳嗽、支气管痉挛,肺水肿引起窒息吸入30分钟就有危险短时间内就死亡氨主要通过呼吸道吸入,此外,也可以通过皮肤吸收。
氨吸人体内后很快转变成尿素。
氨的毒害作用主要由下列三点引起:①减少三磷酸腺甙阻碍三羧酸循环,降低细胞色素氧化酶的作用;②脑氨增加,可引起神经方面的障碍;③高浓度氨的强烈刺激性引起组织的溶解和坏死。
吸入高浓度氨气引起喷嚏、流涎、咳嗽、恶心、头痛、出汗、脸面充血、胸部痛、呼吸急促、尿频、眩晕、窒息感、不安感、胃痛、闭尿等症状。
刺激眼睛引起流泪、眼疼、视觉障碍。
皮肤接触后引起皮肤刺激、皮肤发红、可致灼伤和糜烂。
慢性中毒时出现头痛、恶梦、食欲不振、易激动、慢性结膜炎、慢性支气管炎、血痰、耳聋等。
吸入氨气的患者应立即转移到安全区安置休息并保暖。
咳嗽时可服可待因。
呼吸微弱或停止时立刻进行输氧或人工呼吸。
并速叫医生来诊治。
皮肤接触时,立刻用水冲洗后再用肥皂水洗净,然后盖上用5%的醋酸、柠檬酸、酒石酸或盐酸浸湿的敷料,也可以用2%以上的硼酸水湿敷。
被液氨冻伤时,首先要适当解冻后脱下冻结的衣服。
脱衣时要注意不要扯破皮肤,特别要注意清洗腋窝及会阴等潮湿部位(见附录)。
眼睛受伤时,先用水清洗,或用0.5%~1%明矾溶液洗涤,然后滴入凡士林油或橄榄油。
剧烈疼痛时,可滴人大约1~2滴1%的奴佛卡因或滴入I滴0.5%的地卡因肾上腺素(1:1000)溶液。
6.安全防护接触低浓度氨时,要戴氨用防毒口罩,接触高浓度氨时要用供气面罩。
处理水溶液时,要穿高腰胶鞋、防护眼镜、胶手套等。
钢瓶要存放在室外阴凉干燥通风良好之处,避免阳光直射,避免一切可能的撞击。