物质的量浓度资料.
- 格式:ppt
- 大小:1.57 MB
- 文档页数:30

物质的量浓度计算必备知识规律总结一、物质的量1.意义:表示构成物质的微观粒子多少的物理量。
它表示一定数目粒子的集合体。
2.符号:n二、单位――摩尔1.摩尔:物质的量的单位。
符号:mol2. 阿伏加德罗常数:0.012kg12C所含的碳原子数,符号:N A,近似值6.02×1023mol-1。
1mol任何粒子含有阿伏加德罗常数个微粒。
3.使用范围:微观粒子4.物质的量(n)微粒个数(N)和阿伏加德罗常数(N A)三者之间的关系。
阿伏加德罗常数的测定与原理阿伏加德罗常数的符号是NA,单位是每摩(mol-1),数值是NA =(6.0221376±0.0000036)×1023 /mol阿伏加德罗常数由实验测定。
它的测定精确度随着实验技术的发展而不断提高。
测定方法有电化学当量法、布朗运动法、油滴法、X射线衍射法、黑体辐射法、光散射法等。
这些方法的理论依据不同,但测定结果几乎一样,可见阿伏加德罗常数是客观存在的重要常数。
例如:用含Ag+的溶液电解析出1mol的银,需要通过96485.3C(库仑)的电量。
已知每个电子的电荷是1.60217733×10-19C,物质的量浓度是关于溶液组成的一个重要物理量,是高中化学溶液有关计算的重要内容。
物质的量浓度概念及表达式虽然比较简单,但不注意理解其内涵、不注意问题的特点,应用起来常常会容易出错。
一般说来,要注意以下几方面的问题:1注意溶质是什么溶液中的溶质是什么,是运用物质的量浓度表达式进行计算时首先要考虑的,对有些特殊情况,如3SO 、O H 5CuSO 24⋅等溶于水后所得溶质及氨水中溶质是什么等,要注意辨别。
例1:标准状况下,用一定量的水吸收氨气后制得物质的量浓度为1L mol 0.12-⋅、密度为1mL g 915.0-⋅的氨水。
试计算1体积水吸收多少体积的氨气可制得上述氨水。
(本题中氨的相对分子质量为17.0,水的密度为1mL g 0.1-⋅)解析:很多同学认为氨水中的溶质为O H NH 23⋅,导致计算出错。


主题课:物质的量浓度课时目标1.溶解度的概念及有关计算;2.物质的量浓度、质量分数和溶解度之间的相互换算;3.配制一定物质的量浓度溶液的方法和技能。
4.高考的热点是物质的量浓度的概念及其计算,一定物质的量浓度的溶液的配制方法。
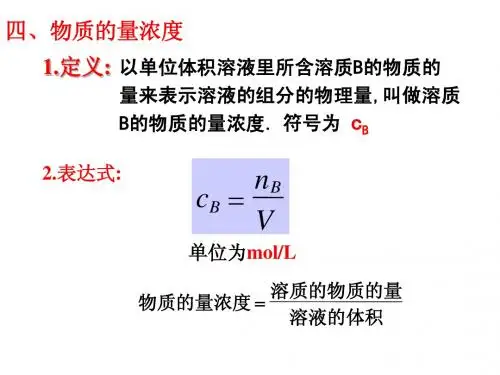
知识精要1.物质的量浓度浓度是指一定温度、压强下,一定量溶液中所含溶质的量的多少。
常见的浓度有溶液中溶质的质量分数,溶液中溶质的体积分数,以及物质的量浓度。
(1定义:物质的量浓度是以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量。
符号用c B表示。
(2表达式:C B=,单位常用mol/L1 单位体积为溶液的体积,不是溶剂的体积。
②溶质必须用物质的量来表示。
②物质的量与其它量之间的换算恒等式:2.一定物质的量浓度溶液的配制溶液的配制步骤:计算→称量→溶解→转移→洗涤→振荡→定容→摇匀→装瓶一定物质的量浓度主要仪器:量筒、托盘天平(砝码)、烧杯、玻璃棒、胶头滴管、容量瓶误差分析:关键看溶质或溶液体积的量的变化。
依据来判断。
3.溶液的稀释与混合(1溶液的稀释定律由溶质的质量稀释前后不变有:m B =m浓×ω浓=m稀×ω稀由溶质稀释前后物质的量不变有:n B =c浓×V浓=c稀×V稀(2溶液在稀释或混合时,溶液的总体积不一定是二者混合的体积之和。
如给出溶液混合后的密度,应根据质量和密度求体积。
4.物质的量浓度与溶质质量分数ω的换算(ρ为该溶液的密度例如:质量分数为98%的浓硫酸(密度为1.84g/mL ),其物质的量浓度是多少?热身练习1.将4gNaOH 固体溶于水配成250mL 溶液,此溶液中NaOH 的物质的量浓度为______。
取出10mL 此溶液,其中含有NaOH______g 。
将取出的溶液加水稀释到100mL ,稀释后溶液中NaOH 的物质的量浓度为______。
2.配制2L1.5mol/LNa 2SO 4溶液,需要固体Na 2SO 4 (A .213gB .284gC .400gD .426g3.0.5L1mol/LFeCl 3溶液与0.2L1mol/LKCl 溶液中的Cl -的数目之比为 (A .1∶3B .3∶1C .5∶2D .15∶24.将30mL0.5mol/LNaOH 溶液加水稀释到500mL ,稀释后溶液中NaOH 的物质的量浓度为(A .0.03mol/LB .0.3mol/LC .0.05mol/LD .0.04mol/L5.50mLH 2SO 4的质量分数为35%、密度为1.24g/cm 3的硫酸中,H 2SO 4的物质的量浓度为 (A .0.044mol/LB .0.44mol/LC .4.4mol/LD .44mol/L6.设N A 为阿伏加德罗常数,下列关于0.2 mol·L-1的Ba (NO 3)2溶液不正确的说法是 (A .2 L 溶液中有阴、阳离子总数为0.8 N AB .500 mL 溶液中NO 浓度为0.2 mol·L -1C .500 mL 溶液中Ba 2+浓度为0.2 mol·L -1D .500 mL 溶液中NO 浓度为0.2 N A7.设阿伏加德常数为N A ,则下列说法正确的是 (A .常温常压下,11.2L 甲烷中含有氢原子数为2N AB .标准状况下,0.3mol 二氧化硫中含有氧原子数为0.3N AC .常温下,2.7g 铝与足量的盐酸反应,失去的电子数为0.3N AD .常温下,1L 0.1mol/L MgCl 2溶液中含Mg 2+数为0.2N A8.下列叙述正确的是 (A .48 g O 3气体含有6.02×1023个O 3分子B .常温常压下,4.6 g NO 2气体含有1.81×1023个NO 2分子 C .0.5 mol·L -1 CuCl 2溶液中含有3.01×1023个Cu 2+D .标准状况下,33.6 L H 2O 含有9.03×1023个H 2O 分子精解名题例1.设N A 为阿伏加德罗常数的值,下列关于0.2mol/L 的CaCl 2溶液不正确的说法是 ( )A.2L 溶液中阴阳离子总数为0.8N AB.500mL 溶液中Cl -离子浓度为0.2mol/LC.500mL 溶液中Ca 2+离子浓度为0.2mol/LD.500mL 溶液中Cl -离子总数为0.2N A例2.利用碳酸钠晶体(Na 2CO 3·10H 2O )来配制0.5mol/L 的Na 2CO 3溶液1000mL ,假如其他操作均准确无误,下列情况会引起配制溶液的浓度偏高的是( )偏低的是( )A.称取碳酸钠晶体100gB.定容时,俯视观察刻度线C.移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗D.定容后,将容量瓶振荡均匀,静置时发现液面低于刻度线,于是又加入少量水至刻度线例3.(上海)实验室需用480毫升0.1摩升的硫酸铜溶液,现选取500毫升容量瓶进行配制,以下操作正确的是 ( )A.称取7.68克硫酸铜,加入500毫升水B.称取12.0克胆矾配成500毫升溶液C.称取8.0克硫酸铜,加入500毫升水D.称取12.5克胆矾配成500毫升溶液例4.用18 mol·L-1硫酸配制100 mL 1.0 mol·L -1的硫酸,若实验仪器有:A.100 mL 量筒B.托盘天平C.玻璃棒D.50 mL 容量瓶E.10 mL 量筒F.胶头滴管G.50 mL 烧杯H.100 mL 容量瓶(1实验时应选用仪器的先后顺序是(填入编号 。



最新整理高三化学教学高中化学重要知识点:物质的量浓度高中化学重要知识点:物质的量浓度定义:单位体积的溶液里所含溶质B的物质的量,也称为B的物质的量浓度符号:cB单位:mol/L(mol·L-1)计算公式:物质的量浓度(cB)=物质的量(n)/溶液的体积(V)物质的量浓度与溶液质量分数、密度的关系:c=1000ρω/M稀释定理:稀释前后溶液中溶质的物质的量不变c(浓溶液)V(浓溶液)=c(稀溶液)V(稀溶液)稀释前后溶液中溶质的质量不变ρ(浓溶液)V(浓溶液)w%(浓溶液)=ρ(稀溶液)V(稀溶液)w%(稀溶液)物质的量浓度与质量分数(质量百分比浓度)的比较:浓度计算的注意事项:物质的量浓度(cB)=物质的量(n)/溶液的体积(V)(1)V指溶液体积而不是溶剂的体积;(2)取出任意体积的1mol/L溶液,其浓度都是1mol/L。
但所含溶质的量则因体积不同而不同;(3)“溶质”是溶液中的溶质,可以是化合物,也可以是离子或气体特定组合,特别的,像NH3、Cl2等物质溶于水后成分复杂,但求算浓度时,仍以溶解前的NH3、Cl2为溶质,如氨水在计算中使用摩尔质量时,用17g/mol。
溶液中溶质的质量分数与溶质的物质的量浓度的换算:溶液中溶质的质量可以用溶质的质量分数表示:m(溶质)=ρ(g·cm-3)·V(L)·w%(1cm3=1mL)溶液中溶质的质量可以用物质的量浓度来表示:m(溶质)=c(mol/L)·V(L)·M(g·mol-1)由于同一溶液中溶质的质量相等,溶液的体积也相等,但注意:1L=1000mL,所以,上述两式可以联系起来:ρ(g·cm-3)·1000V(mL)·w%=c(mol/L)·V(L)·M(g·mol-1)化简得:1000ρw%=cM。




物质的量浓度=(1000 *ρ*ω)/M
ρ(密度)的单位是克每立方厘米,乘以1000,就是克每升,ω是质量分数
这个式子推证是
先算VL(升)溶液的质量是1000ρV(单位克)
那么VL(升)溶液中含有溶质1000ρωV
这些溶质的物质的量是1000ρωV/M
那物质的量浓度就是物质的量除以体积V即(1000 *ρ*ω)/M
物质的量浓度:单位体积溶液所含溶质的物质的量,叫做溶质的物质的量浓度。
则把单位体积设为1L=1000ml(换算单位是因为和密度单位统一)物质的量浓度的基本公式是c=n/V,在这里的n表示的是溶质的物质的量,V表示溶液的体积
那么根据n(溶质的物质的量)=m/M,且m(溶质的质量)=ρv
溶质的质量=溶液的体积×溶质的百分比
所以可以得到,m(溶质的质量)=ρv=ρ×1000ml×w
把这个带进去n(溶质的物质的量)=m/M,得到n=ρ×1000ml×w/M 再带进去c=n/V,得到c=ρ×1000ml×w/M×1L
扩展资料注意事项
⑴只能配制容量瓶上规定容积的溶液。
⑵转移溶液时玻璃棒要靠在刻度线以下。
⑶如果加水定容超过了刻度线,不能将超出部分吸走,而应重新配制。
⑷用胶头滴管定容时,眼睛应平视液面。
⑸摇匀后若出现液面低于刻度线的情况,不能再加水。