
川芎嗪对大鼠蛛网膜下腔出血后血管痉挛的防治研究
申艳莉,罗祖明
(四川大学华西医院,四川成都610041)
【摘要】 目的 探讨川芎嗪对蛛网膜下腔出血(SA H)后血管痉挛(CV S)的防治作用。方法 40只SD大鼠随机分为A:假手术组(空白组);B:痉挛组;C:川芎嗪组;D:尼莫地平组。经自体血红蛋白局部注射法建立SA H后CV S模型。用动态图像分析法监测基底动脉血管直径变化,并测定各组大鼠血浆脂质过氧化物(L PO)的体内代谢产物丙二醛(M DA)水平。结果 B组血管直径较A组缩小(P<0.001);C组、D组血管与B相比直径增大(P<0.001);M DA水平C 组比其余三组降低,其差异有统计学意义(P<0.001)。结论 川芎嗪对SA H后CV S有防治作用。
【关键词】 蛛网膜下腔出血 脑血管痉挛模型 川芎嗪 脂质过氧化物
【中图分类号】 R743.35 【文献标识码】 A 【文章编号】 100420501(2002)06205572-2
Therapeutic effect of L igustraz i nge on cerebra va scular spa s m af ter subarachno id he m orrhage;S heng Y an li,L uo Z um ing.W est Ch ina H osp ita l,S ichuan U n iversity,Cheng d u,S ichuan610041
【Abstract】 Objective To assess the effecacy of L igu strazinge hydroch lo ride fo r cereb ra vascu lar spas m(CV S)af2 ter subarachno id hemo rrhage(SA H).M ethods Fo rty rats w ere divided random ly in to4group s,(a)con tro l group;(b) cereb ra vaso spas m s group;(c)L igu strazine group;(d)N i m o top group.Basilar artery diam eter change w as mon ito red by stereo types m icro scopy after in jecting hemo lysate top ically,and p las m a li p id perox ide(L PO)w as determ ined.Results Compared w ith that in cereb ra vaso spas m s group,the artery diam eter in L igu strazine group dilated sign ifican tly(P<0. 001).T he degree of the dilatati on in L igu strazine group is sam e to that in N i m o top group.Conclusion L igu strazine is effetive in p reven ting CV S after SA H.
【Key words】 L igu strazine Cereb ra vascu lar spas m Subarachno id hemo rrhage L i p id perox ide
SA H后的CV S是SA H病人致残和死亡的主要原因。目前主要的治疗药物为尼莫地平[1],但疗效尚不令人满意,因此寻找新的治疗方法特别是中药抗血管痉挛制剂是亟待解决的问题。川芎嗪是川芎生物碱中的有效单体[2],化学名为四甲基吡嗪。临床试验发现川芎嗪对缺血性脑卒中和心绞痛具有较好的疗效。但迄今为止尚未见到有关川芎嗪防治SA H后CV S的研究。本研究拟采用自体血红蛋白局部注射建立SA H 后的CV S模型,观察川芎嗪对SA H后血管痉挛的防治作用。
1 材料和方法
111 动物:SD大鼠40只,雌雄各半,清洁级,体重200~300g,四川抗生素研究所提供。
112 仪器:泰盟动态图像分析系统;体式显微镜(北京泰克有限公司);高速台式离心机(上海医疗器械厂);呼吸机(浙江大学医疗器械厂);牙科钻。
113 试剂:尼莫地平注射液(尼莫同N i m o top○R,德国拜耳);川芎嗪注射液(ligu strazine hydroch lo ride,北京永康制药公司)。
114 动物模型的建立:SD大鼠40只,随机分为4组。A:假手术组;B:痉挛组;C:川芎嗪组(1419m g kg); D:尼莫地平组(4166m g kg);4组大鼠均用3%苯巴比妥麻醉后,摘眼球取全血2m l后仰卧位固定于手术台。颈前正中切口,气管插管后接呼吸机,断离气管、食管,暴露颅底,用牙科钻小心钻开颅骨,暴露硬脑膜,剥离硬脑膜后清晰可见基底动脉及其分支,37℃生理盐水灌注,同时分离暴露颈总动脉。在体式显微镜下调好焦距和视野,连接动态图像分析系统观测血管形态,并测量血管直径。将全血(内含肝素)离心,吸取上清液(待测),将血红细胞反复吹打并在振荡器上充分振荡,至红细胞破裂,血红蛋白溢出,制成血红蛋白液(H b)。随机抽取三份血红蛋白液,用高铁氰化法测定H b的含量,分别为273g L,279g L,263g L。基底动脉暴露后,A组:直接在基底动脉上滴加全血(含肝素);B组:直接在基底动脉上滴加血红蛋白;C组和D组均在静脉给药015h后在基底动脉上滴加血红蛋白。
115 血管直径测定:每隔10m in测量一次血管直径,连续观测015h。此后每1h测量1次血管直径,连续观测3h。在实验过程中凡检测时间不到265h而中途死亡的大鼠,其数据全部剔除。
116 血浆L PO含量测定:各组大鼠在实验完成后,在基底动脉处取血1m l(含肝素),离心后取上清液待测。分别取013m l血浆用硫代巴比妥酸直接分光光度法测定M DA含量,结果见表2。
117 统计学处理:对所得数据用SPSS1010统计软件
进行单因素方差分析和配伍设计方差分析。
2 结 果
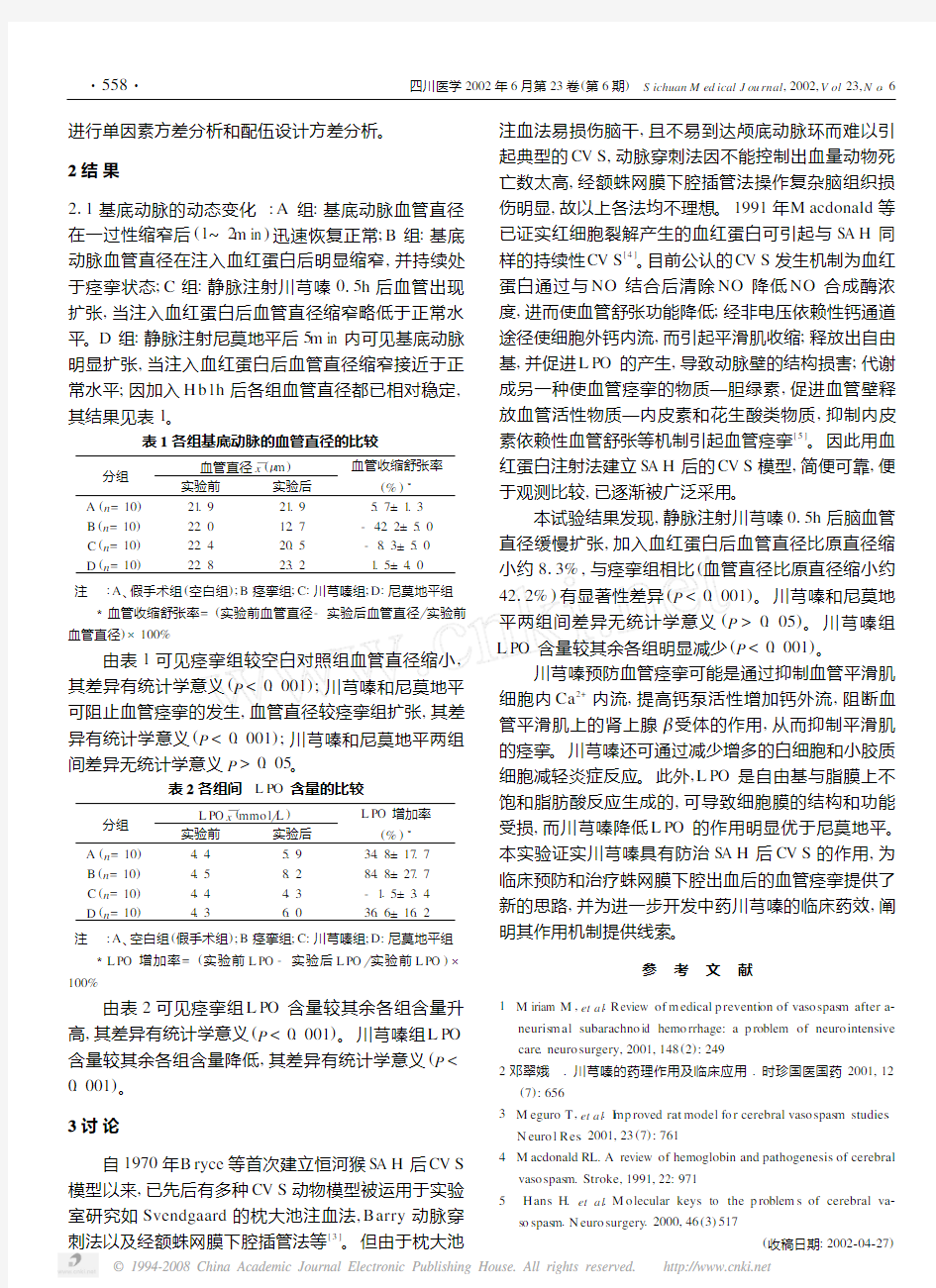
211 基底动脉的动态变化:A组:基底动脉血管直径在一过性缩窄后(1~2m in)迅速恢复正常;B组:基底动脉血管直径在注入血红蛋白后明显缩窄,并持续处于痉挛状态;C组:静脉注射川芎嗪015h后血管出现扩张,当注入血红蛋白后血管直径缩窄略低于正常水平。D组:静脉注射尼莫地平后5m in内可见基底动脉明显扩张,当注入血红蛋白后血管直径缩窄接近于正常水平;因加入H b1h后各组血管直径都已相对稳定,其结果见表1。
表1 各组基底动脉的血管直径的比较
分组
血管直径x
θ(Λm)
实验前实验后
血管收缩舒张率
(%)3
A(n=10)21.921.95.7±1.3
B(n=10)22.012.7-42.2±5.0
C(n=10)22.420.5-8.3±5.0
D(n=10)22.823.21.5±4.0
注:A、假手术组(空白组);B痉挛组;C:川芎嗪组;D:尼莫地平组 3血管收缩舒张率=(实验前血管直径-实验后血管直径 实验前血管直径)×100%
由表1可见痉挛组较空白对照组血管直径缩小,其差异有统计学意义(P<0.001);川芎嗪和尼莫地平可阻止血管痉挛的发生,血管直径较痉挛组扩张,其差异有统计学意义(P<0.001);川芎嗪和尼莫地平两组间差异无统计学意义P>0.05。
表2 各组间L PO含量的比较
分组
L PO x
θ(mmo l L)
实验前实验后
L PO增加率
(%)3
A(n=10)4.45.934.8±17.7
B(n=10)4.58.284.8±27.7
C(n=10)4.44.3-1.5±3.4
D(n=10)4.36.036.6±16.2
注:A、空白组(假手术组);B痉挛组;C:川芎嗪组;D:尼莫地平组 3L PO增加率=(实验前L PO-实验后L PO 实验前L PO)×100%
由表2可见痉挛组L PO含量较其余各组含量升高,其差异有统计学意义(P<0.001)。川芎嗪组L PO 含量较其余各组含量降低,其差异有统计学意义(P< 0.001)。
3 讨 论
自1970年B ryce等首次建立恒河猴SA H后CV S 模型以来,已先后有多种CV S动物模型被运用于实验室研究如Svendgaard的枕大池注血法,B arry动脉穿刺法以及经额蛛网膜下腔插管法等[3]。但由于枕大池注血法易损伤脑干,且不易到达颅底动脉环而难以引起典型的CV S,动脉穿刺法因不能控制出血量动物死亡数太高,经额蛛网膜下腔插管法操作复杂脑组织损伤明显,故以上各法均不理想。1991年M acdonald等已证实红细胞裂解产生的血红蛋白可引起与SA H同样的持续性CV S[4]。目前公认的CV S发生机制为血红蛋白通过与NO结合后清除NO降低NO合成酶浓度,进而使血管舒张功能降低;经非电压依赖性钙通道途径使细胞外钙内流,而引起平滑肌收缩;释放出自由基,并促进L PO的产生,导致动脉壁的结构损害;代谢成另一种使血管痉挛的物质—胆绿素,促进血管壁释放血管活性物质—内皮素和花生酸类物质,抑制内皮素依赖性血管舒张等机制引起血管痉挛[5]。因此用血红蛋白注射法建立SA H后的CV S模型,简便可靠,便于观测比较,已逐渐被广泛采用。
本试验结果发现,静脉注射川芎嗪015h后脑血管直径缓慢扩张,加入血红蛋白后血管直径比原直径缩小约813%,与痉挛组相比(血管直径比原直径缩小约4212%)有显著性差异(P<0.001)。川芎嗪和尼莫地平两组间差异无统计学意义(P>0.05)。川芎嗪组L PO含量较其余各组明显减少(P<0.001)。
川芎嗪预防血管痉挛可能是通过抑制血管平滑肌细胞内Ca2+内流,提高钙泵活性增加钙外流,阻断血管平滑肌上的肾上腺Β受体的作用,从而抑制平滑肌的痉挛。川芎嗪还可通过减少增多的白细胞和小胶质细胞减轻炎症反应。此外,L PO是自由基与脂膜上不饱和脂肪酸反应生成的,可导致细胞膜的结构和功能受损,而川芎嗪降低L PO的作用明显优于尼莫地平。本实验证实川芎嗪具有防治SA H后CV S的作用,为临床预防和治疗蛛网膜下腔出血后的血管痉挛提供了新的思路,并为进一步开发中药川芎嗪的临床药效,阐明其作用机制提供线索。
参考文献
1 M iriam M,et al.R eview of m edical p reventi on of vaso spas m after a2 neuris m al subarachno id hemo rrhage:a p roblem of neuro intensive care.neuro surgery,2001,148(2):249
2 邓翠娥1川芎嗪的药理作用及临床应用1时珍国医国药2001,12
(7):656
3 M eguro T,et al.I mp roved rat model fo r cerebral vaso spas m studies.
N euro l R es.2001,23(7):761
4 M acdonald RL.A review of hemoglobin and pathogenesis of cerebral vaso spas m.Stroke,1991,22:971
5 H ans H.et al.M o lecular keys to the p roblem s of cerebral va2 so spas m.N euro surgery.2000,46(3)517
(收稿日期:2002204227)
SD大鼠饲养管理 操作规程 2007年11月 目录 一、SD大鼠概述 (2) 二、SD大鼠日常饲养管理 (5) 1、进入屏障及准备工作 (5) 2、饲养环境 (6) 3、饲喂 (6) 4、给水 (7) 5、换窝 (7) 6、离乳 (8) 7、留种交配 (9) 8、动物发放 (10) 9、引种 (11)
10、处死 (13) 11、SD大鼠常见疾病 (13) 12、清洁与消毒 (16) 13、退出屏障 (17) 14、常见突发事件的应急处理 (17) 一、SD大鼠概述 大鼠(Rat),啮齿目、鼠科、大鼠属,属野生褐色大鼠(Rattus norvegicus) 的变种。原产于亚洲中部及原苏联部分的温暖地区。十八世纪后期开始人工饲养,十九世纪中叶首次用于心理学的研究,二十世纪以后,大鼠应用于生命科学研究的各个领域,尤其在肿瘤学、药理学、内分泌学、营养学方面应用最为广泛。 1925年美国Sprague dawley农场用Wistar培育而成。其特点为头部狭长,尾长接近身长,产仔多,生长发育较Wistar快,抗病能力尤以对呼吸系统疾病的抵抗力强;自发肿瘤率低,对性激素感受性高; 10 周龄雄鼠体重可达300-400g,雌鼠可达180-270g。SD大鼠常用作营养学、内分泌学和毒理学研究。 行为和习性 (1)SD大鼠性情温顺,易于捉取,一般不会主动咬人,但当粗暴操作或营养缺乏时可攻击人或互相撕咬,哺乳母鼠更易产生攻击人的倾向,配种后的成年雄鼠同笼饲养互相撕咬,严重的甚至咬死。
(2)SD大鼠是杂食动物,有随时采饮的习惯。喜食煮熟的动物肉(如兔肉),甚至是同类的肉。对营养缺乏敏感,特别是维生素和氨基酸缺乏时可出现典型症状。如核黄素缺乏时出现皮炎、脱毛、体质虚弱和生长缓慢,还可引起角膜血管化、白内障、贫血和髓质退化;维生素E缺乏可导致雌大鼠生育能力降低,严重缺乏时雄鼠可终生丧失生殖能力。 (3)SD大鼠的活动多集中在黄昏到清晨这一段时间,白天常在笼内闭目休息,交配多在夜间发生。 (4)SD大鼠对空气中的粉尘、氨气、硫化氢等极为敏感,易引发呼吸道疾病,一般开放饲养的大鼠主要死因为呼吸道疾病。 (5)SD大鼠对各种刺激很敏感,环境条件的微小变化也可引起大鼠的反应,强烈的噪音可导致大鼠恐慌、互相撕咬,带仔母鼠可出现吃仔现象。 (6)SD大鼠具有群居优势,同笼多个饲养比单个饲养的大鼠体重增长快、性情温顺、易于捉取,单个饲养的则胆小易惊、不易捕捉。解剖学特点 (1)大鼠较小鼠个体较大。一般成年大鼠体长不小于18-20cm。尾上覆有短毛和环状角质鳞片,数量多于200片。上下颌各有两个切齿和六个臼齿,共16颗牙齿。齿式为(1003/1003)×2。 (2)大鼠骨骼约105-108块,大鼠的生长发育期长,长骨长期有骨骺存在,不骨化。切齿终生不断生长,大鼠需不断啃咬磨牙以维持其长度恒定,故垫料中应有部分小木块供其啃咬。
1. 将小鼠固定好,将尾巴拉直,绷紧,这是成功的第一步。 小鼠性情较温顺,一般不会咬人,比较容易抓取固定。通常用右手提起小鼠尾巴将其放在鼠笼盖或其它粗糙表面上,在小鼠向前挣扎爬行时,用左手拇指和食指捏住其双耳及颈部皮肤,将小鼠置于左手掌心、无名指和小指夹其背部皮肤和尾部,即可将小鼠完全固定。在一些特殊的实验中,如进行尾静脉注射时,可使用特殊的固定装置进行固定,如尾静脉注射架或粗的玻璃试管。如要进行手术或心脏采血应先行麻醉再操作,如进行解剖实验则必须先行无痛处死后再进行。 或者用这个方法: 1 小鼠要固定好,自制一个笼子,前面通气,中间最好有一个挡板,让小鼠不能后退,筒子后面开一个口,尾巴从这里出来,这样固定牢靠; 2、注射前尾巴用稍热的水浸泡几分钟,有利于注射; 3、先远后尽,不要一开始就从尾根部,那样失败了不好办; 4、进血管后注意保持稳定,针尖很容易刺穿血管的。至于能否穿进,个人手感如何,全靠自己啦。多练习,一定很快掌握的,不难,绝对不难!我练习10余只小鼠就比较熟练了2. 用酒精棉球擦拭尾巴,使血管扩张;或者用热水或者热毛巾焐热,使静脉扩张;选用适当的针头,越细越好;在尾部较靠近上段的地方注射,这里血管比较大。用酒精或热水擦拭,擦拭的时候,可把尾巴用力扯在桌面上。注射状态为尾巴发白,紧靠白色的尾骨两侧清晰可见两根红色静脉。 3. 用左手的食指,中指,无名指及大拇指将小鼠尾巴固定,; 手法:握住1ml注射器前面0.1ml 处。右手小指搭在拽着鼠尾的左手拇指处按此手形进针;看针尖前面那个斜面有3/4(关键),如果血管充盈则进1/2,进入,停,上挑针头,进针;左右轻摆动,如可动,可注射。 原则是:把你第一次打进的手形,完全固定下来,每次都重复。 4. 注射注射时左手扯尾,使尾巴紧贴桌面,尾巴与桌边紧贴转弯处为进针部位,一般选择距尾尖1/4或1/3处进针,此处皮肤较薄,血管清晰,进针容易。进针时针头与桌面平行,针尖稍稍朝下,从中指及无名指与拇指接触处稍上方进针,一旦进入,须将针头稍稍上挑进入,针头沿血管进入,肉眼可关察到针头前进。如果针头在血管中前进,可明显地感觉到针行通畅,毫无阻力。若针头不在血管中,手感针行有阻力,有一种堵的感觉。进针时不要太深,针头入皮肤后马上把针头略往上,平行进针,针扎入时有落空感,推液时无阻力则说明成功了!如针头处出现皮丘则说明在皮下,推出重来。进针处最好在尾巴的1/3-1/2处,甚至可以更下一点。这样一次失败了还可以往上再来,不要马上在最高处打,因为你们要打这么多天。要为以后作准备。用热水、酒精、红外都可以扩张血管。可以视情况而用。总而言之,最重要的是“熟能生巧”。你最好先练习一下或请高手相助。不然到了最后几天,真的很难打的。 2注射:针进入后,切记手不可发抖,因为血管壁非常薄,容易扎穿。推药时,要缓推。若进针成功,推药顺畅,无阻力;若推药时感觉有阻力,说明针头不在血管中,须及时拔出,重新进针。一般选用4号或4号半针头。最好用打疫苗的2毫升一次性注射器。尾静脉注射并不难,主要是一种感觉。若用上十只鼠练手,你必会找到感觉。心要静,手要稳,要有耐心。我研一的时候尾静脉注射让我头疼万分,越急越打不进去。后来静下心来,边注射边找感觉,很快就熟练了。 祝你找到感觉 5 通过看有无回血来测试针是否在静脉内; 6 .注射. 做到以上步骤,保证注射成功!
第一章皮肤 一、皮肤由表皮、真皮和皮下组织构成。 二、皮肤腺有皮脂腺、汗腺和乳腺。 1、皮脂腺分布在毛囊周围。口角部、肛门、包皮和乳头周围有特化的皮脂腺。 2、汗腺,大鼠的汗腺只局限于足垫的皮肤。 3、乳腺 数量大鼠的乳腺共有6对,胸部3对,腹部1对,鼠蹊部2对。个别的大鼠有5对或者7对。 大小和形态随大鼠的年龄和性周期有明显的变化。 部位包埋在皮下组织中,由结缔组织隔与胸壁和腹壁松松地相连。 第二章骨 一.脊柱大鼠的脊柱由57 —61块脊椎骨组成,包括颈椎7、胸椎13、腰椎& 荐锥 4、尾锥27 —31块。锥式C7T13L6S4Cy27—31。骨性标志为第二胸椎,其棘突最高,超过其它脊椎骨。 1、颈椎和其它哺乳动物一样,恒为7块,全无肋骨相连,横突上具有横突孔,供锥动脉通过。 2、胸椎13块,椎骨的长度由前向后逐渐增加(由2毫米增加到4毫米),锥管的直径平均为3.3毫米,较颈部的锥管为狭窄。 3、腰椎6块,每块锥体的长度比较一致,约 6 —7毫米。锥管直径由前面的 4 毫米向后逐渐缩小至2毫米。 二、胸骨 共分为6节,最前一节为胸骨柄,第二到第五节称为胸骨体,最后一节为剑突,棒状的剑突后面接一盘状的剑状软骨。胸骨柄长约10毫米。 第三章肌肉系统(省略) 第四章消化系统 消化系统包括消化管及附属消化器官。消化管可分为口腔、食管、胃、小肠和大肠等部。附属消化器官有齿、舌、唾液腺、肝和胰。 第一节消化管
、口腔1、舌全长约30毫米,不具有正中系带,但是有两条侧系带。 一、食管 分为颈、胸、腹三部。成年大鼠食管的颈-胸段长度约75毫米,腹段通过膈的食管裂孔在膈后的长度约15毫米,食管外径约2毫米。 位置:食管主要是沿气管背侧走行,仅在颈部稍偏左侧。 一、胃 位置:横位于腹腔的左前部,其壁面几乎完全为肝的左叶所覆盖。 大小:胃重为体重的0.5% ,属单室胃。 形态:胃小弯朝向背前方,食管在其中部入胃。胃大弯朝向腹后方,其边缘 有双层的口袋状大网膜。贲门部外观呈半透明状,内壁有粘液腺。 三、小肠 1、十二指肠 长度:长约100毫米。 位置:从幽门发出向右后行,再折向前终于右侧。可分为降支(向右后行)、横支(水平部)、升支(向前行),它们构成一个不完全的环,包围着部分胰腺。 颜色:淡红色。 2、空肠 长度:为小肠的最长部分,大约有700—1000毫米。 位置形态:盘旋在腹腔的右方腹侧部。 3、回肠 长度:较短,约有40毫米。 位置形态:以三角形的系膜回盲褶与盲肠的末端相连,向盲肠的开口与结肠的起始部紧密相接。 二、大肠 1、盲肠 长度:是介于小肠与盲肠之间的一个大的盲囊。长约60毫米,直径约10毫米。位置:通常位于腹腔的左后部。盲肠呈锥体形,分为基部、体部和尖端。 2、结肠 长度:长约100毫米。
大鼠肺微血管内皮细胞 编号名称规格北京派瑞金GK1001大鼠肺微血管内皮细胞5×105cells/瓶 为能尽快开展实验,派瑞金发货的原代细胞均处于对数生长期,且每次发货为汇合率达到70%的细胞,收到细胞后即可开展实验。 派瑞金提供的大鼠肺微血管内皮细胞取自新鲜的组织,按照标准操作流程分离培养。研发的大鼠肺微血管内皮细胞完全培养基能提供细胞最佳的生长条件,降低杂细胞污染,保证不同批次间细胞质量的稳定。 同时,派瑞金还建立了严格的细胞鉴定流程,所提供的原代细胞均需经过细胞类型特异性标记物、细胞形态学等检测,保证细胞纯度在90%以上;同时也需经过微生物检测,保证不含有HIV、HBV、HCV、支原体、真菌及其他类型的细菌。 大鼠肺微血管内皮细胞简介: 1、名称:大鼠肺微血管内皮细胞 2、组织来源:大鼠肺血管组织 3、规格:5×105cells/25cm2培养瓶 4、细胞简介: 大鼠肺微血管内皮细胞分离自正常大鼠肺血管组织,血管内皮细胞密切参与包括再生、发育、伤口愈合等一系列生理及炎症反应。细胞呈梭形或多角形,形成单层后呈典型的鹅卵石样或铺路石样排列。肺微血管内皮细胞构成半选择性屏障,该屏障对于肺气体交换,调节液体和可溶物在血液与肺间质之间的流动具有重要意义。 本公司生产的大鼠肺微血管内皮细胞总量约为5×105cells/瓶,细胞纯度 75%~85%,且不含有HIV-1、HBV、HCV、支原体、细菌、酵母和真菌等。 5、培养基信息: 1)培养基类型:1640培养基(GIBCO,添加NaHCO31.5g/L,Sodium Pyruvate0.11g/L) 2)添加因子:优质胎牛血清10%,细胞生长因子等 大鼠肺微血管内皮细胞使用方法: 收到细胞后,请按照以下方法进行操作。 1.取出25cm2培养瓶,75%酒精消毒,拆下封口膜,放入37℃,5%CO2细胞培养箱中静置6-8小时或者过夜,以稳定细胞状态。 2.待细胞达到80%汇合时准备进行传代培养。 3.细胞传代 1)吸出25cm2培养瓶中的培养基,用PBS清洗细胞一次;
图Ⅷ-1整体骨骼侧面观The skeleton. Lateral View 图Ⅷ-2整体骨骼左前面观The skeleton. Left anterior view 1肋骨rib 2胸椎thoracic vertebra 3颈椎cervical vertebra 4颅骨cranium 5肩胛骨scapula 6肱骨hiimeius 7桡骨radius 8尺骨ulna 9掌骨metacarpal bone 10指骨digital bone 11腰椎lumbar vertebra 12髂骨ilium 13尾骨coccyx 14股骨femur 15髌骨patella 16腓骨fubula 17胫骨tibia 18跖骨metatarsal bone 19趾骨digital bone
图Ⅷ-4头骨侧面The skull. Lateral aspect
图Ⅷ-6下颌骨侧面The mandible. Lateral aspect
1枕骨occipital bone 2顶间骨interparietal bone 3矢状缝sagittal suture 4颧骨malar bone 5上颌骨maxillary bone 6前颌骨premaxillary bone 7枕外嵴external occipital creat 8顶骨parietal bone 9额骨frontal bone 10鼻骨nasal bone 11鼻间缝internasal suture 12前筛孔preethmoid pore 13蝶腭孔sphenopalatine foramen 14门齿 incisor tooth 15下颌骨mandible 16视神经孔optic foramen 17枕骨occipital bone 18茎突styloid process 19外耳道external acoustic meatus 20颞骨temporal bone 21 腭裂patoschisis 22臼齿molar tooth 23腭骨palatine bone 24翼孔pterygoid apertures 25破裂孔foramen lacerum 26枕大孔foramen magnum 27腭后孔posterior palatine foramen 28鼻后孔posterior nasal apertures 29卵圆孔foramen ovale 30鼓骨tympanic bone 31舌下神经孔hypoglossal foramen 32下颌联合mandibular symphysis 33颏孔mental foramen 34冠状突coronoid process 35下颌支ramus of mandible 36角状突process of horn 37下颌孔mandibular foramen 38翼肌窝pterygoid fossa 39髁突condylar process
大鼠和小鼠尾静脉注射技巧与心得 2009/04/01 16:02[分子|细胞|病毒|免疫 ] 1. 将小鼠固定好,将尾巴拉直,绷紧,这是成功的第一步。 小鼠性情较温顺,一般不会咬人,比较容易抓取固定。通常用右手提起小鼠尾巴将其放在鼠笼盖或其它粗糙表面上,在小鼠向前挣扎爬行时,用左手拇指和食指捏住其双耳及颈部皮肤,将小鼠置于左手掌心、无名指和小指夹其背部皮肤和尾部,即可将小鼠完全固定。在一些特殊的实验中,如进行尾静脉注射时,可使用特殊的固定装置进行固定,如尾静脉注射架或粗的玻璃试管。如要进行手术或心脏采血应先行麻醉再操作,如进行解剖实验则必须先行无痛处死后再进行。 或者用这个方法:1 小鼠要固定好,自制一个笼子,前面通气,中间最好有一个挡板,让小鼠不能后退,筒子后面开一个口,尾巴从这里出来,这样固定牢靠;2、注射前尾巴用稍热的水浸泡几分钟,有利于注射;3、先远后尽,不要一开始就从尾根部,那样失败了不好办;4、进血管后注意保持稳定,针尖很容易刺穿血管的。至于能否穿进,个人手感如何,全靠自己啦。多练习,一定很快掌握的,不难,绝对不难!我练习10余只小鼠就比较熟练了 2. 用酒精棉球擦拭尾巴,使血管扩张;或者用热水或者热毛巾焐热,使静脉扩张;选用适当的针头,越细越好;在尾部较靠近上段的地方注射,这里血管比较大。用酒精或热水擦拭,擦拭的时候,可把尾巴用力扯在桌面上。注射状态为尾巴发白,紧靠白色的尾骨两侧清晰可见两根红色静脉。 3.用左手的食指,中指,无名指及大拇指将小鼠尾巴固定,; 手法:握住1ml注射器前面0.1ml处。右手小指搭在拽着鼠尾的左手拇指处按此手形进针;看针尖前面那个斜面有3/4(关键),如果血管充盈则进1/2,进入,停,上挑针头,进针;左右轻摆动,如可动,可注射。 原则是:把你第一次打进的手形,完全固定下来,每次都重复。 4.注射:注射时左手扯尾,使尾巴紧贴桌面,尾巴与桌边紧贴转弯处为进针部位,一般选择距尾尖1/4或1/3处进针,此处皮肤较薄,血管清晰,进针容易。进针时针头与桌面平行,针尖稍稍朝下,从中指及无名指与拇指接触处稍上方进针,一旦进入,须将针头稍稍上挑进入,针头沿血管进入,肉眼可关察到针头前进。如果针头在血管中前进,可明显地感觉到针行通畅,毫无阻力。若针头不在血管中,手感针行有阻力,有一种堵的感觉。进针时不要太深,针头入皮肤后马上把针头略往上,平行进针,针扎入时有落空感,推液时无阻力则说明成功了!如针头处出现皮丘则说明在皮下,推出重来。进针处最好在尾巴的1/3-1/2处,甚至可以更下一点。这样一次失败了还可以往上再来,不要马上在最高处打,因为你们要打这么多天。要为以后作准备。用热水、酒精、红外都可以扩张血管。可以视情况而用。总而言之,最重要的是“熟能生巧”。你最好先练习一下或请高手相助。不然到了最后几天,真的很难打的。 2。注射:针进入后,切记手不可发抖,因为血管壁非常薄,容易扎穿。推药时,要缓推。若进针成功,推药顺畅,无阻力;若推药时感觉有阻力,说明针头不在血管中,须及时拔出,重新进针。一般选用4号或4号半针头。最好用打疫苗的2毫升一次性注射器。尾静脉注射并不难,主要是一种感觉。若用上十只鼠练手,你必会找到感觉。心要静,手要稳,要有耐心。我研一的时候尾静脉注射让我头疼万分,越急越打不进去。后来静下心来,边注射边找感觉,很快就熟练了。 祝你找到感觉 5.通过看有无回血来测试针是否在静脉内; 6.注射. 做到以上步骤,保证注射成功! 注:(1)如果做细胞移植时,应该尽量把细胞打散,不然很容易引起栓塞! (2)练习:建议你先用蓝墨水练手,因为新手往往看不出打入的是皮下还是静脉 其实真的只能熟能生巧一般推荐在尾下1/3处进针,但是我觉得1/2处准确度较好,个人经验针头可以插深入些,防止意外摆动戳破静脉而注入皮下,很多时候你觉得进了血管打的却是皮下,就是因为这个原因。 或者用:经常尾经脉注射胎盘兰,比较容易,静脉在侧面比较粗的那个,可以做个容器,我们是用一个50ml的离心管前面弄个开口,后面的螺盖弄个洞,把老鼠装进去,比较容易,把都对准管小鼠自动进去,把尾巴从盖子的洞穿出来,操作极为方便。刮毛,用热水烫一下,血管涨起来就可以,具体的感觉还要自己实践一下掌握,不过还容易,有3-4只就可以掌握。
图Ⅷ-31左心房与左心室The left atrium and left ventricle 11左心房left atrium 12左心室left ventricle 13肺动脉右支right branch of pulmonary artery 14肺静脉pulmonary vein 15前腔静脉precavalvein 16肺动脉左支left branch of pulmonary art 7tery 17后腔静脉postcaval vein 18心中静脉 middle cardiac vein 19头臂动脉brachiocephalic artery 20主动脉弓aortic arch 21乳头肌papillary muscles 22左颈总动脉left common carotid artery 23左锁骨下动脉left subclavian artery 24右前腔静脉right precaval vein 25心外膜extracardium
图Ⅷ-56前肢内侧面The anterior limb. Medial aspect
图Ⅷ-57后肢内侧面(1)The posterior limb. Medial aspect(1) 1腋神经axillary nerve 2桡神经radial nerve 3头静脉cephalic vein 4正中神经median nerve 5正中动脉median artery 6肌支muscular branch 7尺神经ulnar nerve 8臂动脉brachial artery 9胸长神经long thoracic nerve 10胸外侧动脉external thoracic artery I1颈总动脉common carotid artery 12主动脉弓aorta arch 13左心耳left auricle 14右心耳right auricle 15食管esophagus 16胸主动脉thoracic aorta 17腹壁浅动脉superficial epigastric artery 18腹壁浅静脉superficial epigastric vein 19隐动脉saphenous artery 20隐大静脉great saphenous vein
文章编号:1001-6910(2002)05-0060-03?中医药研究进展? 大鼠脑缺血模型研究进展 王 军综述,陈国华审校 (河南省中医药研究院,河南郑州450004) 摘 要:脑缺血实验动物是研究缺血性脑血管病不可缺少的工具,大鼠为最常见的实验动物。文章就常用大鼠脑缺血动物模型制作方法、影响因素及优缺点作一综述。 关键词:脑缺血 动物模型,动物大鼠 综述 中图分类号:R25512 文献标识码:A 由于临床研究的种种限制,脑缺血动物模型已成为研究脑血管病损伤机理和防治措施不可缺少的工具。多数学者更倾向于选用大鼠复制脑缺血模型,主要由于:①大鼠脑血管解剖特点比较接近人类;②有关大鼠生理、生化、形态及药理等方面的实验资料比较丰富,有利于进行研究和比较;②价格低廉,可进行较大量重复实验;④纯种鼠属近亲交配,品种相对一致,脑血管解剖和生理机能变异较小;⑤大脑体积小,有利于进行固定染色及病理组织学观察[1]。 1 全脑缺血模型 1.1 二血管阻断缺血模型 阻断双侧颈总动脉(CC A)加动脉放血造成低血压而形成前脑缺血。单纯结扎双侧CC A而不降低血压,则不足以使脑血流量(C BF)降低至缺血和能量代谢紊乱的程度。该模型是20世纪70年代由Ekolof和N ordstrom建立并用以研究不完全性脑缺血对能量代射的影响[2,3]。优点:手术简单,失败率低。缺点:仅形成不完全性脑缺血,由于全身低血压严重干扰其它脏器的血供及实验结果。模型不能在清醒动物进行,无法进行神经行为的观察。 1.2 四动脉阻断全脑缺血模型 即双侧CC A和双侧椎动脉阻断,由Pulsinelli于1979年建立[4]。首先在麻醉状态下,经颈腹侧切口,在双CC A放入套扣并外置备用,经背正中切口在第一颈椎翼状孔下电凝双侧椎动脉。24小时后,清醒状态下经外置套扣关闭双侧CC A而形成全脑缺血,并可在一定时间放开而实现再灌流。优点:可同时在动物麻醉和清醒两种状态下进行,并能进行再灌注实验。缺点:操作复杂,且由于椎动脉与脊管前动脉间的交通支存在,个体差异较大,模型不稳定而需筛选。 1.3 三动脉阻断全脑缺血模型[5] 经麻醉动物颈正中切口,分离双侧CC A备用,剪去枕骨腹侧面部分颅骨,用5-0丝线结扎延髓腹侧面上的基底动脉,通过双侧CC A的关闭和开放实现全脑缺血再灌流。模型的成功与否可通过脑电图翻正反射进行验证。由于此模型成功率高,缺血指标的观察明确简单,可根据实验的需要,通过阻断CC A时间的长短控制脑缺血的程度等优点,已广泛用于脑缺血的药物及方法的研究。被认为是至今为止最理想的全脑缺血再灌流的动物模型。 2 局灶性脑缺血模型 由于大脑中动脉(MC A)是人群脑卒中的多发部位,因此,阻断MC A所造成的脑缺血模型被认为是一种理想的动物模型。 2.1 栓塞法 将无菌干燥研碎筛滤的血凝块[6]、碳素颗粒、塑料颗粒、花生四烯酸盐[7]及免脑粉[8]等作为栓塞剂,由颈外动脉(EC A)注入栓子后结扎EC A,开放CC A,栓子由颈内动脉(IC A)进入MC A,造成以MC A供血区脑组织损伤为主的缺血模型。但由于栓子的随机性,无法预测栓塞部位与大小,脑组织缺血不一,不利于神经症状和脑组织定量分析,且与人类卒中差异较大,使其应用受到限制。 2.2 栓线法 1985年K oizumi首次报道栓线法可逆性MC A闭塞动物模型,并在近年来不断得以完善[9,10]。由EC A插人4-0尼龙线进入IC A,阻断MC A起始端而导致局灶性脑缺血(MC AO)。通过提拉插线可造成再灌流损伤模型。优点:无需开颅,是目前唯一能观察再灌流损伤的急、慢性局灶性脑缺血模型。缺点:动物体重要求严格,该模型实质上也是一种栓塞性卒中,与人类常见卒中仍存在着差异。 2.3 光化学法 将大鼠头部固定于立体定位仪上,切开皮肤,暴露颅骨,静脉注射光敏材料虎红酸钠,用特定冷光源(500—600nm)照射切口处颅骨,光线透过颅骨与血管内的光敏物质接触,激发光化学反应而产生单线态氧,直接损伤血管内皮细胞而诱导血栓形成[11]。优点:不开颅,手术创伤小,动物易长时间存活,血栓形成过程与人类近似,适用于抗血小板、抗血栓及内皮细胞保护药物的急慢性动物实验研究。缺点:较早地导致终未动脉及微血管永久性闭塞,不利于扩血管及促进侧支循环作用的研究。 2.4 开颅法 在麻醉大鼠耳眼连线的中点垂直切开皮肤,分离颞肌,剪断颧弓,在颧弓根前方颅骨钻孔,于大脑上、下静脉间用11-0外科无创伤缝合线结扎MC A,造成MC A支配区局灶性脑缺血模型。自T amura等[12]1981年建立以来,一直受到同 ? 6 ?中医研究 2002年10月 第15卷 第5期 TC M Res.October2002V ol.15N o.5 收稿日期:2002-05-24
第八节心脑血管药理学实验方法与技术简介 心脑血管药物实验方法很多,择其要者简介如下: 一、血压测定及相关模型 血压测定法大体分为直接和间接测压法。直接测压可选用颈动脉或股动脉插管,通过压力换能器记录血压变化,一般用麻醉动物作急性实验。常用的间接测压法主要有大鼠尾容积测压及尾动脉脉搏测压法。实验性高血压模型有:1、肾血管性高血压模型(肾动脉狭窄性高血压模型),分为2肾1夹型(两侧肾完整,一侧肾动脉狭窄)、1肾1夹型(一侧肾切除,另一侧肾动脉狭窄)和2肾2夹型(两侧肾完整,两侧肾动脉狭窄),常用动物是狗和大鼠。 2、内分泌性高血压模型常用大鼠,包括DOC盐性高血压模型、肾上腺再生性高血压模型。 3、神经原性高血压模型。 4、遗传性高血压模型,根据采用的遗传学方法进行分类:①选择性近亲繁殖高血压模型(如自发性高血压大鼠SHR、Dahl盐敏感大鼠DS、米兰种高血压大鼠 MHS、遗传性高血压大鼠 GH、以色列种高血压大鼠 SBH、里昂种高血压大鼠 LH)②基因工程高血压模型高血压转基因动物(transgenic animals of hypertension)、高血压基因敲除动物(geneknockout animals of hypertension)。 研究降压药作用机理的实验方法包括:中枢降压(毁髓猫或大鼠模型、减弱神经反射性调节实验等);外周降压(神经节阻断、对传出神经递质及受体的影响、对在体血管阻力或离体血管平滑肌作用实验等)。 二、心脏与血管实验法简介 心脏实验可用在位心脏和离体心脏进行。离体心脏实验最常用的方法是Straub法、八木-Hartung法与Langendorff法。前两种方法主要观察药物直接对心脏收缩力、传导与心输出量的影响,适用于两栖类动物如青蛙、蟾蜍等离体心脏;后者适用于哺乳类动物兔、豚鼠、大鼠等,不仅可观察药物对心肌的直接作用,还可观察药物对冠脉流量的影响。本法虽然排除了神经体液的调控作用,但不能同时控制前、后负荷和心率,故又建立了离体工作心脏实验法。在位心脏实验法有Bülbring法、家兔不破坏胸膜记录心收缩力法、狗心肺装置实验法等。 冠脉血管及冠脉血流量实验法离体实验主要有冠状动脉条实验、Langendorff离体心脏测定冠脉灌流量法;在位心脏测定冠脉血流量及心肌耗氧量、测定区域性心肌血流量、86Rb 测定心肌营养血流量法。 心血管药理实验方法中的技术手段还有:清醒大鼠心功能及血流动力学实验、动物心电图、心导管技术等。 三、抗心肌缺血与再灌注损伤药物实验法简介 首先介绍心肌缺血与再灌注损伤模型的制备:①整体动物结扎冠脉后再灌注模型(常用犬、兔、大鼠进行);②离体心脏缺氧造成全心缺氧和其后的在给氧损伤,亦可结扎离体心脏的冠脉,然后松结产生局部心肌再灌注损伤;③体外心肌培养缺糖缺氧与再给糖给氧产生再灌注损伤。 心肌缺血与梗塞范围测定:组织学检查;NBT或TTC标本染色法;心肌酶活性测定(如CK、LDH);心表面NADH荧光照相法。 还可应用心肌代谢测定法观察药物的影响,如测定血或组织中的乳酸、游离脂肪酸(FFA)、丙二醛(MDA)等,一般用试剂盒检测。 四、脑缺血和脑血流实验法简介 阻断支配脑组织的血管,可模拟与人脑卒中相近似的病理模型,实验性脑缺血模型制备的方法主要有:1、全脑缺血:结扎大鼠双侧颈总动脉和椎动脉;结扎大鼠双侧颈总动脉合
大鼠尾静脉注射 首先是大鼠的固定,我用的是大鼠固定器,很好用,纹丝不动,然后就是找静脉了。两边一边一个,用酒精棉球反复擦洗后,可以看到发青的一条线,有些隐隐约约的,便是静脉了。 下来就是把尾巴拉直,看清血管走行,再就是下针了。 针,最好用5号半的,而且是头皮针,好处有: 一、针粗细合适,我试过,七号的不行,太粗了。四号的易堵。 二、针进去后,会有回血,这很关键,表示进去了。要是普通的针头,要回抽一下,且针头有些短,不易操作,尽管理论上很容易。 三、不管尾巴如何的动,只要是进去了,就不用担心脱针了。 进针时,手法是最重要的。 左手拉直尾巴,看清血管,针头与水平面成十五度到三十度的角,顺着血管的方向,斜面向上,只要斜面一进去,就立即的成水平的稍向上约1到5度,这是因为尾巴是渐粗的,便尾静脉始终是在表面的。这样的下去,一般都会看到回血了。 进针时,不要怕浅了,越浅越可能进去。 下面我把我自己的经验与大家一起分享: 1 尾静脉注射前保持良好心态,每次注射时都要坚信自己能打进去。我觉得心情很重要,我心情好时基本上每次都能打进去。我每天都要打至少二十来只,多则三四十只。所以每次打前我都保持良好心情。 2 注射前准备:用盐水瓶装好一瓶60-70度的温水,温水是用来浸泡尾静脉的,这也很重要,特别是冬天和温度比较低的天气。
注射针头消毒,准备酒精,棉花,棉签,固鼠器。 3 开始注射:把老鼠固定在固鼠器里,把它的尾巴放进盐水瓶里浸泡半分钟至一分钟,温度高时,可泡短点时间,然后再用酒精搽尾静脉,使静脉显露出来。一定要显露出形状,这样就不会盲打。在离尾静脉末端2-3cm出进针,这个地方最好进针,皮薄,静脉不滑。进去后,回抽下看下有没回血,如有回血就可以把要打进去了,如果没回血,就表明没有进静脉,重试。 打完要后,止血,要用消毒的棉签,防止感染。 如果每天要尾静脉注射的话,我觉得最好先在同一个进针孔进针,这样可以减少老鼠的痛苦,而且尾巴不容易扎坏。 注意:如果没进血管,千万别强打进去,这样的话就打到皮下了,进皮下不容易吸收,这样容易使老鼠尾巴烂掉,以后就没法打了。 鼠尾静脉有三根,左右两侧及背侧各一根,左右两侧尾静脉比较容易固定,多采用,背侧一根也可采用,但位置容易固定。操作时先将动物固定在鼠筒内或扣在烧杯中,使尾巴露出,尾部用45~50℃的温水浸润半分钟或用酒精擦拭使血管扩张,并可使表皮角质软化,以左手拇指和食指捏住鼠尾两侧,使静脉充盈,用中指从下面托起尾巴,以无名指和小指夹住尾巴的末梢,右手持注射器连4(1/2)号细针头,使针头与静脉平行(小于30°),从尾下四分之一处(约距尾尖2-3 厘米)处进针,此处皮薄易于刺入,先缓注少量药液,如无阻力,表示针头已进入静脉,可继续注入。注射完毕后把尾部向注射侧弯曲以
●将大鼠腹腔注射 1 0 %水合氯醛以0。03 m L/kg麻醉,也可用3%戊巴比妥纳, 0.2ml/100g体重,注射麻醉剂后,直到身体全身变软,方可把大鼠仰卧固定在手术台 上,背部可以放置一粗试管以充分暴露腹主动脉,常规消毒后用手术剪刀沿腹正中线剪开腹腔,用小镊子轻轻扒开血管周围脂肪,再用棉球把覆盖在血管的多余脂肪擦静,直达清昕看清血管为止(用棉球可以尽量减少小血管破裂出血,影响接下来进针时的视线)。找腹主动脉在脊柱上面,腹腔静脉血管(比腹主动脉粗,黑)旁,找到后,术者先固定血管,尽可避免血管移位,左手拇指和食指固定住血管两旁的脂肪及其它脏器,无名指按住血管进针点的上端,降低血压,可以避免喷血,右手持穿刺针,针尖斜面朝下,人针角度约 30度左右,朝向心端方向刺人,深度以5 mm左右为宜,进针后可以用止血夹夹住针头,可以避免麻醉不够挣扎导致血管被针头戳破。可以反复采集多管的血样进行不同项目的测试,一般体重 2 0 0~ 3 0 0 g 的大鼠 用真空管采血可采血液 8~1 0 m L ,同周龄的老鼠,雄鼠可采的血量多余雌鼠。此方法特点是采血量多,但是只能采一次血,需要点技巧,需多次练习方可熟练。 ●图中粉红色为腹主动脉,粗、且黑为静脉 准备材料:需要一次性采血针和真空采血管 (是不是抗凝的由你自己决定) 取血方法:你应该见过护士给病人取血吧,原理是一样的,打开腹腔后,用镊子将腹腔脏器翻转到右侧(大鼠的左侧),即可见腹主动脉和后腔静脉,其中后腔静脉为暗红色,腹主动脉颜色发白.用小镊子剥离开腹主动脉旁边的筋膜组织(如果你技术熟练可以省略此步)然后用采血管做腹主动脉穿刺见回血后,另一端插入真空管之中,就会有血喷出,直到压力变小后再换一根真空管.
大鼠大脑皮层神经元细胞原代培养 南京军区总院神经内科实验室许丽丽2012年10月 一、试剂 1)Poly-L-lysine(Sigma,P2636) 2)DMEM(Invitrogen,11995-065) 3)FBS(Invitroge,10099-141) 4)Neurobasal(Invitrogen,21103-049) 5)B27(Invitrogen,17504-044) 6)GlutaMAX(Invitrogen,35050-061) 7)HBSS,noCalcium,noMagnesium(Invitrogen,14170-112) 8)0.25%Trypsin-EDTA(Invitrogen,25200-056) 9)DPBS(HyClone,SH30028.01B) 10)ddH2O 11)10%水合氯醛 12)75%酒精 二、器械 1)手术器械:组织剪x2、组织镊x1、直弯镊各x1、眼科剪x2、眼科镊直、弯各x2、显微镊x2(金钟, WA3050)、显微剪x1 2)200ml小烧杯(盛放胎鼠) 3)200目不锈钢筛 4)细胞计数器(求精) 5)50ml离心管(Corning,430828)、15ml离心管(Corning,430790)
6)6孔板(Corning,3516)或24孔板(Corning,3524)96孔板(cosrer,3599) 7)直径为60mm的培养皿(LabServ,310109010) 8)3ml移液管(Biologix,30-0138A1) 9)过滤器(Millex-GP,SLGP033RB) 10)注射器:50ml、5ml各1 11)Pipetteandpipettetips 12)冰袋、手套、棉球、棉签
各位高手提供的方法 希望对你有帮助 我今天尾静脉注射,没有经验,针进去也觉得挺顺,但一推生理盐水尾巴就变白,请问如果打到静脉里,尾巴有何反应,会不会变白?变白是不是插到皮下了呢? 尾巴变白,肯定没有打进血管,进了血管后,注射器推进很顺利,基本没有阻力,血管内也可以看见药液把血液推走。尾巴变白,且注射器推动有阻力,肯定没有进血管。 注射前用热水泡一下尾巴,打左右两侧的静脉,应该是比较好打的。 我推药液时也挺顺的。但推后尾巴变白了,血管内好像也可以看见药液把血液推走。但推走后,看到的就是血管变白了。是不是因为把红色的血液推走了,所以变白了?我说得这种情况有没进血管的可能性呢?我回抽了一下,始终未看到回血。我用的是小鼠,小鼠尾静脉注射时回抽能看到回血吗,好像即使是断尾,也只能采集到0.1ml啊。请指教一下吧?谢谢!小鼠尾静脉注射时是没有回血的,只要注射器推进顺利,且局部没有肿起,一般就是进入血管了 我是麻醉科的,尾静脉注射很熟练。 经验是:1-尾静脉上止血带,使静脉充盈 2-酒精涂搽或温水浸泡 3-剃须刀备皮 4-用套管针而非普通针头,留管后见回血才能确保在静脉内,方能给药。 5-普通细针容易移位和穿破血管。 用温水浸泡时水温应该稍高一点,特别象是在冬天,温度最好是让老鼠不能耐受,即鼠尾会在水中剧烈摆动,此方法特别适用于黑色或褐色的老鼠(当然温度也不能太高,又不是煲汤,呵呵),时间10-20秒即可。进针时角度要小一些,一般15°就行了。进针深度不要太浅,否则当你把手移开准备注射时可能弄破血管。注射时不用看回血,阻力较大即是未进血管,退出重新穿刺。左右两侧的静脉以左侧稍粗,可以首先从这边注射。 在尾静脉注射时,抓住尾巴把小老鼠放在桌上或平的地方,边注射边顺势稍稍往后拉尾巴,小鼠会往前跑而不是回头,这样就能一人注射了。之所以平放是因为老鼠倒提会回头咬人,不安全!这方法是我老师教的我,很不错,一个人熟练的话一个早上能注射60只小鼠,有兴趣的不防试试! 现在的导师有几个会注射尾静脉的,真难为学生。应该是这样尾注射静脉,由一人操作,取出老鼠放到一个空笼子的食合上,尾巴从食合地金属网中穿出;分别用不同手指拉直尾巴合托起尾巴就可以了注射了,之手法慢慢炼吧。注意: 1. 尾静脉注射一定要从末端开始,注意保护尾静脉,这样你注射失败了还有机会再次注射,否着你注射越来越困难,因饰演后期无法再注射而实验失败可就惨了。除非是你指需要注射一次。 2. 认真体验针头进入血管中的滑润感,如果有了这样的体验你就可以做到一针成功。手感不好找或没有经验建议用玻璃注射器,一次性的注射器力度不好掌握。 3. 注射是轻推注射器,见到血管向上变白就是你成功了,不要想要见到回血,回血后再推你的针头在你到手间可能又穿透血管失败了。 4.不要虐待动物,同时不要让其他老鼠看到同伴遭你折磨,否则你要是做免疫研究要失败的。
大鼠和小鼠解剖图谱
图Ⅷ-1整体骨骼侧面观The skeleton. Lateral View 图Ⅷ-2整体骨骼左前面观The skeleton. Left anterior view 1肋骨rib 2胸椎thoracic vertebra 3颈椎cervical vertebra 4颅骨cranium 5肩胛骨scapula 6肱骨hiimeius 7桡骨radius 8尺骨ulna 9掌骨metacarpal bone 10指骨digital bone 11腰椎lumbar vertebra 12髂骨ilium 13尾骨coccyx 14股骨femur 15髌骨patella 16腓骨fubula 17胫骨tibia 18跖骨metatarsal bone 19趾骨digital bone
图Ⅷ-4头骨侧面The skull. Lateral aspect
图Ⅷ-6下颌骨侧面The mandible. Lateral aspect
1枕骨occipital bone 2顶间骨interparietal bone 3矢状缝sagittal suture 4颧骨malar bone 5上颌骨maxillary bone 6前颌骨premaxillary bone 7枕外嵴external occipital creat 8顶骨parietal bone 9额骨frontal bone 10鼻骨nasal bone 11鼻间缝internasal suture 12前筛孔preethmoid pore 13蝶腭孔sphenopalatine foramen 14门齿 incisor tooth 15下颌骨mandible 16视神经孔optic foramen 17枕骨occipital bone 18茎突styloid process 19外耳道external acoustic meatus 20颞骨temporal bone 21 腭裂patoschisis 22臼齿molar tooth 23腭骨palatine bone 24翼孔pterygoid apertures 25破裂孔foramen lacerum 26枕大孔foramen magnum 27腭后孔posterior palatine foramen 28鼻后孔posterior nasal apertures 29卵圆孔foramen ovale 30鼓骨tympanic bone 31舌下神经孔hypoglossal foramen 32下颌联合mandibular symphysis 33颏孔mental foramen 34冠状突coronoid process 35下颌支ramus of mandible 36角状突process of horn 37下颌孔mandibular foramen 38翼肌窝pterygoid fossa 39髁突condylar process
小鼠尾静脉注射:高手经验谈 1、固定:小鼠一定要固定好,注射时尾巴不能动。我一直用小鼠固定器固定,另外一人用手指轻轻夹住尾巴的根部,这样一般能固定的很好。(我自己是找一个去500或者1000ml的烧杯,倒卡在桌子上,小鼠放在里面露出尾巴即可)2.对血管的选择,一般来说,小鼠尾部有三条静脉,左右两边各一根而且比较浅,容易穿刺;中间一根位置较深,不是很容易穿到,建议尽量不选择.另外穿刺选择尾部中下2/3~1/2处比较好,因为此处皮肤较薄,我的体会是可以采用75%酒精反复擦拭穿刺血管,使其充盈,并且使皮肤的角质层软化,利于穿刺. 或者在注射之前,小鼠尾巴用温水(水温约50度左右)泡大约2分钟,这样能使血管充分舒张。用干棉球擦干。 血管应选择两侧的血管,从下向上扎。这样的好处是万一一次扎不进,还可以继续使用此血管。 3.针的选择:书上说使用1毫升的注射器.有人在实践中采用的是头皮针,后接1毫升注射器.因为头皮针针头更小,对血管的损伤更小,适合多次连续给药,其次使用头皮针穿刺后,我们可以通过回血来判断穿刺是否成功.(我的体会是4号半1毫升注射器,已经足够且很容易进针) 4、注射手法:左手食指和中指上下夹注你所选择血管的靠近身体的一边,无名指和小指垫起一块纱布或者纸巾(建立一个穿刺的平面的作用),拇指压住所选血管的尾尖端,上下夹住血管的距离应以不影响右手持针上下移动为宜.(否则容易人为建立穿刺的角度,而使右手持穿刺针穿刺过深,导致穿刺失败.)右手持穿刺针,稍微挑起皮肤一点,就可以平着进针,看到回血表明成功,还可以回抽,见到回血后表明穿刺已进入血管,可以给药. 用左手将鼠尾拉直,右手持1ml注射器的中下1/3部位,针斜面向上,在尾部的下1/3-1/2处进针,针与皮肤稍成一角度(10度左右),进针后要将针头稍向上挑,然后将针向里送一点。如果在血管里,则无阻力,并且能看见针。若针看得很清晰,则扎到了皮下,若针看不清,则扎深了。可轻推液体验证。(联系那么多次,发现开始不能很顺利的进针,原因大部分就是插进去然后有个挑起的