
晶体结构
(2002年)3.(5分)
石墨晶体由如图(1)所示的C原子平面层堆叠形成。有一种常见的2H型石墨以二层重复的堆叠方式构成,即若以A、B分别表示沿垂直于平面层方向(C 方向)堆叠的两个不同层次,它的堆叠方式为ABAB……。图(2)为AB两层的堆叠方式,O和●分别表示A层和B层的C原子。
⑴在图(2)中标明两个晶胞参数a和b。
⑵画出2H型石墨晶胞的立体示意图,并指出晶胞类型。
3.(共5分)
可有多种选取方式,其中一种方式如下图所示:
(2) 请自行设计两个实验(简单说明实验操作和实验现象)来验证Ba2+确实能使平衡向左移动。
(2002年)8.(9分)
有一离子晶体经测定属立方晶系,晶胞参数a=(1=10-8cm),晶胞的顶点位置为Mg2+,体心位置为K+,所有棱边中点为F-。
⑴该晶体的化学组成是;
⑵晶胞类型是;
⑶ Mg2+的F-配位数是,K+的F-配位数是;
⑷该晶体的理论密度是g·cm-3。
⑸设晶体中正离子和负离子互相接触,已知F-的离子半径为,试估计Mg2+的离子半径是,K+的离子半径是。
8.(共9分)
⑴ MgKF3 (2分)
⑵简单立方晶胞 (1分)
⑶ 6 (1分) 12 (1分)
⑷ 3.12 g·cm-3 (2 分)
⑸ (1 分) (1 分)
(2002年)11.(4分)
NiO晶体为NaCl型结构,将它在氧气中加热,部分Ni2+被氧化为Ni3+,晶体结构产生镍离子缺位的缺陷,其组成成为Ni x O(x<1),但晶体仍保持电中性。经测定Ni x O的立方晶胞参数a=,密度为6.47g·cm-3。
⑴ x的值(精确到两位有效数字)为;写出标明Ni的价态的Ni x O晶体
的化学式 。
⑵ 在Ni x O 晶体中Ni 占据 空隙,占有率是 。 11.(共4分)
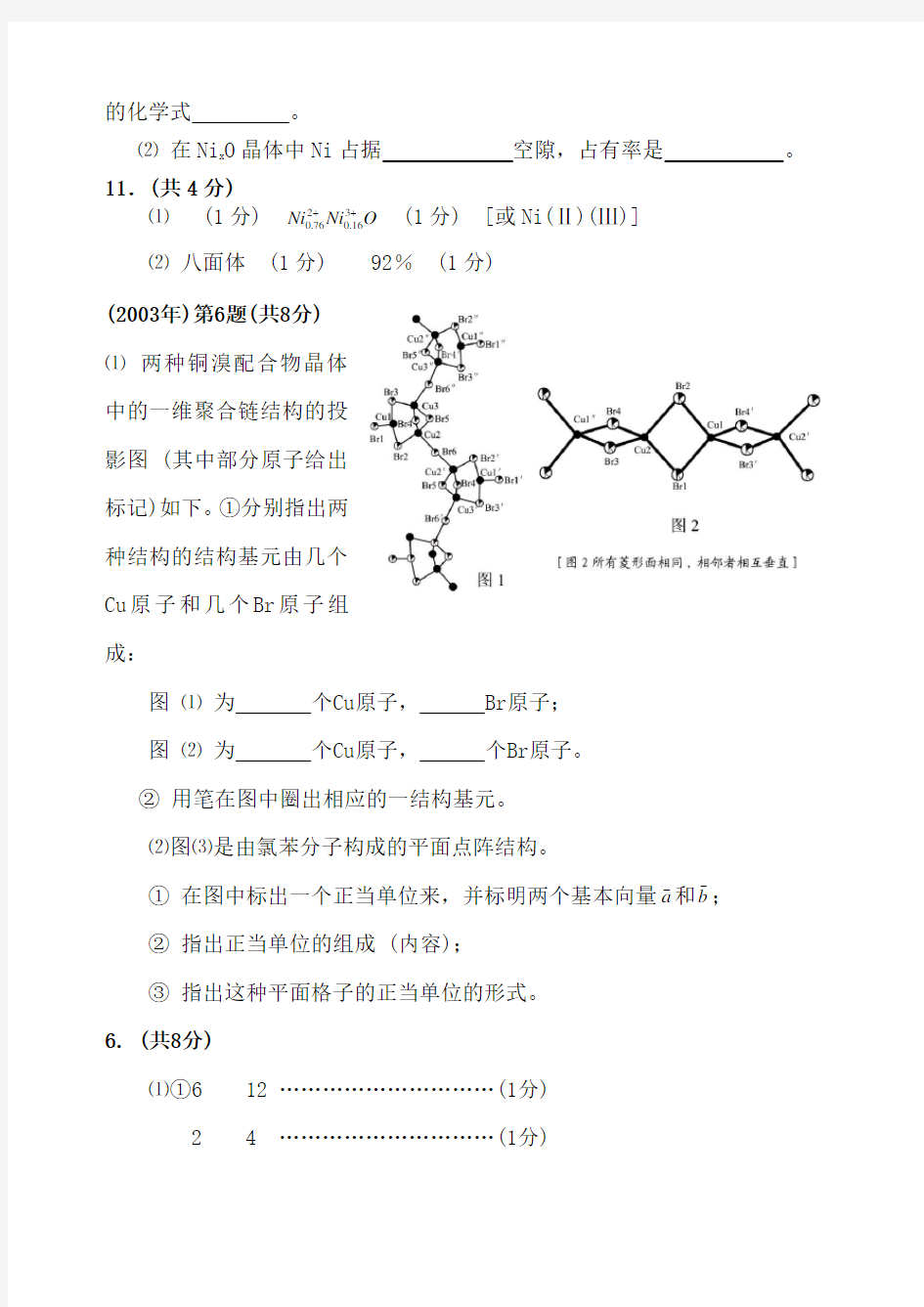
⑴ (1分) O Ni Ni ++316.0276.0 (1分) [或Ni(Ⅱ)(Ⅲ)] ⑵ 八面体 (1分) 92% (1分) (2003年)第6题(共8分) ⑴ 两种铜溴配合物晶体中的一维聚合链结构的投影图 (其中部分原子给出标记)如下。①分别指出两种结构的结构基元由几个Cu 原子和几个Br 原子组成:
图 ⑴ 为 个Cu 原子, Br 原子; 图 ⑵ 为 个Cu 原子, 个Br 原子。
② 用笔在图中圈出相应的一结构基元。 ⑵图⑶是由氯苯分子构成的平面点阵结构。
① 在图中标出一个正当单位来,并标明两个基本向量a ω和b ?
;
② 指出正当单位的组成 (内容); ③ 指出这种平面格子的正当单位的形式。 6. (共8分)
⑴①6 12 …………………………(1分) 2 4 …………………………(1分)
②结构基元如图中实线或虚线所围,也可另取。(2分)
图1 图2
⑵①此结构的正当单位和基本向量如下图所示。 (可有各种不同取法,但形式不变。) ……………(2分)
②图(3)所示结构的正当单位由两个取向相反的氯苯分子构成。…………………… (1分)
③矩形P格子…………………………………… (1分)
(2003年)第12题 (共9分)
甲烷水合物(nCH4 · 46H2O)是一种具有重要经济价值的化合物,在海洋深处蕴藏量非常大,是未来的重要能源之一。它的晶体结构可看作由五角十二面体[512]和十四面体[51262]共面连接堆积形成。在立方晶胞中,[512]的中心处在顶角和体心位置;[51262]中心位置坐标为(0,1/4,1/2)、(0,3/4,1/2)、(1/2,0,1/4)、(1/2,0,3/4)、(1/4,1/2,0)、(3/4,1/2,0)共计6个。它们彼此共用六角形面连成柱体,再和五角十二面体共面连接。右图所示为甲烷水合物中水骨架的结构。
⑴ CH4分子由于体积较小,可包合在这两种多面体中,若全部充满时,确定晶胞的组成(即n值) 。
⑵已知该晶胞参数a = 1180 pm,计算1 m3甲烷水合物晶体中可释放CH4的体积 (标准状况下)。
⑶有的文献中报导开采1 m3的甲烷水合物晶体可得到164 m3的甲烷气体,请将此文献值与(2)的计算结果比较,并给出合理的解释。
12. (共9分)
⑴ 8CH 4·46H 2O 或n = 8 ………………………(3分)
⑵ 按晶体的理想组成和晶胞参数,可算得晶胞体积V 和晶胞中包含CH 4
的物质的量n (CH 4):
V (晶胞) = a 3 = (1180 pm)3 =×l09pm 3 = ×1027-m 3
n (CH 4)=
1
231002.68-?mol =×1023-
mol
1 m 3甲烷水合物晶体中含CH 4的物质的量为:
n =3
2731064.11m m -?××1023
- mol = ×103 mol
它相当于标准状态下的甲烷气体体积:V= ×103××103-m 3=182 m 3…………(4分)
⑶ 文献报导值比实际值小,说明甲烷分子在笼形多面体中并未完全充满,即由于它的晶体中CH 4没有达到理想的全充满的结构。(实际上甲烷水合物晶体结构形成时,并不要求[512]全部都充满CH 4分子。它的实际组成往往介于6CH 4 · 46H 2O 和8CH 4 · 46H 2O 之间。) …(2分) (2004年)第5题(共10分)
长期以来人们一直认为金刚石是最硬的物质,但这种神话现在正在被打破。1990年美国伯克利大学的A .Y .Liu 和M .L .Cohen 在国际着名期刊上发表论文,在理论上预言了一种自然界并不存在的物质β-C 3N 4,理论计算表明,这种C 3N 4物质比金刚石的硬度还大,不仅如此,这种物质还可用作蓝紫激光材料,并有可能是一种性能优异的非线性光学材料。这篇论文发表以后,在世界科学领域引起了很大的轰动,并引发了材料界争相合成β-C 3N 4的热潮,虽然大块的β-C 3N 4晶体至今尚未合成出来,但含有β-C 3N 4晶粒的薄膜材料已经制备成功并验证了理论预测的正确性,这比材料本身更具重
大意义。其晶体结构见图1和图2。
⑴请分析β-C3N4晶体中,C原子和N原子的杂化类型以及它们在晶体中的成键情况:
;
⑵请在图1中画出β-C3N4的一个结构基元,该结构基元包括个碳原子和个氮原子;
⑶实验测试表明,β-C3N4晶体属于六方晶系,晶胞结构见图2(图示原子都包含在晶胞内),晶胞参数a=,c=,请列式计算其晶体密度。
ρ=
;
⑷试简要分析β-C3N4比金刚石硬度大的原因(已知金刚石的密度为
3.51g·cm-3)。
5.(共10分)
⑴β-C3N4晶体中,C原子采取sp3杂化,N原子采取sp2杂化;1个C 原子与4个处于四面体顶点的N原子形成共价键,1个N原子与3个C原子在一个近似的平面上以共价键连接 (2分)
⑵
⑶从图2可以看出,一个β-C3N4晶胞包括6个C原子和8个N原子,其晶体密度为:
37
27236.3]
1024.060sin )1064.0[(1002.68
14612---?=???????+?=
cm g ορ (2分) ⑷ β-C 3N 4比金刚石硬度大,主要是因为:①在β-C 3N 4晶体中,C 原子采取sp 3杂化,N 原子采取sp 2杂化,C 原子和N 原子间形成很强的共价键;②C 原子和N 原子间通过共价键形成网状结构;③密度计算结果显示,β-C 3N 4的密度大于金刚石,即β-C 3N 4,晶体中原子采取更紧密的堆积方式,说明原子间的共价键长很短而有很强的键合力(3分) (2004年)第11题(共9分)
BaTiO 3是一种重要的无机功能材料,工业上常用以下方法制得:将BaCl 2、TiCl 4、H 2O 和H 2C 2O 4混合反应后,经洗涤、干燥后得一组成为Ba %、Ti %、C %、H %的白色粉末A ,进一步热分解A 即可得BaTiO 3。用热分析仪测定A 的热解过程,得下图所示的质量—温度关系曲线:
图中400K 、600K 和900K 时对应的样品的质量分别为、和 试回答:
⑴ A 的化学式为 ; ⑵
在
600K
时
样
品
的
组
成
为 ;
⑶ 晶体结构分析表明,BaTiO 3为立方晶体,晶胞参数a=,一个晶胞中含有一个BaTiO 3‘‘分子”。画出BaTiO 3的晶胞结构示意图,分别指出Ba 2+、Ti(IV)、O 2-三种离子所处的位置及其配位情况。 11.(共9分)
⑴ BaTiO (C 2O 4)2·4H 2O (2分) ⑵ 2
1
BaTi 2O 5+2
1BaCO 3(2分)
⑶
Ba2+:12个O2-形成的多面体 (1分)
Ti(Ⅳ):6个O2-形成的八面体 (1分),
O2-:2个Ti(Ⅳ)和4个Ba2+形成的八面体 (1分)
(2005年)第6题 (共4分)
铌酸锂(LiNbO3)是性能优异的非线性光学晶体材料,有多种性能,用途广泛,在滤波器、光波导、表面声波、传感器、Q-开关以及激光倍频等领域都有重要的应用价值,因而是一种重要的国防、工业、科研和民用晶体材料。铌酸锂的优异性能与它的晶体结构是密不可分的,单晶X-射线衍射测试表明,铌酸锂属三方晶系,晶胞参数a=b=,c=;密度为4.64g/cm3沿着c轴方向的投影见下图,其中Li和Nb原子投影重合,它们处于氧原子投影的六边形中心。
⑴请在下图表示的二维晶体结构上画出一个结构基元。
⑵假设下图是某新型晶体材料LiNbA2沿c轴的投影图(A原子取代氧的位置),在这种晶体中,沿a方向两层Nb原子之间夹着两层A原子和一层Li原子。请写出这种新型晶体材料的晶胞类型,并画出它的一个三维晶胞的透视图。6.(共4分)
⑴
(2分)
⑵简单六方晶胞
(2分)
(2005年)第12题 (共11分)
2005年1月美国科学家在Science上发表论文,宣布发现了Al的超原子结构,并预言其他金属原子也可能存在类似的结构,这是一项将对化学、物理以及材料领域产生重大影响的发现,引起了科学界的广泛关注。这种超
原子是在Al 的碘化物中发现的,以13个Al 原子或14个Al 原子形成Al 13或Al 14超原子结构,量子化学计算结果表明,Al 13形成12个Al 在表面,1个Al 在中心的三角二十面体结构,Al 14可以看作是一个Al 原子跟Al 13面上的一个三角形的3个Al 形成Al —Al 键而获得的。文章还指出,Al l3和Al l4超原子都是具有40个价电子时最稳定。
⑴ 根据以上信息可预测Al 13和Al 14的稳定化合价态分别为 和 。A114应具有元素周期表中 类化学元素的性质,理由是: 。
⑵ 对Al 13和A114的Al —Al 键长的测定十分困难,而理论计算表明,Al 13,和Al 14中的Al —Al 键长与金属铝的Al —Al 键长相当,已知金属铝的晶体结构采取面心立方最密堆积,密度约为2.7g/cm 3,请估算Al 13和Al 14:中Al —Al 的键长。 。
⑶ Al 13三角二十面体中有多少个四面体空隙,假设为正四面体空隙,如果在其中搀杂其他原子,请通过计算估计可搀杂原子的半径最大为多少 12.(共11分)
⑴-1 +2 (Al 13- Al 142+) (2分,各1分)
碱土金属 因为Al 14容易失去2个电子而呈现+2价 (1分) ⑵ 根据晶体密度公式可得:323
7
.21002.64
27a N MZ V A =???==ρ 故晶胞参数α=405pm
因为金属铝形成面心立方晶胞,所以原子半径与晶胞参数之间的关系为: 所以估计Al-Al 键长约为:2r=2×143pm=286pm (3分) ⑶ 有20个四面体空隙 (2分) 设Al 的半径为R ,正四面体空隙可以填充的内切球半径为r ,
则正四面体边长b=2R ,立方体边长R 2,
立方体对角线为:R R R 6])2()2[(2
122
=+
所以Pm pm R R r 2.32143225.0225.0)12
6
(=?==-= (3分)
(2006年)第9题(7分)
1987年,研究者制出一种高温超导材料钆钡铜氧,
其近似化学式为YBa2Cu3O7-(根据正负价平衡,实际上O的个数在6、7之间。故写为7-或6+),其临界温度(Tc)达到92K。
20多年来,此类研究不断深入,2006年5月,有研究者称制得了Tc达150K的氧化物超导材料,图A为该超导材料的一个晶胞,其中四方锥和四边形的元素组成如图B所示,且四方锥的顶点和四边形的中心均落在晶胞的棱上。仔细观察图,回答下列问题:
9-1 研究表明这类超导体中都有金属-氧层,即晶胞中在c轴几乎同一高度上排列着金属原子和氧原子。此晶胞中有个Cu-O层,
在Cu-O层中Cu的配位数是,O的配位数是。
9-2 除了Cu-O层以外,此晶体中还有的金属-氧层是。
9-3 该晶体的近似化学式为。
9-4 研究还发现(1)当该晶体中金属-氧层完全对称排列时,其临界温度只有87K。(2)高温超导材料YBa2Cu3O7-中也有Cu-O层。请据此提出研制新的高温超导材料的一个建议:
第9题(7分)
9-1 6 (1分) 4 2 (每空分,共1分)
9-2 Ba-O层, (In,Sn)-O层 (2分)
9-3 (In,Sn)Ba4Tm4Cu6O18+ [(In,Sn) Ba4Tm4Cu6O18也算对。In,Sn个数可用其他方式表达,之和为2即可](2分)
9-4 改变金属-氧层的排列方式或用其他元素替换Y或In (1分) (2006年)第10题(9分)
锂离子电池、金属氢化物-镍电池(MH-Ni)、无水碱性锌-锰电池、燃料
电池、太阳能电池等是21世纪理想的绿色环保电源。其中液态锂离子电池是指Li+嵌入化合物为正负电极的二次电池。正极采用锂化合物LiCoO2、LiNiO2或LiMn2O4,负极采用碳电极,充电后成为锂-碳层间化合物Li x C6(0 10-1 在电池放电时,Li+在两个电极之间往返嵌入和脱嵌。写出该电池的充放电反应方程式: 10-2 金属锂放电容量(3861mAh·g-1)最大。其中mAh的意思是指用1毫安(mA)的电流放电1小时(h)。则:理论上LiMn2O4的放电容量是mAh·g-1。 10-3 1965年,Juza提出石墨层间化合物组成是LiC6,锂离子位于石墨层间,其投影位于石墨层面内碳六圆环的中央。试在下图中用“·”画出Li 的位置。并在此二维图形上画出一个晶胞。 10-4 LiC6的晶胞参数a=b=。锂插入后,石墨层间距为。试以此计算LiC6的密度。 第10题(9分) 10-1 LiCoO2+6C Li1-x CoO2+Li x C6 (2分) 10-2 96500×1000÷3600÷181=148 mAh·g-1 (2分) 10-3 位置正确 (1分) 晶胞(2分) 10-4 V=abcsin60°=×10-23cm3 m=+×6)/×1023=×10-22g ρ=m/V=2.25g·cm-3 (2分) (2006年)第11题(8分) C60的发现开创了国际科学的一个新领域,除C60分子本身具有诱人的性质外,人们发现它的金属掺杂体系也往往呈现出多种优良性质,所以掺杂C60成为当今的研究热门领域之一。经测定C60晶体为面心立方结构,晶胞参数a=1420pm。在C60中掺杂碱金属钾能生成盐,假设掺杂后的K+填充C60分子堆积形成的全部八面体空隙,在晶体中以K+和C60-存在,且C60-可近似看作与C60分子半径相同的球体。已知C的范德华半径为170pm,K+的离子半径133pm。11-1 掺杂后晶体的化学式为;晶胞类型为; 如果为C60-顶点,那么K+所处的位置是;处于八 面体空隙中心的K+到最邻近的C60-中心的距离是 pm。 11-2 实验表明C60掺杂K+后的晶胞参数几乎没有发生变化,试给出理由。11-3 计算预测C60球内可容纳的掺杂原子的半径。 第11题(8分) 11-1 KC60面心立方晶胞体心和棱心 710pm (各1分,共4分) 11-2 C60分子形成面心立方最密堆积,由其晶胞参数可得C60分子的半径:所以C60分子堆积形成的八面体空隙可容纳的球半径为: r(容纳)=×r(堆积)=×502=208pm 这个半径远大于K+的离子半径133pm,所以对C60分子堆积形成的面心立方晶胞参数几乎没有影响(2分) 11-3 因r(C60)=502pm,所以C60球心到C原子中心的距离为:502-170=332 pm 所以空腔半径,即C60球内可容纳原子最大半径为:332-170=162 pm (2007年)第10题(8分) 利用氢能离不开储氢材料。利用合金储氢的研发,以获得重大进展。研究发现LaNix是一种很好的储氢合金。(相对原子质量:) LaNix属六方晶系(图c),晶胞参数a 0=511pm,c 0=397pm。储氢位置有两种,分别是八面体空隙(“■”)和四面体空隙(“▲”),见图a、b,这些就是氢原子存储处。有氢时,设其化学式为LaNixHy。 10-1 合金LaNix中x的值为________;晶胞中和“■”同类的八面体空隙有______个,并请在图a中标出;和“▲”同类的四面体空隙有______个,并请在图b中标出。 10-2 若每个八面体空隙中均储有H,LaNixHy中y的值是_______。 10-3 若H进入晶胞后,晶胞的体积不变,H的最大密度是____________ g · cm-3 第10题(8分) 10-1 5 (1分) 3 (1分) 6(1分) 10-2 3 (1分) 10-3 (2分) (1分) (2007年)第11题(7分) 同时具备几种功能的多功能材料往往具有特殊的用途而成为材料领域的热点。南京师大结构化学实验室最近设计合成了一种黄色对硝基苯酚水合物多功能晶体材料: C6H5NO3·。实验表明,加热至94℃时该晶体能由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,即具有可逆热色性;同时实验还表明它具有使激光倍频的二阶非线性光学性质。X-射线衍射结果表明该晶体属于单斜晶系,晶胞参数a= pm,b= pm,c=,α=γ=°,β=°,密度1.535 g · cm-3,在晶体中水分子通过氢键把对硝基酚分子连接起来而形成层状结构。 11-1 在上述晶体中形成氢键的氧原子坐标为(,,;,,;,,),请计算晶体中氢键的键长。 11-2 预期上述晶体材料可以作为掺杂材料的主体,在层间嵌入某种金属离子而形成具有特殊功能的掺杂材料,嵌入离子的密度与材料性质密切相关。假设在晶体中每个苯环通过静电与一个嵌入离子相互作用,试计算每立方厘米上述晶体能嵌入离子的数目。 11-3 热分析试验表明,当温度升高到94℃时该晶体开始失重,到131℃重量不再变化,比原来轻了%。试给出该晶体完全变色后的化学式;并据此分析具有可逆热色性的原因;设计一个简单的实验来验证这种分析。 第11题(7分) 11-1 γ氢键 = pm(2分) 11-2 晶胞体积V=**(180—= 根据密度计算公式可得每个晶胞中含苯环数: 每立方厘米包含的嵌入离子数: (2分) 11-3 C 6H 5NO 3 ·的相对分子质量是166,166的%刚好是个H 2O 的重量, 说明从变色开始到完全变色是因为该晶体失去全部结晶水,从而变色后的化学式为C 6H 5NO 3。具有 可逆热色性的原因是:晶体加热到某一温度失去结晶水,晶体结果发生变化;温度降低,晶体又可以吸收空气中的水而是晶体结果幅员从而颜色复原。验证实验:把加热变色后的晶体防入实验室的干燥器中,会发现在温度降低后颜色不能复原,而拿到空气下晶体颜色很快就能复原,说明吸收了空气中的水而使晶体结构得到了还原。所以失水和吸水是该晶体呈现可逆热色性的根本原因 (3分) (2008年)11.(共10分) 热电材料又称温差电材料,是一种利用材料本身温差发电和制冷的功能材料,在能源与环境危机加剧和提倡绿色环保的21世纪,具有体积小、重量轻、无传动部件和无噪声运行等优点的热电材料引起了材料研究学者的广泛重视。近来,美国科学家在国际着名学术期刊Science 上报道了一种高效低温的热电材料,下图是其沿某一方向的一维晶体结构。 11-1在上图中画出它们的结构基元;结构基元的化学式分别为图 1_________,图2___________。 11-2现在,热材料的研究主要集中在金属晶体上,Ti 就是制备热电材料的重要金属之一,已知Ti 的原子半径为145pm ,作A3型堆积,请计算金属晶体Ti 的晶胞参数和密度。 11-3电热晶体NiTiSn 是着名的Half-Heusler 化合物结构,Sn 作A1型堆积, 图 1 图2 Ti 填充Sn 的八面体空隙,Ni 在Ti 的周围形成四面体,并且相邻Ni-Ti 和 Ni-Sn 距离相等,试画出一个NiTiSn 的晶胞结构图,并用文字说明Ni 的位置。 11-4纳米粒子的量子尺寸可以显着提高材料的热电性能,表面原子占总原子数的比例是其具有量子尺寸效应的重要影响因素,假设某NiTiSn 颗粒形状为立方体,边长为NiTiSn 晶胞边长的2倍,试计算表面原子占总原子数的百分比(保留一位小数)。 第11题 (10分) 参考答案: 11-1 (1分) (1 分) 注:实线或虚线部分画一个即可。 结构基元的化学式分别是图1 CdBr 3 ,图2 Bi 2Te 3 。(各1分) 11-2 晶胞参数:Ti 作A3型堆积,所以为如图所示六方晶胞。 在A3型堆积中取出六方晶胞,平行六面体的底是平行四边形,则晶胞参数: a = b = 2r = 2145 = 290pm 由晶胞可以看出,六方晶胞的边长c 为四面体高的两倍,即: 晶体密度: 平行四边形的面积: () 3 3 10 -23/61.41014528106.0247.9 22cm g NV M =?????= =晶胞 ρ(2分) 2 2360sin a a a S =?=ο 11-3 NiTiSn的晶胞结构图: Ni处在Sn的一半四面体空隙中,(或Ni处在一半小立方体中)。(2分)11-4 边长为NiTiSn晶胞边长2倍的纳米颗粒的总原子数=53+4×8=157 表面原子数=52×6-8×2-12×3=98 或:表面原子数=53-33=98 表面原子数/总原子数=98/157=%(2分) (2000)4.理想的宏观单一晶体呈规则的多面体外形。多面体的面叫晶面。今有一枚 MgO单晶如附图1所示。它有6个八角形晶面和8个正三角形晶面。宏观晶体的晶面 是与微观晶胞中一定取向的截面对应的。已知MgO的晶体结构属NaCl型。它的单晶 的八角形面对应于它的晶胞的面。请指出排列在正三角形晶面上的原子(用元素符号表示原子,至少画出6个原子,并用直线把这些原子连起,以显示它们的几何关系)。(6分) 【答案】 ; 所有原子都是Mg(3分)所有原子都是O(3分) 注:画更多原子者仍应有正确几何关系;右图给出了三角形与晶胞的关系,不是答案。 (2000)5.最近发现一种由钛原子和碳原子构成的气态团簇分子,如右图所示,顶角 和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是______。 【答案】Ti14C13(2分)说明:凡按晶胞计算原子者得零分。 (2001)第5题(5分)今年3月发现硼化镁在39K呈超导性,可能是人类对超导认识的新里程碑。在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,像维夫饼干,一层镁一层硼地相间,图5-1是该晶体微观空间中取出的部分原子沿C轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。 5-1 由图5-1可确定硼化镁的化学式为:。 5-2 在图5-l右边的方框里画出硼化镁的一个晶胞的透视图,标出该晶胞内面、棱、顶角上可能存在的所有硼原子和镁原子(镁原子用大白球,硼原子用小黑球表示)。 图5-1硼化镁的晶体结构示意图 第5题(5分)5-1 MgB2(2分)(注:给出最简式才得分) 或 a = b ≠ c,c轴向上(3分) 5-2 (注:任何能准确表达出Mg︰B=1︰2的晶胞都得满分,但所取晶胞应满足晶胞是晶体微观空间基本平移单位的定义,例如晶胞的顶角应完全相同等。) (2001)第10题(5分)最近有人用一种称为“超酸”的化合物H(CB11H6Cl6) 和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11H6Cl6]-。回答如下问题: 10-1 以上反应看起来很陌生,但反应类型上却可以跟中学化学课本中的一个化学反应相比拟,后者是:。 10-2 上述阴离子[CB11H6Cl6]-的结构可以跟图10-1的硼二十面体相比拟,也是一个闭合的纳米笼,而且,[CB11H6Cl6]-离子有如下结构特征:它有一根轴穿过笼心,依据这根轴旋转360°/5的度数,不能察觉是否旋转过。请在图10-1右边的图上添加原子(用元素符号表示)和短线(表示化学键)画出上述阴离子。 图10-1 第10题(5分)NH3+HCl = NH4Cl (2分) (注:答其他非质子转移的任何“化合反应”得1分)。(3分)(注:硼上氢氯互换如参考图形仍按正确论,但上下的C、B分别连接H和Cl,不允许互换。) (2001)第11题(10分)研究离子晶体,常考察以一个离子为中心时,其周围不同距离的离子对它的吸引或排斥的静电作用力。设氯化钠晶体中钠离子跟离它最近的氯离子之间的距离为d,以钠离子为中心,则: 11-1 第二层离子有个,离中心离子的距离为 d,它们是离子。 11-2 已知在晶体中Na+离子的半径为116pm,Cl-离子的半径为167pm,它们在晶体中是紧密接触的。求离子占据整个晶体空间的百分数。 11-3 纳米材料的表面原子占总原子数的比例极大,这是它的许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和形状恰等于氯化钠晶胞的大小和形状,求这种纳米颗粒的表面原子占总原子数的百分比。 高一化学竞赛辅导——晶体的结构和性质(第12周) 学习重难点: 1.了解晶体的特性,理解晶胞。 2.. 分子晶体、原子晶体、离子晶体和金属晶体组成粒子,粒子间作用力、熔沸点、硬度、导电性; 3.理解影响晶体熔点和沸点的因素、能进行不同晶体熔沸点比较。 学习过程: 一、晶体和晶胞 1、通常人们说的固体包括两类物质: 和 。 其中,橡胶、玻璃、琥珀、树脂属于 。 晶体具有的本质特征是“自范性”。即晶体能够自发的呈现封闭的规则凸多面体的外形,非晶态物质没有自范性。 2、晶面夹角不变定律(大概了解即可) 3、晶胞 (1)用锤子轻轻敲打具有整齐外形的晶体,会发现晶体劈裂出现的心晶面与某原来晶面平行,这种现象叫做晶体的解理性。古人由晶体解理性猜测,晶体是由无数个肉眼看不到的,形状、大小、组成原子数目和种类、取向相同的微小几何体堆积而成的,后来,这种观念发展成为晶胞的概念。 (2)晶胞:整块晶体是由完全等同的晶胞无隙并置堆积而成的。 注意:永远不要将晶胞看成是一个孤立的多面体,而应视为晶体微观空间中的一个单元,看见它,就要想象它的上下左右有完全相同的晶胞。 (3)晶胞中原子的计算 [例1] 如下图,是某晶体最小的结构单元,试写出其化学式。 分析:此题采用延伸法: 顶点上的原子,被8个晶体所共用,对每一个晶体只提供81 棱边上的原子,被4个晶体所共用,对每一个晶体只提供41 面心上的原子,被2个晶体所共用,对每一个晶体只提供2 1 体心上的原子,被1个晶体所共用,对每一个晶体只提供1 据此:1:3:11:4 1 12:818::=??=z y x 化学式为 [例2] 下图是超导化合物----钙钛矿晶体中最小重复单元(晶胞)的结构。请回答: (1)该化合物的化学式为 。 (2)在该化合物晶体中,与某个钛离子距离最近且相等的其他钛离子共有 个。 [例3] 根据离子晶体的晶胞(晶体中最小重复单元),求阴、阳离子个数比的方法是: (1)处于顶点的离子,同时为8个晶胞共有,每个离子有1/8属于晶胞; (2)处于棱上的离子同时为4个晶胞共有,每个离子有1/4属于晶胞; (3)处于面上的离子,同时为2个晶胞共有,每个离子有1/2属于晶胞; (4)处于内部的离子,则完全属于该晶胞。 现有甲、乙、丙三种晶胞,可推知甲晶体化学式为 ,乙晶体的化学式为 ,丙晶体中C 与D 的个数比为 。 [例4] 下图是NaCl 晶体结构的示意图: (1)若用+ -?Na - -Cl O ,请将位置表示出来; (2)每个+ Na 周围与它最接近且距离相等的+ Na 有 个。 分析:解答此类问题常用的是“分割法”——从晶体中分出最小的结构单元,或将最小的结构单元分成若干个面。 答案:12 二、分子晶体 ①概念:只含___________的晶体,称为分子晶体。 ②构成晶体的微粒是___________ ③晶体内微粒间的作用: 分子内原子间_______________________,相邻分子之间__________________________。 ④分子晶体的物理性质是: 熔点和沸点较______,有些分子具有易挥发、升华的性质。 硬度_________,一般都是绝缘体,熔融态_______导电。 2.常见的分子晶体 ①所有____________________,如水、硫化氢、氨、氯化氢、甲烷等。 ②部分____________________,如卤素(X 2)、氧(O 2)、硫(S 8)、氮(N 2)、白磷(P 4)、碳60(C 60)、稀有气体等。 晶体结构与性质 一、晶体的常识 1.晶体与非晶体 得到晶体的途径:熔融态物质凝固;凝华;溶质从溶液中析出 特性:①自范性;②各向异性(强度、导热性、光学性质等) ③固定的熔点;④能使X-射线产生衍射(区分晶体和非晶体最可靠的科学方法) 2.晶胞--描述晶体结构的基本单元.即晶体中无限重复的部分 一个晶胞平均占有的原子数=1 8×晶胞顶角上的原子数+1 4×晶胞棱上的原子+1 2×晶胞面上的粒子数+1×晶胞体心内的原子数 思考:下图依次是金属钠(Na)、金属锌(Zn)、碘(I 2)、金刚石(C)晶胞的示意图.它们分别平均含几个原子? eg :1.晶体具有各向异性。如蓝晶(Al 2O 3·SiO 2)在不同方向上的硬度不同;又如石墨与层垂直方向上的电导率和与层平行方向上的电导率之比为1:1000。晶体的各向异性主要表现在( ) ①硬度 ②导热性 ③导电性 ④光学性质 A.①③ B.②④ C.①②③ D.①②③④ 2.下列关于晶体与非晶体的说法正确的是( ) A.晶体一定比非晶体的熔点高 B.晶体一定是无色透明的固体 C.非晶体无自范性而且排列无序 D.固体SiO 2一定是晶体 3.下图是CO 2分子晶体的晶胞结构示意图.其中有多少个原子? 二、分子晶体与原子晶体 1.分子晶体--分子间以分子间作用力(范德华力、氢键)相结合的晶体 注意:a.构成分子晶体的粒子是分子 b.分子晶体中.分子内的原子间以共价键结合.相邻分子间以分子间作用力结合 ①物理性质 a.较低的熔、沸点 b.较小的硬度 c.一般都是绝缘体.熔融状态也不导电 d.“相似相溶原理”:非极性分子一般能溶于非极性溶剂.极性分子一般能溶于极性溶剂 ②典型的分子晶体 a.非金属氢化物:H 2O、H 2 S、NH 3 、CH 4 、HX等 b.酸:H 2SO 4 、HNO 3 、H 3 PO 4 等 c.部分非金属单质::X 2、O 2 、H 2 、S 8 、P 4 、C 60 d.部分非金属氧化物:CO 2、SO 2 、NO 2 、N 2 O 4 、P 4 O 6 、P 4 O 10 等 f.大多数有机物:乙醇.冰醋酸.蔗糖等 ③结构特征 a.只有范德华力--分子密堆积(每个分子周围有12个紧邻的分子) CO 2 晶体结构图 b.有分子间氢键--分子的非密堆积以冰的结构为例.可说明氢键具有方向性 ④笼状化合物--天然气水合物 高中化学选修三第三章晶体结构与性质 一、晶体常识 1、晶体与非晶体比较 2、获得晶体的三条途径 ①熔融态物质凝固。 ②气态物质冷却不经液态直接凝固(凝华)。 ③溶质从溶液中析出。 3、晶胞 晶胞是描述晶体结构的基本单元。晶胞在晶体中的排列呈“无隙并置”。 4、晶胞中微粒数的计算方法——均摊法 某粒子为n个晶胞所共有,则该粒子有1/n属于这个晶胞。中学常见的晶胞为立方晶胞。 立方晶胞中微粒数的计算方法如下: ①晶胞顶角粒子为8个晶胞共用,每个晶胞占1/8 ②晶胞棱上粒子为4个晶胞共用,每个晶胞占1/4 ③晶胞面上粒子为2个晶胞共用,每个晶胞占1/2 ④晶胞内部粒子为1个晶胞独自占有,即为1 注意:在使用“均摊法”计算晶胞中粒子个数时要注意晶胞的形状。 二、构成物质的四种晶体 1、四种晶体的比较 晶体类型分子晶体原子晶体金属晶体离子晶体熔沸点很低很高一般较高,少部分低较高 溶解性相似相溶难溶于任何溶剂难溶于常见溶剂(Na等 与水反应) 大多易溶于水等 极性溶剂 导电传热性一般不导电,溶于水 后有的导电 一般不具有导电 性(除硅) 电和热的良导体 晶体不导电,水溶 液或熔融态导电 延展性无无良好无 物质类别及实例气态氢化物、酸(如 HCl、H2SO4)、大多数 非金属单质(如P4、 Cl2)、非金属氧化物 (如SO2、CO2,SiO2 除外)、绝大多数有机 物(有机盐除外) 一部分非金属单 质(如金刚石、硅、 晶体硼),一部分 非金属化合物(如 SiC、SiO2) 金属单质与合金(Na、 Mg、Al、青铜等) 金属氧化物(如 Na2O),强碱(如 NaOH),绝大部分 盐(如NaCl、CaCO3 等) (1)不同类型晶体的熔、沸点高低一般规律:原子晶体>离子晶体>分子晶体。 金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。 (2)原子晶体 由共价键形成的原子晶体中,原子半径小的键长短,键能大,晶体的熔、沸点高。如熔点:金刚石>碳化硅>硅 (3)离子晶体 一般地说,阴阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,相应的晶格能大,其晶体的熔、沸点就越高。 (4)分子晶体 ①分子间作用力越大,物质熔、沸点越高;具有氢键的分子晶体熔、沸点反常的高。 ②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。 ③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,熔、沸点越高。 ④同分异构体,支链越多,熔、沸点越低。 (5)金属晶体 金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高。 三、几种典型的晶体模型 晶体晶体结构示意图晶体中粒子分布详解 CsCl 晶体每8个Cs+、8个Cl-各自构成立方体,在每个立方体的中心有一个异种粒子(Cs+或Cl-)。在每个Cs+周围最近的等距离(设为a/2)的Cl-有8个,在每个Cs+周围最近的等距离(必为a)的Cs+有6个(上下左右前后),在每个Cl-周围最近的等距离的Cl-也有6个 (四)竞赛专项练习题 之晶体结构 (四)晶体结构 一、(2005)(12分) LiCl和KCl同属NaCl型晶体,其熔点分别为614℃和776℃。Li+、K+和Cl-的半径分别为76pm、133pm和181pm。在电解熔盐LiCl以制取金属锂的生产工艺中,加入适量的KCl晶体,可使电解槽温度下降至400℃,从而使生产条件得以改善。 1.说明加入熔点高的KCl反而使电解温度大大下降的原因; 2.有人认为,LiCl和KCl可形成固溶体(并画出了“固溶体的晶胞”)。但实验表明,液相LiCl和KCl能以任意比例混溶而它们的固相完全不混溶(即不能生成固溶体!)。请解释在固相中完全不混溶的主要原因。 3.写出计算LiCl和KCl两种晶体密度之比的表达式(须包含离子半径的符号); 4.在KCl晶体中,K+离子占据由Cl- 离子围成的八面体空隙,计算相距最近的八面体空隙中心之间的距离。 5.实验证明,即使产生了阳离子空位,KCl晶体在室温下也不导电。请通过计算加以说明。 二、(2005)(12分)为纪念1905年爱因斯坦连续发表6篇论文导致物理学大变革100周年,今年被定为国际物理年。本题涉及的“热电效应”机理也是爱因斯坦首先阐释的,即他提出的被后人称为“爱因斯坦振荡器”的独立振荡原子与温度关系的模型。 1.左上图是热电效应之一的图解。给出图中所有英文单词(或词组)及物理学符号的意义,并为此图写一篇不超过200字(包括标点符号等)的说明文。 2.右上图是化学家合成的能实现热电效应的一种晶体的晶胞模型。图中的大原子是稀土原子,如镧;小原子是周期系第五主族元素,如锑;中等大小的原子是周期系VIII 族元素,如铁。按如上结构图写出这种热电晶体的化学式。给出计算过程。提示:晶胞的6个面的原子数相同。设晶体中锑的氧化态为-1,镧的氧化态为+3,问:铁的平均氧化态多大? 三、(2005B)(10分)固体发光材料是一种能将激发的能量转变为可见光的固体物质。在基质中掺入杂质,含量可达千分之几或百分之几,可调整发光效率、余辉及发光光谱。如在刚玉Al2O3基质中掺入0.05~1.0%的Cr3+及在Y2O3基质中掺入Eu3+等均可制成固体发光材料。 1.推测Al2O3基质中掺入Cr3+的发光原理。 2.Y2O3属立方晶系,将Y2O3的立方晶胞分为8个小立方体,Y在小立方体的面心和顶点,O位于小立方体内的四面体空隙,画出这样四个小立方体,指出Y和O的配位数。 【答案】 个六元环共有。每个六元环实际拥有的碳原子数为 ______个。C-C键夹角:_______。C原子的杂化方式是______ SiO2晶体中,每个Si原子与个O原子以共价键相结合,每个O原子与个Si 原子以共价键相结合,晶体中Si原子与O原子个数比为。晶体中Si原子与Si—O键数目之比为。最小环由个原子构成,即有个O,个Si,含有个Si-O键,每个Si原子被个十二元环,每个O被个十二元环共有,每个Si-O键被__个十二元环共有;所以每个十二元环实际拥有的Si原子数为_____个,O原子数为____个,Si-O键为____个。硅原子的杂化方式是______,氧原子的杂化方式是_________. 知该晶胞中实际拥有的Na+数为____个 Cl-数为______个,则次晶胞中含有_______个NaCl结构单元。 3. CaF2型晶胞中,含:___个Ca2+和____个F- Ca2+的配位数: F-的配位数: Ca2+周围有______个距离最近且相等的Ca2+ F- 周围有_______个距离最近且相等的F——。 4.如图为干冰晶胞(面心立方堆积),CO2分子在晶胞中的位置为;每个晶胞含二氧化碳分子的个数为;与每个二氧化碳分子等距离且最近的二氧化 碳分子有个。 5.如图为石墨晶体结构示意图, 每层内C原子以键与周围的个C原子结合,层间作用力为;层内最小环有 _____个C原子组成;每个C原子被个最小环所共用;每个最小环含有个C原子,个C—C键;所以C原子数和C-C键数之比是_________。C原子的杂化方式是__________. 6.冰晶体结构示意如图,冰晶体中位于中心的一个水分子 周围有______个位于四面体顶角方向的水分子,每个水分子通过 ______条氢键与四面体顶点上的水分子相连。每个氢键被_____个 水分子共有,所以平均每个水分子有______条氢键。 7.金属的简单立方堆积是_________层通过_________对 _________堆积方式形成的,晶胞如图所示:每个金属阳离子的 配位数是_____,代表物质是________________________。 8.金属的体心立方堆积是__________层通过 ________对________堆积方式形成的,晶胞如图: 每个阳离子的配位数是__________.代表物质是 _____________________。 晶体结构综合例题 一.有一立方晶系的离子晶体,其结构如右图所示,试回答: 1.晶体所属的点阵形式及结构基元; 2.已知=169,=181,试问此两种离于联合组成了何种型式 的密堆积; 3.2+处在何种空隙里? 4.指出各离子的配位情况? 解:1. 立方P,3 ; 2. A1型(立方面心)堆积, +,-离子半径大致相近; 3. 八面体空隙中; 4. 2+周围-配位数6,+配位数8;-周围2+配位数2,+配位数4;+周围-配位数12,2+配位数8。 二.黄铜矿是最重要的铜矿,全世界的2/3的铜是由它提炼 的。 1.右图为黄铜矿的晶胞。计算晶胞中各种原子的数目,写出 黄铜矿的化学式; 2.在高温下,黄铜矿晶体中的金属离子可以发生迁移。若铁 原子与铜原子发生完全无序的置换,可将它们视作等同的金属离 子,请说出它的晶胞。 3.在无序的高温型结构中,硫原子作什么类型的堆积? 金属原子占据什么类型的空隙?该空隙被金属原子占据的分数是 多少? 4.计算黄铜矿晶体的密度; (晶胞参数:52.4,103.0;相对 原子量:63.5 55.84 S 32.06)。 解:1. 各种原子的数目, , S: 4, 4, 8; 黄铜矿的化学式2 ; 2.它的晶胞与晶胞相同;但金属离子随机性为50%; (如图); 3.硫原子作A1型(立方F)堆积; 金属原子占据四面体空 隙; 该空隙被金属原子占据的分数1/2; 4.容易计算黄铜矿晶体的密度4.313 . 1/21/2 S 三.冰晶石(36)用作电解法炼铝的助熔剂。冰晶石晶胞是以大阴离子(63- )构成的面 心立方晶格,+ 可看作是填充在晶格的空隙中,已知冰晶石的密度为2.953,—F 键长181 ,相对原子质量: 23.0; 27.0;F 19.0。 1.指出63- 配离子中心离子的杂化轨道类型、配离子空间构型和所属分子点群。 2.指出36的点阵形式;阴离子作何种形式的堆积,阳离子占据何种空隙及占有率;写出它们的分数坐标。 3.计算冰晶石晶体的晶胞参数。 4. 计算+ 的半径。 解:1. 63- 配离子中心离子的杂化轨道类型为 3d 2杂化; 配离子空间构型为正八面体; 所属分子点群为 。 2. 36的点阵形式为立方F ;阴离子作A 1型堆积,阳离子占据100%八面体空及 100%四面体空隙;它们的分数坐标为 63-: (0,0,0) (1/2,1/2,0) (1/2,0,1/2) (0,1/2,1/2)(1分); : (1/4,1/4,1/4) (1/4,1/4,3/4) (1/4,3/4,1/4) (1/4,3/4,3/4) (3/4,1/4,1/4) (3/4,1/4,3/4) (3/4,3/4,1/4) (3/4,3/4,3/4) (1/2,1/2,1/2) (0,0,1/2) (0,1/2,0) (1/2,0,0). 3.晶胞内含4个[36]单元,36摩尔质量为210。设晶胞边长为a ,则95.21 1002.642103 23=???a 780 4. 181, 按四面体空隙计算 pm R a 1564 3 =--;按八面体空隙计算为209(舍去); 真实值为157. 四.合金可看作由下图所示的a 、b 两种原子层交替堆积排列而成:a 是由和共同组成的层,层中-之间由实线相连;b 是完全由原子组成的层,-之间也由实线相连。图中由虚线勾出的六角形,表示由这两种层平行堆积时垂直于层的相对位置。c 是由a 和b 两种原子层交替堆积成的晶体结构图。在这结构中:同一层的-为294;相邻两层的-为327。 1.确定该合金的化学式; 2.有几个原子配位(周围的原子数,不一定要等距最近); 的配位情况如何,列式计算的平均配位数; 3.该晶体属何种晶系;写出各原子的分数坐标;计算晶胞参数。 4.计算该合金的密度( 40.1 63.5) 5.计算、原子半径。 专题练习:晶体结构 1. 石墨晶体由如图(1)所示的C 原子平面层堆叠形成。有一种常见的2H 型石墨以二层重复的堆叠方式构成,即若以A 、B 分别表示沿垂直于平面层方向(C 方向)堆叠的两个不同层次,它的堆叠方式为ABAB……。图(2)为AB 两层的堆叠方式,O 和●分别表示A 层和B 层的C 原子。 ⑴ 在图(2)中标明两个晶胞参数a 和b 。 ⑵ 画出2H 型石墨晶胞的立体示意图,并指出晶胞类型。 2. 有一离子晶体经测定属立方晶系,晶胞参数a =4.00?(1?=10-8cm),晶胞的顶点位置为Mg 2+,体心位置为K +,所有 棱边中点为F -。 ⑴ 该晶体的化学组成是 ; ⑵ 晶胞类型是 ; ⑶ Mg 2+的F -配位数是 ,K +的F -配位数是 ; ⑷ 该晶体的理论密度是 g·cm -3。 ⑸ 设晶体中正离子和负离子互相接触,已知F -的离子半径为1.33?,试估计Mg 2+的离子半径是 ?,K +的离子半径是 ?。 3. NiO 晶体为NaCl 型结构,将它在氧气中加热,部分Ni 2+被氧化为Ni 3+,晶体结构产生镍离子缺位的缺陷,其组成成为 Ni x O(x<1),但晶体仍保持电中性。经测定Ni x O 的立方晶胞参数a=4.157?,密度为6.47g·cm -3。 ⑴ x 的值(精确到两位有效数字)为 ;写出标明Ni 的价态的Ni x O 晶体的化学式 。 ⑵ 在Ni x O 晶体中Ni 占据 空隙,占有率是 。 4. 完成下列各题: Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl ⑴ 两种铜溴配合物晶体中的一维聚合链结构的投影图 (其中部分原子给出标记)如下。 ①分别指出两种结构的结构基元由几个Cu 原子和几个Br 原子组成: 图 ⑴ 为 个Cu 原子, Br 原子; 图 ⑵ 为 个Cu 原子, 个Br 原子。 ② 用笔在图中圈出相应的一结构基元。 ⑵图⑶是由氯苯分子构成的平面点阵结构。 ① 在图中标出一个正当单位来,并标明两个基本向量a 和b ; ② 指出正当单位的组成 (内容); ③ 指出这种平面格子的正当单位的形式。 5. 甲烷水合物(nCH 4 · 46H 2O)是一种具有重要经济价值的化合物,在海洋深处蕴藏量非常大,是未来的重要能源之一。 它的晶体结构可看作由五角十二面体[512]和十四面体[51262]共面连接堆积形成。在立方晶胞中,[512]的中心处在顶角和体心位置;[51262]中心位置坐标为(0,1/4,1/2)、(0,3/4,1/2)、(1/2,0,1/4)、(1/2,0,3/4)、(1/4,1/2,0)、(3/4, 离子晶体 氯化钠晶体 (1)NaCl晶胞每个Na+等距离且最近的Cl-(即Na+配位数)为6个 NaCl晶胞每个Cl-等距离且最近的Na+(即Cl-配位数)为6个 (2)一个晶胞内由均摊法计算出一个晶胞内占有的Na+4_个; 占有的Cl-4个。 (3)在该晶体中每个Na+周围与之最接近且距离相等的Na+ 共有12个; 与每个Na+等距离且最近的Cl-所围成的空间几何构型为正八面体 CsCl晶体(注意:右侧小立方体为CsCl晶胞;左侧为8个晶胞) (1) CsCl晶胞中每个Cs+等距离且最近的Cl-(即Cs+配位数) 为8个 CsCl晶胞中每个Cl-等距离且最近的Cs+(即Cl-配位数) 为8个,这几个Cs+在空间构成的几何构型为正方体。 (2)在每个Cs+周围与它最近的且距离相等的Cs+有6个 这几个Cs+在空间构成的几何构型为正八面体。 (3)一个晶胞内由均摊法计算出一个晶胞内占有的Cs+ 1个;占有的Cl- 1个。 CaF 2 晶体 (1)) Ca2+立方最密堆积,F-填充在全部四面体空隙中。 (2)CaF 2 晶胞中每个Ca2+等距离且最近的F-(即Ca2+配位数) 为8个 CaF 2 晶胞中每个F-等距离且最近的Ca2+(即F-配位数)为4个 (3)一个晶胞内由均摊法计算出一个晶胞内占有的Ca2+4个; 占有的F-8个。ZnS晶体: (1)1个ZnS晶胞中,有4个S2-,有4个Zn2+。 (2)Zn2+的配位数为4个,S2-的配位数为 4个。 原子晶体 金刚石金刚石晶胞金刚石晶胞 (1)金刚石晶体 a、每个金刚石晶胞中含有8个碳原子,最小的碳环为6元环,并且不在同一平 面(实际为椅式结构),碳原子为sp3杂化,每个C以共价键跟相邻的_4_个C 结合,形成正四面体。键角109°28’ b、每个碳原子被12个六元环共用,每个共价键被6个六元环共用 c、12g金刚石中有2mol共价键,碳原子与共价键之比为 1:2 1998-2008年高中化学竞赛(初赛)有关晶体结构的试题及答案解析 2008第3题(8分) X-射线衍射实验表明,某无水MgCl2晶体属三方晶系,呈层形结构,氯离子采取立方最密堆积(ccp),镁离子填满同层的八面体空隙;晶体沿垂直于氯离子密置层的投影图如下。该晶体的六方晶胞的参数:a=363.63pm,c=1766.63pm;p=2.53g·cm-3。 3-1 以“”表示空层,A、B、C表示Cl-离子层,a、b、c表示Mg2+离子层,给出三方层 型结构的堆积方式。 3-2计算一个六方晶胞中“MgCl2”的单元数。 3-3 假定将该晶体中所有八面体空隙皆填满Mg2+离子,将是哪种晶体结构类型? 第3题(10分) 3-1 ··· AcB CbA BaC A ···(5分) 大写字母要体现出Cl-层作立方最密堆积的次序,镁离子与空层的交替排列必须正确,镁离子层与氯离子层之间的相对位置关系(大写字母与小写字母的相对关系)不要求。必须表示出层型结构的完整周期,即至少写出包含 6 个大写字母、3 个小写字母、3个空层的排列。若只写对含 4 个大写字母的排列,如“··· AcB CbA ···”,得2.5 分。 3-2 (3分) Z 的表达式对,计算过程修约合理,结果正确(Z =3.00—3.02,指出单元数为整数 3),得 3 分。Z 的表达式对,但结果错,只得 1 分。 3-3 NaCl 型 或 岩盐型(2 分) 2007第1题 (14分) 1-1 EDTA 是乙二胺四乙酸的英文名称的缩写,市售试剂是其二水合二钠盐。 (1)画出EDTA 二钠盐水溶液中浓度最高的阴离子的结构简式。 C H 2N C H 2H 2C N H 2C CH 2 H 2C COO -COO - -OOC -OOC H H (2分) 答(- OOCCH 2)2NCH 2CH 2N(CH 2COO -)2H H 或CH 2NH(CH 2COO -)22 得2分,质子 必须在氮原子上。 (2) Ca(EDTA)2-溶液可用于静脉点滴以排除体内的铅。写出这个排铅反应的化学方程 式(用Pb 2+ 表示铅)。 Pb 2+ + Ca(EDTA)2- = Ca 2+ + Pb (EDTA)2- (1分) (3)能否用EDTA 二钠盐溶液代替Ca(EDTA)2-溶液排铅?为什么? 不能。若直接用EDTA 二钠盐溶液,EDTA 阴离子不仅和Pb 2+反应, 也和体内的Ca 2+结合造成钙的流失。 (答案和原因各0.5 分,共 1 分) 1-2 氨和三氧化硫反应得到一种晶体,熔点205o C ,不含结晶水。晶体中的分子有一个三重 旋转轴,有极性。画出这种分子的结构式,标出正负极。 (2分) 硫氧键画成双键或画成S →O ,氮硫键画成N →S ,均不影响得分。结构式1分,正负号1分。答H 3NSO 3、H 3N-SO 3等不得分。正确标出了正负号,如+H 3NSO 3-、+H 3N-SO 3-得1分。其他符合题设条件(有三重轴,有极性)的结构,未正确标出正负极,得1分,正确标出正负极,得2分。 1-3 Na 2[Fe(CN)5(NO)]的磁矩为零,给出铁原子的氧化态。Na 2[Fe(CN)5(NO)]是鉴定S 2-的 试剂,二者反应得到紫色溶液,写出鉴定反应的离子方程式。 Fe(II) 答II 或+2也可 (2分) [Fe(CN)5(NO)]2-+S 2- = [Fe(CN)5(NOS)]4- 配合物电荷错误不得分 (1分) 1-4 CaSO 4 ? 2H 2O 微溶于水,但在HNO 3 ( 1 mol L -1)、HClO 4 ( 1 mol L -1)中可溶。写出能够 解释CaSO 4在酸中溶解的反应方程式。 CaSO 4 + H + = Ca 2+ + HSO 4 (1分) 第三章晶体结构与性质第一节晶体的常识知识归纳 一、晶体与非晶体 1.晶体与非晶体的本质差异: 2.获得晶体的三条途径 (1)______物质凝固; (2)______物质冷却不经液态直接凝固(______); (3)______从溶液中析出。 3.晶体的特点 (1)自范性 ①定义:在适宜的条件下,晶体能够自发地呈现规则的______,这称为晶体的______。非晶体物质没有这个特性。 ②形成条件:晶体______适当。 ③本质原因:晶体中粒子在______里呈现______的______排列。 (2)晶体在不同的方向上表现出不同的物理特质即______。 (3)晶体的______较固定。 (4)区分晶体和非晶体的最可靠的科学方法是对固体进行______实验。 二、晶胞 1.概念 晶胞是晶体中最小的______。 2.结构 晶胞一般都是______,晶体是由无数晶胞“______”而成。 (1)无隙:相邻晶胞之间无任何______。 (2)并置:所有晶胞都是______排列的,取向______。 (3)所有晶胞的______及内部的原子______及几何排列是完全相同的。 【答案】一、1.有周期性没有相对无序 2.(1)熔融态(2)气态凝华(3)溶质 3.(1)多面体外形性质自范性生长的速率三维空间周期性有序 (2)各向异性(3)熔点(4)X-射线衍射 二、1.结构重复单元 2.平行六面体无隙并置(1)间隙(2)平行相同(3)形状种类 知识重点 与晶体有关的计算 晶体结构的计算常常涉及如下数据:晶体密度、N A、M、晶体体积、微粒间距离、微粒半径、夹角等,密度的表达式往往是列等式的依据。解答这类题时,一要掌握晶体“均摊法”的原理,二要有扎实的立体几何知识,三要熟悉常见晶体的结构特征,并能融会贯通,举一反三。 1.“均摊法”原理 晶胞中任意位置上的一个原子如果被n个晶胞所共有,则每个晶胞对这个原子分得的份额就是1 n 。 非平行六面体形晶胞中粒子数目的计算同样可用“均摊法”,其关键仍然是确定一个粒子为几个晶胞所共 有。例如,石墨晶胞每一层内碳原子排成六边形,其顶点(1个碳原子)对六边形的贡献为1 3 ,那么一个六 边形实际有6×1 3 =2个碳原子。又如,在六棱柱晶胞(如下图所示的MgB2晶胞)中,顶点上的原子为6个 晶胞(同层3个,上层或下层3个)共有,面上的原子为2个晶胞共有,因此镁原子个数为12×1 6 +2× 1、晶体类型判别: 分子晶体:大部分有机物、几乎所有酸、大多数非金属单质、所有非金属氢化物、部分非金属氧化物。 原子晶体:仅有几种,晶体硼、晶体硅、晶体锗、金刚石、金刚砂(SiC)、氮化硅 (Si3N4)、氮化硼(BN)、二氧化硅(SiO2)、氧化铝(Al2O3)、石英等; 金属晶体:金属单质、合金; 离子晶体:含离子键的物质,多数碱、大部分盐、多数金属氧化物; 2、分子晶体、原子晶体、金属晶体、离子晶体对比表 晶体类型分子晶体原子晶体金属晶体离子晶体 定义分子通过分子间 作用力形成的晶 体 相邻原子间 通过共价键 形成的立体 网状结构的 晶体 金属原子通 过金属键形 成的晶体 阴、阳离子通 过离子键形成 的晶体 组成晶体的粒子分子原子金属阳离子 和自由电子 阳离子和 阴离子 组成晶体粒子间的相互作用范德华力或氢键共价键 金属键(没 有饱和性方 向性) 离子键(没有 饱和性方向 性) 典型实例冰(H2O)、 P4、I2、干冰 (CO2)、S8 金刚石、晶 体硅、 SiO2、SiC Na、Mg、 Al、Fe NaOH、 NaCl、K2SO4 特征熔点、 沸点 熔、沸点较低熔、沸点高 一般较高、 部分较低 熔、沸点较高导热性不良不良良好不良 导电性 差,有些溶 于水可导电 多数差良好 固态不导电, 熔化或溶于水 能导电 机械加 工性能 不良不良良好不良 硬度硬度较小高硬度 一般较高、 部分较低 略硬而脆 溶解性相似相溶不溶 不溶,但有 的反应 多数溶于水, 难溶于有机溶 剂 3、不同晶体的熔沸点由不同因素决定: 离子晶体的熔沸点主要由离子半径和离子所带电荷数(离子键强弱)决定,分子晶体的熔沸点主要由相对分子质量的大小决定,原子晶体的熔沸点主要由晶体中共价键的强弱决定,且共价键越强,熔点越高。 4、金属熔沸点高低的比较: (1)同周期金属单质,从左到右(如Na、Mg、Al)熔沸点升高。 晶 体结构 (2002年)3.(5分) 石墨晶体由如图(1)所示的C 原子平面层堆叠形成。有一种常见的2H 型石墨以二层重复的堆叠方式构成,即若以A 、B 分别表示沿垂直于平面层方向(C 方向)堆叠的两个不同层次,它的堆叠方式为ABAB……。图(2)为AB 两层的堆叠方式,O 和●分别表示A 层和B 层的C 原子。 ⑴ 在图(2)中标明两个晶胞参数a 和b 。 ⑵ 画出2H 型石墨晶胞的立体示意图,并指出晶胞类型。 3.(共5分) 可有多种选取方式,其中一种方式如下图所示: (2) 请自行设计两个实验(简单说明实验操作和实验现象)来验证Ba 2+确实能使平衡向左移动。 (2002年)8.(9分) 有一离子晶体经测定属立方晶系,晶胞参数a =?(1?=10- 8cm),晶胞的顶点位置为Mg 2+,体心位置 为K +,所有棱边中点为F -。 ⑴ 该晶体的化学组成是 ; ⑵ 晶胞类型是 ; ⑶ Mg 2+的F -配位数是 ,K +的F -配位数是 ; ⑷ 该晶体的理论密度是 g·cm -3。 ⑸ 设晶体中正离子和负离子互相接触,已知F -的离子半径为?,试估计Mg 2+的离子半径 是 ?,K +的离子半径是 ?。 8.(共9分) ⑴ MgKF 3 (2分) ⑵ 简单立方晶胞 (1分) ⑶ 6 (1分) 12 (1分) ⑷ 3.12 g·cm -3 (2 分) ⑸ ? (1 分) ? (1 分) (2002年)11.(4分) NiO 晶体为NaCl 型结构,将它在氧气中加热,部分Ni 2+被氧化为Ni 3+,晶体结构产生镍离子缺位的缺 陷,其组成成为Ni x O(x<1),但晶体仍保持电中性。经测定Ni x O 的立方晶胞参数a=?,密度为6.47g·cm -3。 ⑴ x 的值(精确到两位有效数字)为 ;写出标明Ni 的价态的Ni x O 晶体的化学式 。 ⑵ 在Ni x O 晶体中Ni 占据 空隙,占有率是 。 11.(共4分) ⑴ (1分) O Ni Ni ++316.0276.0 (1分) [或Ni(Ⅱ)(Ⅲ)] ⑵ 八面体 (1分) 92% (1分) (2003年)第6题(共8分) ⑴ 两种铜溴配合物晶体中的一维聚 合链结构的投影图 (其中部分原子 给出标记)如下。①分别指出两种结 构的结构基元由几个Cu 原子和几个 Br 原子组成: 图 ⑴ 为 个Cu 原子, Br 原子; (四)晶体结构 一、(2005)(12分)LiCl和KCl同属NaCl型晶体,其熔点分别为614℃和776℃。Li+、K+和Cl-的半径分别为76pm、133pm和181pm。在电解熔盐LiCl 以制取金属锂的生产工艺中,加入适量的KCl晶体,可使电解槽温度下降至400℃,从而使生产条件得以改善。 1.说明加入熔点高的KCl反而使电解温度大大下降的原因; 2.有人认为,LiCl和KCl可形成固溶体(并画出了“固溶体的晶胞”)。但实验表明,液相LiCl和KCl能以任意比例混溶而它们的固相完全不混溶(即不能生成固溶体!)。请解释在固相中完全不混溶的主要原因。 3.写出计算LiCl和KCl两种晶体密度之比的表达式(须包含离子半径的符号); 4.在KCl晶体中,K+离子占据由Cl- 离子围成的八面体空隙,计算相距最近的八面体空隙中心之间的距离。 5.实验证明,即使产生了阳离子空位,KCl晶体在室温下也不导电。请通过计算加以说明。 二、(2005)(12分)为纪念1905年爱因斯坦连续发表6篇论文导致物理学大变革100周年,今年被定为国际物理年。本题涉及的“热电效应”机理也是爱因斯坦首先阐释的,即他提出的被后人称为“爱因斯坦振荡器”的独立振荡原子与温度关系的模型。 1.左上图是热电效应之一的图解。给出图中所有英文单词(或词组)及物理学符号的意义,并为此图写一篇不超过200字(包括标点符号等)的说明文。 2.右上图是化学家合成的能实现热电效应的一种晶体的晶胞模型。图中的大原子是稀土原子,如镧;小原子是周期系第五主族元素,如锑;中等大小的原子是周期系VIII 族元素,如铁。按如上结构图写出这种热电晶体的化学式。给出计算过程。提示:晶胞的6个面的原子数相同。设晶体中锑的氧化态为-1,镧的氧化态为+3,问:铁的平均氧化态多大? 三、(2005B)(10分)固体发光材料是一种能将激发的能量转变为可见光的固体物质。在基质中掺入杂质,含量可达千分之几或百分之几,可调整发光效率、余辉及发光光谱。如在刚玉Al2O3基质中掺入0.05~1.0%的Cr3+及在Y2O3基质中掺入Eu3+等均可制成固体发光材料。 1.推测Al2O3基质中掺入Cr3+的发光原理。 2.Y2O3属立方晶系,将Y2O3的立方晶胞分为8个小立方体,Y在小立方体的面心和顶点,O位于小立方体内的四面体空隙,画出这样四个小立方体,指 晶体结构与性质 一、晶体的常识 1.晶体与非晶体 得到晶体的途径:熔融态物质凝固;凝华;溶质从溶液中析出 特性:①自范性;②各向异性(强度、导热性、光学性质等) ③固定的熔点;④能使X-射线产生衍射(区分晶体和非晶体最可靠的科学方法) 2.晶胞--描述晶体结构的基本单元,即晶体中无限重复的部分 一个晶胞平均占有的原子数=×晶胞顶角上的原子数+×晶胞棱上的原子+×晶胞面上 的粒子数+1×晶胞体心内的原子数 思考:下图依次是金属钠(Na)、金属锌(Zn)、碘(I 2 )、金刚石(C)晶胞的示意图,它们分别平均含几个原子? eg:1.晶体具有各向异性。如蓝晶(Al 2O 3 ·SiO 2 )在不同方向上的硬度不同;又如石墨与 层垂直方向上的电导率和与层平行方向上的电导率之比为1:1000。晶体的各向异性主要表现在() ①硬度②导热性③导电性④光学性质 A.①③ B.②④ C.①②③ D.①②③④ 2.下列关于晶体与非晶体的说法正确的是() A.晶体一定比非晶体的熔点高 B.晶体一定是无色透明的固体 C.非晶体无自范性而且排列无序 D.固体SiO 2 一定是晶体 3.下图是CO 2 分子晶体的晶胞结构示意图,其中有多少个原子? 二、分子晶体与原子晶体 1.分子晶体--分子间以分子间作用力(范德华力、氢键)相结合的晶体 注意:a.构成分子晶体的粒子是分子 b.分子晶体中,分子内的原子间以共价键结合,相邻分子间以分子间作用力结合 ①物理性质 a.较低的熔、沸点 b.较小的硬度 c.一般都是绝缘体,熔融状态也不导电 d.“相似相溶原理”:非极性分子一般能溶于非极性溶剂,极性分子一般能溶于极性溶剂 ②典型的分子晶体 a.非金属氢化物:H 2O、H 2 S、NH 3 、CH 4 、HX等 b.酸:H 2SO 4 、HNO 3 、H 3 PO 4 等 c.部分非金属单质::X 2、O 2 、H 2 、S 8 、P 4 、C 60 d.部分非金属氧化物:CO 2、SO 2 、NO 2 、N 2 O 4 、P 4 O 6 、P 4 O 10 等 f.大多数有机物:乙醇,冰醋酸,蔗糖等 ③结构特征 a.只有范德华力--分子密堆积(每个分子周围有12个紧邻的分子) CO 2 晶体结构图 化学竞赛辅导练习6 ——晶体结构(2018-07-1) 一、求晶体的化学式和原子坐标 1.(2000)5.最近发现一种由钛原子和碳原子构成的气态团簇分子,如右图所示, 顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是 ______。 2.(2005)第2题2-2右图是化学家合成的能实现热电效应的一种晶体的晶胞模型。 图中的大原子是稀土原子,如镧;小原子是周期系第五主族元素,如锑;中等 大小的原子是周期系VIII 族元素,如铁。按如上结构图写出这种热电晶体的化 学式。给出计算过程。提示:晶胞的6个面的原子数相同。设晶体中锑的氧化 态为-1,镧的氧化态为+3,问:铁的平均氧化态多大? 3.2008第5题(5分) 1963年在格陵兰Ika峡湾发现一种水合碳酸钙矿物ikaite。它形成于冷的海水中,温度达到8o C即分解为方解石和水。1994年的文献指出:该矿物晶体中的Ca2+ 离子被氧原子包围,其中2个氧原子来自同一个碳酸根离子,其余6个氧原子来自6个水分子。它的单斜晶胞的参数为:a = 887 pm, b = 823 pm, c = 1102 pm, β = 110.2°,密度d = 1.83 g cm 3,Z = 4。 5-1 通过计算得出这种晶体的化学式。 4.(2008)第8题(9分) 由烷基镁热分解制得镁的氢化物。实验测定,该氢化物中氢的质量分数为7.6%,氢的密度为0.101 g cm 3,镁和氢的核间距为194.8 pm。已知氢原子的共价半径为37pm,Mg2+ 的离子半径为72 pm。 8-2将上述氢化物与金属镍在一定条件下用球磨机研磨,可制得化学式为Mg2NiH4的化合物。 X-射线衍射分析表明,该化合物的立方晶胞的面心和顶点均被镍原子占据,所有镁原子的配位数都相等。推断镁原子在Mg2NiH4晶胞中的位置(写出推理过程)。 二、画晶胞(同一种晶体可以取不同的晶胞,但习用晶胞有规定,是平行六面体(三维)和平行四边形(二维)) 5.(2003)第6题(12分)2003年3月日本筑波材料科学国家实验室一个研究小组发现首例带结晶水的晶体在5K下呈现超导性。据报道,该晶体的化学式为Na0.35CoO2? 1.3H2O,具高中化学竞赛-晶体结构-10年真题加完整答案
晶体的结构和性质(竞赛)
高中化学选修三_晶体结构与性质
(完整word版)高中化学选修3第三章晶体结构与性质讲义及习题
最新(四)竞赛专项练习题之晶体结构
高中化学选修三选修物质结构与性质第三章第章常见晶体结构晶胞分析归纳整理总结
化学竞赛晶体结构综合例题
竞赛习题-晶体结构题
高中化学 常见晶胞模型
高中化学竞赛初赛有关晶体结构的试题及答
高中化学晶体结构与性质范文晶体的常识
高中化学晶体结构知识汇总
化学竞赛——晶体结构
竞赛专项练习题之晶体结构
高中化学选修三——晶体结构与性质
化学竞赛辅导练习6---晶体结构