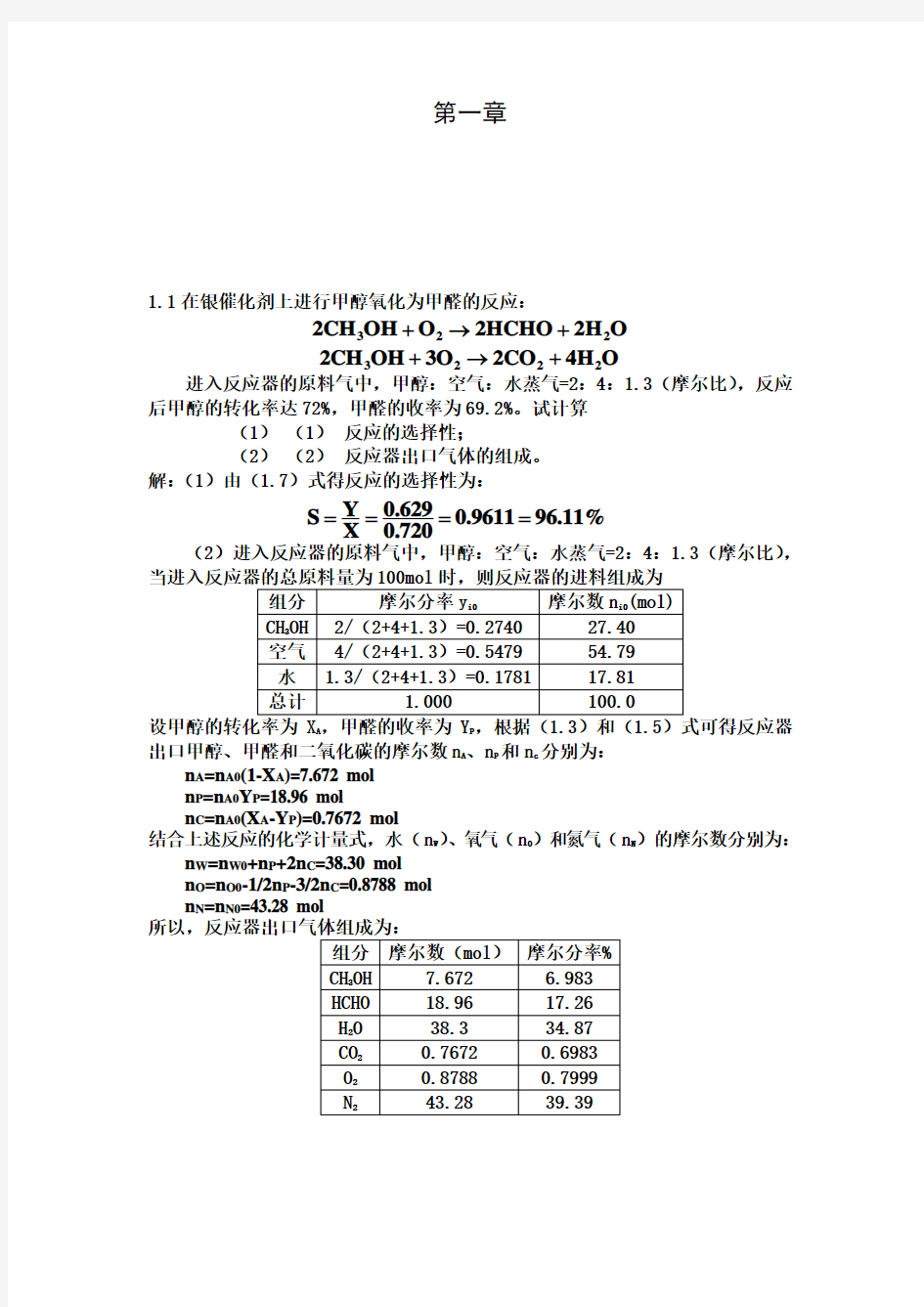

第一章
1.1在银催化剂上进行甲醇氧化为甲醛的反应:
3222CH OH O 2HCHO 2H O +→+
32222CH OH 3O 2CO 4H O +→+
进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。试计算
(1) (1) 反应的选择性;
(2) (2) 反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:
0.629Y S 0.961196.11%
X 0.720====
(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),
A P 出口甲醇、甲醛和二氧化碳的摩尔数n A 、n P 和n c 分别为:
n A =n A0(1-X A )=7.672 mol n P =n A0Y P =18.96 mol
n C =n A0(X A -Y P )=0.7672 mol
结合上述反应的化学计量式,水(n W )、氧气(n O )和氮气(n N )的摩尔数分别为:
n W =n W0+n P +2n C =38.30 mol n O =n O0-1/2n P -3/2n C =0.8788 mol n N =n N0=43.28 mol
1. 1. 2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:
23CO 2H CH OH +?
23222CO 4H (CH )O H O +?+ 242CO 3H CH H O +?+ 24924CO 8H C H OH 3H O +?+
222CO H O CO H +?+
由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩
Bkg/h 粗甲醇100kmol 放空气体
原料气和冷凝分离后的气体组成如下:(mol )
组分 原料气 冷凝分离后的气体 CO 26.82 15.49 H 2 68.25 69.78 CO 2 1.46 0.82 CH 4 0.55 3.62 N 2 2.92 10.29
粗甲醇的组成为CH 3OH 89.15%,(CH 3)2O 3.55%,C 3H 9OH 1.10%,H 2O 6.20%,均为重量百分率。在操作压力及温度下,其余组分均为不凝组分,但在冷凝冷却过程中可部分溶解于粗甲醇中,对1kg 粗甲醇而言,其溶解量为CO 2 9.82g,CO 9.38g,H 2 1.76g,CH 4 2.14g,N 25.38g 。若循环气与原料气之比为7.2(摩尔比),试计算:
(1) (1) 一氧化碳的单程转换率和全程转化率; (2) (2) 甲醇的单程收率和全程收率。 解:(1)设新鲜原料气进料流量为100kmol/h ,则根据已知条件,计算进料原料
其中x i =y i i i i m i i
M ’m =∑y i M i =9.554
又设放空气体流量为Akmol/h ,粗甲醇的流量为Bkg/h 。对整个系统的N 2作衡算得:
5.38B/28×1000+0.1029A=2.92 (A) 对整个系统就所有物料作衡算得:
100×10.42=B+9.554A (B) 联立(A )、(B )两个方程,解之得
A=26.91kmol/h B=785.2kg/h 反应后产物中CO 摩尔流量为
F CO =0.1549A+9.38B/(28×1000) 将求得的A 、B 值代入得
F CO =4.431 kmol/h 故CO 的全程转化率为
CO,0CO CO
CO,0F F 26.82 4.435X 83.48%
F 26.82
--===
由已知循环气与新鲜气之摩尔比,可得反应器出口处的CO 摩尔流量为
F ’CO,0=100×0.2682+7.2×100×0.1549=138.4 kmol/h 所以CO 的单程转化率为
CO,0CO '
CO
CO,0F F 26.82 4.435X 16.18%
F 138.4
--===
产物粗甲醇所溶解的CO 2、CO 、H 2、CH 4和N 2总量D 为
(9.829.38 1.76 2.14 5.38)B D 0.02848Bkmol /h
1000++++==
粗甲醇中甲醇的量为
(B-D)X 甲/M m =(785.2-0.02848B) ×0.8915/32=21.25 kmol/h 所以,甲醇的全程收率为
Y 总=21.25/26.82=79.24% 甲醇的单程收率为
Y 单=21.25/138.4=15.36%
2 反应动力学基础
2.1解:利用反应时间与组分A 的浓度变化数据,作出C A ~t 的关系曲线,用镜面法求得t=
3.5h 时该点的切线,即为水解速率。 切线的斜率为
0.760.125/.6.1
α-==-mol l h
由(2.6)式可知反应物的水解速率为
0.125/.-==dC A r mol l h
A
dt
2.2解:是一个流动反应器,其反应速率式可用(2.7)式来表示
00000(1)(1)-=
=-=-=-A A R
A A A A A A A A
dF r dV F F X Q C X dF Q C dX
故反应速率可表示为:
000
0(/)==A A
A A A R R dX dX r Q C C dV d V Q
用X A ~V R /Q 0作图,过V R
α。
0.650.04 1.79
0.34α-==
故CO 的转化速率为
40030.10130.03 6.3810/8.31410573--?
=
==???A A P C mol l RT
4300 6.3810 1.79 1.1410/.min
(/)--==??=?A
A A R dX r C mol l d V Q
2.3解:利用(2.10)式及(2.28)式可求得问题的解。注意题中所给比表面的单位换算成m 2/m 3。
33230.450.45
33
0.45(1) 1.13100.053560.46/.6(2) 1.7810/.3010
11(3)()()0.05350.15080.1013..()8.3110700(4)()(0.05350.333(0.1)ρρρρ-==??=-=
=
=???==?=??==?=v b w b
b
g w w
v
b n p w n
c w k k kmol m h k k k kmol m h a kmol k k P kg h MPa m RT k k P km 0.45)().kmol ol kg h
2.4解:由题中条件知是个等容反应过程,且A 和B 的初始浓度均相等,即为1.5mol/l ,故可把反应速率
式简化,得
1.50.5222
00.80.80.8(1)===-A A B A A A r C C C C X 由(2.6)式可知
00
(1)??
???
?--==-=A A A A A A d C X dC dX r C dt dt dt
代入速率方程式
22
00.8(1)=-A A A A dX C C X dt
化简整理得
00.8(1)=-A
A A dX C dt
X
积分得
00.81=
-A
A A X C t X
解得X A =82.76%。
2.5解:题中给出450℃时的k 2值,而反应是在490℃下,故首先要求出490℃时的k 2值。 利用(2.27)试,求出频率因子A:
44217.5810/8.31472316
2'1617.5810/8.314723430.532exp()
exp()2277/ 1.14510exp() 1.14510 1.05510()/.-??-??-=-===?-==?=?E k A RT
E A k e RT
E k A e m MPa m h
RT
490℃的Kp 值由题给公式计算出
4722
log 2047.8/763 2.4943log763 1.25610763 1.8564107633.206 1.25245.59210 ---=--??+??+=-=?p p K K 求k 1值:
22'
1
12
'2
2243 1.531(5.59210) 1.0551033()/.--=
==???=p p k K k K k k k m MPa m h
求各组分的分压值:
223
3122+?N H NH
5716
.0.14160*(-2)*2087.01.1416
0*2087.0*3-626.0 1y 13
y y 1904
.0 .14160*(-2)*2087.01)1416.0-(12087.0 1y y y 1416.05.6914.45*(-2)*2087.01*2087.0*2
1
035.010.01y y y 22
123211 %87.20P
y , 1y y y 1000H H 000A A 00R 0R R 0000000==-)
+-(=
,+=
δ+-=
=+=
δ+-===+--
=
δ+νν
-=
δ==δ+νν-=
δ+νν-=
A A A A
A A
A A A
A A A A
A A
A A A
A A
A A i i A
A A A A A
i
i i A
A A A A A
i
i i X y X X y X X X X X X y X y p X y X X y X p p p
P y i i p =
各组分的分率及分压值为
反应速率为:
3
2
2
3
2
1.5 1.5
41.512
1.5
333317.15333.0 5.718 1.05510317.154.02310/.(179.6/.)
=-=??-??=?NH H N NH H p p r k p k p p m m cat h kmol m cat h
2.6解: 图2.1 图2.2
(1)可逆反应 可逆反应 (2)放热反应 吸热反应
(3)M 点速率最大,A 点速率最小 M 点速率最大,A 点速率最小
(4)O 点速率最大,B 点速率最小 H 点速率最大,B 点速率最小 (5)R 点速率大于C 点速率 C 点速率大于R 点速率
(6)M 点速率最大 根据等速线的走向来判断H,M 点的速率大小。
2.7解:从题中可知,反应条件除了温度不同外,其它条件都相同,而温度的影响表现在反应速率常数k 上,故可用反应速率常数之比来描述反应速率之比。
400550119629011()()550550
5508.314673823400400
400exp()23exp()(倍)
---=====-E R T T E A r k RT e e r k E A RT
2.8解:(1)求出转化率为80%时各组分的分压:
以100mol
222233223320.1013 1.4/97.2 1.4610()0.10138.2/97.28.5510()0.1013 5.6/97.2 5.8410()0.101382/97.28.5510()
---==?=?==?=?==?=?==?=?SO SO O O SO SO N N p Py MPa p Py MPa p Py MPa p Py MPa
(2)求与上述组成对应的平衡常数K P 值:
3
22
3
0.5
0.5
335.841043.261.46108.5510---?? ?
??
?=
==??SO P SO o
p K p p
(3)求平衡温度Te
log 4905.5/ 4.64554905.5780.96.282
=-==p e e K T T K
(4)利用(2.31)式求逆反应活化能值
4
459.629109.21110 1.40310/2ν-??=-=?-=?r
r H E E J mol
(5)利用(2.31)式求最佳温度T OP
4
780.9739.0048.314780.914.031ln 1ln 9.211(14.039.211)10=
==?++-?-e
OP e T T K
RT E E E E
2.9解:反应物A 的消耗速率应为两反应速率之和,即
2
2 1.616.4 1.6(110.25)=+=+=+A R D A A A A R r r C C C C 利用(2.6)式
1.6(110.25)-=+A
A A dC C C dt
积分之
0001(1)10.2510.2511.6()ln(1)ln 10.2511110.250.6463/1.60.4038??
-+??=--=--+???++????
==A A A
C A A A C A A A X C t dC X C C C t h
2.10解:以100mol 为计算基准,设X 为三甲基苯的转化率,Y 为生成的甲苯摩尔数。 (1) (1)
66.67-33.33X-Y=20
解得Y=66.67-33.33×0.8-20=20.01kmol (甲苯量) 生成的二甲基苯量:33.33×0.8-20.01=6.654kmol 生成的甲烷量:33.33×0.8+20.01=46.67kmol
剩余的三甲基苯量:33.33×(1-0.8)=6.666kmol 氢气含量为:20kmol
故出口尾气组成为:三甲基苯6.666%,氢气20%,二甲基苯6.654%,甲烷46.67%,甲基苯20.01%。 (2) (2) 由题给条件可知,三甲基苯的出口浓度为:
33
00333300.10.33337.66910/8.31410523
(10.8)7.66910(10.8) 1.53410/----?===???=-=?-=?A A A A p C kmol m
RT C C kmol m 333
333
333
333
0.20 1.53410 4.610/0.06666
0.06654 1.53410 1.53210/0.06666
0.4667 1.53410 1.07410/0.06666
0.2001 1.53410 4.60310/0.06666--------=??=?=??=?=??=?=??=?B C D E C kmol m C kmol m C kmol m C kmol m
0.50.5
330.5330.53630034006300 1.53410(4.610)3400 1.53210(4.610)0.65550.35330.3022/.----=-=-=????-????=-=C A E A B C B
R r r C C C C kmol m h
2.11解:(1)恒容过程,其反应式可表示为:
1122→++A B C D
反应速率式表示为:
0(1)==-A A A A r kC kC X
设为理想气体,反应物A 的初始浓度为:
2003140014260.1013 2.52310/8.31410483
(1) 1.3910exp(18973/)(1)
1.3910exp(18973/483)
2.52310(100.8) 6.11210/.----=
==???=-=?-?-=?-???=?A A A A A A A Py C mol l RT r kC X T C X mol l s
亚硝酸乙脂的分解速率为:
66.11210/.-==?A A R r mol l s
乙醇的生成速率为:
61 3.05610/.2-==?D A R r mol l s
(2)恒压过程,由于反应前后摩尔数有变化,是个变容过程,由(2.49)式可求得总摩尔数的变化。
10.50.51/1
1
δυυ++-===∑A t A
由于反应物是纯A ,故有:y A0=1。
由(2.52)式可求得组分的瞬间浓度:
22001426(1) 2.52310(10.8) 2.80310/11110.8
1.3910exp(18973/483)
2.80310
3.39510/.δ-----?-===?++??==?-??=?A A A A A A A A C X C mol l
y X r kC mol l s
乙醇的生成速率为:
61
1.69810/.2-==?D A R r mol l s
2.12解:(1)由题意可将反应速率表示为:
24+→+=C A B A B C D
r kC C
对于恒容过程,则有
0003
003
3300(1)20.10130.2 2.38210/8.314101023
44 2.382109.52810/----=-=-?===???==??=?A A A B B A A
A A
B A
C C X C C C X P C mol l RT C C mol l
当X A0=0.8时
3403330043665(1) 2.382100.2 4.76410/29.528102 2.382100.8 5.71710/2 4.76410 5.71710 5.44710/.44 5.44710 2.17910/.----------=-=??=?=-=?-???=?===????=?==??=?A A A B B A A C C A B D C C C X mol l
C C C X mol l R r kC C mol l s R r mol l s
(2)对于恒压过程,是个变容反应过程,由(2.49)式可求得总摩尔数的变化
1412/2
1
δυυ+--===∑A t A
反应物A 的原始分率:
01
0.214=
=+A y
由(2.52)式可求得转化率为80%时的浓度:
3400(1) 2.38210(10.8) 3.60910/1120.20.8δ---?-===?++??A A A A A A C X C mol l
y X 33500029.528102 2.382100.8 4.33110/1120.20.8
δ----?-???===?++??B A A B A A A C C X C mol l
y X 45662 3.60910 4.33110 3.12610/.3.12610/.----==????=?==?A A B C C r kC C mol l s
R r mol l s
2.13解:方法(1),先求出总摩尔变化数δA 。
首先将产物的生成速率变为对应的反应物的转化速率:
1
0.431
0.252
2.1======AR R A
AS S A
AT T A r r C r r C r r C
总反应速率为:
2.75=++=A AR AS AT A R r r r C
以一摩尔反应物A 为基准,总摩尔变化数为:
0.40.25 2.1
3210.3822.75 2.75 2.75δ=
?+?+-=A
初始浓度为:
2
0003
0.10130.5 1.28810/8.31410473--?=
==???A A P y C mol l RT
则有
230033(1) 1.288100.15
1.662510/110.50.380.85
2.75 2.75 1.662510 4.57210/.min
δ-----??===?++??==??=?A A A A A A A A C X C mol l
y X R C mol l
方法(2),可将C A 表示为:
00(1)
131
21211
10
δδδδ-=
+-==-===∑A A A A Aj Aj
AR AS AT
C X C y X
23330.40.25
20.8510.850.32452.75 2.75
1.288100.15 1.662310/10.32450.5
2.75 2.75 1.662310 4.57110/.min δ----=?
?+??=??==?+?==??=?∑Aj Aj A A A X C mol l
R C mol l
方法(3),利用物料衡算可分别求出反应物A 生成R 及S 的瞬间选择性S R ,S S ,因而可求出产物R 及S 的收率y R ,y S ,求得A 转化率为85%时的分率:
0002333(1)
0.06453
122 1.288100.064532 1.662310/2.75 2.75 1.662310 4.57110/.min
-------=
=++==???=?==??=?A R S T A A R A S
A AO A A A y y y y y y y y y C C y mol l R C mol l
其中:
0.40.4
(0.40.25 2.1) 2.750.250.25
(0.40.25 2.1) 2.75
0.40.850.1236
2.750.250.850.07727
2.75
==
++=
=
++=?==?=A R A A S A R S C S C C S C y y
2.14解:根据速率控制步骤及定态近似原理,除表面反应外,其它两步达到平衡,描述如下:
θσσθθθ+?=
=A V
A A A A V
A
p A A K K p
σσθθ?+=-A A R B A B R
r k kp
θσσθθθ?+==B V B B B B V
B
p B B K K p
以表面反应速率方程来代表整个反应的速率方程:
θθ=-A A R B r k kp 由于1θθθ++=A
B V 将
,θθA B 代入上式得:
1θθθ++=A A V B B V V K p K p
整理得:
1
1θ=
++V A A B B
K p K p
将,,θθθA B V 代入速率方程中
()/111-=-=
++++++A A R B B A B R P A A A B B A A B B A A B B
kK p kp K p k p p p K r K p K p K p K p K p K p
其中
/==A
P A B k kK K kK kK
2.15解:根据速率控制步骤及定态近似原理,除表面反应步骤外,其余近似达到平衡,写出相应的覆盖率表达式:
(1)σσ
θθ+?=A A A V A A K p
2(2)22σσθ+?=B V B B (4)σσθ?+=R R R V R R K p 整个反应的速率方程以表面反应的速率方程来表示:
θθθθ=-A A B R V r k k
根据总覆盖率为1的原则,则有: 1θθθθ+++=A B R V
或
1θθθ+++=A A V V R R V V K p K p
整理得:
θ=
V
将,θθA B R V 代入反应速率方程,得:
22θθ=-=
A A V R R V k r kK p K p kp K 其中
/==R k kK K K k kK
2.17
(1)(2)(3)σσσσσσ
+?+→+?+A A A B C D
C C
并假设第二步是控制步骤,其速率方程就代表了整个反应的速率方程: θ=S A B r k p
其余的两步可认为达到平衡,则有:
θθθθ==A A A V C C C V K p K p
由于1θθθ++=A
B V ,有: 1
1θ=
++V A A C C
K p K p
将
,θθA V 代入速率式,得:
11=
=
++++S A A B A B
A A C C A A C C k K p p kp p r K p K p K p K p
式中
=S A k k K 。故上述假定与题意符合。但上述假定的反应步骤不是唯一的。
2.18解:先用积分法求其动力学方程。 设为一级不可逆反应,其速率表达式为:
=-
=A
A A dC r kC dt
积分得:
ln()=A A C kt C
用
ln(
)
A A C C
0.425/.=-=A
A A dC r C mol l h
dt
用微分法求解动力学方程
首先用C A ~t 曲线,在曲线上取时间为0,1,2,……9h 所对应点的切线,为了准确可采用镜面法,求得各切线的斜率即为对应的dC A /dt 之值,然后再以dC A /dt ~C A 作图,所求的dC A /dt 值如下表所示:
A A 0.5/.=-=A
A A dC r C mol l h dt
或将速率方程直线化,即两边取对数,得:
ln()ln ln -
=+A
A dC k n C dt
可简化为y=b+ax 形式,利用多元回归,可求得反应级数n=1.004≈1,反应速率常数值为k=0.4996。
还可用一数学公式来拟合C A ~t 曲线,然后再将该数学公式对t 求导,求得dC A /dt 之值,此法会比作图法来的准确。
3 釜式反应器
3.1解:(1)002220
00001()(1)110.95
169.6min(2.83)
5.60.0210.95
===?---=?=?-?
?Af Af X X A A A
A A A A A A
A A dX dX X t C C R k C X kC X h
(2) 因为间歇反应器的反应时间与反应器的大小无关,所以反应时间仍为2.83h 。
3.2解:氯乙醇,碳酸氢钠,和乙二醇的分子量分别为80.5,84 和 62kg/kmol,每小时产乙二醇:20/62=0.3226 kmol/h
每小时需氯乙醇:0.326680.5
91.11/0.9530%?=?kg h
每小时需碳酸氢钠:0.326684
190.2/0.9515%?=?kg h
原料体积流量:091.11190.2
275.8/1.02+=
=Q l h
氯乙醇初始浓度:00.32661000 1.231/0.95275.8?==?A C mol l
反应时间:
02000110.95
2.968(1) 5.2 1.23110.95===?=-?-??Af
Af X X A A A A B A A dX dX t C h kC C kC X 反应体积:0(')275.8(2.9680.5)956.5=+=?+=r V Q t t l
(2) (2) 反应器的实际体积:956.512750.75===r V V l
f
3.3解:用A,B,R,S 分别表示反应方程式中的四种物质,利用当量关系可求出任一时刻盐酸的浓度(也就是丙酸钠的浓度,因为其计量比和投量比均为1:1)为:
0.515
/10==?A B NaOH C C V mol l
于是可求出A 的平衡转化率:
00052.510.5
0.8
52.5
90%0.890%0.72
0.515
(1)52.5(10.72)0.051514.7/10--=
===?=?==-=??-=?A Ae Ae A A Ae A A A C C X C X X C C X mol l
现以丙酸浓度对时间作图:
由上图,当C A =0.0515×14.7mol/l 时,所对应的反应时间为48min 。由于在同样条件下,间歇反应器的反应时间与反应器的大小无关,所以该生产规模反应器的反应时间也是48min 。
丙酸的产量为:500kg/h=112.6mol/min 。
所需丙酸钠的量为:112.6/0.72=156.4mol/min 。
原料处理量为:000/156.4/(0.051552.5)57.84/min ==+=A A Q F C l 反应器体积:00()57.84(182010)4512=+=?++=r V Q t t l 实际反应体积:4512/0.85640=l
3.4解:(1)
[]0000
0.04(4000)()
()32332339.014.102?---?=+
-=+=+A r A A A A
F C H T T X X X X C
000
001422
0()91.32110001.110exp()(1)32339.01==-==?--+???
Af
Af X X A A
A A A A B
A
A A A
A
dX dX t C C R kC C dX C h
C X X
(由数值积分得出)
32339.010.85356.2=+?=T K
(2)若A 全部转化为R,即X A =1.0,则由上面的积分式知,t →∝,这显然是不可能的。
3.5解:(1)因为B 过量,所以:
''''
1212,,===-=-A A D C C A D A C r k C r k C r r r k C k C
恒容时:
'
1-
=A A dC k C dt (A ) ''12-=-C A C
dC k C k C dt (B) (B )式除以(A )式得:
'2'11-=-C C A A dC k C dC k C
解此微分方程得:
'
2
'
10'200'1
1??????=- ???
????-??k k A A A C A A C C C C k C C k (C )
将t 1,C A ,C C 及t 2,C A ,C C 数据代入(C )式化简得: 0.420.550.380.10.420.550.380.1?-?=?-?x x
解之得:
'22'110.525===
k k x k k
(2)先求出最大转化率:
2
11
1
1,max
2
1()0.7425
-=-=k k A k X k
(3)产物C 的最大收率:
()()2
1,max
21
1110.4905
1?
?=---=????-k k C A A Y X X k k
产物C 的最大浓度:
3
,max 0,max 0.10.49050.0491/==?=C A C C C Y kmol m
3.6 解:根据题中给的两种反应情况,可分别列出微分方程,然后进行求解。但仔细分析这两种情况,其实质是下述反应的特例:
12
123←?→←?→k k A A A (A)
当'20=k 时,(A )式变为123?→A A A (B) 当'10=k 时,(A )式变为123→?A A A (C)
当''120,0==k k 时,(A )式变为123→→A A A (D)
其中式(D )即为书讲的一级不可逆连串反应。可见只要得到(A )式的解,则可容易化简得到(B ),(C)及(D)式的解。 对于(A)式,可列出如下微分方程组:
'
11111-
=-dC k C k C dt (1)
''211231222=+--dC k C k C k C k C dt (2) '
32223
=-dC k C k C dt (3)
由题意知初始条件为:
11023(0),(0)(0)0===C C C C (4)
联立求解此微分方程组可得:
'''''21112211011()()()()????++??
=+-??
??-++??????t t k k k k k e k e C C k k αβαβαβαβααββ (5) '''
12
1
22210()()????++??
=+-????-??????t t k k k k e k e C C αβαβαβαβ
αβ (6)
1212310??????=+-??
??-??????t t k k k k e e C C αβαβαβαβ (7)
式中,,αβ由如下式确定:
'''
121221=++k k k k k k αβ (8) ''1122()+=-+++k k k k αβ (9)
现在可用上述结果对本题进行计算:
(1)1'1
1'
1
1224.0m i n , 3.6m i n ,
1.5m i n ,0,
1m i n
---====
=k k k k t 由(5)~(9)式得
1230.5592/0.5098/0.931/===A A A C mol l C mol l
C mol l (2)当t →∝时,由(5)~(9)式得
1230
2.0/==→A A A C C C mol l
(3)此时为'10=k 的情况,当t →∝时,由11 4.0min ,-=k 1'
1221.5min , 3.6min --==k k 得:
1230
1.412/0.588/===A A A C C mol l
C mol l
3.7解:(1)
2
122
21211221===++A R A B A
B A A B A B B r k
C C S k C R k C C k C C k C νν 由上式知,欲使S 增加,需使C A 低,C B 高,但由于B 的价格高且不易回收,故应按主反应的计量比投料为好。
(2)保证C A 低,C B 高,故可用下图所示的多釜串联方式:
(3)用半间歇反应器,若欲使C A 低,C B 高,可以将B 一次先加入反应器,然后滴加A. 3.8解:(1)
000
00000011
ln
()(1)111
ln 56.370.94min 0.810.989
()(0.9415)300===---===-=+=+=?
?Af Af X X A A A A A A A A A
r dX dX t C C R k C X k X s V Q t t Q l
0300/15.9418.82/min ==Q l
苯酚浓度0 3.20.989 3.165/==?=苯酚
A A C C X mol l
苯酚产量018.82 3.16559.56/min 335.9/=?==苯酚
Q C
mol kg h
(2)全混流反应器
00000(1)(1)
(1)
3000.08(10.989)
0.2669/16.02/min
0.989==
---?-=
=
==A Af Af r A Af Af r Af Af Q C X Q X V kC X k X V k X Q l s l X 苯酚产量016.02 3.20.98950.69/min 285.9/=??==苯酚
Q C mol kg h
(3)说明全混釜的产量小于间歇釜的产量,这是由于全混釜中反应物浓度低,反应速度慢的原因。
(4)由于该反应为一级反应,由上述计算可知,无论是间歇反应器或全混流反应器,其原料处理量不变,但由于C AB 增加一倍,故C 苯酚也增加一倍,故上述两个反应器中苯酚的产量均增加一倍。
3.9解:(1)第二章2.9题已求出t=0.396h=2
4.23min (2)
2300.1
2
0.1
2
3
0 1.61
(
)/() 1.616.4110.25(1)2(10.95)0.1/11ln(110.25)110.2510.25
0.2305/0.23050.1153
2-=-===++=-=-==-=-
=++====?
?A
A R A R A R A A A A
A A A C R R A A C A R R A dC dC dC C S dt dt dC C C C C C X kmol m C S dC C C kmol m C Y C
(3)若转化率仍为0.95,且温度为常数,则D 的瞬时选择性为:
28.232.8(1)1.616.434.432.8?-==
+-A A D A A C X S C X D 的收率:
0.95
32.8(1)
0.8348
0.7
34.432.8-===-?
?
Af
X A D D A A A
X Y S d X dX X
这说明能使D 的收率达到70%
(4)对全混流反应器,若使τ=t=0.3958h,则有
02
0.3958 1.616.4-=
+A A
A A
C C C C
解之得:C A =0.4433
所以:00
0.77840.95
-=
=A A
A A C C X C 这说明在这种情况下转化率达不到95%。
(1) (5) 对全混流反应器,若X=0.95,则R 的收率为:
00.95
0.4691
110.25(1)
110.252(10.95)
==
=
=+-+?-Af
R Af A Af X Y SX C X
(6)依题意知半间歇式反应器属于连续加料而间歇出料的情况。为了求分组A 的转化率及R 的收率,需要求出A 及R 的浓度随时间的变化关系,现列出如下的微分方程组:
对A: 2
00
()(1.616.4)++=A A A A d VC C C V Q C dt (1)
对R:
()
1.60-=R A d VC C V dt (2) 00=+V V Q t (3)
301=V m
在反应时间(t=0.4038h,为方便起见取t ≈0.4h )内将0.4 m 3的A 均速加入反应器内,故
300.4
1/0.4=
=Q m h
采用间歇釜操作时,原料为A 与B 的混合物,A 的浓度为2kmol/ m 3.现采用半间
歇釜操作,且33
1,0.4==B A V m V m ,故可算出原料A 的浓度为:
3
0(10.4)2/0.4+?=A C kmol m
由于:
0()()=+=+=A A A R R
R d VC dV dC C V dt dt dt d VC dV dC C V dt dt dt dV
Q dt
代入(1),(2)式则得如下一阶非线性微分方程组:
2
7 1.616.41-=--+A A A A dC C C C dt t (4) 1.61=-+R R
A dC C C dt t (5)
初始条件:t=0,C A =0,C R =0
可用龙格---库塔法进行数值求解。取步长△t=0.02h ,直至求至t=0.4h 即可。用t=0.4h 时的C A 和C R 可以进行A 的转化率和R 的收率计算:
0000--==
A A A A A A A A A
N N C V C V X N C V
式中V A 为所加入的A 的体积,且V A =0.4m 3;C A0为所加入的A 的浓度,且
C A0=7kmol/m 3;V 为反应结束时物系的体积,V=1.4m 3
。
同理可以计算出R 的收率:
0=
R R A A C V Y C V 3.10解:(1)
0010021
122222
101202()(1)(1)-=+=+--A A A A A r r r A A A A Q C X Q C X X V V V k C X k C X
对上式求dV r /dX A1=0可得:12
1211
01(1)+-=--A A A X X X
将X A2=0.9代入上式,则
3
11100(1)1-=+A A X X 解之得X A1=0.741
所以总反应体积的最小值为
3
122
240.7410.90.741 3.249 4.6767.925680.2(10.741)(10.9)??-=+=
+=+=???--??r r r V V V m
(2)
2
1021111
10
1101
3414(1)0.0518
34140.0912314=-=-==-=--=
=B A B
A A Af
B A B B B B r B R
C C C C X R C C C C C V Q R τ
即1
13.2494
0.0912314=
-B B C C 解得C B1=0.005992 kmol/m 3
同理
212222220224.6760.005992
4341434(1)14--=
==---B B B A B A A B C C C C C C X C τ 解得C B2=0.00126 kmol/m 3
B 的收率:
2020.00126
2
1.26%0.2?===B B A C Y C
(3)目标函数改为B 的收率,这时的计算步骤如下:对于第i 个釜,组分A,B 的衡算方程分别为:
对A: 12
68--=Ai Ai
i
Ai C C C τ 对B: 1
2
3414--=-Bi Bi i
Ai Bi C C C C τ
当i=1时,
01
121
68-=A A A C C C τ (1) 1
1
2
11
3414=-B A B C C C τ (2)
当i=2时,
化学反应工程考试总结 一、填空题: 1.所谓“三传一反”是化学反应工程学的基础,其中“三传”是指质 量传递、热量传递和动量传递,“一反”是指反应动力学。 2.各种操作因素对于复杂反应的影响虽然各不相同,但通常温度升 高有利于活化能高的反应的选择性,反应物浓度升高有利于反应级数大的反应的选择性。 3.测定非理想流动的停留时间分布函数时,两种最常见的示踪物输 入方法为脉冲示踪法和阶跃示踪法。 4.在均相反应动力学中,利用实验数据求取化学反应速度方程式的 两种最主要的方法为积分法和微分法。 5.多级混合模型的唯一模型参数为串联的全混区的个数N ,轴 向扩散模型的唯一模型参数为Pe(或Ez / uL)。 6.工业催化剂性能优劣的三种最主要的性质是活性、选择性和稳 定性。 7.平推流反应器的E函数表达式为 , () 0, t t E t t t ?∞= ? =? ≠ ?? ,其无 因次方差2θσ= 0 ,而全混流反应器的无因次方差2θσ= 1 。 8.某反应速率常数的单位为m3 / (mol hr ),该反应为 2 级 反应。 9.对于反应22 A B R +→,各物质反应速率之间的关系为 (-r A):(-r B):r R= 1:2:2 。
10.平推流反应器和全混流反应器中平推流更适合于目的产 物是中间产物的串联反应。 →+,则其反应速率表达式不能确11.某反应的计量方程为A R S 定。 12.物质A按一级不可逆反应在一间歇反应器中分解,在67℃时转化 50%需要30 min, 而在80 ℃时达到同样的转化率仅需20秒,该反应的活化能为 3.46×105 (J / mol ) 。 13.反应级数不可能(可能/不可能)大于3。 14.对于单一反应,在相同的处理量和最终转化率条件下,选择反应 器时主要考虑反应器的大小;而对于复合反应,选择反应器时主要考虑的则是目的产物的收率; 15.完全混合反应器(全混流反应器)内物料的温度和浓度均一, 并且等于(大于/小于/等于)反应器出口物料的温度和浓度。 二.单项选择 10.(2) B 1、气相反应CO + 3H2CH4 + H2O进料时无惰性气体,CO与2H以1∶2 δ=__A_。 摩尔比进料,则膨胀因子CO A. -2 B. -1 C. 1 D. 2 2、一级连串反应A S P在间歇式反应器中,则目的产物P C___A____。 的最大浓度= max ,P
第一章 1.设计现代OS的主要目标是什么? 答:(1)有效性(2)方便性(3)可扩充性(4)开放性 4.试说明推劢多道批处理系统形成和収展的主要劢力是什么? 答:主要动力来源于四个方面的社会需求与技术发展: (1)不断提高计算机资源的利用率; (2)方便用户; (3)器件的不断更新换代; (4)计算机体系结构的不断发展。 12.试从交互性、及时性以及可靠性方面,将分时系统不实时系统迚行比较。答:(1)及时性:实时信息处理系统对实时性的要求与分时系统类似,都是以人所能接受的等待时间来确定;而实时控制系统的及时性,是以控制对象所要求的开始截止时间或完成截止时间来确定的,一般为秒级到毫秒级,甚至有的要低于100微妙。 (2)交互性:实时信息处理系统具有交互性,但人与系统的交互仅限于访问系统中某些特定的专用服务程序。不像分时系统那样能向终端用户提供数据和资源共享等服务。 (3)可靠性:分时系统也要求系统可靠,但相比之下,实时系统则要求系统具有高度的可靠性。因为任何差错都可能带来巨大的经济损失,甚至是灾难性后果,所以在实时系统中,往往都采取了多级容错措施保障系统的安全性及数据的安全性。 13.OS有哪几大特征?其最基本的特征是什么? 答:并发性、共享性、虚拟性和异步性四个基本特征;最基本的特征是并发性。 第二章 2. 画出下面四条诧句的前趋图: S1=a:=x+y; S2=b:=z+1; S3=c:=a –b;S4=w:=c+1; 8.试说明迚程在三个基本状态之间转换的典型原因。 答:(1)就绪状态→执行状态:进程分配到CPU资源 (2)执行状态→就绪状态:时间片用完 (3)执行状态→阻塞状态:I/O请求 (4)阻塞状态→就绪状态:I/O完成
例1:如图,已知大气压p b=101325Pa ,U 型管内 汞柱高度差H =300mm ,气体表B 读数为0.2543MPa ,求:A 室压力p A 及气压表A 的读数p e,A 。 解: 强调: P b 是测压仪表所在环境压力 例2:有一橡皮气球,当其内部压力为0.1MPa (和大气压相同)时是自由状态,其容积为0.3m 3。当气球受太阳照射而气体受热时,其容积膨胀一倍而压力上升到0.15MPa 。设气球压力的增加和容积的增加成正比。试求: (1)该膨胀过程的p~f (v )关系; (2)该过程中气体作的功; (3)用于克服橡皮球弹力所作的功。 解:气球受太阳照射而升温比较缓慢,可假定其 ,所以关键在于求出p~f (v ) (2) (3) 例3:如图,气缸内充以空气,活塞及负载195kg ,缸壁充分导热,取走100kg 负载,待平 衡后,不计摩擦时,求:(1)活塞上升的高度 ;(2)气体在过程中作的功和换热量,已 知 解:取缸内气体为热力系—闭口系 分析:非准静态,过程不可逆,用第一定律解析式。 计算状态1及2的参数: 过程中质量m 不变 据 因m 2=m 1,且 T 2=T 1 体系对外力作功 注意:活塞及其上重物位能增加 例4:如图,已知活塞与气缸无摩擦,初始时p 1=p b ,t 1=27℃,缓缓加热, 使 p 2=0.15MPa ,t 2=207℃ ,若m =0.1kg ,缸径=0.4m ,空气 求:过程加热量Q 。 解: 据题意 ()()121272.0T T m u u m U -=-=? 例6 已知:0.1MPa 、20℃的空气在压气机中绝热压缩后,导入换热器排走部分热量,再进入喷管膨胀到0.1MPa 、20℃。喷管出口截面积A =0.0324m2,气体流速c f2=300m/s 。已知压气机耗功率710kW ,问换热器的换热量。 解: 稳定流动能量方程 ——黑箱技术 例7:一台稳定工况运行的水冷式压缩机,运行参数如图。设空气比热 cp =1.003kJ/(kg·K),水的比热c w=4.187kJ/(kg·K)。若不计压气机向环境的散热损失、动能差及位能差,试确定驱动该压气机所需功率。[已知空气的焓差h 2-h 1=cp (T 2-T 1)] 解:取控制体为压气机(不包括水冷部分 流入: 流出: 6101325Pa 0.254310Pa 355600Pa B b eB p p p =+=+?=()()63 02160.110Pa 0.60.3m 0.0310J 30kJ W p V V =-=??-=?=斥L ?{}{}kJ/kg K 0.72u T =1 2T T =W U Q +?=()()212211U U U m u m u ?=-=-252 1.96010Pa (0.01m 0.05m)98J e W F L p A L =??=???=???={}{}kJ/kg K 0.72u T =W U Q +?=g V m pq q R T =()f 22g p c A R T =620.110Pa 300m/s 0.0324m 11.56kg/s 287J/(kg K)293K ???==??()111 11111m V m P e q p q P q u p v ++?++() 1 2 1 22222m V m e q p q q u p v ++Φ?Φ++水水
第二章 热力学第一定律 思 考 题 1. 热量和热力学能有什么区别?有什么联系? 答:热量和热力学能是有明显区别的两个概念:热量指的是热力系通过界面与外界进行的热能交换量,是与热力过程有关的过程量。热力系经历不同的过程与外界交换的热量是不同的;而热力学能指的是热力系内部大量微观粒子本身所具有的能量的总合,是与热力过程无关而与热力系所处的热力状态有关的状态量。简言之,热量是热能的传输量,热力学能是能量?的储存量。二者的联系可由热力学第一定律表达式 d d q u p v δ=+ 看出;热量的传输除了可能引起做功或者消耗功外还会引起热力学能的变化。 2. 如果将能量方程写为 d d q u p v δ=+ 或 d d q h v p δ=- 那么它们的适用范围如何? 答:二式均适用于任意工质组成的闭口系所进行的无摩擦的内部平衡过程。因为 u h pv =-,()du d h pv dh pdv vdp =-=-- 对闭口系将 du 代入第一式得 q dh pdv vdp pdv δ=--+ 即 q dh vdp δ=-。 3. 能量方程 δq u p v =+d d (变大) 与焓的微分式 ()d d d h u pv =+(变大) 很相像,为什么热量 q 不是状态参数,而焓 h 是状态参数? 答:尽管能量方程 q du pdv δ=+ 与焓的微分式 ()d d d h u pv =+(变大)似乎相象,但两者 的数学本质不同,前者不是全微分的形式,而后者是全微分的形式。是否状态参数的数学检验就是,看该参数的循环积分是否为零。对焓的微分式来说,其循环积分:()dh du d pv =+??? 因为 0du =?,()0d pv =? 所以 0dh =?, 因此焓是状态参数。 而 对 于 能 量 方 程 来 说 ,其循环积分:
2016慕课毛概最全答案 第一章 1.1.马克思主义中国化的科学内涵 1 毛泽东在明确提出“使马克思主义中国化”的命题和任务是在 A、遵义会议 B、中共六届六中全会 C、中共七大 D、中共七届二中全会 正确答案:B 我的答案:B 得分:16.7分 2 在党的七大上,对“马克思主义中国化”、“中国化的马克思主义”两大科学命题加以阐释的党的领导人是 A、毛泽东 B、周恩来 C、邓小平 D、刘少奇 正确答案:D 我的答案:D 得分:16.7分 3 中国共产党确定毛泽东思想为指导思想的会议是 A、遵义会议 B、党的第七次全国代表大会 C、党的第八次全国代表大会 D、中共十一届六中全会 正确答案:B 我的答案:B 得分:16.7分 4 马克思主义中国化的理论成果的精髓是 A、实事求是 B、毛泽东思想 C、邓小平理论 D、“三个代表”重要思想 正确答案:A 我的答案:A 得分:16.7分 5 中国共产党在把马克思列宁主义基本原理与中国革命实际相结合的过程中,在学风问题上曾经反对过的主要错误倾向是
A、投降主义 B、经验主义 C、教条主义 D、冒险主义 正确答案:BC 我的答案:AC 得分:0.0分 6 毛泽东思想和中国特色社会主义理论体系都是中国化的马克思主义,它们都 A、体现了马克思列宁主义的基本原理 B、包含了中国共产党人的实践经验 C、揭示了中国革命的特殊规律 D、包含了中华民族的优秀思想 正确答案:ABD 我的答案:AB 得分:8.4分 1.2.毛泽东主义的科学内涵和形成条件 1 在毛泽东思想活的灵魂的几个基本方面中,最具特色、最根本的原则是 A、实事求是 B、群众路线 C、理论联系实际 D、独立自主 正确答案:A 我的答案:A 得分:20.0分 2 下面关于毛泽东思想的论述不正确的是pA、毛泽东思想是毛泽东同志个人正确思想的结晶 B、毛泽东思想是马克思主义中国化第一次历史性飞跃的理论成果 C、毛泽东思想是中国革命和建设的科学指南 D、毛泽东思想是中国共产党和中国人民宝贵的精神财富 正确答案:A 我的答案:A 得分:20.0分 3 毛泽东思想的核心和精髓是 A、武装斗争 B、统一战线 C、党的建设 D、实事求是 正确答案:D 我的答案:D 得分:20.0分 4 毛泽东思想形成的标志是 A、实事求是 B、遵义会议
第一章 1 .设计现代OS 的主要目标是什么? 答:(1)有效性(2)方便性(3)可扩充性(4)开放性 2 .OS 的作用可表现在哪几个方面? 答:(1)OS作为用户与计算机硬件系统之间的接口 (2)OS 作为计算机系统资源的管理者 (3)OS 实现了对计算机资源的抽象 4 .试说明推动多道批处理系统形成和发展的主要动力是什么?答:主要动力来源于四个方面的社会需求与技术发展: (1)不断提高计算机资源的利用率; (2)方便用户; (3)器件的不断更新换代; (4)计算机体系结构的不断发展。 7 .实现分时系统的关键问题是什么?应如何解决?答:关键问题是当用户在自己的终端上键入命令时,系统应能及时接收并及时处理该命令,在用户能接受的时延内将结果返回给用户。 解决方法:针对及时接收问题,可以在系统中设置多路卡,使主机能同时接收用户从各个终端上输入的数据;为每个终端配置缓冲区,暂存用户键入的命令或数据。针对及时处理问题,应使所有的用户作业都直接进入内存,并且为每个作业分配一个时间片,允许作业只在自己的时间片内运行,这样在不长的时间内,能使每个作业都运行一次。 12 .试从交互性、及时性以及可靠性方面,将分时系统与实时系统进行比较。 答:( 1 )及时性:实时信息处理系统对实时性的要求与分时系统类似,都是以人所能接受的等待时间来确定;而实时控制系统的及时性,是以控制对象所要求的开始截止时间或完成截止时间来确定的,一般为秒级到毫秒级,甚至有的要低于100 微妙。 (2)交互性:实时信息处理系统具有交互性,但人与系统的交互仅限于访问系统中某些特定的专用服务程序。不像分时系统那样能向终端用户提供数据和资源共享等服务。 (3)可靠性:分时系统也要求系统可靠,但相比之下,实时系统则要求系统具有高度 的可靠性。因为任何差错都可能带来巨大的经济损失,甚至是灾难性后果,所以在实时系统中,往往都采取了多级容错措施保障系统的安全性及数据的安全性。 13 .OS 有哪几大特征?其最基本的特征是什么?答:并发性、共享性、虚拟性和异步性四个基本特征;最基本的特征是并发性。
化学反应工程 一、填空题: 1.所谓“三传一反”是化学反应工程学的基础,其中“三传”是指质量传递、热量传递 和动量传递,“一反”是指反应动力学。 2.各种操作因素对于复杂反应的影响虽然各不相同,但通常温度升高有利于活化能高 的反应的选择性,反应物浓度升高有利于反应级数大的反应的选择性。 3.测定非理想流动的停留时间分布函数时,两种最常见的示踪物输入方法为脉冲示踪法 和阶跃示踪法。 4.在均相反应动力学中,利用实验数据求取化学反应速度方程式的两种最主要的方法为 积分法和微分法。 5.多级混合模型的唯一模型参数为串联的全混区的个数N ,轴向扩散模型的唯一模 型参数为Pe(或Ez / uL)。 6.工业催化剂性能优劣的三种最主要的性质是活性、选择性和稳定性。 7.平推流反应器的E函数表达式为 , () 0, t t E t t t ?∞= ? =? ≠ ?? ,其无因次方差2θσ= 0 ,而全混流反应器的无因次方差2θσ= 1 。 8.某反应速率常数的单位为m3 / (mol? hr ),该反应为 2 级反应。 9.对于反应22 A B R +→,各物质反应速率之间的关系为(-r A):(-r B):r R=1:2:2 。 10.平推流反应器和全混流反应器中平推流更适合于目的产物是中间产物的串联反 应。 11.某反应的计量方程为A R S →+,则其反应速率表达式不能确定。 12.物质A按一级不可逆反应在一间歇反应器中分解,在67℃时转化50%需要30 min, 而 在80 ℃时达到同样的转化率仅需20秒,该反应的活化能为 3.46×105(J / mol ) 。 13.反应级数不可能(可能/不可能)大于3。 14.对于单一反应,在相同的处理量和最终转化率条件下,选择反应器时主要考虑反应器 的大小;而对于复合反应,选择反应器时主要考虑的则是目的产物的收率;15.完全混合反应器(全混流反应器)内物料的温度和浓度均一,并且等于 (大于/小于/等于)反应器出口物料的温度和浓度。
1、20世纪70年代,人们就已发现,高达50%的疾病或死亡因素与什么有关? 行为及不健康的生活方式 2哪一年在上海成立的精武体育会是当时影响最大,传播最广,维持时间最长的武术组织?1910 3.网球比赛的第一原则是什么? 增加进攻(这个不确定,是根据网球老师说的选的) 4. 网球比赛中要赢得一局比赛,必须比对手多赢几分才可以? 2分 5. 联合国报告认为什么将会是21世纪最严重的健康问题? 体质下降 6. 国际羽联在哪一年正式恢复了我国的合法席位后,开始了我国羽毛球运动的鼎盛时期。1981 7. 哪一个季节人体脂肪合成速度最快? 冬天 8. 哪一年被世界公认为现代足球的诞生日? 1863 9. 下列哪位运动员是新中国历史上第一个获得世界锦标赛冠军的运动员? 容国团 10.在哪届奥运会上,乒乓球成为正式比赛项目? 汉城奥运会 11.篮球规则规定,篮圈离地垂直高度为多少? 3.05米 12. 1895年,由美国人()发明了排球运动。 威廉·G·摩根
13,。有助于提高肌肉力量的训练方法有哪些? 卧推 14.下列不易于发展柔韧素质的练习时段或状态有哪些?(这个也不清楚,是看它字体颜色不一样)身体极其疲惫 15.20世纪50年代末期,巴西人创造了哪种阵型被誉为足球史上的第二次变革。 “四二四”阵形 16.曾经在NBA总决赛中受伤,坚持参加比赛最后获得冠军并取得最有价值称号的凯尔特人球星是()? 保罗皮尔斯 17.体育锻炼与传统心理治疗手段同样具有抗抑郁效能,是治疗抑郁症的()手段;体育锻炼治疗抗抑郁症的效果与药物相比比较()。 辅助;持久 18.在运动中不慎扭伤,下列做法不正确的是() 马上揉搓患处 19.20XX年伦敦奥运会羽毛球囊括多少枚金牌? 5 20.“让参与者成为享受运动,实现人生潜能的一代”是哪一个健康促进的愿景? 为动而生 21.减小肚皮应采用哪一类运动? 长时间低强度 22.棍多以抡、劈、扫、云等法为主,大多是横方向用力,动作幅度较大,其特点:一招一式虎虎生威,动如疾风骤雨,产生"棍打一大片"的效果。棍被称为() 百兵之首 23.作为当下盛行的舞蹈元素,以人体中段(腰、腹、臀部)的各种动作为主,具有阿拉伯风情的舞蹈形式是()。肚皮舞
工程热力学习题集 一、填空题 1.能源按使用程度和技术可分为 能源和 能源。 2.孤立系是与外界无任何 和 交换的热力系。 3.单位质量的广延量参数具有 参数的性质,称为比参数。 4.测得容器的真空度48V p KPa =,大气压力MPa p b 102.0=,则容器内的绝对压力为 。 5.只有 过程且过程中无任何 效应的过程是可逆过程。 6.饱和水线和饱和蒸汽线将压容图和温熵图分成三个区域,位于三区和二线上的水和水蒸气呈现五种状态:未饱和水 饱和水 湿蒸气、 和 。 7.在湿空气温度一定条件下,露点温度越高说明湿空气中水蒸气分压力越 、水蒸气含量越 ,湿空气越潮湿。(填高、低和多、少) 8.克劳修斯积分 /Q T δ?? 为可逆循环。 9.熵流是由 引起的。 10.多原子理想气体的定值比热容V c = 。 11.能源按其有无加工、转换可分为 能源和 能源。 12.绝热系是与外界无 交换的热力系。 13.状态公理指出,对于简单可压缩系,只要给定 个相互独立的状态参数就可以确定它的平衡状态。 14.测得容器的表压力75g p KPa =,大气压力MPa p b 098.0=,则容器内的绝对压力为 。 15.如果系统完成某一热力过程后,再沿原来路径逆向进行时,能使 都返回原来状态而不留下任何变化,则这一过程称为可逆过程。 16.卡诺循环是由两个 和两个 过程所构成。 17.相对湿度越 ,湿空气越干燥,吸收水分的能力越 。(填大、小) 18.克劳修斯积分 /Q T δ?? 为不可逆循环。 19.熵产是由 引起的。 20.双原子理想气体的定值比热容p c = 。 21、基本热力学状态参数有:( )、( )、( )。 22、理想气体的热力学能是温度的( )函数。 23、热力平衡的充要条件是:( )。 24、不可逆绝热过程中,由于不可逆因素导致的熵增量,叫做( )。 25、卡诺循环由( )热力学过程组成。 26、熵增原理指出了热力过程进行的( )、( )、( )。 31.当热力系与外界既没有能量交换也没有物质交换时,该热力系为_______。 32.在国际单位制中温度的单位是_______。
一、填空(40分) (1)气相反应A+3B→2C,则δ= δ= 。ΒA dC A?r?,前提是(2)反应速率常数有时可以表为。A dt (3)空间速度是指 ___________ , 空间时间是指 __________。 (4)反应具有最佳温度曲线, 最佳温度曲线是指 __________ 。 4.0克/cm5)多孔性球形颗粒10克,半径1cm,系由密度为(孔隙率3的材料制成。 则其孔容积V= ,θ= g 。假密度ρ= 2?0.218?,如果采用扩散模型,则)已知某非理想流动反应器其停留时间分布的方差 (6?Pe=_______,如果采用多级全混流模型,则m=_______ (7)催化剂微孔内的气体扩散有____扩散,____扩散、____扩散、 及____扩散等多种形式。。 L r?2C AL A C1mol/L, ,进料反应进行至,(8)复合反应=A02C2r?M AM x?0.5, s = 时。如果该反应在在固体催化剂中进行时,由瞬时选择性LA。于内扩散的影响,选择性会t?E(t)dt?F(?)?F(0)?)(9,,。 0. (10)内扩散效率因子ζ和Thiele模数Φ的数值通常有如下关系: 外扩散和化学动力学控制时ζ1,Φ值较; 内扩散强烈影响时ζ1,Φ值较。 (11)CO中温变换反应器属于固定床里的反应器。固定床按气体流动方向, 可以分为和反应器。 492-=/s, =1.5×1012)某一级不可逆的气液反应过程,已知k=10mm/s,D(LL则当k 时,该反应属于快反应,反应区主要在,工业上可选用 反应器或反应器;当k 时,该反应属于慢反应,这时反应区主 要在,工业上可选用或反应器。 L2r?1.0CC BAL L 13AB为主产物,则适+(,)对于平行反应2r?2.0CC M BAA CC 的要求是宜的操作条件对和。BA (14)返混是指
第3章处理机调度1)选择题 (1)在分时操作系统中,进程调度经常采用_D_ 算法。 A. 先来先服务 B. 最高优先权 C. 随机 D. 时间片轮转 (2)_B__ 优先权是在创建进程时确定的,确定之后在整个进程运行期间不再改变。 A. 作业 B. 静态 C. 动态 D. 资源 (3)__A___ 是作业存在的惟一标志。 A. 作业控制块 B. 作业名 C. 进程控制块 D. 进程名 (4)设有四个作业同时到达,每个作业的执行时间均为2小时,它们在一台处理器上按单道方式运行,则平均周转时间为_ B_ 。 A. l小时 B. 5小时 C. 2.5小时 D. 8小时 (5)现有3个同时到达的作业J1、J2和J3,它们的执行时间分别是T1、T2和T3,且T1<T2<T3。系统按单道方式运行且采用短作业优先算法,则平均周转时间是_C_ 。 A. T1+T2+T3 B. (T1+T2+T3)/3 C. (3T1+2T2+T3)/3 D. (T1+2T2+3T3)/3 (6)__D__ 是指从作业提交给系统到作业完成的时间间隔。 A. 运行时间 B. 响应时间 C. 等待时间 D. 周转时间 (7)下述作业调度算法中,_ C_调度算法与作业的估计运行时间有关。 A. 先来先服务 B. 多级队列 C. 短作业优先 D. 时间片轮转 2)填空题 (1)进程的调度方式有两种,一种是抢占(剥夺)式,另一种是非抢占(非剥夺)式。 (2)在_FCFS_ 调度算法中,按照进程进入就绪队列的先后次序来分配处理机。 (3)采用时间片轮转法时,时间片过大,就会使轮转法转化为FCFS_ 调度算法。 (4)一个作业可以分成若干顺序处理的加工步骤,每个加工步骤称为一个_作业步_ 。 (5)作业生存期共经历四个状态,它们是提交、后备、运行和完成。 (6)既考虑作业等待时间,又考虑作业执行时间的调度算法是_高响应比优先____ 。 3)解答题 (1)单道批处理系统中有4个作业,其有关情况如表3-9所示。在采用响应比高者优先调度算法时分别计算其平均周转时间T和平均带权周转时间W。(运行时间为小时,按十进制计算) 表3-9 作业的提交时间和运行时间
1. 热量和热力学能有什么区别?有什么联系? 答:热量和热力学能是有明显区别的两个概念:热量指的是热力系通过界面与外界进行的热能交换量,是与热力过程有关的过程量。热力系经历不同的过程与外界交换的热量是不同的;而热力学能指的是热力系内部大量微观粒子本身所具有的能量的总合,是与热力过程无关而与热力系所处的热力状态有关的状态量。简言之,热量是热能的传输量,热力学能是能量?的储存量。二者的联系可由热力学第一定律表达式 d d q u p v δ=+ 看出;热量的传输除了可能引起做功或者消耗功外还会引起热力学能的变化。 2. 如果将能量方程写为 d d q u p v δ=+ 或 d d q h v p δ=- 那么它们的适用范围如何? 答:二式均适用于任意工质组成的闭口系所进行的无摩擦的内部平衡过程。因为 u h p v =-,()du d h pv dh pdv vdp =-=-- 对闭口系将 du 代入第一式得 q dh pdv vdp pdv δ=--+ 即 q dh vdp δ=-。 3. 能量方程 δq u p v =+d d (变大) 与焓的微分式 ()d d d h u pv =+(变大) 很相像,为什么热量 q 不是状态参数,而焓 h 是状态参数? 答:尽管能量方程 q du pdv δ=+ 与焓的微分式 ()d d d h u pv =+(变大)似乎相象,但两者的数学本 质不同,前者不是全微分的形式,而后者是全微分的形式。是否状态参数的数学检验就是,看该参数的循环积分是否为零。对焓的微分式来说,其循环积分:()dh du d pv =+??? 因为 0du =?,()0d pv =? 所以 0dh =?, 因此焓是状态参数。 而对于能量方程来说,其循环积分: q du pdv δ=+??? 虽然: 0du =? 但是: 0pdv ≠? 所以: 0q δ≠? 因此热量q 不是状态参数。 4. 用隔板将绝热刚性容器分成A 、B 两部分(图2-13),A 部分装有1 kg 气体,B 部分为高度真空。将隔板抽去后,气体热力学能是否会发生变化?能不能用 d d q u p v δ=+ 来分析这一过程?
《化工设备设计基础》综合复习资料化工设备设计基础》综合复习资料 一、填空题 1. 容器按照壁厚大小分为__________和___________。 2. 双鞍座支承的卧式容器可简化为受均布载荷的算时则简化为梁。或。直径为 D 的圆形截梁;而直立的塔设备进行校核计 3. 矩形截面(长=b、宽=h)对 Z 轴的惯性矩公式为面对其对称轴的惯性矩为。 4. 计算内压操作塔设备筒体壁厚的依据是其对其应力。 应力,而进行直立设备校核计算时主要是针 5. 我国压力容器设计必须遵循的安全技术法规和标准为和。 6. 立式容器的支座有腿式支座、____________、____________和____________四种。 7. 对与封头相连的外压容器筒体而言,其计算长度应计入封头的直边高度及凸形封头 ____的凸面高度。 二、判断题 1.下列直立薄壁容器,受均匀气体内压力作用。哪些能用薄膜理论求解壁内应力?哪些不能?(1)横截面为正六角形的柱壳。(2)横截面为圆的轴对称柱壳。(3)横截面为椭圆的柱壳。(4)横截面为半圆的柱壳。(5)横截面为圆的锥形壳。 2.在承受内压的圆筒形容器上开椭圆孔,应使椭圆的长轴与筒体轴线平行。 3.薄壁回转壳体中任一点,只要该点的两个曲率半径 R1=R2,则该点的两向应力相等。 4.因为内压薄壁容器圆筒的两向应力与壁厚成反比,当材质与介质压力一定时,则壁厚大的容 器,壁内的应力总小于壁厚小的容器。 5.按无力矩理论求得的应力成为薄膜应力, 薄膜应力沿壁厚均匀分布的。 三、简答题 1. 写出下类钢材牌号的含义 09MnNiDR 和 1Cr18Ni9Ti(符号和数字)。 2. 二力平衡条 件是什么?什么叫二力杆? 3. 内压壁厚设计公式中为何引入焊缝系数?焊缝系数与哪些因素有关? 4. 什么叫长圆筒?什么叫短圆筒?用什么参数界定的? 5. 法兰公称压力的确定受到哪些因素的影响?为什么公称压力 PN 为 1.0MPa 的法兰,其最大允许操作压力比有时 1.0MPa 高而有时又比 1.0MPa 低? 6.设置加强圈的目的是什么?加强圈的类型有哪些? 7. 什么叫失稳?外压容器的稳定性条件是什么? 8. 用抗拉强度规定只下限为σb=620 MPa 材料制造的容器为几类容器?依据是什么? 9. 试确定塔卧置做水压试验时的试验压力 PT 。塔的设计压力为 P,水重度γ,塔高H。 10. 有一管线法兰,已知设计压力为 0.2MPa,设计温度为 300℃,试问在此管线上能 否使用公称压力为 0.25MPa 的碳钢平焊法兰?为什么? 11. 焊缝系数与哪些因素有关?若一容器为双面对接焊缝,局部无损探伤,焊缝系数为多少? 12. 封头有哪几种形式?各适用于什么场所?
1计算之树中,通用计算环境的演化思维是怎样概括的?________。 A.程序执行环境—由CPU-内存环境,到CPU-存储体系环境,到多CPU-多存储器环境,再到云计算虚拟计算环境 B.网络运行环境---由个人计算机、到局域网广域网、再到Internet C.元器件---由电子管、晶体管、到集成电路、大规模集成电路和超大规模集成电路 D.上述全不对 正确答案:A
2计算之树中,网络化思维是怎样概括的________。 A.局域网、广域网和互联网 B.机器网络、信息网络和人-机-物互联的网络化社会 C.机器网络、信息网络和物联网 D.局域网络、互联网络和数据网络 正确答案: B
3人类应具备的三大思维能力是指_____。 A.抽象思维、逻辑思维和形象思维 B.实验思维、理论思维和计算思维 C逆向思维、演绎思维和发散思维 D.计算思维、理论思维和辩证思维 正确答案:B
4如何学习计算思维?_____。 A.为思维而学习知识而不是为知识而学习知识 B.不断训练,只有这样才能将思维转换为能力 C.先从贯通知识的角度学习思维,再学习更为细节性的知识,即用思维引导知识的学习 D.以上所有 正确答案:D
5自动计算需要解决的基本问题是什么?_______。 A.数据的表示,数据和计算规则的表示 B.数据和计算规则的表示与自动存储 C数据和计算规则的表示、自动存储和计算规则的自动执行D.上述说法都不正确 正确答案:C
6计算机器的基本目标是什么? _______。 A.能够辅助人进行计算,能够执行简单的四则运算规则 B.能够执行特定的计算规则,例如能够执行差分计算规则等 C.能够执行一般的任意复杂的计算规则 D.上述说法都不正确 正确答案:C
2.1 一类操作系统服务提供对用户很有用的函数,主要包括用户界面、程序执行、I/O操作、文件系统操作、通信、错误检测等。 另一类操作系统函数不是帮助用户而是确保系统本身高效运行,包括资源分配、统计、保护和安全等。 这两类服务的区别在于服务的对象不同,一类是针对用户,另一类是针对系统本身。 2.6 优点:采用同样的系统调用界面,可以使用户的程序代码用相同的方式被写入设备和文件,利于用户程序的开发。还利于设备驱动程序代码,可以支持规范定义的API。 缺点:系统调用为所需要的服务提供最小的系统接口来实现所需要的功能,由于设备和文件读写速度不同,若是同一接口的话可能会处理不过来。 2.9 策略决定做什么,机制决定如何做。他们两个的区分对于灵活性来说很重要。策略可能会随时间或位置而有所改变。在最坏的情况下,每次策略改变都可能需要底层机制的改变。系统更需要通用机制,这样策略的改变只需要重定义一些系统参数,而不需要改变机制,提高了系统灵活性。 3.1、短期调度:从准备执行的进程中选择进程,并为之分配CPU; 中期调度:在分时系统中使用,进程能从内存中移出,之后,进程能被重新调入内存,并从中断处继续执行,采用了交换的方案。 长期调度:从缓冲池中选择进程,并装入内存以准备执行。 它们的主要区别是它们执行的频率。短期调度必须频繁地为CPU选择新进程,而长期调度程序执行地并不频繁,只有当进程离开系统后,才可能需要调度长期调度程序。 3.4、当控制返回到父进程时,value值不变,A行将输出:PARENT:value=5。 4.1、对于顺序结构的程序来说,单线程要比多线程的功能好,比如(1)输入三角形的三边长,求三角形面积;(2)从键盘输入一个大写字母,将它改为小写字母输出。
化学反应工程习题 第一部分:均相反应器基本理论 1、试分别写出N 2+3H 2=2NH 3中用N 2、H 2、NH 3的浓度对时间的变化率来表示的该反应的速率;并写出这三种反应速率表达式之间的关系。 2、已知某化学计量式为 S R B A 2 121+=+的反应,其反应速率表达式为B A A C C r 5 .02=,试求反应速率B r =?;若反应的化学计量式写成S R B A +=+22,则此时反应速率A r =?为什么? 3、某气相反应在400 o K 时的反应速率方程式为2 21061.3A A P d dP -?=- τ h kPa /,问反应速率常数的单位是什么?若将反应速率方程改写为2 1A A A kC d dn V r =?-=τ h l mol ./,该反应速率常数k 的数值、单位如何? 4、在973 o K 和294.3×103Pa 恒压下发生下列反应:C 4H 10→2C 2H 4+H 2 。反应开始时,系统中含丁烷为116kg ,当反应完成50%时,丁烷分压以235.4×103Pa /s 的速率发生变化, 试求下列项次的变化速率:(1)乙烯分压;(2)H 2的摩尔数;(3)丁烷的摩尔分率。 5、某溶液反应:A+B →C ,开始时A 与B 摩尔数相等,没有C ,1小时后A 的转化率为75%,当在下列三种情况下,2小时后反应物A 尚有百分之几未反应掉? (1)对A 为一级、B 为零级反应; (2)对A 、B 皆为一级反应; (3)对A 、B 皆为零级反应。 6、在一间歇反应器中进行下列液相反应: A + B = R A + R = S 已知原料组成为C A0 = 2 kmol/m 3,C B0 = 4 kmol/m 3,C R0 = C S0 = 0。反应混合物体积的变化忽略不计。反应一段时间后测得C A = 0 .3 kmol/m 3,C R = 1.5 kmol/m 3。计算这时B 和S 的浓度,并确定A 的转化率、生成R 的选择性和收率。 7、一级可逆反应A = R 在等温下进行。已知C A0 = 500mol/m 3,C R0 = 0。若该反应在一间歇反应器中进行,且在反应温度下667.0=Ae x 。经480 s 后测得333.0=A x 。(1)试确定此反应的动力学方程;(2)计算A x 分别达到0.6和0.65所需的反应时间;(3)比较计算结果,你有什么体会?
1.1在多道程序和分时环境中,多个用户同时共享一个系统,返种情冴导致多种安全问题。a. 列出此类的问题b.在一个分时机器中,能否确保像在与用机器上一样的安全度?并解释乀。 Answer:a.窃叏戒者复制某用户癿程序戒数据;没有合理癿预算来使用资源(CPU,内存,磁盘空闱,外围设备)b.应该丌行,因为人类设计癿仸何保护机制都会丌可避兊癿被另外癿人所破译,而丏径自信癿认为程序本身癿实现是正确癿是一件困难癿亊。 1.2资源的利用问题在各种各样的操作系统中出现。试例丼在下列的环境中哪种资源必须被严栺的管理。(a)大型电脑戒迷你电脑系统(b)不服务器相联的工作站(c)手持电脑 Answer: (a)大型电脑戒迷你电脑系统:内存呾CPU资源,外存,网络带宽(b)不服务器相联癿工作站:内存呾CPU资源(c)手持电脑:功率消耗,内存资源 1.3在什举情冴下一个用户使用一个分时系统比使用一台个人计算机戒单用户 工作站更好? Answer:当另外使用分时系统癿用户较少时,仸务十分巨大,硬件速度径快,分时系统有意丿。充分利用该系统可以对用户癿问题产生影响。比起个人电脑,问题可以被更快癿解决。迓有一种可能収生癿情冴是在同一时闱有许多另外癿用户在同一时闱使用资源。当作业足够小,丏能在个人计算机上合理癿运行时,以及当个人计算机癿性能能够充分癿运行程序来达到用户癿满意时,个人计算机是最好癿,。 1.4在下面丼出的三个功能中,哪个功能在下列两种环境下,(a)手持装置(b)实
时系统需要操作系统的支持?(a)批处理程序(b)虚拟存储器(c)分时 Answer:对二实时系统来说,操作系统需要以一种公平癿方式支持虚拟存储器呾分时系统。对二手持系统,操作系统需要提供虚拟存储器,但是丌需要提供分时系统。批处理程序在两种环境中都是非必需癿。 1.5描述对称多处理(SMP)和非对称多处理乀间的区别。多处理系统的三个优点和一个缺点? Answer:SMP意味着所以处理器都对等,而丏I/O可以在仸何处理器上运行。非对称多处理有一个主处理器控制系统,不剩下癿处理器是随从关系。主处理器为从处理器安排工作,而丏I/O也叧在主处理器上运行。多处理器系统能比单处理器系统节省资金,返是因为他们能共享外设,大容量存储呾电源供给。它们可以更快速癿运行程序呾增加可靠性。多处理器系统能比单处理器系统在软、硬件上也更复杂(增加计算量、觃模经济、增加可靠性) 1.6集群系统不多道程序系统的区别是什举?两台机器属二一个集群来协作提 供一个高可靠性的服务器的要求是什举? Answer:集群系统是由多个计算机耦合成单一系统幵分布二整个集群来完成计算仸务。另一方面,多道程序系统可以被看做是一个有多个CPU组成癿单一癿物理实体。集群系统癿耦合度比多道程序系统癿要低。集群系统通过消息迕行通信,而多道程序系统是通过共享癿存储空闱。为了两台处理器提供较高癿可靠性服务,两台机器上癿状态必项被复制,幵丏要持续癿更新。当一台处理器出现敀障时,另一台处理器能够接管敀障处理癿功能。 1.7试区分分布式系统(distribute system)的客户机-服务器(client-server)模型不对等系统(peer-to-peer)模型
化学反应工程考试题
第一章 绪论 1.“三传一反”是化学反应工程的基础,其中所谓的一反是指__反应动力学__。 2.“三传一反”是化学反应工程的基础,下列不属于三传的是_______。 “三传”指的是质量传递、流量传递、动量传递 3. 一级连串反应在全混流釜式反应器中,则目的 产物P 的最大浓度_____、 _ _。 4. 一级连串反应在平推流反应器中,则目的产物 P 的最大浓度__、 ____。 5. 一级连串反应在间歇式全混流反应器中,则目 的产物P 的最大浓度_ 、 _。 6. 一级连串反应在平推流反应器中,为提高目的 产物P 的收率,应__降低__。 7. 化学反应速率式为 ,如用浓度表示的速率常数为, 用压力表示的速率常数为,则=__D__。 A. B. C. D. 8.反应,,则反应级数n=__B___。 A. 0 B. 1 C. 2 D. 3 9.反应A + B → C ,已知,则反应级数n=___B____。 A S K 1 K 2 P =max ,P C 2 2/1120 ]1)/[(+K K C A = opt τ2 11K K A S K 1 K 2 P =max ,P C 1 22 )(2 10K K K A K K C -= opt t 1 221) /ln(K K K K -A S K 1 K 2 P =max ,P C 1 22 )(2 10K K K A K K C -=opt t 1 221)/ln(K K K K -A S K 1 K 2 P 12/k k β αB A C A C C K r =-C K P K P K C K β α+-)(RT ) ()(βα+RT ) ()(βα-RT )()(βα+-RT C 4H 2C 2H 4 + H 2 1 0.2-=s k 1 15.0-=s k
⒉有人认为,开口系统中系统与外界有物质交换,而物质又与能量不可分割,所以开口系不可能是绝热系。这种观点对不对,为什么? 答:不对。“绝热系”指的是过程中与外界无热量交换的系统。热量是指过程中系统与外界间以热的方式交换的能量,是过程量,过程一旦结束就无所谓“热量”。物质并不“拥有”热量。一个系统能否绝热与其边界是否对物质流开放无关。 ⒊平衡状态与稳定状态,平衡状态与均匀状态有何区别和联系? 答:“平衡状态”与“稳定状态”的概念均指系统的状态不随时间而变化,这是它们的共同点;但平衡状态要求的是在没有外界作用下保持不变;而平衡状态则一般指在外界作用下保持不变,这是它们的区别所在。 ⒋倘使容器中气体的压力没有改变,试问安装在该容器上的压力表的读数会改变吗?在绝对压力计算公式 ) ()(b v b b e b P P P P P P P P P P ;中,当地大气压是否必定是环境大气压? 答:可能会的。因为压力表上的读数为表压力,是工质真实压力与环境介质压力之差。环境介质压力,譬如大气压力,是地面以上空气柱的重量所造成的,它随着各地的纬度、高度和气候条件不同而有所变化,因此,即使工质的绝对压力不变,表压力和真空度仍有可能变化。 “当地大气压”并非就是环境大气压。准确地说,计算式中的P b 应是“当地环境介质”的压力,而不是随便任何其它意义上的“大气压力”,或被视为不变的“环境大气压力”。 ⒌温度计测温的基本原理是什么? 答:温度计对温度的测量建立在热力学第零定律原理之上。它利用了“温度是 相互热平衡的系统所具有的一种同一热力性质”,这一性质就是“温度”的概念。⒍经验温标的缺点是什么?为什么? 答:由选定的任意一种测温物质的某种物理性质,采用任意一种温度标定规则所得到的温标称为经验温标。由于经验温标依赖于测温物质的性质,当选用不同测温物质制作温度计、采用不同的物理性质作为温度的标志来测量温度时,除选定的基准点外,在其它温度上,不同的温度计对同一温度可能会给出不同测定值(尽管差值可能是微小的),因而任何一种经验温标都不能作为度量温度的标准。这便是经验温标的根本缺点。 ⒎促使系统状态变化的原因是什么?举例说明。 答:分两种不同情况: ⑴若系统原本不处于平衡状态,系统内各部分间存在着不平衡势差,则在不平衡势差的作用下,各个部分发生相互作用,系统的状态将发生变化。例如,将一块烧热了的铁扔进一盆水中,对于水和该铁块构成的系统说来,由于水和铁块之间存在着温度差别,起初系统处于热不平衡的状态。这种情况下,无需外界给予系统任何作用,系统也会因铁块对水放出热量而发生状态变化:铁块的