
模拟题一
一.单项选择题(每题1分,共20分)
本大题解答(用A 或B 或C 或D )请填入下表:
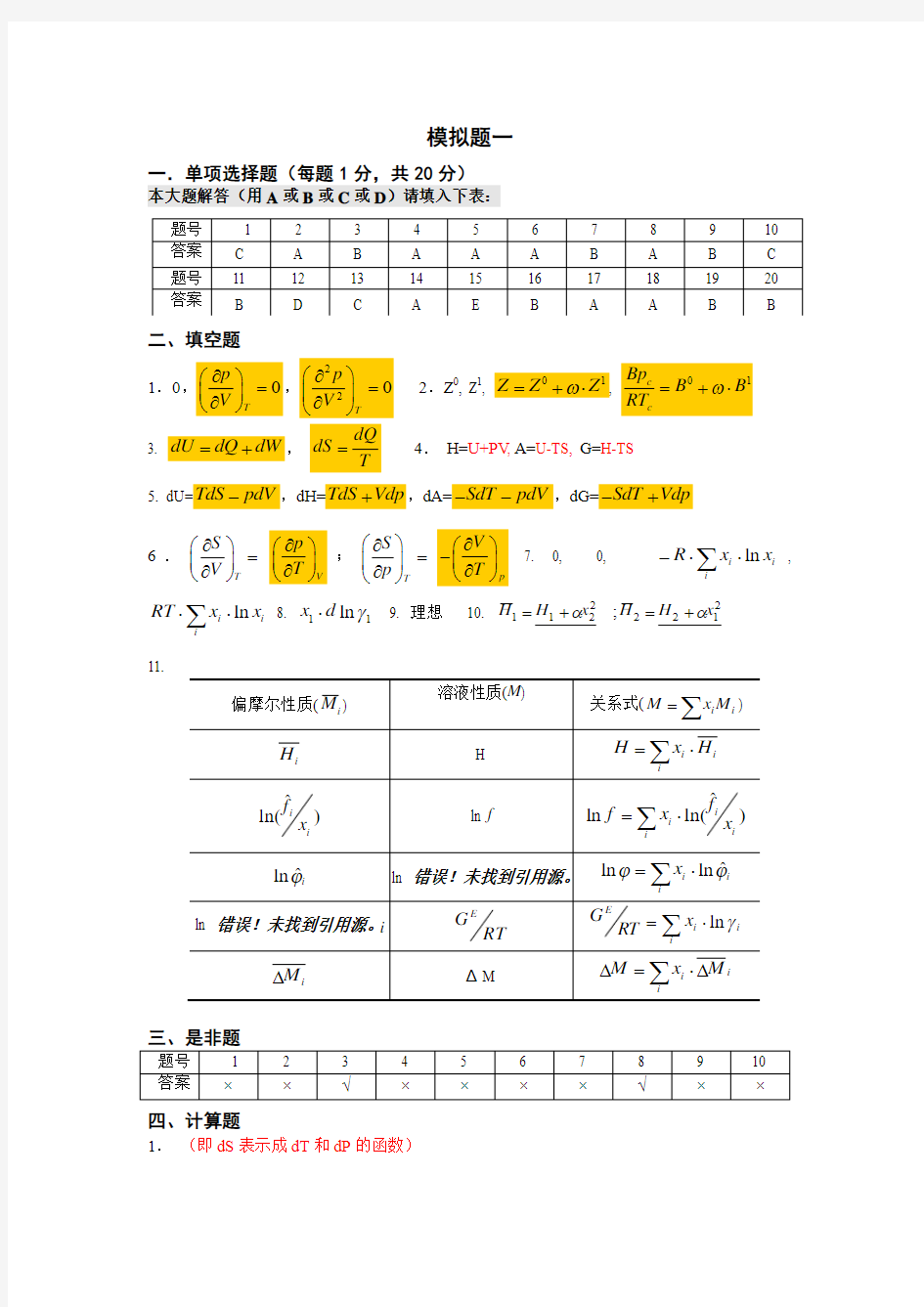
二、填空题
1.0,0T p V ???= ????,220T
p V ???= ???? 2.Z 0, Z 1
, 01Z Z Z ω=+?, 01c c Bp B B RT ω=+? 3. dU dQ dW =+, dQ
dS T
=
4. H=U+PV , A=U-TS, G=H-TS 5. dU=TdS pdV -,dH=TdS Vdp +,dA=SdT pdV --,dG=SdT Vdp -+
6.T S V ???=
????V p T ??? ????;T
S p ???= ?
???p V T ???- ???? 7. 0, 0, ∑??-i i i x x R ln , ∑??i
i i x x RT ln 8. 11ln γd x ? 9. 理想 10. 2
12222
11;x H H x H H αα+=+= 11.
偏摩尔性质(M i )
溶液性质(M )
关系式(i
i
M x M ∑=
)
i H
H
∑?=i
i i H x H
)?ln(i
i
x f
ln f
∑?=i
i
i
i x f x f )?ln(
ln
i ?
?ln ln 错误!未找到引用源。
∑?=i
i i x ?
??ln ln ln 错误!未找到引用源。i
RT
G E
∑?=i
i i E
x RT
G γln
i M ?
ΔM
∑??=?i
i i M x M
三、是非题
题号
1 2
3
4 5
6
7
8
9 10
答案
×
×
√
×
×
×
×
√
×
×
四、计算题
1. (即dS 表示成dT 和dP 的函数)
题号 1 2 3 4 5 6 7 8 9 10 答案 C A B A A A B A B C 题号 11 12 13 14 15 16 17 18 19 20 答案
B
D
C
A
E
B
A
A
B
B
p T
dS dS dS dT dp dT dp ????
=+ ? ?
???? p p
dQ dS T dT dT ?? ???= ? ?
?? ?
??,等压条件下,p dQ C dT =,所以,p p p dQ C dS T dT dT T ??
???== ? ??? ??? 由Maxwell 方程可知,p T
S V p T ??????=- ?
???????
因此,
p T
p p
S S dS dT dp T p C V dT dp T T ??????
=+ ? ??????????=- ???? 2. 1V = 28-20X 1+10 X 1
2
2V = 40 + 10 X 1 2 1V ∞= 28cm 3 /mol 2V ∞= 50 cm 3 /mol
V 1 = 18 cm 3 /mol V 2 = 40 cm 3 /mol , ΔV = 10X 1 X 2 V E
= 10X 1 X 2
3. 设加入W 克水,最终体积V cm 3;原来有n W 和n E 摩尔的水和乙醇,则有
?????
?
???
??=?+?=??+??? ??+=+??? ??+=+=+=65
354618964
461858
.5611.17181801.5861.1410''E W E
W E W E E W W E W E E W W n W n n n n W n V n V W n V n n V n V n 解方程组得结果:kg W m V 3830,46.133
==
4.解:(a )()725.1235.096.1)235.096.1(ln ?ln 11,,1112=-=-=?????
???=???? ??dn n n d n f n x f n P T
MPa x e f 12.1?1725.11==, 同样得MPa x e f 68.5?2
96.12== (b)725.1235.096.1ln ln 0
,1121=-====x x f
f ,所以725.11e f =
同样得 96.1ln 2=f ,所以96
.12e f =
模拟题二
一.单项选择题
1A 2D 3D 4B 5D 6C 7A 8D 9A 10E 11B 12C 13A 14C 15A
二、判断题:
1√ 2 х 3√ 4х 5√ 6х 7√ 8√ 9х 10√ 三、填充题:
1.Lewis-Randall 定则, Henry 定则 2.dU=TdS -PdV ; dH =TdS + VdP;
dA =-PdV -
SdT;
dG =VdP -SdT 3.0,0, i
i
x x R ∑-ln i
i
x x RT ∑ln
五、计算题: 1.
2、1V = 28-20X 1+10 X 1 2 2V = 40 + 10 X 1 2
1V ∞= 28 cm 3 /mol 2V ∞= 50 cm 3 /mol V 1 = 18 cm 3 /mol V 2 = 40 cm 3 /mol ΔV = 10X 1 X 2
V E
= 10X 1 X 2
3. ()0803
.00121
.1120320121
.110001=--=--=
+-=l g l g l V V V V x x V x V V ()118.40708303.02.259291697.033.2091-=?+?=+-=Jg x
H x H H g l ()1
13159.108303.00763.891697.07038.01--=?+?=+-=K Jg x
S x S S g l 1
053.183159.115.32318.407--=?-=-=Jg TS
H G 2
12
12221)ln (x Ax Ax x Ax x x RT
G i i E =+==∑γC B A x Ax f x Ax f Ax f x f -+++=++===1
22112212
2
1
111ln ln ln ?ln )?ln(ln γ
模拟题三
一、选择题
1C 2D 3A 4A 5B 6C 7D 8A 9B 10C 11A 12C 13D 14A 15A 16D 1718A 19B 20D 21C 22B 23A 24D 25B26B 27A 28A 29D 30D 31A 32A 33C 34D35B36B 37A 38D 39D 40B 41A 42B 43A 44A 45A 46D 47B 48C 49C 50B 51A 52B 53A 54A 55A
二、填空题(共6小题,12分)
1、三相点
2、Maxwell 关系式
3、0,0
4、将不易测定的状态性质偏导数与可测状态性质偏导联系起来.
5、体积
6、M-M '(T,P 一定)
7、0
8、理想溶液,0,0
9、?V =αX 1X 210、X 2 d ㏑
γ2 , =011、a i /X i 12、△U =Q +W △H +1/2△U 2+g △z=Q+W s 或△H +△E k +△E p =Q +W s 13、
ds ≥0
14、环境基态完全平衡15、不可逆性16、汽化熵17、第一定律;第二定律
三、判断题
√×√×××√××√×
四、名词解释
1、(5分) *
M M M R -= 指气体真实状态下的热力学性质M 与同一T ,P 下当气体处于理想
状态下热力学性质M* 之间的差额。 2、(5分)
000
.1)lg(7.0--==r T s r P ω 表示分子与简单的球形流体(氩,氪、氙)分子在形状
和极性方面的偏心度。
5、(5分)偏摩尔性质 i
j n P T i
i n nM M ≠??=,,])
([
在T 、P 和其它组分量n j 均不变情况下,向无限多的溶液中加入1mol 的组分i 所引起的一系列热力学性质的变化。
6、(5分)超额性质的定义是 M E
= M -M
id
,表示相同温度、压力和组成下,真实溶液与理
想溶液性质的偏差。ΔM E
与M E 意义相同。其中G E
是一种重要的超额性质,它与活度系数相关。
7、(5分)理想溶液有二种模型(标准态):^
f i id = X i f i (LR ) 和^
f i id
= X i k i (HL )
有三个特点:同分子间作用力与不同分子间作用力相等,混合过程的焓变化,内能变化和体
A x Ax f x Ax f Ax f x f ++=++===221122122
1
2
222ln ln ln ?ln )?ln(ln γA
x C B x Ax Cx Bx A x f x x f x f +-+=-+=+=12121
1212111)(?ln ?ln ln
积变化为零,熵变大于零,自由焓变化小于零。
五、简答题
1、(8分)偏离函数定义, *
M M M R -=
指气体真实状态下的热力学性质M 与同一T ,P 下当气体处于理想状态下热力学性质M* 之间的差额。如果求得同一T ,P 下M R ,则可由理想气体的M* 计算真实气体的M 或ΔM 。 2、(8分)(1)虽然甲烷具有较高的燃烧值,但在它的临界温度远低于常温,而乙烷的临界温度也低于夏天的最高温度,也就是说,即使压力再高,也不能使它们液化。
(2)尽管己烷的临界压力较低,但它的正常沸点远高于常温,即在常温它不易气化,不利于燃烧。 3、(6分)无
4、(6分)用热力学的普遍原理来检验实验数据的可靠性。检验的基本公式是Gibbs-Duhem 方程。该方程确立了混合物中所有组分的逸度(或活度系数)之间的相互关系。常用的方法是面积检验法和点检验法。汽液平衡数据的热力学一致性是判断数据可靠性的必要条件,但不是充分条件。3. 相平衡的热力学一致性检验
5、(6分)所有工作于等温热源和等温冷源之间的热机,以可逆热机效率最大, 所有工作于等温热源和等温冷源之间的可逆热机其效率相等,与工作介质无关。 η
max
=1-T2/T1
6、(6分)采用节流原理,当湿蒸汽充分节流后变为过热蒸汽,测定过热蒸汽的温度、压力得知过热蒸汽的焓值,从而求得湿蒸汽的干度。
7、(6分)理想功是指体系的状态变化是在一定的环境条件下按完全可逆的过程进行时,理论上可以产生的最大功或者必须消耗的最小功。损失功时指给定相同的状态变化时的不可逆实际功与理想功之间的差值。 Wl=W ac -W id
六、图示或计算题
1、(20分) (1) ?H=0 (2) ?S=0 (3) ?T=0 (4) ?P=0
01
2
3
4
5
6
1
2
3
4
5
6
S
T
3
113
113123121122211121213123
1211
122
12
112020)52020)60040600()4004060420()()()()4/600/400)3/640/420)2406004060420)1()1601802x x H H x x x x x x x H H x H H x H H x H x H x H m ol
J H m ol J H m ol J H m ol J H x H x x dx dH
x H dx dH x H H x dx dH 、E i i i i i i i -=?=-=-++-+-=-+-=-=-=?====+=+-=-+=-=--=∑∑∑∞∞
3. 1)
MPa
e e
P x P x P x x x x x x P P P P P x Py P x Py y x y x A x ARTx Ax x Ax x RT x RT G s s s s s s s s x i i E 07891.005918
.001973.00667.075.00174.025.075.0;25.00667.0ln 6878.20174.0ln 6878.2:ln ln ln ln //,1,)36878
.27.14ln ln lim ln )2)()ln (2
2
125.06878.275.06878.2222111212122122112211222211112
21110
12
12122
21=+=??+??=+===+=+=+=→=========+==??→∞∑γγγγγγγγαγγγ得+=1联立求解+与 和 即恒沸时2
4、(15分)解:进出透平机的蒸汽状态见下图所示,焓、熵值从附录水蒸汽表中查到, 按稳流系统热力学第一定律对透平机进行能量衡算,ΔH=Q-W s 则()s s s W W W H H m 95.0%512-=-=-
蒸汽流量
1
124.166506
.32474.26313600
300095.095.0-?=-??-=--=
h kg H H W m s
按本题意,等熵膨胀的空气应该是湿蒸汽,即为饱和蒸汽和饱和水的混合物,此时熵值,
即为饱和蒸汽和饱和水的熵按比例混合,从附录查得饱和蒸汽的熵
1
17153.7--?=K kg kJ S g ,从饱和水性质表查得饱和液体的熵,1
19875.0--??=K kg kJ S l
设空气中气相重量百分含量为x,
则 7.1271=7.7153×x +(1-x )×0.9875 解得 x =0.9126
空气的焓值 H=x ×H g +(1-x )H l
=0.9126×2631.4+(1-0.9126)×304.25=2428.0kJ ·kg -1 定熵效率
T
4 2 3
1
6 5
S
5、(15分)解:由水和水蒸汽性质表可查得各状态点的焓和熵值,设298K ,液态水为基准态,有效能为零。
根据有效能计算式:
)()(0000S S T H H B B ---=-
计算结果见下表所列。 序号 t,℃ P,MPa H,kJ ·kg -1 S,kJ ·kg -1·K -1 B,kJ ·kg -1 0 25 0.1 104.89 0.3674 0 1 160 0.15 2792.8 7.4665 572.4 2 160 0.3 2782.3 7.1276 662.9 3 100 0.07 2680.0 7.5341 439.4 4 100 0.1 2676.2 7.3614 487.1 5 100 0.1 419.04 1.3069 34.2 6 0
0.1
-334.4
-1.2247
35.2
判断水蒸汽的价值,应当用有效能而不是焓,从表中1,2可见,相同温度下,高压蒸汽的焓值虽不如低压蒸汽高,但是其有效能却比低压蒸汽为高。实际使用中,当然高压蒸汽的使用价值高,相对称为高品质能量。
模拟题四
模拟题五一、填空题
1. B 2. C 3. D 4. B 5. D 6. B 7. C 8. B 9. A 10. C 11. B 12. D 二、填空题
1.
2. 错 3. 不能 4. 正确 5. 错 6. 错
7. -10
8. 活度系数法,状态方程法 9. 减少 10. 11.5 11.大于、大于. 12. 升高
三、分析说明题
(1)状态(T 、P )的焓值H 是相对于某一基准态的焓值。1分
如基准态规定不同,同一状态点(T 、P )其焓值也是不同的。小张遇到问题,因不同来源水蒸汽图或表的焓值基准态规定不同造成的。4分
要注意问题:所查询过程始态和终态的焓值的基准态应相同。2分 (2)对锅炉进行能量衡算Q + W = △H + △[(1/2)C 2
]+ △(gh ) 1分 W ≈0 △(gh) ≈0 △[(1/2)C 2 ] ≈0 1分 ∴ Q ≈△H 1分 方法一:△H = H 2- H 1 [KJ/Kg] 查水蒸汽图或表的始、末态的焓值。1分 方法二:设计过程计算焓变(1分)
5Mpa 、40℃水→5Mpa 饱和水→5Mpa 饱和水蒸汽→5Mpa 、400℃的过热蒸汽。
据热容进行显热计算)(1212
1
t t C dt C H p t t p -≈=??[KJ/Kg],据汽化潜热进行相变热计算。
……
四、计算题
1、
(1)普遍化三参数压缩因子法:(共6分)
(1分)
?=
=
c
r c
r T T T P P P (1分)查压缩因子表得Z 0和Z 1
(1分)10Z Z Z
?+=?ω
偏摩尔性质(M i )
溶液性质(M ) i ?
?ln ln 错误!未找到引用
源。
ln 错误!未找到引用
源。i
RT G E
(1分)P
T
Z
ZRT P 丙烷μυυ314.8=?= (1分)如P 、T 、υ量纲不正确,则
扣1分
如果T 量纲为[K] ,P 量纲为[pa] 则υ量纲为[g m /3
]; 如果T 量纲为[K] ,P 量纲为[Kpa] 则υ量纲为[Kg m /3
]。
(1分))(50V 3m m υυ==∴ (υ量纲为[Kg m /3])
(2)真实气体状态方程法:(共7分)
(4×1=4分))(5.0b T a b RT P +--=
υυυ 已知.K)/(314
.8kg KJ R 丙烷
μ=
K T k p a
p 4101053=?=
(1分)而
c
c C C c
c
C C P T R b P T R f b P T R a P T R f a /0864.0),,(/42748.0),,(5
.22?====或或
须查取丙烷的临界参数
(1分)据)
(5.0b T a b RT P +--=
υυυ,经试差计算得υ(Kg m /3), (1分))(50V 3m m υυ==∴ (υ量纲为[Kg m /3])
2、(1)共9分
4分
R R H H H H 2*1+?+-=? 2分
1+1+1=3分
(2)共4分
如据 计算,一方面:对于真实流体特别
H 2R -H 1R ?H=? B 过热蒸汽4 .052Mpa ,653K B 饱和蒸汽(理气) 1 .013Mpa ,453K B 饱和蒸汽
1 .013Mpa ,453K
B 过热蒸汽(理气) 4 .052Mpa ,653K ?H*
653453
32653
453
2
653
453
*
|)3
1
5.0()(0CT BT AT dT CT BT A dT C H H H P P T ++=++=+
=?+?=??
?dP T
V
T V dT C H P P p P ?
?
??-+=?21
])([653
453
是新开发的物系,其热容往往比较缺乏;另一方面真实流体的状态方程比较复杂,即计算较繁琐、工作量大。基于此,则工程中计算过程△H 可引入剩余性质的概念,计算较简单、方便。 1+2+1=4分
3. (1)汽液平衡式i S i i i g i
L i y P P x f f ?=???=γ??
1分 3分(不作化简说明的,则扣1分)
(2)
J
n P T i E i n RT G n ,,)/(ln ????
??????=γ 2分
2
2
12122)/(n n n x x RT G E
?=?=而 1分 2
2
12ln x =∴γ 2122ln x =γ 1.5+1.5=3分
(3)
11121112220.735(1)0.73512169.4981.3150.695()
150.695()
S S
x x P P y P y x p x p e x e x Kpa p Kpa γγ-=?+?=??+??=+=∴=
1.5+1+0.5=3分
模拟题六
一、填空题
212
212)1(2)
1(31.3737.8211x e x e x x -+=-
1. C 2. A 3. C 4. D 5. A 6. C 、 C 7. C 8. B 9. A 10. B 11. A 13. A
二、填空题 1.
2. 错 3. T r P r ω 4. 饱和液体 5. t< t C 6. 对 7. 液 8. 焓、 熵、内能 9. 11.5 10. < > 11. 减少 12. 错
三、分析说明题(11分)第1题5分、第2题6分
1、 如果该模型合理,则应满足G-D 方程0)(ln )(ln 2211=+γγd x d x 1分
222211
)(ln )(ln dx d x dx d x γγ-= 1分 而 )65()1()
(ln 222211
x x x dx d x -?-=γ1分 )56)(1()
(ln 2222
22
--?-=-x x x dx d x γ 1分 该模型合理 1分 2、(1)夏天从低温热源(房间)将热量移到高温热源(环境)以实现制冷的效果,(1分)该过程是不能自发进行的(1分)。而借助空调消耗电功,则制冷循环就可自发进行了,即可将热量从低温热源移到高温热源。(1分)
(2)冬天从低温热源(环境)将热量移到高温热源(房间)以实现供热的效果,(1分)该过程是不能自发的(1分)。而借助空调消耗电功,则热泵供热循环就可自发进行了。(1分)
……
四、计算题(共39分)(每题13分)
1.(1) 3+1×2=5分 0,1,2(104.892684.9)298(0.3674 5.4924)105
2.8/(104.892792.2)298(0.3674 6.4448)876.3/id id id W H T S
W KJ Kg W KJ Kg =?-?=--?-=-=--?-=- (2) 3+1×2=5分
偏摩尔性质(M i )
溶液性质(M ) i ?
?ln ln 错误!未找到引用
源。
i
f ?ln ln f
12(104.892684.9)2580.1.8/(104.892792.2)2687.3/Q H
Q KJ Kg Q KJ Kg
=?=-=-=-=- (3) 高压蒸汽的作功本领比低压蒸汽强。高压蒸汽的加热能力比低压蒸汽弱,因此用低压蒸汽作为工艺加热最恰当,并可减少设备费用。 1.5+1.5=3分
2、(1)汽液平衡式i S i i i g
i
L
i y P P x f f ?=??=γ即?? 3分
(2)
J
n P T i E i n RT G n ,,)/(ln ????
??????=γ 2分
2
2
121735.0735.0/n n n x x RT G E
?=??=而 1分 2
2
1735.0ln x =∴γ 212735.0ln x =γ 1+1=2分
(3)
2
2
1112111222
0.735(1)0.73512
169.4981.3150.695()
150.695()
S S
x x P P y P y x p x p e
x e
x Kpa p Kpa γγ-=?+?=??+??=+=∴= 1.5+1+0.5=3分
11111111
0.676
S
S P y x p y x p P γγ?=??∴=??= 2分
211
0.7351
/s
x x p y e p ??==0.676 3、解:(1)H 3 = H 4=270kJ ·kg -1
制冷能力 q 0=H 1-H 4=1430-270=1160KJ ·kg -1 (3分)
制冷剂循环量 14
005.341160
104-?=?==h kg q Q G (2.5分)
(2)冷凝过程即2→3,放出热量Q=G(H 3-H 2)=34.5(270-1690)= - 48645KJ ·h -1 ( 2.5
分)
(3)压缩机功率 kW H H G N 40.23600
)
14301680(5.343600)(12=-=-=
(2.5分)
(4)制冷系数
64.4250
11601430168027014301241==--=--=
H H H H ξ (2.5分)
模拟题八
一、单项选择题
本大题解答(用A 或B 或C 或D )请填入下表:
二、填充题
1.0; 2.真实气体,理想气体; 3.0
???i
i i
id
i
i
i
i i f x f f f x a
=
=
=γ
4.12
1T T -
=η ;
5.)()(12012S S T H H W id ---=,)()(12012S S T H H W E id x ---==?; 6.Gibbs-Duhem ; 7.不可逆性; 8.完全可逆;
9.大; 10.1; 11.无热; 12.混合; 13.Tr ,Pr , ω
三、判断题
题号 1 2 3 4 5 答案
X
X
√
√
X
四、简答题
1.答:稳定流动系统的热力学第一定律表达式为:s W Q z g u H +=?+?+
?2
2
1 (1) 流体流经换热器传质设备
W s =0;另外,考虑动能项和势能项与焓变之间的数量级差别,动能项和势能项可以忽略,即02
12
≈?u ,0≈?z g ;因此,稳流系统热力学第一定律可化简为:Q H =?
流体流经泵、压缩机、透平等设备
在数量级的角度上,动能项和势能项不能与焓变相比较,可以忽略,即
02
12
≈?u ,0≈?z g ;即:s W Q H +=?
若这些设备可视为与环境绝热,或传热量与所做功的数值相比可忽略不计,那么进
一步可化简为:s W H =?
题号 1 2 3 4 5 6 7 8 9 10 答案 B C C D B C A A C B 题号 11 12 13 14 15 16 17 18 答案
C
D
C
D
A
D
B
C
2.组分i 在汽相分逸度系数=V
i φ? 1 ,=S
i
φ? 1
五、计算题
1.解:(1)126.23109.025541.0120)1(-?=?+?=?+-?=Kg KJ x H x H H g L
1126745.79.04808.81.04177.0)1(--??=?+?=?+-?=K Kg KJ x S x S S g L
0=Q 111395.1535.66745.7--??-?=?K Kg KJ ===体12t S -S S S
14.86331746.2310-?--?Kg KJ ===H Ws
1012031395.129831746.2310-?-?--??-?=Kg KJ S T H W id =)=(t 106.3391395.1298-?=?=??=Kg KJ S T W t L
%8.71%1001203
4
.863=?==
id s W W η (2)110168.0298
--??=?K 5
T Q 0Kg KJ S ==环环
111563.10168.01395.1--??+?+?=?K Kg KJ ==环体S S S t 14.85854.863-?-=+-?Kg KJ ==Q -H Ws
106.3441563.1298-?=?=??=Kg KJ S T W t L
11203-?-=Kg KJ W id =
%4.71%1001203
4
.858=?==
id s W W η
2.解:
已知P ,x i 假设: T
计算: P i s
i γ
计算: y i 公式:P
P x s
i i ??=
i i y γ
ξ≤-∑1i
y
No ,重新调整 T
输出T ,y i
[]
[]
m ol J H H H m ol
J H H m ol J H H H m ol
J H H x x x x dx H d x H H x x x x x dx H
d x H H x x x x dx H
d x x x x x x H x x /8.6688.41627/8.41lim /9.4389.20418/9.20lim 8.41)31)(9.20()1(9.20)
132(9.20)31)(9.20)(1()31(9.20)
1()31(9.20)2()1(9.20))1((9.20)2(9.2022220
211110
13
1
211211
122131211311
113111211
211212121=+=?+==?=?=+=?+==?=?=---=?-?=?+-=--+-=?-+?=?-=-+-=?-=+=?∞∞→∞∞∞→∞ 3.解:(1)由于 ()
j
n p T i E i n RT nG ,,ln ?
??
?????=γ 故:对于二元混合物,可以使用二元截矩公式计算活度系数
二元截矩公式为:???
???
?
-=-=1
12221d d d d x M x M M x M
x M M 则:????
???
??-=-=1E
122
E
2
1d )G d(ln d )G d(ln x RT x RT G
x RT x RT G E E
γγ 将21/x x RT G E
β=代入上式,整理得:???==2
1
22
2
1ln ln x x βγβγ 4、(1)P=851.3mmHg
(2)根据相对挥发度在两端一个大于1,一个小于,所以存在恒沸点,又根据
1,1>>B A γγ,所以为最高恒沸点
(3)2
6ln A B x ?=γ
模拟题九
一、选择正确答案并简要说明为什么
1. 选(a )。 由剩余性质定义*M M M
R
-=。
2. 选(b )。 过程不可逆g S 0?>, 吸热f S 0?>,S 0∴?>。
3. 选(b )(c)。 由理想功的定义及理想功与火用 变化的关系x id E W ?=-或id x W E =-?
4. 选(a )(b) 。 由热力学第一定律知,节流过程是等焓过程,但节流过程是不可逆过程
S 0∴?>
二、简答题
1. (1)图解法,如图示 。
(2)公式法
(3)偏摩尔混合变量法
1M
(4)由定义式 (5)有吉布斯—杜亥姆方程。 上述答案任意三种均可。 2. 2
s 1h u g Z q W 2
?+
?+?=-(以1Kg 为基准) 对于换热过程,21u 2?=0,g Z ?=0,2
s 1h u g Z q W 2
?+?+?=-s W =0 h q ∴?=。
换热量可由过程的焓变化求出。(举例可任意)
三、证明题
解: 等T ,等P
i i x dM 0=∑ 1122
x d H x d H 0+= 21211
dH dH
x x 0dx dx += 1
2
2
211
dx H d x dx H d x = 1221x 2Bx x 2Bx = =∴左式右式 即从热力学角度考虑该对方程合理。
四、计算题
1. 解:
① 绝热 Q=0, W S =-△H 1230932707386/s W H H KJ Kg =-=-= ② S T H E x ?-?=?0=(2707-3093)-298×(7.127-6.207)=-660.16kJ/Kg ③ 0274.16/N A T S KJ Kg ?=?=
0 1
M 2M
1x
④ x id E W ?=- 660.16/id W KJ Kg ∴=∵绝热 ∴△S sur =0 则 W L =△A N,t =T 0△S sys =274.16kJ/Kg 2. 解:
E
1111122112212122212
G d(x )(1x )
ln 0.7x x x 0.7RT dx 0.7x x 0.7x (12x )
0.7x x 0.7x (x x )0.7x γ-==+?=+-=+-= 同理 2
21ln 0.7x γ=
3. 解: 相平衡判据简化为:s i i i i p x Py γ=
s
1111s s
111222x P y x P x P γγγ=
+ 1ln γ=0.7?2
0.5=0.175
1211.1912 1.1912
γγγ∴===
12y 0.68 y 0.32 P 126.87()KPa ∴===
模拟题十
一、选择题
1.B
2.D
3.B
4.A
5.B
6.C
7. D
8. A
9. B 10. A 11.B 12. B 13. A 14. B 15.B 16B 17 A 18.B 19.B 20.C
二、填空题
1.温度
2. R/PV 或 1/T
3. 最大
4.id R
M M M -= 5. 汽液平衡
6.∑==
r
j j
ij
i d dn 1
ε
ν 7. Gibbs-Duhem 方程
8. 理想气体的混合物 9. 热力学第一定律、热力学第一定律和热力学第二定律
三、判断题
1.
× 2. × 3. × 4. √ 5. √ 6. × 7. √ 8. × 9. × 10. √
四、简答题
1(5分). 解: p
p p p S H H T S H H T S T ??? ???????? ????=?????=???
????)(
p p
C T H =??? ????
T S H p
=???
???? ∴ 0 p
p C T S T =
???
???? 2.(5分) 解:id E
H H H
-= id E H H H ?-?=?
对于理想溶液:0=?id
H
∴ H H E
?=?
E id E H H H H ?=-=
∴ H H E
?=
五、论述题
解:恒温恒压下D G - Eq
0ln =∑i
i
d x γ
(2分)
+111
ln dx d x γ0ln 1
22=dx d x γ 21dx dx -= (1分)
212
1
1111
2ln ln x Ax dx d x dx d x -=-=γγ
模拟题一 一.单项选择题(每题1分,共20分) 本大题解答(用A或B或C或D)请填入下表: 1.T温度下的纯物质,当压力低于该温度下的饱和蒸汽压时,则气体 的状态为(c ) A.饱和蒸汽 B.超临界流体 C.过热蒸汽 2.T温度下的过冷纯液体的压力P(a ) A.>()T P s B.<()T P s C.=()T P s 3.T温度下的过热纯蒸汽的压力P( b ) A.>()T P s B.<()T P s C.=()T P s 4.纯物质的第二virial系数B() A 仅是T的函数 B 是T和P的 函数 C 是T和V的 函数 D 是任何两强度性质 的函数 5.能表达流体在临界点的P-V等温线的正确趋势的virial方程,必须 至少用到() A.第三virial系 数B.第二virial 系数 C.无穷 项 D.只需要理想气 体方程 6.液化石油气的主要成分是() A.丙烷、丁烷和少量 的戊烷B.甲烷、乙烷 C.正己 烷 7.立方型状态方程计算V时如果出现三个根,则最大的根表示() A.饱和液摩尔体积 B.饱和汽摩尔体积 C.无物理意义
8. 偏心因子的定义式( ) A. 0.7lg()1 s r Tr P ω==-- B. 0.8lg()1 s r Tr P ω==-- C. 1.0lg()s r Tr P ω==- 9. 设Z 为x ,y 的连续函数,,根据欧拉连锁式,有( ) A. 1x y z Z Z x x y y ?????????=- ? ? ?????????? B. 1y x Z Z x y x y Z ?????????=- ? ? ?????????? C. 1y x Z Z x y x y Z ?????????= ? ? ?????????? D. 1y Z x Z y y x x Z ?????????=- ? ? ?????????? 10. 关于偏离函数M R ,理想性质M *,下列公式正确的是( ) A. *R M M M =+ B. *2R M M M =- C. *R M M M =- D. *R M M M =+ 11. 下面的说法中不正确的是 ( ) (A )纯物质无偏摩尔量 。 (B )任何偏摩尔性质都是T ,P 的函数。 (C )偏摩尔性质是强度性质。(D )强度性质无偏摩尔量 。 12. 关于逸度的下列说法中不正确的是 ( ) (A )逸度可称为“校正压力” 。 (B )逸度可称为“有效压力” 。 (C )逸度表达了真实气体对理想气体的偏差 。 (D )逸度可代替压力,使真实气体的状态方程变为fv=nRT 。 (E )逸度就是物质从系统中逃逸趋势的量度。 13. 二元溶液,T, P 一定时,Gibbs —Duhem 方程的正确形式是 ( ). a. X 1dlnγ1/dX 1+ X 2dlnγ2/dX 2 = 0 b. X 1dlnγ1/dX 2+ X 2 dlnγ2/dX 1 = 0 c. X 1dlnγ1/dX 1+ X 2dlnγ2/dX 1 = 0 d. X 1dlnγ1/dX 1– X 2 dlnγ2/dX 1 = 0 14. 关于化学势的下列说法中不正确的是( ) A. 系统的偏摩尔量就是化学势 B. 化学势是系统的强度性质
北京化工大学2016——2017学年第一学期 《化工热力学》期末考试试卷 班级: 姓名: 学号: 任课教师: 分数: 一、(2?8=16分)正误题(正确的画√,错误的画×,标在[ ]中) [√]剩余性质法计算热力学性质的方便之处在于利用了理想气体的性质。 [×]Virial 方程中12B 反映了不同分子间的相互作用力的大小,因此120B =的气体混合物,必定是理想气体混合物。 [√]在二元体系中,如果在某浓度范围内Henry 定律适用于组分1,则在相同的浓度范围内,Lewis-Randall 规则必然适用于组分2。 [×]某绝热的房间内有一个冰箱,通电后若打开冰箱门,则房间内温度将逐渐下降。 [×]溶液的超额性质数值越大,则溶液的非理想性越大。 [×]水蒸汽为加热介质时,只要传质推动力满足要求,应尽量采用较低压力。 [×]通过热力学一致性检验,可以判断汽液平衡数据是否正确。 [×]如果一个系统经历某过程后熵值没有变化,则该过程可逆且绝热。 二、(第1空2分,其它每空1分,共18分)填空题 (1)某气体符合/()p RT V b =-的状态方程,从 1V 等温可逆膨胀至 2V ,则体系的 S ? 为 21ln V b R V b --。 (2)写出下列偏摩尔量的关系式:,,(/)j i E i T p n nG RT n ≠???=?????ln i γ,
,,(/)j i R i T p n nG RT n ≠???=??????ln i ?, ,,(/)j i i T p n nG RT n ≠???=?????i μ。 (3)对于温度为T ,压力为P 以及组成为{x}的理想溶液,E V =__0__, E H =__0__,/E G RT =__0__,ln i γ=__0__,?i f =__i f __。 (4)Rankine 循环的四个过程是:等温加热(蒸发),绝热膨胀(做功),等压(冷凝)冷却,绝热压缩。 (5)纯物质的临界点关系满足0p V ???= ????, 220p V ???= ???? ,van der Waals 方程的临界压缩因子是__0.375__,常见流体的临界压缩因子的范围是_0.2-0.3_。 二、(5?6=30分)简答题(简明扼要,写在以下空白处) (1)简述如何通过水蒸汽表计算某一状态下水蒸汽的剩余焓和逸度(假定该温度条件下表中最低压力的蒸汽为理想气体)。 剩余焓: ①通过线性插值,从过热水蒸汽表中查出给定状态下的焓值; ②从饱和蒸汽表中查得标准状态时的蒸发焓vap H ?(饱和液体的焓-饱和蒸汽的焓); ③通过00()T ig ig ig p p T H C dT C T T ?=≈-? 计算理想气体的焓变; ④通过R ig vap H H H H ?=-?-?得到剩余焓。 逸度: ①通过线性插值,从过热水蒸汽表中查出给定状态下的焓和熵并根据G H TS =-得到Gibbs 自由能(,)G T p ; ②从过热蒸汽表中查得最低压力时的焓和熵,计算得到Gibbs 自由能0(,)ig G T p ;
第1章 绪言 一、是否题 1. 孤立体系的热力学能和熵都是一定值。(错。G S H U ??=?=?,,0,0但和 0不一定等于A ?,如一体积等于2V 的绝热刚性容器,被一理想的隔板一分为二,左侧状 态是T ,P 的理想气体,右侧是T 温度的真空。当隔板抽去后,由于Q =W =0, 0=U ?,0=T ?,0=H ?,故体系将在T ,2V ,0.5P 状态下达到平衡,()2ln 5.0ln R P P R S =-=?,2ln RT S T H G -=-=???,2ln RT S T U A -=-=???) 2. 封闭体系的体积为一常数。(错) 3. 理想气体的焓和热容仅是温度的函数。(对) 4. 理想气体的熵和吉氏函数仅是温度的函数。(错。还与压力或摩尔体积有关。) 5. 封闭体系的1mol 气体进行了某一过程,其体积总是变化着的,但是初态和终态的体积相等, 初态和终态的温度分别为T 1和T 2,则该过程的? =2 1 T T V dT C U ?;同样,对于初、终态压力相 等的过程有? =2 1 T T P dT C H ?。(对。状态函数的变化仅决定于初、终态与途径无关。) 6. 自变量与独立变量是一致的,从属变量与函数是一致的。(错。有时可能不一致) 三、填空题 1. 状态函数的特点是:状态函数的变化与途径无关,仅决定于初、终态 。 2. 单相区的纯物质和定组成混合物的自由度数目分别是 2 和 2 。 3. 1MPa=106Pa=10bar=9.8692atm=7500.62mmHg 。 4. 1kJ=1000J=238.10cal=9869.2atm cm 3=10000bar cm 3=1000Pa m 3。 5. 普适气体常数R =8.314MPa cm 3 mol -1 K -1=83.14bar cm 3 mol -1 K -1=8.314 J mol -1 K -1 =1.980cal mol -1 K -1。 第2章P-V-T关系和状态方程 一、是否题 1. 纯物质由蒸汽变成液体,必须经过冷凝的相变化过程。(错。可以通过超临界流体区。) 2. 当压力大于临界压力时,纯物质就以液态存在。(错。若温度也大于临界温度时,则是超临 界流体。) 3. 纯物质的饱和液体的摩尔体积随着温度升高而增大,饱和蒸汽的摩尔体积随着温度的升高而减小。(对。则纯物质的P -V 相图上的饱和汽体系和饱和液体系曲线可知。) 4. 纯物质的三相点随着所处的压力或温度的不同而改变。(错。纯物质的三相平衡时,体系自 由度是零,体系的状态已经确定。)
化学化工学院《化工热力学》课程考试试题(A 卷) 2013-2014学年 第一学期 班级 时量120分钟 总分100分 考试形式:闭卷 一、填空题(24分,每空1.5分) 1、写出热力学基本方程式dU= ;dA = 。 2、几个重要的定义公式: A= ; H= ;G=__________。 3、对理想溶液,ΔH=_______,ΔS=________。 4、热力学第一定律的公式表述(用微分形式): 。 5、等温、等压下的二元液体混合物的活度系数之间的关系_________+0ln 11=γd x 。 6、化工热力学研究的主要方法包括: 、 、 。 7、以压缩因子表示的三参数对应态原理的关系式: 。 8、朗肯循环的改进的方法: 、 、 。 二、选择题(每个2分,共22分,每题只一个选择项是正确答案) 1、纯物质的第二virial 系数( ) A 、仅是温度的函数 B 、是温度和压力的函数 C 、 是温度和体积的函数 D 、是任何两强度性质的函数 2、泡点的轨迹称为( ) A 、饱和汽相线 B 、汽液共存线 C 、饱和液相线 3、等温等压下,在A 和B 组成的均相体系中,若A 的偏摩尔体积随A 浓度的减小而减小,则B 的偏摩尔体积将随A 浓度的减小而( ) A 、增加 B 、减小 C 、不变 D 、不一定 4、关于活度和活度系数的下列说法中不正确的是 ( ) A 、活度是相对逸度,校正浓度,有效浓度; B 、理想溶液活度等于其浓度。 C 、活度系数表示实际溶液与理想溶液的偏差。 D 、γi 是G E /RT 的偏摩尔量。 5、在一定的温度和压力下二组分体系汽液平衡的条件是( )。 为混合物的逸度)) (; ; ; L2V1V2L1L2 L1V2122f f f D f f f f C f f f f B f f f f A V L V L V L V (????).(????)(????).(=======11 6、关于偏摩尔性质,下面说法中不正确的是( ) A 、纯物质无偏摩尔量。 B 、T 与P 一定,偏摩尔性质就一定。
化工热力学习题集(附标准答案)
————————————————————————————————作者:————————————————————————————————日期:
模拟题一 一.单项选择题(每题1分,共20分) 本大题解答(用A 或B 或C 或D )请填入下表: 1. T 温度下的纯物质,当压力低于该温度下的饱和蒸汽压时,则气体的状态为(C ) A. 饱和蒸汽 B. 超临界流体 C. 过热蒸汽 2. T 温度下的过冷纯液体的压力P ( A ) A. >()T P s B. <()T P s C. =()T P s 3. T 温度下的过热纯蒸汽的压力P ( B ) A. >()T P s B. <()T P s C. =()T P s 4. 纯物质的第二virial 系数B ( A ) A 仅是T 的函数 B 是T 和P 的函数 C 是T 和V 的函数 D 是任何两强度性质的函数 5. 能表达流体在临界点的P-V 等温线的正确趋势的virial 方程,必须至少用到( ) A. 第三virial 系数 B. 第二virial 系数 C. 无穷项 D. 只需要理想气体方程 6. 液化石油气的主要成分是( A ) A. 丙烷、丁烷和少量的戊烷 B. 甲烷、乙烷 C. 正己烷 7. 立方型状态方程计算V 时如果出现三个根,则最大的根表示( B ) A. 饱和液摩尔体积 B. 饱和汽摩尔体积 C. 无物理意义 8. 偏心因子的定义式( A ) A. 0.7lg()1 s r Tr P ω==-- B. 0.8lg()1 s r Tr P ω==-- C. 1.0lg()s r Tr P ω==- 9. 设Z 为x ,y 的连续函数,,根据欧拉连锁式,有( B ) A. 1x y z Z Z x x y y ???? ?????=- ? ? ?????????? B. 1y x Z Z x y x y Z ????????? =- ? ? ?????????? C. 1y x Z Z x y x y Z ????????? = ? ? ?????????? D. 1y Z x Z y y x x Z ????????? =- ? ? ?????????? 10. 关于偏离函数M R ,理想性质M *,下列公式正确的是( C ) A. *R M M M =+ B. *2R M M M =- C. *R M M M =- D. *R M M M =+ 11. 下面的说法中不正确的是 ( B ) (A )纯物质无偏摩尔量 。 (B )任何偏摩尔性质都是T ,P 的函数。 (C )偏摩尔性质是强度性质。(D )强度性质无偏摩尔量 。 12. 关于逸度的下列说法中不正确的是 ( D ) (A )逸度可称为“校正压力” 。 (B )逸度可称为“有效压力” 。 (C )逸度表达了真实气体对理想气体的偏差 。 (D )逸度可代替压力,使真实气体 的状态方程变为fv=nRT 。 (E )逸度就是物质从系统中逃逸趋势的量度。 题号 1 2 3 4 5 6 7 8 9 10 答案 题号 11 12 13 14 15 16 17 18 19 20 答案
泰山学院课程考试专用 泰山学院材料与化学工程系2005级、2007级3+2化学工程与 工艺专业本科2007~2008学年第一学期 《化工热力学》试卷A (试卷共8页,答题时间120分钟) 一、 判断题(每小题1分,共15 分。请将答案 填在下面的表格内) 1、只要温度、压力一定,任何偏摩尔性质都等于化学位。 2、对于确定的纯气体来说,其维里系数B 、C 、……只是温度的函数。 3、孤立体系的熵总是不变的。 4、当过程不可逆时,体系的作功能力较完全可逆的情况下有所下降。 5、二元液相部分互溶体系及其蒸汽的达到相平衡时,体系的自由度为2。 6、理想溶液中所有组分的活度系数均为1。 7、二元混合物的相图中泡点线表示的饱和汽相,露点线表示的是饱和液相。 8、二元组分形成恒沸物时,在恒沸点体系的相对挥发度等于1。 9、若化学平衡常数随着温度的升高而升高,则反应的标准焓变化0H ?为负值。 10、纯物质的平衡汽化过程,其摩尔体积、焓及吉布斯函数的变化均大于零。 11、在一定温度和压力下的理想溶液的组分逸度与其摩尔分数成正比。 12、对于理想溶液的某一容量性质恒有0i i M M =。 13、能量不仅有数量的大小还有质量的高低,相同数量的电能和热能来说,电 能的做功能力大于热能。 14、无论以Henry 定律为基准,还是以Lewis-Randall 规则为基准定义标准态 逸度,混合物中组分i 的活度和逸度的值不变。 15、逸度与压力的单位是相同的。
二、填空题(1-5题每空1分,6-11题每空2分,共25分) 1、在相同的初态下,节流膨胀的降温效果 (大于/小于) 等熵膨胀的降温效果。 2、恒温恒压下,吉布斯-杜亥姆方程为 (以i M 表示)。 3、形成二元溶液时,当异种分子之间的作用力小于同种分子之间的作用力时, 形成正偏差溶液,正偏差较大的溶液具有最 的沸点。 4、对于二元混合物来说一定温度下的泡点压力与露点压力 (相同/不 同)的。 5、当过程的熵产生 时,过程为自发过程。 6、当化学反应的温度不发生变化时,对体积增大的气相反应,增大压力,反 应进度 ,加入惰性气体反应进度 。 7、已知平衡压力和液相组成,用完全理想体系下的汽液平衡准则计算泡点温 度时,在假设的温度下算出1i y <∑,说明假设的温度 , 应 ,重新计算,直到1i y =∑。 8、正丁醇(1)和水(2)组成液液平衡系统,25℃,测得水相中正丁醇的摩 尔分数为0.00007,而醇相中水的摩尔分数为0.26,则水在水相中的活度系数为 ,水在醇相中的活度系数为 。 9、某换热器内,冷热两种流体进行换热,热流体的流率为 -1100kmol h ?,-1-129kJ kmol K p c =??,温度从500K 降为350K,冷流体的流率 也是-1100kmol h ?,-1-129kJ kmol K p c =??,温度从300K 进入热交换器,该换热器表面的热损失-187000kJ h Q =-?,则冷流体的终态温度t 2= K,该换热过程的损耗功W L = kJ/h 。设300K T Θ=,冷热流体的压力变化可以忽略不计。
一.选择题(每题2分,共10分) 1、纯物质的第二virial 系数B ( A ) A 仅就是温度的函数 B 就是T 与P 的函数 C 就是T 与V 的函数 D 就是任何两强度性质的函数 2、T 温度下的过冷纯液体的压力P (A 。参考P -V 图上的亚临界等温线。) A. >()T P s B. <()T P s C. =()T P s 3、 二元气体混合物的摩尔分数y 1=0、3,在一定的T,P 下,8812.0?,9381.0?21==?? ,则此时混合物的逸度系数为 。(C) A 0、9097 B 0、89827 C 0、8979 D 0、9092 4、 某流体在稳流装置中经历了一个不可逆绝热过程,装置所产生的功为24kJ,则流体的熵变( A ) A 、大于零 B 、小于零 C 、等于零 D 、可正可负 5、 Henry 规则( C ) A 仅适用于溶剂组分 B 仅适用于溶质组分 C 适用于稀溶液的溶质组分 D 阶段适用于稀溶液的溶剂 二、填空题(每题2分,共10分) 1. 液态水常压下从25℃加热至50℃,其等压平均热容为75、31J/mol,则此过程的焓变为 (1882、75)J/mol 。 2. 封闭体系中的1mol 理想气体(已知ig P C ),按下列途径由T 1、P 1与V 1可逆地变化至P 2,则, 等温过程的 W =21ln P P RT -,Q =21ln P P RT ,U = 0 ,H = 0 。 3. 正丁烷的偏心因子ω=0、193,临界压力为p c =3、797MPa,则在Tr =0、7时的蒸汽压为 ( 0、2435 )MPa 。 4. 温度为T 的热源与温度为T0的环境之间进行变温热量传递,其等于热容为Cp,则ExQ 的 计算式为(00(1)T xQ p T T E C dT T =-? )。 5. 指出下列物系的自由度数目,(1)水的三相点 0 ,(2)液体水与水蒸汽处于汽液平衡 状态 1 三、简答题:(共30分) 1. 填表(6分)
一、 单项选择题(每题3分,共30分): 1.关于化工热力学研究特点的下列说法中不正确的是( B ) A. 研究体系为实际状态。 B. 解释微观本质及其产生某种现象的内部原因。 C. 处理方法为以理想态为标准态加上校正。 D. 获取数据的方法为少量实验数据加半经验模型。 2.下列关于G E 关系式正确的是( C )。 A. G E = RT ∑X i ln X i B. G E = RT ∑X i ln a i C. G E = RT ∑X i ln γi D. G E = R ∑X i ln X i 3.下列偏摩尔自由焓表达式中,错误的为( D )。 A. i i G μ=- B. dT S dP V G d i i i - ---=;C. ()i j n P T i i n nG G ≠? ???????=-,, D. ()i j n nV T i i n nG G ≠? ???????=-,, 4.下述说法哪一个正确? 某物质在临界点的性质( D ) (A )与外界温度有关 (B) 与外界压力有关 (C) 与外界物质有关 (D) 是该物质本身的特性。 5.关于逸度的下列说法中不正确的是 ( D ) (A )逸度可称为“校正压力” 。 (B )逸度可称为“有效压力” 。 (C )逸度表达了真实气体对理想气体的偏差 。 (D )逸度可代替压力,使真实气体的状态方程 变为fv=nRT 。 (E )逸度就是物质从系统中逃逸趋势的量度。 6.范德华方程与R -K 方程均是常见的立方型方程,对于摩尔体积V 存在三个实根或者一个实根,当存在三个实根时,最大的V 值是 B 。 A 、饱和液体体积 B 、饱和蒸汽体积 C 、无物理意义 D 、饱和液体与饱和蒸汽的混合体积 7.对于流体混合物,下面式子错误的是 D 。 A B 、 i i i V P U H += C i i V i i U U = D 、理想溶液的i i S S = i i G G = 8.由纯组分形成理想溶液时,其混合焓ΔH id B 。 A. >0; B. =0; C. <0 ; D. 不确定。 9.体系中物质i 的偏摩尔体积i V 的定义式为: D 。 A.i j n v T i i i n V V ≠??=,,][ B .i j n v T i i n V V ≠??=,,][总 C .i j n p T i i i n V V ≠??=,,][ D. i j n p T i i n V V ≠??=,,][总 10.混合物的逸度与纯组分逸度之间的关系是 C 。 A.i i f x f ∧ ∑=; B. i f f ∧ ∑=; C. ln i i i x f x f ∧ ∑=ln ; D. ln 0 ln f x f i ∑=
化工热力学复习题 一、选择题 1. T 温度下的纯物质,当压力低于该温度下的饱和蒸汽压时,则气体的状态为( C ) A. 饱和蒸汽 超临界流体 过热蒸汽 2. 纯物质的第二virial 系数B ( A ) A 仅是T 的函数 B 是T 和P 的函数 C 是T 和V 的函数 D 是任何两强度性质的函数 3. 设Z 为x ,y 的连续函数,,根据欧拉连锁式,有( B ) A. 1x y z Z Z x x y y ?????????=- ? ? ?????????? B. 1y x Z Z x y x y Z ?????????=- ? ? ?????????? C. 1y x Z Z x y x y Z ?????????= ? ? ?????????? D. 1y Z x Z y y x x Z ?????????=- ? ? ?????????? 4. 关于偏离函数M R ,理想性质M *,下列公式正确的是( C ) A. *R M M M =+ B. *2R M M M =- C. *R M M M =- D. *R M M M =+ 5. 下面的说法中不正确的是 ( B ) (A )纯物质无偏摩尔量 。 (B )任何偏摩尔性质都是T ,P 的函数。 (C )偏摩尔性质是强度性质。 (D )强度性质无偏摩尔量 。 6. 关于逸度的下列说法中不正确的是 ( D ) (A )逸度可称为“校正压力” 。 (B )逸度可称为“有效压力” 。 (C )逸度表达了真实气体对理想气体的偏差 。 (D )逸度可代替压力,使真实气体的状态方程变为fv=nRT 。 (E )逸度就是物质从系统中逃逸趋势的量度。 7. 二元溶液,T, P 一定时,Gibbs —Duhem 方程的正确形式是 ( C ). a. X 1dlnγ1/dX 1+ X 2dlnγ2/dX 2 = 0 b. X 1dlnγ1/dX 2+ X 2 dlnγ2/dX 1 = 0 c. X 1dlnγ1/dX 1+ X 2dlnγ2/dX 1 = 0 d. X 1dlnγ1/dX 1– X 2 dlnγ2/dX 1 = 0 8. 关于化学势的下列说法中不正确的是( A ) A. 系统的偏摩尔量就是化学势 B. 化学势是系统的强度性质 C. 系统中的任一物质都有化学势 D. 化学势大小决定物质迁移的方向 9.关于活度和活度系数的下列说法中不正确的是 ( E ) (A )活度是相对逸度,校正浓度,有效浓度;(B) 理想溶液活度等于其浓度。 (C )活度系数表示实际溶液与理想溶液的偏差。(D )任何纯物质的活度均为1。 (E )r i 是G E /RT 的偏摩尔量。 10.等温等压下,在A 和B 组成的均相体系中,若A 的偏摩尔体积随浓度的改变而增加,则B 的偏摩尔体积将(B ) A. 增加 B. 减小 C. 不变 D. 不一定 11.下列各式中,化学位的定义式是 ( A ) 12.混合物中组分i 的逸度的完整定义式是( A )。 A. d G ___i =RTdln f ^i , 0lim →p [f ^i /(Y i P)]=1 B. d G ___i =RTdln f ^i , 0lim →p [f ^ i /P]=1 C. dG i =RTdln f ^i , 0lim →p f i =1 ; D. d G ___i =RTdln f ^i , 0lim →p f ^ i =1 13. 关于偏摩尔性质,下面说法中不正确的是( B ) A.偏摩尔性质与温度、压力和组成有关 B .偏摩尔焓等于化学位 C .偏摩尔性质是强度性质 D. 偏摩尔自由焓等于化学位 j j j j n nS T i i n T P i i n nS nV i i n nS P i i n nU d n nA c n nG b n nH a ,,,,,,,,])([.])([.])([.])([.??≡??≡??≡??≡μμμμ
模拟题一 1. T 温度下的纯物质,当压力低于该温度下的饱和蒸汽压时,则气体的状态为( c ) A. 饱和蒸汽 B. 超临界流体 C. 过热蒸汽 2. T 温度下的过冷纯液体的压力P ( a ) A. >()T P s B. <()T P s C. =()T P s 3. T 温度下的过热纯蒸汽的压力P ( b ) A. >()T P s B. <()T P s C. =()T P s 4. 纯物质的第二virial 系数B ( a ) A 仅是T 的函数 B 是T 和P 的函数 C 是T 和V 的函数 D 是任何两强度性质的函数 5. 能表达流体在临界点的P-V 等温线的正确趋势的virial 方程,必须至少用到( a ) A. 第三virial 系数 B. 第二virial 系数 C. 无穷项 D. 只需要理想气体方程 6. 液化石油气的主要成分是( a ) A. 丙烷、丁烷和少量的戊烷 B. 甲烷、乙烷 C. 正己烷 7. 立方型状态方程计算V 时如果出现三个根,则最大的根表示( ) A. 饱和液摩尔体积 B. 饱和汽摩尔体积 C. 无物理意义 8. 偏心因子的定义式( ) A. 0.7lg()1s r Tr P ω==-- B. 0.8lg()1s r Tr P ω==-- C. 1.0lg()s r Tr P ω==- 9. 设Z 为x ,y 的连续函数,,根据欧拉连锁式,有( ) A. 1x y z Z Z x x y y ?????????=- ? ? ?????????? B. 1y x Z Z x y x y Z ?????????=- ? ? ?????????? C. 1y x Z Z x y x y Z ?????????= ? ? ?????????? D. 1y Z x Z y y x x Z ?????????=- ? ? ?????????? 10. 关于偏离函数M R ,理想性质M *,下列公式正确的是( ) A. *R M M M =+ B. *2R M M M =- C. *R M M M =- D. *R M M M =+ 11. 下面的说法中不正确的是 ( ) (A )纯物质无偏摩尔量 。 (B )任何偏摩尔性质都是T ,P 的函数。
《化工热力学》试题(一) 一、填空题(10分): 1. 纯物质的P-V-T 图上,高于临界压力和临界温度的区域称为 。 2. 写出偏摩尔性质i γln 对应的溶液性质 。 3. 工作于温度为T 1的高温热源和温度为T 2的低温冷源之间的可逆热机的效率为 。 4. 理想溶液混合过程的=?id H 。 5.对于二组分汽液两相平衡体系来说,其体系的自由度为 。 二、判断题(14分) 1. 理想气体混合物就是一种理想溶液。( ) 2. 三参数对应态原理由于两参数对应态原理是因为前者适用于任何流体。( ) 3. 吸热过程一定使系统熵增,反之熵增过程也是吸热过程。( ) 4. 纯物质的气液平衡常数K =1。( ) 5. 对于一个绝热不可逆过程,可以设计一个绝热可逆过程来计算其熵的变化。( ) 6. 混合物气液相图中的泡点曲线表示的是饱和气相,而露点曲线表示的是饱和液相。 ( ) 7. 在一定温度和压力下的理想溶液的组分逸度与其摩尔分数成正比。( ) 三、选择题(16分) 1. 对于一给定的物质来说,virial 方程中的virial 系数与( )有关。 A .温度 B .压力 C .密度 D .体积 2.对于一均相物质,其H 和U 的关系为 A .U H ≤ B .U H > C .U H = D .不能确定 3.气液平衡关系i S i i x P Py =的适用条件是: A .无限制条件 B .低压条件下的非理想液相 C .理想气体和理想溶液 D .理想溶液和非理想气体 4.已知乙炔在7.0=r T 时,其对比饱和蒸汽压为0.0655,则乙炔的偏心因子为: A .0.195 B .0.184 C .0.084 D .0.127 5.偏心因子是从下列定义的:
《化工热力学》习题集 郑州大学化工学院 周彩荣 2008.12.
第二章 流体的p-V-T 关系和状态方程 一、问答题: 2-1为什么要研究流体的pVT 关系? 2-2在p -V 图上指出超临界萃取技术所处的区域,以及该区域的特征;同时指出其它重要的点、 线、面以及它们的特征。 2-3 要满足什么条件,气体才能液化? 2-4 不同气体在相同温度压力下,偏离理想气体的程度是否相同?你认为哪些是决定偏离理想气 体程度的最本质因素? 2-5 偏心因子的概念是什么?为什么要提出这个概念?它可以直接测量吗? 2-6 什么是状态方程的普遍化方法?普遍化方法有哪些类型? 2-7简述三参数对应状态原理与两参数对应状态原理的区别。 2-8总结纯气体和纯液体pVT 计算的异同。 2-9如何理解混合规则?为什么要提出这个概念?有哪些类型的混合规则? 2-10状态方程主要有哪些类型? 如何选择使用? 请给学过的状态方程之精度排个序。 二、计算题:(说明:凡是题目中没有特别注明使用什么状态方程的, 你可以选择你认为最适宜的方程,并给出理由) 2-1. 将van der Waals 方程化成维里方程式;并导出van der Waals 方程常数a 、b 表示的第二维里 系数B 的函数表达式 2-2. 维里方程可以表达成以下两种形式。 21(pV B C Z RT V V = =+++……1) 21''(2pV Z B p C p RT ==+++……) 请证明:'B B RT = 2'2 ()C B C RT ?= 2-3. 某反应器容积为,内装有温度为的乙醇45。现请你试用以下三种 方法求取该反应器的压力,并与实验值(2.75)比较误差。 (1)用理想气体方程;;(2)用RK 方程;(3)用普遍化状态方程。 31.213m 0 227C .40kg MPa 2-4. 容积1m 3的贮气罐,其安全工作压力为100atm ,内装甲烷100kg ,问: 1)当夏天来临,如果当地最高温度为40℃时,贮气罐是否会爆炸?(本题用RK 方程计算)
化工热力学期末试题(A)卷 2007~2008年使用班级化学工程与工艺专业05级 班级学号姓名成绩 一.选择 1.纯物质在临界点处的状态,通常都是 D 。 A.气体状态 B.液体状态 C.固体状态D.气液不分状态 2.关于建立状态方程的作用,以下叙述不正确的是 B 。 A. 可以解决由于实验的P-V-T数据有限无法全面了解流体P-V-T 行 为的问题。 B.可以解决实验的P-V-T数据精确度不高的问题。 C.可以从容易获得的物性数据(P、V、T、x)来推算较难测定的数据( H,U,S,G ) D.可以解决由于P-V-T数据离散不便于求导和积分,无法获得数据点以外的P-V-T的问题。 3.虚拟临界常数法是将混合物看成一个虚拟的纯物质,从而将纯物质对比态原理的计算方法用到混合物上。. A 。 A.正确 B.错误 4.甲烷P c=,处在P r=时,甲烷的压力为 B 。 A.B. MPa; C. MPa
5.理想气体的压缩因子Z=1,但由于分子间相互作用力的存在,实际气体 的压缩因子 C 。 A . 小于1 B .大于1 C .可能小于1也可能大于1 6.对于极性物质,用 C 状态方程计算误差比较小,所以在工业上 得到广泛应用。 A .vdW 方程,SRK ; B .RK ,PR C .PR ,SRK D .SRK ,维里方程 7.正丁烷的偏心因子ω=,临界压力P c = 则在T r =时的蒸汽压为 2435.0101==--ωc s P P MPa 。 A 。 A .正确 B .错误 8.剩余性质M R 的概念是表示什么差别的 B 。 A .真实溶液与理想溶液 B .理想气体与真实气体 C .浓度与活度 D .压力与逸度 9.对单位质量,定组成的均相流体体系,在非流动条件下有 A 。 A .dH = TdS + Vdp B .dH = SdT + Vdp C .dH = -SdT + Vdp D .dH = -TdS -Vdp 10.对1mol 符合Van der Waals 状态方程的气体,有 A 。 A .(S/V)T =R/(v-b ) B .(S/V)T =-R/(v-b) C .(S/V)T =R/(v+b) D .(S/V)T =P/(b-v) 11.吉氏函数变化与P-V-T 关系为()P RT G P T G x ig ln ,=-,则x G 的状态应该为
Michigan State University DEPARTMENT OF CHEMICAL ENGINEERING AND MATERIAL SCIENCE ChE 821: Advanced Thermodynamics Fall 2008 1. (30) A thermodynamicist is attempting to model the process of balloon inflation by assuming that the elastic casing behaves like a spring opposing the expansion (see below). The model assumes that the piston/cylinder is adiabatic. As air (following the ideal gas law) is admitted, the spring is compressed. The pressure on the spring side of the piston is zero, so that the spring provides the only force opposing movement of the piston. The pressure in the tank is related to the gas volume by Hooke’s law P ? P i = k (V – V i ) where k = 1E-5 MPa/cm 3, P i = 0.1 MPa, T i = 300K, and V i = 3000 cm 3, Cv = 20.9 J/mol K, independent of temperature, and the reservoir is at 0.7 MPa and 300K. Provide the balances needed to determine the gas temperature in the cylinder at volume V = 4000cm 3. Perform all integrations. Do not calculate the gas temperature, but provide all equations and parameter values to demonstrate that you could determine the gas temperature. 2. (30) Consider two air tanks at the initial conditions shown below. We wish to obtain work from them by exchanging heat and mass between the tanks. No gas may be vented to the atmosphere, and no heat may be exchanged with the atmosphere. Reversible devices may be used to connect the two tanks. Provide the balances necessary to calculate the maximum work that may be obtained. Perform all integrations. Do not calculate the work value, but provide all equations and parameter values to demonstrate that you could determine the work value. C p = 29.3 J/molK. Use the ideal gas law. Tank A 400 K 5 bar 6 m 3 Tank B 200 K 0.1 bar 10 m 3
一. 选择题(每题2分,共10分) 1.纯物质的第二virial 系数B ( A ) A 仅是温度的函数 B 是T 和P 的函数 C 是T 和V 的函数 D 是任何两强度性质的函数 2.T 温度下的过冷纯液体的压力P (A 。参考P -V 图上的亚临界等温线。) A. >()T P s B. <()T P s C. =()T P s 3. 二元气体混合物的摩尔分数y 1=0.3,在一定的T ,P 下,8812.0?,9381.0?21==?? ,则此时混合物的逸度系数为 。(C ) A 0.9097 B 0.89827 C 0.8979 D 0.9092 4. 某流体在稳流装置中经历了一个不可逆绝热过程,装置所产生的功为24kJ ,则流体的熵变( A ) A.大于零 B.小于零 C.等于零 D.可正可负 5. Henry 规则( C ) A 仅适用于溶剂组分 B 仅适用于溶质组分 C 适用于稀溶液的溶质组分 D 阶段适用于稀溶液的溶剂 二、 填空题(每题2分,共10分) 1. 液态水常压下从25℃加热至50℃,其等压平均热容为75.31J/mol,则此过程的 焓变为(1882.75)J/mol 。 2. 封闭体系中的1mol 理想气体(已知ig P C ),按下列途径由T 1、P 1和V 1可逆地变 化至P 2,则,等温过程的 W =21ln P P RT -,Q =2 1 ln P P RT ,U = 0 ,H = 0 。 3. 正丁烷的偏心因子ω=0.193,临界压力为p c =3.797MPa ,则在Tr =0.7时的蒸 汽压为( 0.2435 )MPa 。 4. 温度为T 的热源与温度为T 0的环境之间进行变温热量传递,其等于热容为Cp , 则E xQ 的计算式为(0 (1)T xQ p T T E C dT T = - ? )。
第二篇模拟试题与参考答案
化工热力学模拟试题(1)及参考答案 一(共18分) 判断题(每题3分) 1 纯物质的饱和液体的摩尔体积随着温度升高而增大,饱和蒸气的摩尔体积随着温度的升高而减小。 ( ) 2 若某系统在相同的始态和终态间,分别进行可逆与不可逆过程,则?S 不可逆>?S 可逆。 ( ) 3 由三种不反应的化学物质组成的三相pVT 系统,达平衡时,仅一个自由度。 ( ) 4 热量总是由TdS ?给出。 ( ) 5 不可逆过程孤立系统的熵是增加的,但过程的有效能是减少的。 ( ) 6 物质的偏心因子ω是由蒸气压定义的,因此ω具有压力的单位。 ( ) 二(共16分) 简答题(每小题8分) 1 Virial 方程()2 11''==+++??????pV Z B p C p RT ()212= =+++??????pV B C Z RT V V 如何证明: B B RT '= 22C B C (RT)-'= 2 水蒸气和液态水的混合物在505K 下呈平衡态存在,如果已知该混合物的比容为3-141cm g ?,根据蒸气表的数据计算混合物的焓和熵。已知在该温度下的饱和水蒸气性质 为: 三(15分) 用泵以756kg h ?的速度把水从45m 深的井底打到离地10m 高的开口储槽中,冬天为了防冻,在运送过程中用一加热器,将-131650kJ h ?的热量加到水中,整个系统散热速度为-126375kJ h ?,假设井水为2℃,那么水进入水槽时,温度上升还是下降?其值若干?假设动能变化可忽略,泵的功率为2马力,其效率为55%(1马力=735W )(视为稳流系统)。 四(20分) 一个Rankine 循环蒸气动力装置的锅炉,供给2000kPa ,400℃的过热蒸气透平,其流量-125200kg h ?,乏气在15kPa 压力下排至冷凝器,假定透平是绝热可逆操作的,冷凝器出口为饱和液体,循环水泵将水打回锅炉也是绝热可逆,求:(1)透平所做的功?(2)水泵所做的功?(3)每千克蒸气从锅炉获得的热量?已知2000kPa ,400℃过热蒸气的热力 学性质为:-1H 29452J g .=?,-1-1 S 71271J g K .=??;15kPa 压力下的乏气热力学性质为: 21kg cm -?、27℃压缩到268kg cm -?,并经级间冷却到27℃,设压缩实际功率1224kcal kg -?, 求级间冷却器应移走的热量,压缩过程的理想功、损耗功与热力学效率,设环境温度为27℃。已知甲烷的焓和熵数据如下: