
波谱分析(spectra analysis)
波谱分析的内涵与外延:
定义:利用特定的仪器,测试化合物的多种特征波谱图,通过分析推断化合物的分子结构。特定的仪器:紫外,红外,核磁,质谱,(X-射线,圆二色谱等)
特征波谱图: 四大谱;X-射线单晶衍射,圆二色谱等
化合物:一般为纯的有机化合物
分子结构:分子中原子的连接顺序、位置;构象,空间结构
仪器分析(定量),波谱分析(定性)
综合性、交叉科学(化学、物理、数学、自动化、计算机)
作用:波谱解析理论原理是物理学,主要应用于化学领域(天然产物化学和中药化学、有机化学、药物化学等),在药物、化工,石油,食品及其它工业部门有着广泛的应用;分析的主要对象是有机化合物。
课程要求:本课将在学生学习有机化学、分析化学、物理化学等课程的基础上,系统讲授紫外光谱(UV)、红外光谱(IR)、核磁共振光谱(NMR)和质谱(MS)这四大光谱的基本原理、特征、规律及图谱解析技术,并且介绍这四大光谱解析技术的综合运用,培养学生掌握解析简单有机化合物波谱图的能力。为学习中药化学有效成分的结构鉴定打下基础。
第一章紫外光谱(ultraviolet spectra,UV)
一、电磁波的基本性质和分类
1、波粒二象性
光的三要素:波长(λ),速度(c),频率(v)
电磁波的波动性
光速c:c=3.0 x 1010 cm/s
波长λ:电磁波相邻波峰间的距离。用nm,μm,cm,m 等表示
频率v:v=c/ λ,用Hz 表示。
电磁波的粒子性
光子具有能量,其能量大小由下式决定:
E = hν= hc/λ(式中E为光子的能量,h为普朗克常数,其值为6.624×10-34j.s )
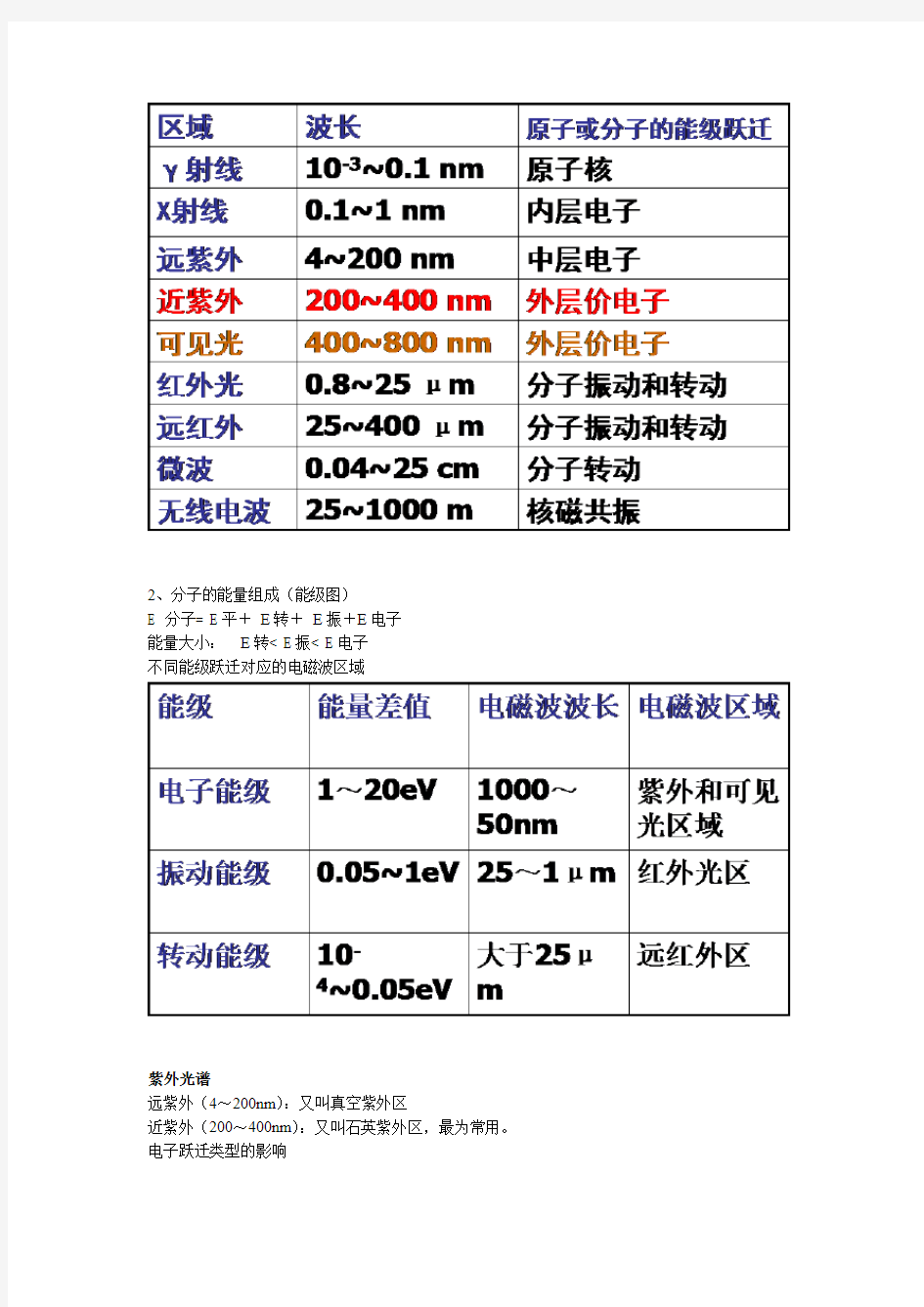
电磁波的分类
2、分子的能量组成(能级图)
E 分子= E平+E转+E振+E电子
能量大小:E转< E振< E电子
不同能级跃迁对应的电磁波区域
紫外光谱
远紫外(4~200nm):又叫真空紫外区
近紫外(200~400nm):又叫石英紫外区,最为常用。电子跃迁类型的影响
σ→σ*跃迁:150nm左右,真空紫外区
n→σ*跃迁:一般小于200nm 弱吸收,ε约100
π→π*跃迁:160~180nm(孤立双键),>200nm (共轭双键)强吸收,ε约104
n→π*跃迁:200~400nm 弱吸收,ε约100
2.3.表示方法和常用术语
发色团:
广义上讲,是分子中能吸收紫外光或可见光的结构系统。
狭义上讲,凡具有π电子的基团。
如:c=c, c=o,苯环等芳香族化合物。
助色团:
基团本身不能吸收大于200nm的紫外光,但它与一定的发色团相连时,则可使发色团所产生的吸收峰向长波方向移动,同时吸收强度也增加,这些基团称助色团,即有助于光波的吸收。常见的助色团有-OH, -OR, -NHR, -SH, -Cl, -Br, -I等。
红移:由于取代作用或溶剂效应导致紫外吸收峰向长波方向移动的现象。
蓝移:紫外吸收峰向短波方向移动。
增色作用:使紫外吸收强度增加的作用。
减色作用:使紫外吸收强度降低的作用。
2.6吸收强度的主要影响因素
1、跃迁几率
2、靶面积
2.7测定用溶剂的选择
原则:
1、紫外透明,无吸收
2、溶解度好
、不与样品发生化学反应3.
第三节推测化合物λmax的经验规则
一.非共轭有机化合物的紫外吸收(了解)
二、共轭有机化合物的紫外吸收
(一)共轭烯烃的λmax的计算方法
1、共轭二烯,三烯及四烯λmax的计算(Woodward-Fieser经验规则,)
1,增加一个共轭双键(增加共轭度)
2,环外双键(固定构象,增加共轭几率)
3,取代基
烷基和环残基(σ-π超共轭)
O、N、X、S (p-π共轭)
(1)环外双键:双键在环外,且其中一个C构成环的一员
(2)环残基:与双烯C相连的饱和环骨架的一部分。
注意事项:
交叉共轭体系,只能选一个较长的共轭体系
芳香系统也不适用,另有规则。
只适用于小于或等于四个双键的化合物。
共轭体系中的所有取代基及所有的环外双键均应考虑在内。
2.共轭多烯λmax计算(Fieser-Kuhn公式)
λmax=114+5M+n(48-1.7n)-16.5 Rendo-10 Rexo
εmax=1.74×104n
其中,M―烷基数
n―总共轭双键数
Rendo―具有环内双键的环数
Rexo―具有环外双键的环数
第四节紫外光谱在有机化合物结构研究中的应用
1、确定未知化合物是否含有与某一已知化合物相同的共轭体系(确定样品是否为已知化合物)有标准品时:若两个化合物相同,其紫外光谱应完全相同。但要注意,紫外光谱相同,结构不一定相同。
无标准品时:查找有关光谱文献进行对照,注意所使用的溶剂与文献一致。
2、确定未知结构中的共轭结构单元
(1)将λmax的计算值与实测值比较
(2)与同类型的已知化合物UV光谱比较
许多类型的化合物,如黄酮类、蒽醌类和香豆素类等,其基本骨架是一致的,其结构与紫外光谱特征之间的规律已比较清楚。同种类型的化合物在紫外光谱上既有共性(骨架),又有个性(取代)。
这种方法在鉴定化合物结构中经常用到。
3、确定构型、构象
4、测定互变异构现象
紫外光谱仪器-紫外分光光度计
由五个基本部分组成:
1、光源
2、分光系统(单色器)
3、吸收池
4、检测器
5、记录仪
、光源:常用的光源是钨灯、氢灯和氘灯。1.
钨灯:用来做可见光的光源,其发射的波长范围在320~2500nm,用作测量可见光区的吸收光谱。氢灯和氘灯:用于紫外光区的光源,波长范围在180~375nm。
2、分光系统(单色器)
单色器的主要部件是棱镜和光栅。现代多用光栅作为单色器,其分辨率较高。
3、比色皿:可分为石英和玻璃两种比色皿。前者适用于紫外可见光区,后者只能用于可见光区。
4、检测器:常用的检测器有光电池、光电管和光电倍增管等。其中光电倍增管的灵敏度高,是应用最广的一种检测器。
5、记录仪
第二章红外光谱(Infrared spectra, IR)
教学要求
了解红外光谱的基本原理
掌握分子的振动能级基频跃迁与峰位的关系
掌握红外光谱区的八个重要区段
概念:特征谱带区,指纹区,相关峰
了解红外光谱在结构分析中的应用
第一节基础知识
IR历史
1800 年,英国科学家W. Herschel发现红外线。
1881年,Abney 和Festing 第一次将红外线用于分子结构的研究。
1889年,Angstrem首次证实CO和CO2气体分子具有不同的红外光谱图。
红外光谱的特点
1、具有高度的特征性
2、对样品的适应性相当广泛,无论固态、液态或气态样品都可进行测定
4、对于特征基团的分析准确
3、常规红外光谱仪价格较低(与核磁、质谱比)
一、红外光谱
是研究红外光与物质分子间相互作用的吸收光谱
E 分子= E移+E振+E转+E电子
红外光谱又称作振-转光谱
通常将红外光分为三个区域:
近红外区(泛频区:12500-4000cm-1)
中红外区(基本振动:4000-400cm-1 )
远红外区(转动区:400-25cm-1 )
在常温下,分子几乎均处于基态,所以在红外吸收光谱中通常只考虑下面两种跃迁:
V0→V1:基频峰,峰强v0→1=v(1-2Xe)
V0→V2:倍频峰,峰弱v0→2=2v(1-3Xe)
(二)多原子分子的振动
1、振动自由度与峰数
将多原子的复杂振动分解为许多简单的基本振动(简正振动)基本振动的数目:振动自由度(分子自由度)
:平动自由度+转动自由度+振动自由度)3N分子自由度数(.
振动自由度:
分子自由度数(3N)-(平动自由度+转动自由度)
非线性分子振动自由度=3N-(3+3)=3N-6
线性分子振动自由度=3N-(3+2)=3N-5
2、振动类型
(1)伸缩振动(v):对称伸缩振动vs 不对称伸缩振动vas
对称伸缩振动:两个键同时伸长或缩短
不对称伸缩振动:一个键伸长,一个缩短
特点:只有键长的变化,没有键角的变化。
剪式振动δs
面内弯曲振动δip
平面摇摆ρ
(2)弯曲振动
(δ)
非平面摇摆ω
面外弯曲振δo.o.
扭曲振动τ
弯曲振动:原子在键轴前后或左右弯曲振动。
特点:只有键角变化,无键长变化。
红外吸收在低频率区,一般在1500cm-1以下。
红外光谱产生的基本条件
1、hv红外光=ΔE分子振动
2、分子振动时,其偶极矩μ必须
发生变化,即Δμ≠0。
3、影响峰数的原因
理论上,每个振动自由度在红外光谱区都应产生一个吸收峰,但实际峰数往往少于振动数目。原因:
1 当振动过程中分子不发生瞬间偶极矩变化时,不引起红外吸收。
2 频率完全相同的振动彼此发生简并。
3 强宽峰覆盖与它频率相近的弱而窄的吸收峰。
4 吸收峰有时落在中红外区以外(4000~650cm-1),不被检测。
5 吸收峰太弱,无法测定。
也有使峰数增多的因素,如倍频与组频等。但这些峰落在中红外区的较少,而且都非常弱。三、分子偶极变化与峰强
(一)峰强的表示法
百分透光率:红外光谱用百分透光率T表示峰强。
T%=I/I0×100% 故T%越小,吸收峰越强。
百分吸收率:吸光度:A
摩尔吸光系数:ε>100 vs ε=20-100 s
ε=10-20 m ε<1 w
(二)决定峰强的因素
(1)振动过程中偶极矩的变化
原子的电负性:vC=O>vC=C,vOH>vC-H>vC-C
vas>vs, v>δ:振动形式
分子的对称性:CO2的对称伸缩O=C=O
其它
(2)能级跃迁的几率基频几率最大
四、影响峰位的因素
(一)内部因素
1.电子效应
由于取代基具有不同的电负性,通过电子效应使分子中的电子云分布发生变化,从而改变化学键的键力常数,也就改变了基团的特征吸收频率。
(1)诱导效应(inductive effect)
取代基的电负性,引起电子云密度的变化,称为诱导效应。分为吸电子诱导效应(-I效应)和给电子诱导效应(+I效应)
(2)共轭效应(简称+C或+M效应)
共轭效应使电子密度平均化,C=O的双键性降低,键力常数减少,故吸收峰移向低波数区。当同时存在I效应和C效应时,吸收峰的位移方向由影响较大的那个效应决定。
2.空间效应
(1)场效应(简称F效应)
(2)空间障碍(位阻)
(3)跨环效应
是一种特殊的空间电子效应,由于两基团的空间位置相近而产生的跨环共轭效应,使红外吸收向低波数移动。
(4)环张力
环外双键和环上羰基,其频率随着环张力增加而增加。
环内双键的伸缩频率则随环张力的增加而降低。
3.氢键效应
氢键的形成使参与形成氢键的化学键力常数减少,可使伸缩频率向低波数方向移动,谱带变宽。(1)分子内氢键(与浓度无关)
氢键的形成使参与形成氢键的化学键力常数减少,可使伸缩频率向低波数方向移动,谱带变宽。
(1)分子内氢键(与浓度无关)
可使谱带大幅度向低波数方向移动(P54举例)
(2)分子间氢键(与浓度有关)
醇、酚、羧酸。其中羧酸的分子间氢键缔合不仅使羰基的吸收频率发生变化,而且也使羟基出现在3200~2500cm-1区间。
4.互变异构
5.振动偶合效应
当两个基团在分子中靠近,且振动频率相同或相近时,其相应的吸收峰强度增强或发生裂分,形成两个峰,这叫振动偶合。
费米共振:
当倍频峰(或组频)位于某强的基频吸收峰附近时,弱的倍频或组频峰的吸收强度被大大强化,间或发生峰带裂分,这种倍频与基频峰之间的振动偶合称为费米共振。
6.样品的物理状态的影响
,其红外吸收光谱有不同程度的差异。核对光谱同一样品在不同的状态测定(气、液、固).
时要注意。
(二)外部因素
1.溶剂影响
极性基团的伸缩频率常随溶剂极性增大而降低。如羧酸的羰基在不同溶剂中伸缩频率如下:
气体vC=O 1780cm-1 乙醚vC=O 1760cm-1
乙醇vC=O 1720cm-1 碱液vC=O 1610~1550cm-1
第二节红外光谱中的重要区段
一、特征谱带区、指纹区及相关峰的概念
1、特征谱带区
有机化合物的分子中一些主要官能团的特征吸收多发生在红外区域的4000~1333cm-1。该
区域吸收峰比较稀疏,容易辨认,故通常把该区域叫特征谱带区,该区相应的吸收峰称做特征吸收或特征峰。
2、指纹区
1333~400cm-1的低频区称为指纹区。该区域对于各个化合物来说特异性较强,犹如每个人的指纹一样。
3、相关峰
一个基团常有数种振动形式,每种红外活性的振动通常都相应产生一个吸收峰。习惯上把这些相互依存而又相互可以佐证的吸收峰叫相关峰。
二.红外光谱中的八个重要区段
(一)3750~3000cm-1 ,X-H伸缩振动区
(二)3300~3000cm-1,不饱和烃和芳烃C-H伸缩振动区
(三)3000~2700cm-1, 饱和烃的C-H和醛基C-H伸缩振动区
(四)2400~2100cm-1, 三键对称伸缩振动区
(五)1900~1650cm-1, 羰基的伸缩振动区
(六)1680~1500cm-1, 双键的伸缩振动区
(七)1475~1050 cm-1, C-H弯曲振动(面内)及X-Y伸缩振动
(八)1000~650cm-1,C-H弯曲振动(面外)
1、3750~3000cm-1 X-H (X= N, O, S) 伸缩振动区
基团类型波数cm-1 峰强备注
vO-H
游离O-H 3700~3500 较强,尖锐稀溶液或气态
缔合O-H 3450~3200 强,宽
羧酸3400~2500 强而散(很特征)
vN-H
游离N-H 3500~3300 弱,稍尖伯胺双峰
缔合N-H 3500~3100 弱而尖仲胺是单峰
叔胺无吸收峰
酰胺3500~3300 可变
2、3300~3000cm-1 不饱和烃和芳烃C-H伸缩振动区
基团类型波数cm-1 峰强备注
C≡C-H 3300 强很特征
Ar-H 3030 弱-中
C=C-H 3040~3010 弱-中强
cm-13000 伸缩振动均在C-H此区域是区别饱和及不饱和烃的重要区域,不饱和烃和芳烃.
以上,饱和烷烃均在3000 cm-1以下。
3、3000~2700cm-1
饱和烃的C-H和醛基C-H伸缩振动区
C-H键类型波数cm-1 峰强备注
-CH3 2960,2780 高强双峰
-CH2 2930,2850 强双峰不特征
-C-H 2890 中强
-OCH3 2830~2810 中强
2820,2720 中强,尖双峰2720低,特征
-O-CH2-O 2780~2765 弱-相关峰930
(四)三键C-C对称伸缩振动区(2400~2100cm-1)
三键类型波数cm-1 峰强
H-C≡C-R 2140~2100 强
R'-C≡C-R 2260~2190 可变
R-C≡C-R 无吸收
RC≡N 2260~2240 强
R'-C≡C-C≡C-R 2400~2100 弱-中强
(五)羰基的伸缩振动区(1900~1650cm-1)
羰基吸收最常出现的区域为1755~1670cm-1,
表现为一特征的强峰。
羰基峰位的计算方法:p74
(六)双键的对称伸缩振动区(1680~1500cm-1)
双键类型波数cm-1 峰强
>C=C< 1680~1620 不定
>C=N-1690~1640 不定
-N=N-1630~1575 不定
说明:1、分子比较对称时,C=C 峰很弱。
2、芳香化合物在1600~1500cm-1处有一个
或一个以上强峰。
3、C=C 吸收高频区与C=O 区别。
(七)C-H弯曲振动(面内)(1475~1300 cm-1)及X-Y伸缩振动(1300 ~1050 cm-1)
基团类型波数cm-1 峰强
δas CH3 1470~1430 中
δs CH3 1396~1365 中-弱
δas CH2 1470~1430 中
说明:1、羧酸盐(COO-) vs 1450~1300强峰,
硝基(NO2) vs 1385~1290强峰,
砜类(SO2) vas 1440~1290强峰
2、偕二甲基,双峰;
偕三甲基,双峰,一强一弱p78
X-Y伸缩振动(强):对鉴定醇、醚、酯有帮助
(八)C-H弯曲振动(面外)(1000~650cm-1)
峰强cm-1 波数基团类型
RCH=CH2 990, 910 强
RCH=CHR(顺)690 中-强
RCH=CHR(反)970 中-强
R2C=CH2 890 中-强
R2C=CHR 840~790 中-强
脂肪族化合物CH面外弯曲振动区
说明:1、分子中有-(CH2)n-基团,且n > 4时,在720~750cm-1也会出现CH平面摇摆振动吸收峰,随着n的减少,吸收峰向高波数移动。
2、亚甲二氧基(-O-CH2-O-)与苯环相连时,在925~935cm-1有很强的特征吸收峰。
3、甙键为β构型时,在890cm-1处会出现糖的端基原子的δCH吸收,可作为鉴定甙
键构型的辅助手段。
三.芳香族化合物的特征吸收(表2-13)
相关峰波数cm-1 峰强备注
vCH 3040~3030 中
vC=C 1600~1430 不定芳核骨架振动
1600, 1500
δCH 910~690 强判断取代类型
芳香化合物的判断:
考察3040~3030 vCH和1600~1430芳核骨架振动同时存在,确定有无芳香环。
与烯烃的区别:
烯烃在1600附近只有一个峰,一般以1640为中心;芳香环在1600~1430至少两个以上的峰(一般有1600和1500附近两个主峰)
与烷烃的区别:
烷烃vCH在2900,芳香环在3030。(以3000为界)
烷烃在1450和1390 附近的δCH ,与芳香环在1600~1430至少两个以上的峰
最主要能与同时含烷基和烯基的化合物分开:
芳香环在1600~1430至少两个以上的峰(一般有1600和1500附近两个主峰,特别是1600的峰)红外谱图解析的一般步骤
根据分子式,计算不饱和度。通过不饱和度可估计分子结构中是否有双键、三键或芳香环等。可先从4000~1333cm-1的特征区入手,找出存在的官能团,并兼顾指纹区的谱带,估计分子类型。
通过标准谱图验证解析结果的正确性。对于新化合物,还需配合UV, NMR, MS 等数据进行综合解析。
不饱和度(Degree of unsaturation)
定义:又称缺氢指数。是指分子与同碳数的饱和开链烃比较,每缺少2个氢为1个不饱和度。如:乙烯变成饱和烷烃需要两个氢原子,不饱和度为1。
由分子的不饱和度可以推断分子中含有双键,三键,环,芳环的总数目。作用:
注意多环:剪开而不剪短
计算:-1/2n1
n1, n3, n4, n5, n6分别为分子中一价,三价,四价,五价,六价元素数目
理解:骨架,串糖葫芦
若分子中仅含一,二,三,四价元素(H,O,N,C),则可按下式进行不饱和度的计算:数+C数-1/2H数
注意:
与O无关
化合价不分正负,按提供的成键电子数计算
注意变价元素(S,P)DMSO
谱图解析的注意事项:
1、如果在4000~400cm-1区间只显示少数几个
宽吸收峰的谱图,这很可能是无机化合物。(特别是3000附近)
2、解析谱图时,辨认吸收峰位置无疑是重要的,
但吸收峰的强度和峰形也是红外吸收的重要
特点,对确定结构很有用。如羟基,氨基。(三要素)
3、同一基团的几种振动吸收峰的相互印证,
如苯环、醛类。(相关峰)
4、判断化合物是饱和还是不饱和。
(以3000cm-1为界)
5、注意区别和排除非样品的谱带的干扰。如
大气中的CO2在2350和667cm-1有吸收;因
KBr吸水,在3410~3300cm-1有吸收(1630附近也有弱峰)。
6、在一张谱图上,并不是所有的吸收峰都能
指出其归属,有许多谱峰,特别是指纹区
的谱峰很难找到它们的归属的。
第三节红外光谱在结构分析中的应用
一.鉴定未知结构的官能团
1、对于结构简单的化合物,有时仅需知
道其分子式和其他少量信息,即可利
用IR谱完全确定其结构式。
2、一般来说,完整的确定一个未知化合物的
结构,需要测定一些物理常数和UV, NMR,
MS等波谱数据的配合才能完成。但红外光
谱在确定化合物中存在的官能团上,有独到
之处。
二.鉴定是否为某已知成分
1.有标准品时,样品和标准品在同一条件下测得的红外光谱比较,完全相同时(包括指纹区)可以判定为同一化合物。(有极个别例外)
2.无标准品,但有标准图谱时,与谱图核对。
注意所用仪器是否一致,样品的物理状态及所用溶剂是否一致等。
P92
标准谱图集:
红外光谱仪器及实验技术
一、色散型红外光谱仪
由光源、单色器、样品池、检测器和计算机组成。
1、光源
能斯特灯、硅碳棒
2、单色器
棱镜和光栅
3、检测器
热检测器和光检测器
二、傅立叶变换红外光谱仪(FT-IR)
最核心的部分是迈克尔逊干涉仪。较色散型
红外光谱仪有以下优点:
1、分辨率高
0.1~0.005cm-1 (0.2~3cm-1)
2、扫描时间短
1秒(几分钟)
3、光谱范围宽
10000~10cm-1 (4000~400cm-1)
4、灵敏度高10-9 g
样品处理技术技术
1、气态样品
可直接导入已抽真空的气体池内测定。
2、液体样品
液膜法
3、固体样品
(1)KBr压片法
(2)研糊法(石蜡油)
1,红外数据库
2,联用技术
(GC/FTIR)
(SFC/IR)
拉曼光谱
拉曼光谱:散射光谱
红外光谱:吸收光谱
雷利散射:弹性散射
拉曼散射:非弹性碰撞
拉曼光谱强度取决于极化率的变化,与红外光谱互补。
第三章核磁共振
教学要求
基本概念:
了解核自旋,核进动等。
理解核跃迁,核驰豫,磁旋比
掌握屏蔽效应,化学位移,偶合常数,化学等价,磁等价等。及其影响因素。根据化学位移和偶合常数等数据解谱
了解二维核磁共振
第一节核磁共振的基础知识
核磁共振的基本原理
产生核磁共振的必要条件
屏蔽效应及在其影响下的能级跃迁
1.1 核磁共振的基本原理
1.1.1 原子核的自旋与自旋角动量、核磁矩、磁旋比
核自旋
原子核是带正电的微粒(由质子+中子组成),大多数原子核都具有自旋现象。
I=1/2 :电荷均匀分布于原子核表面,核磁共振谱线较窄,最适宜于核磁共振检测,是NMR研究的主要对象。如1H,13C;19F,31P等
I>1/2 电荷非均匀分布于原子核表面的核,都具有特有的弛豫机制(Relaxation), 导致核磁共振的谱线加宽,不利于核磁共振检测。
分子中,电子能级、振动能级跃迁,较大,可以有效的自发辐射;核自旋能级小,
自发辐射几率几乎为0。
自旋-晶格弛豫
(spin-lattice Relaxation)
晶格泛指环境,即高能态自旋核把能量传给周围环境(同类分子、溶剂小分子、固体晶格等)转变为热运动而本身回到低能态维持Boltzmann分布。结果是N-数目下降。
自旋-晶格弛豫又称纵向弛豫。
高能态核把能量传给同类低能态的自旋核,本身回到低能态,维持Boltzmann分布。结果是高低能态自旋核总数不变。
核的进动和拉莫(Larmor)
自旋轴的方向与一致),自旋轴又与H0 的自旋核, 绕自旋轴旋转
(
保持一角进动(Precess),或称Larmor进动。类似于陀螺在重力场中的进动。
1.2 产生核磁共振的必要条件
若在垂直于H0的方向加射频场,其频率为,当时,核就会吸收能量,由
低能态(+1/2)跃迁至高能态(-1/2),这种现象称核磁共振。产生NMR条件
(1)的自旋核磁性核
(2)外磁场H0 能级裂分
(3)与H0相互垂直的射频(辐射频率),且
(1)根据书上公式3-6 核磁共振实现方法2种
扫场法:
固定射频磁场频率,让H0连续变化。
扫频法:
磁场H0固定,让射频场频率连续变化。
连续波核磁共振仪已被脉冲傅立叶变换.
核磁共振仪所取代。值大,核的共振吸收向高场(或低频)位移。核外电子云的密度高,σσ值小,核的共振吸收向低场(或高频)位移。核外电子云的密度低,
1HNMR
氢核磁共振谱第二节
NMR信号位置的变化。化学位移(Chemical shift) ——由于化学环境不同所引起的δ表示。化学位移常用
化学位移的表示方法
表示:以某一标准物为标准,测得样品共振峰与标准样共振峰的距离。以δ
标准样的共振频率;ν标样——ν样品——样品的共振频率;是为了读数方便。ν0 ——仪器的工作频率;乘106 化学位移的影响因素
诱导效应
化学键的各向异性值的影响浓度、温度、溶剂对δ
)
电负性取代基的影响诱导效应(
诱导效诱导效应是通过成键电子传递的,随着与电负性取代基距离的增大,值得注意的是,3
个以上碳的影响可以忽略不计。应的影响逐渐减弱,通常相隔
化学键的各向异性因化学键的键型不同,导致与其相连的氢核的化学位移不同。
氢核交换,化学位移值不固定1 ,可能出峰,也可能不出峰2
H的办法判断活泼1,重水交换DMSO
,2(CDCl3)
活泼氢的化学位移νν£6·?ù?
ùê?±δ=10ν0
氢键
形成氢键,质子受屏蔽作用小,
化学位移向低场移动,如5-羟基黄酮。
2.2 峰面积与氢核数目
各吸收峰的面积正比于引起该吸收的氢核数目
1,阶梯式积分曲线(近代)
2,积分面积(现代实际)
3,书面直接告知面积比
面积比得同类型氢核比
实际谱图中很少完美的正数比(基线不平、峰型畸变、活泼H,峰交叠)(0.9——1.1)
同类型氢核
2.3 峰的裂分及耦合常数
自旋-自旋偶合
自旋核与自旋核之间的相互作用(干扰)。
偶合的结果
造成谱线增多,称之裂分。
偶合的程度
用偶合常数(J)表示,单位: Hz
1,自旋-自旋偶合机理(裂分原因)
2,核的等价性
3,峰裂分:(n+1)规律
4,偶合常数
裂分原因:在外磁场下,相邻的磁性核的自旋偶合(自旋干扰)。
HF的F核,在外磁场中的两种自旋取向,产生两种不同方向的小磁场。对H核产生作用。
偶合常数:Ja,b=Jb,a
2、核的等价性
化学等价(chemical equivalence)
若分子中两相同原子(或相同基团)处于相同化学环境时,他们是化学等价的。
在化学反应中:反应速度相等
在波谱测定中:测量结果相等。
在HNMR中:化学等价的H核,其化学环境完全相等,化学位移相等。
化学不等价,则化学位移不相等。
(化学环境相差越大,化学位移也就相差越大)
1,对称性导致的化学等价:
二重轴(绕轴旋转180度后与原图型完全重合)(化学等价)
只有对称面(非手性环境,化学等价;手性环境,化学不等价)。
2,σ键的快速旋转导致的化学等价
CH3-CXYZ (Newman投影式,构象几率的加权平均)
all the
(特丁基总在一处出峰。HNMR在任何环境下都是化学等价的,同一甲基上的三个氢,same)
CH2上的两个H的化学等价性:
X-CH2CH2-Y 等价
R-CH2CXYZ 不等价
3,环的翻转导致的化学等价:
常见的化学不等价情况
(1)固定环上
(2)
(3)
磁等同氢核
磁等价(magnetic equivalence)
分子中某组氢核:
1,化学环境相同,化学位移相同,
2,且对组外任一磁性核的偶合相等,只表现出一种偶合常数,
则这组氢核称为磁等同氢核。
1,化学不等价,一定是磁不等同的。
2,化学等价,不一定磁等同
A,化学等价,磁等同的情况
B,化学等价,磁不等同的情况
自旋偶合始终存在,但由它引起的峰的裂分则只有当相互偶合的核的化学位移值不等时才能表现出来,即当两H核化学等价时,相互之间不会裂分。化学等价比磁等价更有意义(峰分组、峰裂分)。
3,峰裂分数:(2nI+1)或(n+1)规律
某组环境相同的核,与n个环境相同的核偶合,则被裂分为(2nI+1)个峰。
在HNMR中,H核的I=1/2,则某组环境相同的H核,与n个环境相同的H核偶合,则被裂分为(n+1)个峰。
峰强度可按二项式展开后的系数表示。(X+1)m ,m=N-1(N为裂分数)
画自旋偶合图,逐级分解偶合关系,每一级偶合遵照n+1规则
分解时先后顺序不影响最终结果,但一般按偶合常数由大到小,这样简洁、交叉少)。
特别注意偶合常数,偶合常数相同的为一级(或很相近,稍有形变);
4.偶合常数J P143
偶合使得吸收信号裂分为多重峰,多重峰中相邻两个峰之间的距离称为偶合常数(J),单位为赫兹(Hz)。
J的数值大小表示两个质子间相互偶合(干扰)的大小,可判断化合物片断的结构。
裂分峰组的中心位置是该组磁核的化学位移值。裂分峰之间的裂距反映耦合常数J 的大小,确切地说是反映J 的绝对值,因为J 值有正负之分,只是J 值的正负在核磁共振谱图上反映不出来,一般可以不予考虑。
计算:在测量耦合常数时应注意J 是以频率(Hz)为单位,而核磁共振谱图的横坐标是化学位移值,直接从谱图上量得的裂分峰间距(Δδ)必须乘以仪器的频率才能转化为Hz。J=
Δδ×仪器频率
磁等价的核相互之间也有耦合作用,但没有谱峰裂分的现象。
J
偶合常数.
偶合常数J不因外磁场的变化而改变;同时,它受外界条件如溶剂、温度、浓度变化等的影响也很小(相对化学位移)。
由于偶合作用是通过成键电子传递的,因此,J值的大小与两个(组)氢核之间的键数有关。一般说来,间隔3个单键以上时,J趋近于0。
偶合常数与分子结构的关系
质子与质子(1H,1H)之间的偶合
通过两个键之间的偶合(偕偶)
---同碳质子间的偶合
通过三个键之间的偶合(邻偶)
---邻碳质子间的偶合
大于三键之间的偶合(远程偶合)
---间隔三根以上化学键的偶合
芳环体系
苯的衍生物Jm = 4J ~2Hz, Jp = 5J 0~1Hz
吡啶衍生物J2, 4 J3,5 J4, 6 = 4J ~2Hz
J2. 5 J3, 6 = 5J 0~1Hz
呋喃,吡咯类衍生物
4J = J2, 4 = J3, 5 1~2Hz
核磁共振氢谱谱图的分类P138
(低级偶合:一级谱图
高级偶合:二级谱图)
自旋系统的分类与命名
常见的自旋系统
低级偶合:一级谱图
系统中两个(组)相互干扰的氢核化学位移差距Δν远大于偶合常数,
即Δν/J ≥ 6
裂分峰数目符合(n+1)规律。裂分峰强度符合二项展开式的系数。
裂距等于偶合常数,可直接读出。
J= Δν×仪器频率
系统的表达:英文字母表上相距较远的字母
高级偶合:二级谱
系统中两个(组)相互干扰的氢核化学位移差距Δν接近于偶合常数,
即Δν/J ≯ 6
1、一般,峰的数目超过n+1规律所得数目
2、各峰间相对强度关系复杂
3、δ、J都不能直接读出,需计算。
系统的表达:英文字母表上相距较近的字母
自旋系统的分类
二旋系统>C=CH2, X-CH=CH-Y, C*-CH2-等。
三旋系统X-CH=CH2 , -CH2-CH< ,
三取代苯,二取代吡啶等。
四旋系统X-CH2-CH2-Y ,二取代苯,
一取代吡啶等。
五旋系统CH3-CH2-X , 一取代苯等。
AB2 系统
AB2系统比较复杂,最多时出现9条峰,其中A 4条峰, 1H;B 4条峰,2H;1条综合峰。常见官能团的复杂谱图(用自旋耦合图分析)
1、单取代苯环
在苯环氢区域内,有5个H存在时,可判定为单取代。
第一类取代基:-CH3,-CH2-,-Cl,-Br,-CH=CHR,-C≡CR等。对苯环的邻、间、对位氢影响不
大,故它们的峰拉不开,总体看来是一个中间高,两边低的大峰。
第二类取代基:是有机化学中使苯环活化的邻、对位定位基。有-OH,-OR,-NH2,-NHR,-NRR'等。使苯环邻、对位氢的电子云密度增加,而使邻对位移向高场移动。
第三类取代基:是间位定位基,有-CHO,-COR,-COOR,-COOH,-CONHR,-NO2,
-N=N-Ar,-SO3H等。使苯环电子云密度降低,移向低场。邻位两个氢最低场。
2、对位二取代苯环
苯环上四个氢构成AA'BB'体系,谱线左右对称。这是取代苯环中最易识别的。现在一般呈现AX
3、邻位二取代苯环
相同基团取代,为AA'BB'体系,左右对称。现在一般呈现一级谱图
不同基团取代,为ABCD体系。谱峰复杂。
4、间位二取代苯环
相同基团取代,为AB2C体系.
不同基团取代,为ABCD体系。谱峰复杂,但由于两取代基团中间隔离的氢无2J偶合,经常显示初略的单峰,可做判断。
5、正构长链烷烃
X-(CH2)n-CH3,端甲基的三重峰畸变,总体表现
在δ 1.25ppm形成一个粗的单峰。
HNMR谱测定技术
1,试样与溶剂
1,样品纯度,用量
95%,10mg
2,核磁样品管
3,氘代溶剂的选择:主要是考虑溶解度,氘代氯仿最常用(适用于大多数非强极性成分,便宜)。强极性(氘代甲醇、重水)。
特定样品氘代溶剂的选择:氘代二甲亚砜(用在一般溶剂难溶的物质,黄酮类成分、酚
羟基);氘代吡啶(皂甙)。
信号不重叠、符合文献传统。(中一)
氘代溶剂的干扰峰
(少量未氘代完全的H和溶剂中水)
CDCl3 7.26(s),1.55(s,水)
CD3SOCD3 2.50(5), 3.31(s,水)
C5D5N 8.73(s), 7.58(s),7.21(s), 4.91(s,水)
CD3OD 3.31(5), 4.84(s,水)
CD3COCD3 2.05(5), 2.8(s ,水)
D2O 4.7(s)
C6D6 7.2(s)
CD3CN 2.09(5) , 1.94(s ,水)
3,重氢交换法
D2O 交换: -OH, -NH2, -COOH, -SH…
作用:确定活泼H
4,去偶试验
作用:辅助确定H的相互偶合
谱图中化合物的结构信息
(1)峰的数目:标志分子中化学不等价质子的种类,多少种;
(2)峰的强度(面积):每类质子的数目(相对),多少个;
(3)峰的位移:每类质子所处的化学环境,化合物中位置;
(4)峰的裂分数:相近碳原子上质子数;
(5)偶合常数(J):确定化合物构型。
不足之处:仅能确定质子(氢谱)。
1HNMR解析步骤
1,总体检查图谱:
谱图是否正常:底线是否平坦,信噪比是否符合要求;TMS是否正常;区分杂质峰,溶剂峰等。(样品问题,送样问题,作谱问题)
谱峰的整体分布:谱峰的多少,主要谱峰的位置(化合物的粗略信息)
2,已知分子式,则计算不饱和度,大于4时,考虑可能存在苯环。
3,根据积分曲线算出各个信号对应的H的个数。即确定谱图中各峰组对应的H数。(设定一个H的积分,以此推断其他H信号积分)(从积分判断杂质的多少,以去掉杂质峰)。
4,分子对称性的分析
5,对活泼H的判断(重水交换)
,对每个峰的、J进行分析,解释低级偶合系统,尽可能得到结构片段及其相关片段信6息。(位移分区,不同类型的质子,注意大于9的低场信号(醛、酸、酚羟基),强单峰(甲
信号的整体分布,大体反映化合物类型)H(峰形、位移、偶合)氧基、甲基)(注意谱图常数)。
7,必要时采用更换溶剂、NOE测定、强场NMR简化谱图。
8,解析信息,得出各种片断,组合可能的结构式。根据化学位移计算公式和偶合常数考察结构合理性。
,对推出的结构进行指认。9.
10,查出化合物的标准HNMR数据。
第三节核磁共振碳谱(13C-NMR)
13CNMR灵敏度低的原因:
①13C的天然丰度低,(13C1.1%,1H99.98%)
第二章:紫外吸收光谱法 一、选择 1. 频率(MHz)为4.47×108的辐射,其波长数值为 (1)670.7nm (2)670.7μ(3)670.7cm (4)670.7m 2. 紫外-可见光谱的产生是由外层价电子能级跃迁所致,其能级差的大小决定了 (1)吸收峰的强度(2)吸收峰的数目(3)吸收峰的位置(4)吸收峰的形状 3. 紫外光谱是带状光谱的原因是由于 (1)紫外光能量大(2)波长短(3)电子能级差大 (4)电子能级跃迁的同时伴随有振动及转动能级跃迁的原因 4. 化合物中,下面哪一种跃迁所需的能量最高 (1)σ→σ*(2)π→π*(3)n→σ*(4)n→π* 5. π→π*跃迁的吸收峰在下列哪种溶剂中测量,其最大吸收波长最大 (1)水(2)甲醇(3)乙醇(4)正己烷 6. 下列化合物中,在近紫外区(200~400nm)无吸收的是 (1)(2)(3)(4) 7. 下列化合物,紫外吸收λmax值最大的是 (1)(2)(3)(4) 二、解答及解析题 1.吸收光谱是怎样产生的?吸收带波长与吸收强度主要由什么因素决定? 2.紫外吸收光谱有哪些基本特征? 3.为什么紫外吸收光谱是带状光谱? 4.紫外吸收光谱能提供哪些分子结构信息?紫外光谱在结构分析中有什么用途又有何局限性? 5.分子的价电子跃迁有哪些类型?哪几种类型的跃迁能在紫外吸收光谱中反映出来? 6.影响紫外光谱吸收带的主要因素有哪些? 7.有机化合物的紫外吸收带有几种类型?它们与分子结构有什么关系? 8.溶剂对紫外吸收光谱有什么影响?选择溶剂时应考虑哪些因素? 9.什么是发色基团?什么是助色基团?它们具有什么样结构或特征? 10.为什么助色基团取代基能使烯双键的n→π*跃迁波长红移?而使羰基n→π*跃迁波长蓝移?
一、判断题正确填‘R’,错误的填‘F’(每小题2分,共12分) 1. 紫外吸收光谱、红外吸收光谱、核磁共振波谱和质谱是有机结构分析的四种主要的有机光谱分析方法,合称四大谱。() 2. 电磁辐射的波长越长,能量越大。() 3. 根据N规律,由C,H,O,N组成的有机化合物,N为奇数,M一定是奇数;N为偶数,M也为偶数。() 4. 核磁共振波谱法与红外光谱法一样,都是基于吸收电磁辐射的分析法。() 5. 当分子受到红外激发,其振动能级发生跃迁时,化学键越强吸收的光子数目越多。() 6.(CH3)4Si 分子中1H核共振频率处于高场,比所有有机化合物中的1H 核都高。() 二、选择题(每小题2分,共30分). 1. 光或电磁辐射的二象性是指() A电磁辐射是由电矢量和磁矢量组成。B电磁辐射具有波动性和电磁性C电磁辐射具有微粒性和光电效应 D 电磁辐射具有波动性和微粒性 2. 光量子的能量与电磁辐射的的哪一个物理量成正比() A 频率 B 波长 C 周期 D 强度 3. 可见光区、紫外光区、红外光区和无线电波四个电磁波区域中,能量最大和最小的区域分别为() A紫外光区和无线电波B紫外光区和红外光区 C可见光区和无线电波D可见光区和红外光区 4. 在质谱图中,CH2Cl2中M:(M+2):(M+4)的比值约为:() A 1:2:1 B 1:3:1 C 9:6:1 D 1:1:1 5. 下列化合物中,分子离子峰的质核比为偶数的是() A C8H10N2O B C8H12N3 C C9H12NO D C4H4N 6. CI-MS表示() A电子轰击质谱B化学电离质谱 C 电喷雾质谱 D 激光解析质谱 7. 红外光可引起物质的能级跃迁是()
目录 第二章:紫外吸收光谱法....................................................................... 3第三章红外吸收光谱法.......................................................... 7第四章 NMR习题 .............................................................. 11第五章质谱.................................................................. 17波谱分析试卷A ............................................................................. 27波谱分析试卷B ............................................................................. 34波谱分析试卷C ............................................................................. 44二......................................................................................... 54第二章红外光谱............................................................................ 55第三章核磁共振.......................................................................... 57第三章核磁共振-碳谱...................................................................... 61第四章质谱............................................................................... 64第一节:紫外光谱(UV) ....................................................................... 69
波谱分析(spectra analysis) 波谱分析的内涵与外延: 定义:利用特定的仪器,测试化合物的多种特征波谱图,通过分析推断化合物的分子结构。特定的仪器:紫外,红外,核磁,质谱,(X-射线,圆二色谱等) 特征波谱图: 四大谱;X-射线单晶衍射,圆二色谱等 化合物:一般为纯的有机化合物 分子结构:分子中原子的连接顺序、位置;构象,空间结构 仪器分析(定量),波谱分析(定性) 综合性、交叉科学(化学、物理、数学、自动化、计算机) 作用:波谱解析理论原理是物理学,主要应用于化学领域(天然产物化学和中药化学、有机化学、药物化学等),在药物、化工,石油,食品及其它工业部门有着广泛的应用;分析的主要对象是有机化合物。 课程要求:本课将在学生学习有机化学、分析化学、物理化学等课程的基础上,系统讲授紫外光谱(UV)、红外光谱(IR)、核磁共振光谱(NMR)和质谱(MS)这四大光谱的基本原理、特征、规律及图谱解析技术,并且介绍这四大光谱解析技术的综合运用,培养学生掌握解析简单有机化合物波谱图的能力。为学习中药化学有效成分的结构鉴定打下基础。 第一章紫外光谱(ultraviolet spectra,UV) 一、电磁波的基本性质和分类 1、波粒二象性 光的三要素:波长(λ),速度(c),频率(v) 电磁波的波动性 光速c:c=3.0 x 1010 cm/s 波长λ :电磁波相邻波峰间的距离。用nm,μm,cm,m 等表示 频率v:v=c/ λ,用Hz 表示。 电磁波的粒子性 光子具有能量,其能量大小由下式决定: E = hν = hc/λ(式中E为光子的能量,h为普朗克常数,其值为6.624× 10-34j.s ) 电磁波的分类
目录 第二章:紫外吸收光谱法 .................................................................................................................................................... 3第三章红外吸收光谱法.............................................................................................................................................. 8第四章NMR习题 ................................................................................................................................................... 12第五章质谱............................................................................................................................................................... 19波谱分析试卷A ................................................................................................................................................................. 30波谱分析试卷B .................................................................................................................................................................. 38波谱分析试卷C ................................................................................................................................................................. 47二.......................................................................................................................................................................................... 56第二章红外光谱............................................................................................................................................................... 57第三章核磁共振........................................................................................................................................................... 59第三章核磁共振-碳谱................................................................................................................................................... 64第四章质谱..................................................................................................................................................................... 66第一节:紫外光谱(UV) .................................................................................................................................................... 72
教学大纲 课程名称现代波谱分析课程负责人刘博静 开课系部化学与化工学院教研室第一基础教研室 二0一五年九月一日
《现代波谱分析》教学大纲 一、课程基本信息 课程编号: 中文名称:现代波谱分析 英文名称:Modern Spectrum Analysis 适用专业:应用化学专业 课程性质:专业方向选修课 总学时:36 (其中理论教学28学时,实验教学8学时) 总学分:2 二、课程简介 《现代波谱分析》是应用本科专业学生在掌握《无机化学》、《分析化学》和仪器分析》等课程知识后开设的一门专业选修课,该课程内容主要包括:有机质谱、核磁共振氢谱、核磁共振碳谱、红外和拉曼光谱、紫外和荧光光谱的基本原理、仪器简介与实验技术、基本规律与影响因素、谱图解析的基本程序与应用,以及谱图的综合解析。通过本课程的学习使学生了解波谱分析法的概念、作用以及各波谱之间的互相联系;掌握各分析法的基本原理和谱图特征;掌握应用四大波谱进行结构解析的基本程序;了解有关的实验技术;培养并提高学生的识谱能力、综合运用所学波谱知识解决有机化合物结构表征问题的能力,为学生后续课程学习、毕业论文(设计)和研发工作奠定良好的理论基础。 三、相关课程的衔接 已修课程:有机化学、仪器分析、分析化学 并修课程:工业分析食品分析 四、教学的目的、要求与方法 (一)教学目的 本课程的教学环节包括课题讲授,学生自学,习题讲解和期末考试,通过以上学习,要求学生掌握和了解四大谱图的基本理论及分析方法,培养并提高学生
的识谱能力、综合运用所学波谱知识解决有机化合物结构表征问题的能力,为学生今后毕业论文和工作奠定良好的理论基础。 (二)教学要求 通过本课程的学习,使学生了解有机化合物结构鉴定的现代波谱分析手段、方法;掌握结构解析的原理、规律和过程;掌握波谱的特征数据和化合物结构的关系以及在有机化合物结构鉴定中的应用;培养学生单独或综合利用波谱学技术解决实际问题的能力。 (三)教学方法 以讲授式为主,其它教学方法为辅。 五、教学内容(实验内容)及学时分配 第一章紫外光谱(4学时) 教学内容: 1、紫外光谱基本原理 2、紫外光谱仪 3、各类化合物紫外吸收光谱 4、紫外光谱的应用 本章重点:紫外光谱在结构解析中的应用 本章难点:紫外吸收与分子结构的关系、影响因素;紫外光谱在结构解析中的应用 第二章红外光谱(6学时) 教学内容: 1、红外光谱的基本原理 2、影响红外吸收频率的因素 3、红外光谱仪及样品制备技术 4、各类化合物的红外特征光谱 5、红外图谱解析 6、拉曼光谱简介 7、红外光谱技术的进期及应用 本章重点:利用红外光谱判断常见简单化合物的官能团及结构。
波谱解析试题A 一、名词解释(5*4分=20分) 1.波谱学:波谱学是涉及电池辐射与物质量子化的能态间的相互作用,其理论基础是量子化的能量从辐射场向物质转移。 2.屏蔽效应:感生磁场对外磁场的屏蔽作用称为电子屏蔽效应 3.电池辐射区域:γ射线区,X射线区,远紫外,紫外,可见光区,近红外,红外,远红外区,微波区和射频区 4.重排反应;在质谱裂解反应中,生成的某些离子的原子排列并不保持原来分子结构的关系,发生了原子或基团重排,产生这些重排离子的反应叫做重排反应 5.驰骋过程:要想维持NMR信号的检测,必须要有某种过程,这个过程就是驰骋过程,即高能态的核以非辐射的形式放出能量回到低能态,重建Boltzmann分布的过程。 二、选择题。(10*2分=20分)CDBBA BCCAB 1. 化合物中只有一个羰基,却在1773cm-1和1736cm-1处出现两个吸收峰这是因为:(C ) A、诱导效应 B、共轭效应 C、费米共振 D、空间位阻 2. 一种能作为色散型红外光谱仪的色散元件材料为:() A、玻璃 B、石英 C、红宝石 D、卤化物晶体 3. 预测H2S分子的基频峰数为:(B ) A、4 B、3 C、2 D、1 4. 若外加磁场的强度H0逐渐加大时,则使原子核自旋能级的低能态跃迁到高能态所需的能量是如何变化的:() A、不变 B、逐渐变大 C、逐渐变小 D、随原核而变 5. 下列哪种核不适宜核磁共振测定:() A、12C B、15N C、19F D、31P 6.在丁酮质谱中,质荷比质为29的碎片离子是发生了() A、α-裂解 B、I-裂解 C、重排裂解 D、γ-H迁移 7. 在四谱综合解析过程中,确定苯环取代基的位置,最有效的方法是()
《波普分析》复习题 一、名词解释 1.助色团: 2.振动偶合: 3.指纹区: 4.化学位移: 5.质谱法: 6.发色团: 7.费米共振: 8.相关峰: 9.化学位移: 10.氮律: 二、判断题 1.质谱图上不可能出现m/z比分子离子峰小3~14的碎片离子峰() 2.共轭体系越长,吸收峰红移越显著,吸收强度增加。() 3.某化合物在己烷中最大吸收波长是307nm,在乙醇中最大吸收波长是305nm, 该吸收是由π~π*跃迁引起的。() 4.瞬间偶极距越大,红外吸收峰越强。() 5.含芳氨基的化合物,介质由中性变为酸性时,谱带红移。() 6.溶剂极性增大,K带发生红移。()7.在核磁共振中,偶合质子的谱线裂分数目取决于邻近磁核的数目。() 8.根据n+l规律,C1CH2CH2Br中的两个CH2质子均为三重峰。() 9.丙基苯质谱中,肯定出现92、91的强质谱峰。() 10.含零个氮原子化合物,经简单开裂后,子离子为奇数。() 11.键力常数越大,红外振动吸收频率越小() 12.相连基团电负性越强,化学位移值越大,出现在高场。()
13.在氢谱中,一氯乙烷裂分一组三重峰,一组四重峰。() 14.异丙基苯质谱中,肯定出现92、91的强质谱峰。() 三.选择题(每题2分,共20分) 1.化合物CH3Br的质谱中,M+2峰的相对丰度与M峰的相对丰度比值约为() A 1:1 B 1:2 C 1:3 D 1:6 2.紫外光谱中,引起K带的跃迁方式是( D ) A σ→σ* B n→σ* C n→π* D π→π* 3.在醇类化合物中,νOH随溶液浓度的增加,向低波数方向移动的原因是( ) A 形成分子间氢键随之加强 B 溶液极性变大 C 诱导效应随之变大 D 溶质与溶剂分子间的相互作用 4.自旋量子数I=1/2的原子核在磁场中,相对于外磁场,有多少种不同的能量状态?() A 1 B 2 C 4 D 0 5.化合物Cl—CH2—O—CH3中,H a和 H b质子峰的裂分数及强度分别为() A H a:5和l:4:6:4:1, H b:3和1:2:1 B H a:2和1:1,H a:2和1:1 C H a:4和1:3:3:1,H b:3和1:2:1 D H a:1和2, H b:1和3 6.下面四个化合物质子的化学位移最大的是() A CH3F B CH4 C CH3Cl D CH3Br 7. 在100MHz仪器中,某质子的化学位移δ=l,其共振频率与TMS相差() A 100Hz B 60Hz C 1Hz D 200Hz 8. 某化合物中三种质子相互耦合成AM2X2系统J AM=10Hz,J XM=4Hz,它们的峰形为() A A为单质子三重峰,M为双质子4重峰,X为双质子三重峰 B A为单质子三重峰,M为双质子6重峰,X为双质子三重峰 C A为单质子单峰,M为双质子6重峰,X为双质子三重峰 D A为单质子二重峰,M为双质子6重峰,X为双质子三重峰 9.解析质谱时常根据某些离子的丰度比确定化合物的分子式,这类离子是() A 分子离子 B 亚稳离子 C 重排离子 D 同位素离子 10.某化合物相对分子质量M=102,红外光谱显示该化合物为一种酯类化合物。质谱图上m/z 74处出现一强峰。则该化合物为() A CH3CH2COOC2H5 B (CH3)2CHCOOCH3 C CH3(CH2)2COOCH3 D CH3COOC3H7 11.下列化合物中,其紫外光谱上能同时产生K带、R带的是() A CH3COCH3 B CH2=CHCH2CH2COCH3 C CH≡C—CHO D CH3CH2CH2CH2OH 12.由n→π*跃迁所产生的吸收带为() A K带 B R带 C B带 D E带 13.碳的杂化态对C—H键振动频率的影响是( )
有机波谱分析考试题库 及答案 内部编号:(YUUT-TBBY-MMUT-URRUY-UOOY-DBUYI-0128)
目录 第二章:紫外吸收光谱法 一、选择 1. 频率(MHz)为×108的辐射,其波长数值为 (1)(2)μ(3)(4) 2. 紫外-可见光谱的产生是由外层价电子能级跃迁所致,其能级差的大小决定了(1)吸收峰的强度(2)吸收峰的数目(3)吸收峰的位置(4)吸收峰的形状 3. 紫外光谱是带状光谱的原因是由于 (1)紫外光能量大(2)波长短(3)电子能级差大 (4)电子能级跃迁的同时伴随有振动及转动能级跃迁的原因 4. 化合物中,下面哪一种跃迁所需的能量最高
(1)σ→σ*(2)π→π*(3)n→σ*(4)n→π* 5. π→π*跃迁的吸收峰在下列哪种溶剂中测量,其最大吸收波长最大 (1)水(2)甲醇(3)乙醇(4)正己烷 6. 下列化合物中,在近紫外区(200~400nm)无吸收的是 (1)(2)(3)(4) 值最大的是 7. 下列化合物,紫外吸收λ max (1)(2)(3)(4) 20. 计算波长为250nm、400nm的紫外光频率、波数及其所具有的能量(以eV和kJ·mol-1为单位表示)。 ×1015Hz,40×103cm-1,,·mol-1; ×1015Hz,25×103cm-1,,·mol-1 21. 计算具有和能量光束的波长及波数。 827nm,×103cm-1;200nm,50×103cm-1 22. 已知丙酮的正己烷溶液有两吸收带,其波长分别为189nm 和280nm,分别属π→π*跃迁和n→π*跃迁,计算π,n,π* 轨道之间的能量差。 (1)152kcal·mol-1;(2) kcal·mol-1
《波谱分析》期末考试题B 一、判断题正确填‘R’,错误的填‘F’(每小题2分,共12分) 1. 紫外吸收光谱、红外吸收光谱、核磁共振波谱和质谱是有机结构分析的四种主要的有机光谱分析方法,合称四大谱。() 2. 电磁辐射的波长越长,能量越大。() 3. 根据N规律,由C,H,O,N组成的有机化合物,N为奇数,M一定是奇数;N为偶数,M也为偶数。() 4. 核磁共振波谱法与红外光谱法一样,都是基于吸收电磁辐射的分析法。() 5. 当分子受到红外激发,其振动能级发生跃迁时,化学键越强吸收的光子数目越多。() 6.(CH3)4Si 分子中1H核共振频率处于高场,比所有有机化合物中的1H核都高。() 二、选择题(每小题2分,共30分). 1. 光或电磁辐射的二象性是指() A电磁辐射是由电矢量和磁矢量组成。 B电磁辐射具有波动性和电磁性 C电磁辐射具有微粒性和光电效应 D 电磁辐射具有波动性和微粒性 2. 光量子的能量与电磁辐射的的哪一个物理量成正比() A 频率 B 波长 C 周期 D 强度 3. 可见光区、紫外光区、红外光区和无线电波四个电磁波区域中,能量最大和最小的区域分别为() A紫外光区和无线电波 B紫外光区和红外光区 C可见光区和无线电波 D可见光区和红外光区 4. 在质谱图中,CH2Cl2中M:(M+2):(M+4)的比值约为:() A 1:2:1 B 1:3:1 C 9:6:1 D 1:1:1
5. 下列化合物中,分子离子峰的质核比为偶数的是() A C8H10N2O B C8H12N3 C C9H12NO D C4H4N 6. CI-MS表示() A电子轰击质谱 B化学电离质谱 C 电喷雾质谱 D 激光解析质谱 7. 红外光可引起物质的能级跃迁是() A 分子的电子能级的跃迁,振动能级的跃迁,转动能级的跃迁 B 分子内层电子能级的跃迁 C 分子振动能级及转动能级的跃迁 D 分子转动能级的跃迁 8. 红外光谱解析分子结构的主要参数是() A 质核比 B 波数 C 偶合常数 D 保留值 9. 某化合物在1500~2800cm-1无吸收,该化合物可能是() A 烷烃 B 烯烃 C 芳烃 D炔烃 10. 在偏共振去偶谱中,RCHO的偏共振多重性为() A 四重峰 B 三重峰 C 二重峰 D 单峰 11. 化合物CH3-CH=CH-CH=O的紫外光谱中,λmax=320nm(εmax=30)的一个吸收带是() A K带 B R带 C B带 D E2带 12. 质谱图中强度最大的峰,规定其相对强度为100%,称为() A 分子离子峰 B 基峰 C亚稳离子峰 D准分子离子峰 13. 化合物CH3CH2CH3的1HNMR中CH2的质子信号受CH3偶合裂分为() A 四重峰 B 五重峰 C 六重峰 D 七重峰 14. 分子式为C5H10O的化合物,其NMR谱上只出现两个单峰,最有可能的结构式为() A (CH3)2CHCOCH3 B (CH3)3C-CHO C CH3CH2CH2COCH3 D CH3CH2COCH2CH3 15. 在偏共振去偶谱中,R-CN的偏共振多重性为()
高光谱分辨率遥感 用很窄(10-2l)而连续的光谱通道对地物持续遥感成像的技术。在可见光到短波红外波段其光谱分辨率高达纳米(nm)数量级,通常具有波段多的特点,光谱通道数多达数十甚至数百个以上,而且各光谱通道间往往是连续的,每个像元均可提取一条连续的光谱曲线,因此高光谱遥感又通常被称为成像光谱(ImagingSpectrometry)遥感。 高光谱遥感具有不同于传统遥感的新特点: (1)波段多——可以为每个像元提供几十、数百甚至上千个波段; (2)光谱范围窄——波段范围一般小于10nm; (3)波段连续——有些传感器可以在350~2500nm的太阳光谱范围内提供几乎连续的地物光谱; (4)数据量大——随着波段数的增加,数据量成指数增加; (5)信息冗余增加——由于相邻波段高度相关,冗余信息也相对增加。 优点: (1)有利于利用光谱特征分析来研究地物; (2)有利于采用各种光谱匹配模型; (3)有利于地物的精细分类与识别。 ENVI高光谱数据处理流程: 一、图像预处理 高光谱图像的预处理主要是辐射校正,辐射校正包括传感器定标和大气纠正。辐射校正一般由数据提供商完成。 二、显示图像波谱 打开高光谱数据,显示真彩色图像,绘制波谱曲线,选择需要的光谱波段进行输出。 三、波谱库 1、标准波谱库 软件自带多种标准波谱库,单击波谱名称可以显示波谱信息。 2、自定义波谱库 ENVI提供自定义波谱库功能,允许基于不同的波谱来源创建波谱库,波谱
来源包括收集任意点波谱、ASCII文件、由ASD波谱仪获取的波谱文件、感兴趣区均值、波谱破面和曲线等等。 3、波谱库交互浏览 波谱库浏览器提供很多的交互功能,包括设置波谱曲线的显示样式、添加注记、优化显示曲线等 四、端元波谱提取 端元的物理意义是指图像中具有相对固定光谱的特征地物类型,它实际上代表图像中没有发生混合的“纯点”。 端元波谱的确定有两种方式: (1)使用光谱仪在地面或实验室测量到的“参考端元”,一般从标准波谱库选择; (2)在遥感图像上得到的“图像端元”。 端元波谱获取的基本流程: (1)MNF变换 重要作用为:用于判定图像内在的维数;分离数据中的噪声;减少计算量;弥补了主成分分析在高光谱数据处理中的不足。 (2)计算纯净像元指数PPI PPI生成的结果是一副灰度的影像,DN值越大表明像元越纯。 作用及原理: 纯净像元指数法对图像中的像素点进行反复迭代,可以在多光谱或者高光谱影像中寻找最“纯”的像元。(通常基于MNF变换结果来进行)
波谱解析试题及答案 【篇一:波谱分析期末试卷】 >班级:姓名:学号:得分: 一、判断题(1*10=10 分) 1、分子离子可以是奇电子离子,也可以是偶电子离子。 ?????????() 2、在紫外光谱分析谱图中,溶剂效应会影响谱带位置,增加溶剂极性将导致k 带紫移,r 带红 移。... ??. ???????????????????????() 4、指纹区吸收峰多而复杂,没有强的特征峰,分子结构的微小变化不会引起这一区域吸 收峰的变化。........................................... . ?(.. ) 5、离子带有的正电荷或不成对电子是它发生碎裂的原因和动力之 一。....... () 7、当物质分子中某个基团的振动频率和红外光的频率一样时,分子就要释放能量,从 原来的基态振动能级跃迁到能量较高的振动能级。 ??????????.?() 8、红外吸收光谱的条件之一是红外光与分子之间有偶合作用,即分子振动时,其偶极 矩必须发生变 化。??????????????.. ??????????.() 9、在核磁共振中,凡是自旋量子数不为零的原子核都没有核磁共振现象。() 10、核的旋磁比越大,核的磁性越强,在核磁共振中越容易被发现。???() 二、选择题(2*14=28 分) 2.a.小 b. 大c.100nm 左右 d. 300nm 左右 2、在下列化合物中,分子离子峰的质荷比为偶数的是 ??????????() a.c9h12n2 b.c9h12no c.c9h10o2 d.c10h12o
3 、质谱中分子离子能被进一步裂解成多种碎片离子,其原因是????????.. () a. 加速电场的作用。 b. 电子流的能量大。 c. 分子之间相互碰撞。 d.碎片离子均比分子离子稳定。 a .苯环上有助色团 b. 苯环上有生色团 c .助色团与共轭体系中的芳环相连 d. 助色团与共轭体系中的烯相连 5、用紫外可见光谱法可用来测定化合物构型,在几何构型中, 顺式异构体的波长一般都比反式的对应值短,并且强度也较小,造成此现象最 主要的原因是... ? ....... (.). a.溶剂效应 b. 立体障碍c.共轭效应 d. 都不对 6 ????????.(. ) a .屏蔽效应增强,化学位移值大,峰 在高场出现; b. 屏蔽效应增强,化学位移值大,峰在低场出现; c .屏蔽效应减弱,化学位移值大,峰在低场出现; d. 屏蔽效应减弱,化学位移值大,峰在高场出现; 7 、下面化合物中质子化学位移最大的 是??????... ??????????. ?.(. )a.ch3cl b. 乙烯c.苯 d. ch3br 8、某化合物在220 —400nm 范围内没有紫外吸收,该化合物可能属于以下化合物中的哪一 类????????????????????????????? ??.. () a.芳香族类化合物 b. 含双键化合物c.醛类 d.醇类 9、核磁共振在解析分子结构的主要参数 是..... a .化学位移 b. 质荷比 ..).. c.保留值 d. 波数 10、红外光谱给出的分子结构信息 是?????????????????.. () a.骨架结构 b.连接方式 c .官能团 d.相对分子质量 11、在红外吸收光谱图中,2000-1650cm-1 和900-650 cm-1 两谱带是什么化合物的特征谱 带...... ???????????????????????
波谱解析法期末综合试卷 班级:姓名:学号:得分: 一、判断题(1*10=10分) 1、分子离子可以是奇电子离子,也可以是偶电子离子。………………………() 2、在紫外光谱分析谱图中,溶剂效应会影响谱带位置,增加溶剂极性将导致K带紫移,R带红 移。... ……. …………………………………………………………….............() 3、苯环中有三个吸收带,都是由σ→σ*跃迁引起的。…………………….......…() 4、指纹区吸收峰多而复杂,没有强的特征峰,分子结构的微小变化不会引起这一区域吸收峰的变 化。..........................................................................................................….. () 5、离子带有的正电荷或不成对电子是它发生碎裂的原因和动力之一。..................() 6、在紫外光谱中,π→π*跃迁是四种跃迁中所需能量最小的。…………………..() 7、当物质分子中某个基团的振动频率和红外光的频率一样时,分子就要释放能量,从原来的基态振动能级跃迁到 能量较高的振动能级。………………………….…() 8、红外吸收光谱的条件之一是红外光与分子之间有偶合作用,即分子振动时,其偶极矩必须发生变 化。……………………………………..………………………….() 9、在核磁共振中,凡是自旋量子数不为零的原子核都没有核磁共振现象。..........() 10、核的旋磁比越大,核的磁性越强,在核磁共振中越容易被发现。……….......() 二、选择题(2*14=28分) 1、含O、N、S、卤素等杂原子的饱和有机物,其杂原子均含有未成键的()电子。由于其所占据的非键轨道能级较高,所以其到σ*跃迁能()。 1 . A. π B. n C. σ 2. A.小 B. 大C.100nm左右 D. 300nm左右 2、在下列化合物中,分子离子峰的质荷比为偶数的是…………………………() A.C9H12N2 B.C9H12NO C.C9H10O2 D.C10H12O 3、质谱中分子离子能被进一步裂解成多种碎片离子,其原因是……………………..() A.加速电场的作用。 B.电子流的能量大。 C.分子之间相互 碰撞。 D.碎片离子均比分子离子稳定。 4、在化合物的紫外吸收光谱中,哪些情况可以使化合物的π→π*跃迁吸收波长蓝移。..................................................................................................................................()
【关键字】考试 第二章:紫外吸收光谱法 一、选择 1. 频率(MHz)为4.47×108的辐射,其波长数值为 (1)670.7nm (2)670.7μ(3)670.7cm (4)670.7m 2. 紫外-可见光谱的产生是由外层价电子能级跃迁所致,其能级差的大小决定了 (1)吸收峰的强度(2)吸收峰的数目(3)吸收峰的位置(4)吸收峰的形状 3. 紫外光谱是带状光谱的原因是由于 (1)紫外光能量大(2)波长短(3)电子能级差大 (4)电子能级跃迁的同时伴随有振动及转动能级跃迁的原因 4. 化合物中,下面哪一种跃迁所需的能量最高 (1)σ→σ*(2)π→π*(3)n→σ*(4)n→π* 5. π→π*跃迁的吸收峰在下列哪种溶剂中测量,其最大吸收波长最大 (1)水(2)甲醇(3)乙醇(4)正己烷 6. 下列化合物中,在近紫外区(200~400nm)无吸收的是 (1)(2)(3)(4) 7. 下列化合物,紫外吸收λmax值最大的是 (1)(2)(3)(4) 2、解答及解析题 1. 吸收光谱是怎样产生的?吸收带波长与吸收强度主要由什么因素决定? 2. 紫外吸收光谱有哪些基本特征? 3. 为什么紫外吸收光谱是带状光谱? 4. 紫外吸收光谱能提供哪些分子结构信息?紫外光谱在结构分析中有什么用途又有何局限性? 5. 分子的价电子跃迁有哪些类型?哪几种类型的跃迁能在紫外吸收光谱中反映出来?
6. 影响紫外光谱吸收带的主要因素有哪些? 7.有机化合物的紫外吸收带有几种类型?它们与分子结构有什么关系? 8. 溶剂对紫外吸收光谱有什么影响?选择溶剂时应考虑哪些因素? 9. 什么是发色基团?什么是助色基团?它们具有什么样结构或特征? 10.为什么助色基团取代基能使烯双键的n→π*跃迁波长红移?而使羰基n→π*跃迁波长蓝移? 11. 为什么共轭双键分子中双键数目愈多其π→π*跃迁吸收带波长愈长?请解释其因。 12. 芳环化合物都有B吸收带,但当化合物处于气态或在极性溶剂、非极性溶剂中时,B吸收带的形状有明显的差别,解释其原因。 13. pH对某些化合物的吸收带有一定的影响,例如苯胺在酸性介质中它的K吸收带和B吸收带发生蓝移,而苯酚在碱性介质中其K吸收带和B吸收带发生红移,为什么?羟酸在碱性介质中它的吸收带和形状会发生什么变化? 14. 某些有机化合物,如稠环化合物大多数都呈棕色或棕黄色,许多天然有机化合物也具有颜色,为什么? 15. 六元杂环化合物与芳环化合物具有相似的紫外吸收光谱,请举几个例子比较之,并解释其原因。 16. 紫外光谱定量分析方法主要有哪几种?各有什么特点? 17. 摩尔吸光系数有什么物理意义?其值的大小与哪些因素有关?试举出有机化合物各种吸收带的摩尔吸光系数的数值范围。 18. 如果化合物在紫外光区有K吸收带、B吸收带和R吸收带,能否用同一浓度的溶液测量此三种吸收带? 19. 紫外分光光度计主要由哪几部分所组成?它是怎样工作的? 20. 计算波长为250nm、400nm的紫外光频率、波数及其所具有的能量(以eV和kJ·mol-1为单位表示)。 21. 计算具有1.50eV和6.23eV能量光束的波长及波数。 22. 已知丙酮的正己烷溶液有两吸收带,其波长分别为189nm 和280nm,分别属π→π*跃迁和n→π*跃迁,计算π,n,π*轨道之间的能量差。 23. 画出酮羰基的电子轨道(π,n,π*)能级图,如将酮溶于乙醇中,其能级和跃迁波长将发生什么变化?请在图上画出变化情况。 24. 化合物A在紫外区有两个吸收带,用A的乙醇溶液测得吸收带波长λ1=256nm,λ2=305nm,而用A的己烷溶液测得吸收带波长为λ1=248nm、λ2=323nm,这两吸收带分别是何种电子跃迁所产生?A属哪一类化合物? 25. 异丙叉丙酮可能存在两种异构体,它的紫外吸收光谱显示(a)在λ=235nm有强吸收,ε=1.20×104,(b)在λ>220nm区域无强吸收,请根据两吸收带数据写出异丙丙酮两种异构体的结构式。
最新有机波谱分析考试题库及答案目录 第二章:紫外吸收光谱 法 ..................................................................... ........................................................ , 第三章红外吸收光谱法...................................................................... ................................................... , 第四章 NMR习 题 ..................................................................... ........................................................ ,, 第五章质 谱 ..................................................................... ................................................................. ,, 波谱分析试卷 A ...................................................................... ................................................................. ,, 波谱分析试卷 B ...................................................................... ................................................................. ,, 波谱分析试卷 C ...................................................................... ................................................................. ,, 二 ..................................................................... ........................................................................
波谱解析法期末综合试卷 班级: 姓名: 学号: 得分: 一、判断题(1*10=10 分) 1、 分子离子可以是奇电子离子,也可以是偶电子离 子。 ) ……………………… ( 2、 在紫外光谱分析谱图中,溶剂效应会影响谱带位置,增加溶剂极性将导致 K 带紫移,R 带红移。... ……. …………………………………………………………….............( ) 3、 苯环中有三个吸收带,都是由 σ→σ 跃迁引起的。 ……… …………….......…( ) 4、 指纹区吸收峰多而复杂,没有强的特征峰,分子结构的微小变化不会引起这一区域吸 收峰的变化。..........................................................................................................….. ( ) 5、 离子带有的正电荷或不成对电子是它发生碎裂的原因和动力之一。..................( ) 6、 在紫外光谱中,π→π 跃迁是四种跃迁中所需能量最小的。………………….. ( ) 7、 当物质分子中某个基团的振动频率和红外光的频率一样时,分子就要释放能量,从 原来的基态振动能级跃迁到能量较高的振动能级。 ) ………………………….…( 8、 红外吸收光谱的条件之一是红外光与分子之间有偶合作用,即分子振动时,其偶极 矩必须发生变化。 ) ……………………………………..……… ………………….( 9、 在核磁共振中,凡是自旋量子数不为零的原子核都没有核磁共振现象。..........( ) 10、 核的旋磁比越大,核的磁性越强,在核磁共振中越容易被发现。……….......( ) 二、选择题(2*14=28 分) 1、含 O 、N 、S 、卤素等杂原子的饱和有机物,其杂原子均含有未成键的( )电子。 由于其所占据的非键轨道能级较高,所以其到 σ 跃迁能( )。 1 . A. π B. n C. σ * * *